环丙酮
外观
| 环丙酮 | |
|---|---|
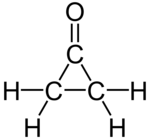
| |
| IUPAC名 cyclopropanone | |
| 识别 | |
| CAS号 | 5009-27-8 |
| PubChem | 138404 |
| ChemSpider | 122027 |
| SMILES |
|
| InChI |
|
| InChIKey | VBBRYJMZLIYUJQ-UHFFFAOYAV |
| 性质 | |
| 化学式 | C3H4O |
| 摩尔质量 | 56.06326 g·mol⁻¹ |
| 密度 | 0.867 g/mL,25 °C |
| 熔点 | −90 °C |
| 沸点 | 50-53 °C,22 mmHg |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
环丙酮(化学式:C3H4O)是环丙烷的氧代衍生物。其熔点为-90°C,很不稳定,可通过乙烯酮与重氮甲烷在-145°C时反应制备。[1][2] 由于母体化合物不甚稳定,合成中使用环丙酮的缩酮[3][4] 代替环丙酮,效果是等同的。
环丙酮的衍生物结构特殊,具有一些不同的性质,因此经常是有机化学研究的对象。[5]
衍生物
[编辑]环丙酮环系是很多有机反应的中间体。Favorskii重排中便涉及到一个环丙酮并环的中间体。
环丙酮环系水合形成羰基水合物(偕二醇),羰基碳变为sp3杂化,可以使所需的键角减小,缓解张力。因此环丙酮环系的水合物比较稳定。
用偕二卤代卡宾与烯烃反应,生成的产物经水解后,可以得到环丙酮的衍生物。它们可以作为1,3-偶极体,与环状双烯体(如呋喃)发生环加成反应。[6][7] 对此,有人提出以下的价互变异构来解释这个现象:
另两个结构都为碳-碳键断开,一个为电荷分离,另一个为双自由基结构。有些环丙酮的反应支持了以上机理:光学纯的(+)-反式-2,3-二叔丁基环丙酮加热到80°C时,会发生外消旋化;[8] 以及光照时,氧代脱氢吡唑烷放出氮气生成茚满的反应(见下),便都可看作是采取了上述的互变异构机理。[9]
参见
[编辑]参考资料
[编辑]- ^ Preparation and characterization of cyclopropanone, methylcyclopropanone, 2,2-dimethylcyclopropanone and tetramethylcyclopropanone N. J. Turro and W. B. Hammond, Tetrahedron, Volume 24, Issue 18, 1968, Pages 6017-6028 doi:10.1016/S0040-4020(01)90985-8
- ^ Cryochemical synthesis and molecular energetics of cyclopropanone and some related compounds E. F. Rothgery, R. J. Holt, H. A. McGee, , Jr. J. Am. Chem. Soc.; 1975; 97(17); 4971-4973. doi:10.1021/ja00850a034
- ^ Organic Syntheses, Coll. Vol. 7, p.131 (1990); Vol. 63, p.147 (1985). [Link http://www.orgsynth.org/orgsyn/pdfs/CV7P0131.pdf (页面存档备份,存于互联网档案馆)]
- ^ Datasheet commercial supplier Link 互联网档案馆的存档,存档日期2007-09-26.
- ^ Cyclopropanones Nicholas J. Turro, Acc. Chem. Res.; 1969; 2(1); 25-32. doi:10.1021/ar50013a004
- ^ Cyclopropanones. XII. Cycloaddition reactions of cyclopropanones Nicholas J. Turro, Simon S. Edelson, John R. Williams, Thomas R. Darling, Willis B. Hammond, J. Am. Chem. Soc.; 1969; 91(9); 2283-2292. doi:10.1021/ja01037a018
- ^ Cyclopropanones. XVII. Kinetics of the cycloaddition reaction of cyclopropanones with 1,3-dienes Simon S. Edelson, Nicholas J. Turro J. Am. Chem. Soc.; 1970; 92(9); 2770-2773. doi:10.1021/ja00712a030
- ^ Thermal reactions of a cyclopropanone. Racemization and decarbonylation of trans-2,3-di-tert-butylcyclopropanone Frederick D. Greene, David B. Sclove, Jose F. Pazos, Ronald L. Camp J. Am. Chem. Soc.; 1970; 92(25); 7488-7488. doi:10.1021/ja00728a051
- ^ First Direct Detection of 2,3-Dimethyl-2,3-diphenylcyclopropanone Andrey G. Moiseev, Manabu Abe, Evgeny O. Danilov, and Douglas C. Neckers, J. Org. Chem.; 2007; 72(8) pp 2777 - 2784; (Article) doi:10.1021/jo062259r


