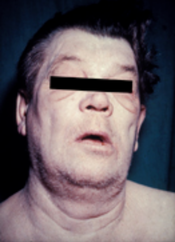
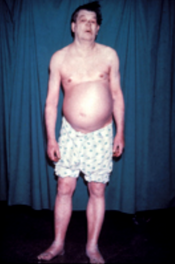
甲狀腺機能低下症
| 甲狀腺機能低下症 Hypothyroidism | |
|---|---|
| 同义词 | 甲状腺功能减退症 |
 | |
| 三碘甲狀腺原氨酸(Triiodothyronine, T3(圖))與 四碘甲狀腺素(Thyroxine, T4)通常以1:20的比例共同構成甲狀腺素(Thyroid hormone) | |
| 读音 | |
| 症状 | 畏寒、疲勞、便秘、抑鬱、體重增加[3] |
| 併發症 | 妊娠期間患病可能導致胎兒罹患先天性碘缺乏症候群[4] |
| 常見始發於 | 60歲以上[3] |
| 类型 | 甲狀腺疾病、疾病 |
| 肇因 | 碘缺乏、桥本氏甲状腺炎[3] |
| 診斷方法 | 血液检查(促甲状腺激素、T4)[3] |
| 相似疾病或共病 | 抑鬱、失智症、心臟衰竭、慢性疲勞症候群[5] |
| 預防 | 碘盐[6] |
| 治療 | 左旋甲狀腺素鈉[3] |
| 盛行率 | 0.3–0.4%(美國)[7] |
| 分类和外部资源 | |
| 醫學專科 | 內分泌學 |
| ICD-11 | 5A00 |
| ICD-10 | E03.9 |
| ICD-9-CM | 244.9 |
| DiseasesDB | 6558 |
| MedlinePlus | 000353 |
| eMedicine | 122393 |
| Orphanet | 181396 |
甲狀腺機能低下症(Hypothyroidism),又称作甲状腺功能减退症,或是简称甲减,是一個因甲狀腺無法分泌足夠的甲狀腺激素的內分泌疾病。此病可以造成很多症狀,像是畏寒、疲勞、便祕、抑鬱,還有體重增加。有時候頸部前端會因為有甲狀腺腫而腫大[3]。妊娠期間沒有治療的甲狀腺機能低下症者會造成嬰兒的生長和智力發展遲緩或是造成先天性碘缺乏症候群(俗稱呆小症)[4]。
世界上,食物中的碘缺乏是最常見造成甲狀腺機能低下症的主要病因[7][8]。橋本氏甲狀腺炎則是在食物中碘充足的國家中最常造成此病的病因[3]。較少見的病因包含先前使用過碘-131的治療、下視丘或是腦垂腺前葉的損傷、一些特定的藥物、先天性甲狀腺機能低下症,或是先前有過甲狀腺手術等[3][9]。診斷的部分,當有所懷疑時,可以經由量測促甲狀腺激素(TSH)和T4的血液檢查來證實[3]。
碘鹽讓許多人不會得到甲狀腺機能低下症[6]。用左旋甲狀腺素鈉來補充甲狀腺激素可以治療此病。醫療專家們建議補充的劑量要根據症狀、促甲狀腺激素(TSH)和甲狀腺激素來調整。另外,治療此病的藥物對孕婦來說是安全的。儘管食物中有適量的碘很重要,但如果太多可能會惡化某些特殊形式的甲狀腺機能低下症[3]。
綜觀世界上,估計約有10億人口是缺乏碘的,然而不知道有多少人真有甲狀腺機能低下症[10]。在美國,有0.3%~0.4%的人口有此病;而約有4.3%~8.5%者有無症狀的甲狀腺機能低下症,也就是此病比較輕微的形式,其TSH指數上升,但甲狀腺素正常[7]。此病在女性身上比在男性身上常見。在超過60歲的人身上也比較容易得病[3]。此外,狗也會得甲狀腺機能低下症,而貓和馬就比較少見[11]。此病的英文「hypothyroidism」是源自於希臘文,「hypo」表示低下,「thyreos」表示屏蔽,以及「eidos」表示形式[12]。
症状和徵象[编辑]
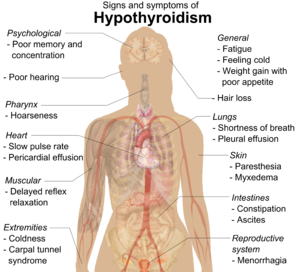
患有甲减的病人通常没有明显的临床症状出现,或者只有一些温和的症状表现出来。有一些症状和徵象是和甲减有联系的,可以与一些基础的原因联系相关联,有一些症状是直接和甲状腺激素缺乏相关的。[13][14]桥本氏甲状腺炎可能会表现出甲状腺肥大的症状。[13][15]膝跳反射缓慢是甲减的一个徵象,可以反映出激素缺少的严重程度。[7]如果严重甲减长期得不到治疗,会使心跳放缓、动脉硬化、心肌无力等病症[16]。
| 症状[13] | 徵象[13] |
|---|---|
| 疲倦 | 嗜睡、精神萎靡、消极;反应慢、记忆力减退,注意力难以集中,情绪抑郁, |
| 怕冷 | 四肢冰冷,肌肉无力、僵硬、酸痛,糖胺聚糖堆积,皮肤不再红润,变得苍白、干燥、粗糙 |
| 头发易断、易脱落;指甲变脆 | |
| 消化不良 | 食欲不振、便秘、体重增加,心率下降[17] |
| 呼吸短促 | 声音嘶哑、语言含糊不清,筋腱反射迟缓tendon reflex |
| 月经不规律 | 经血重后续跟随 轻月经,性冷淡,性能力下降,腕管综合症 |
| 知觉异常 | 听力下降、四肢、面部、眼皮浮肿,甲狀腺腫、气胸, 腹水肿, 心包积液 |
粘液性水肿昏迷[编辑]
粘液性水肿昏迷是一种罕见的威胁生命的甲减状态。在已经患有甲减的基础上发生其它疾病可能引起粘液性水肿昏迷,但是也可能只由甲减引起。这种疾病主要的症状为体温非常低但是不会表现出颤栗,意志模糊,心率缓慢并且呼吸能力下降。同时可能存在甲减的症状,如舌头颜色改变或者增大。[18]
怀孕[编辑]
即使是温和甲减,也被认为与生育能力减弱,增加流产风险有关。甲减在怀孕初期,即使没有明显症状,也可能提高先兆子痫,后代智力低下的风险,并且提高婴儿在出生前后的死亡率。[19]孕妇患有甲减的概率是0.3-0.5%。[20]
儿童[编辑]
患有甲减的新生儿可能发育出正常的身高和体重(虽然头部可能会略大,因为后囱门可能是打开的) 有些患儿可能有嗜睡,肌肉紧张度下降,马啼声哭泣,难以喂食,便秘,舌头增大,脐氙,皮肤干燥,体温降低和黄疸。虽然之后由于儿童的甲状腺无法分泌足量的甲状腺素可能引起甲状腺肿,但是情况比较罕见。[21]甲状腺肿也可能因为儿童在碘缺乏地区生长引起。[22]生长发育可能会迟缓,没有被治疗婴儿可能会导致智力低下(在严重病例中,智商可能会低6-15个点) 也可能出现其它症状:大规模的精细运动失调,肌无力,斜视,注意力集中时间短,语言发育迟缓。[21]
对于年龄稍大的儿童和青少年,甲减的症状包括:肥胖,低温耐受降低,嗜睡,肌无力,便秘,发育迟缓,脸色苍白,皮肤干燥,体毛增加,不规律月经和青春期推后。同时可能伴有膝跳反射缓慢,心率缓慢。肿瘤可能与甲状腺肿大并发。[23]
病因[编辑]
甲减是由于腺体本身功能不全(原发性甲减),或者缺少足量的促甲状腺激素(中枢性甲减)造成的。[7][24]原发性甲减发生的概率大概是中枢性甲减的一千倍。[9]
原发性甲减和地方性甲状腺肿在世界范围内最主要的诱因是碘缺乏。在一些富碘地区,原发性甲减的主要病因是自體免疫疾病桥本氏病。[7][8]甲状腺肿也可能与桥本氏病有关。桥本氏病的特点是存在T淋巴细胞对甲状腺的浸润和针对特殊的甲状腺抗原的抗体,如甲状腺过氧化酶抗体、甲状腺球状蛋白抗体和促甲状腺激素抗体。[7]
大约有5%的女性在分娩后的9个月内会发生产后甲状腺炎。主要表现为短期的甲减症状。发生产后甲状腺炎大概有20-40%的概率发展成永久性的甲减。[25]
自體免疫性的甲状腺炎与其它的自身性免疫疾病有关系,包括像1型糖尿病、恶性贫血、重症肌无力、脂泻病、类风湿性关节炎、系统性红斑狼疮等。自體免疫性的甲状腺炎也可能作为自體免疫多症候群的一部分出现。[7]
病理[编辑]

人体组织的正常功能需要甲状腺激素来维持。健康的情况下,甲状腺素(T4)主要是由甲状腺分泌,在其它组织中通过硒依赖碘化甲状腺氨酸脱碘酶处理转化为三碘化甲腺氨酸(T3)。[26]三碘化甲腺氨酸与细胞核上的甲状腺激素受体结合,促进某些基因的表达和特定蛋白质的合成。甲状腺素还会与细胞膜上的 integrin αvβ3结合,促进钠氢反向转运物和血管及细胞的生长。[27]在血液中,99.97%的甲状腺素与血浆蛋白(如甲状腺素结合球蛋白)结合,只有游离状态的甲状腺激素具有生物学活性。[7]
甲状腺是甲状腺激素在人体内唯一的来源。生产甲状腺激素的过程需要碘元素,和氯基酪氨酸。碘元素通过血液运送到甲状腺并与甲状腺球蛋白结合。这个过程被促甲状腺激素(TSH)控制,TSH由脑垂体控制。缺少足够的碘元素或者缺少足够的TSH,可以造成分泌甲状腺激素数量下降。[24]
下丘脑-垂体-甲状腺轴在维持正常的甲状腺激素水平上起了重要的作用。 脑下垂体前叶腺被下丘脑分泌的促甲状腺释放激素(TRH)刺激,释放促甲状腺激素。TSH和TRH的释放被甲状腺素反馈抑制。缺少足量的TRH会导致缺少TSH进而导致缺少甲状腺素,不过这是一种比较罕见的情况。[9]
怀孕会导致甲状腺素生理的显著变化。甲状腺体会增大10%,甲状腺素会多分泌50%,对碘元素的需求增加。很多甲状腺功能正常的女性但是由于具有对甲状腺激素的自體免疫,或者缺碘,在分娩前后出现了会出现甲减的迹象。[28]
诊断[编辑]
目前认为甲减最好的初步检测方法是通过实验室对血液中的促甲状腺激素水平进行测量,并且通常在几周以后进行第二次TSH水平测试来确诊。[29]由于激素水平异常也可能是由于其它疾病引起的,所以只有在强烈怀疑甲状腺机能异常时TSH水平检测才应该被推荐使用。TSH水平升高时,表明甲状腺没有产生足够的甲状腺激素,在进行TSH水平测试的时候,血液中游离的T4通常也会被测量。[7][23]在检测甲减的时候T3的水平并不被鼓励参考。[7]这里有一些甲减的症状记录表,他们在诊断中仅提供有限的参考。
| TSH | T4 | 说明 |
|---|---|---|
| 正常 | 正常 | 甲状腺功能正常 |
| 升高 | 偏低 | 显性甲减 |
| 正常/偏低 | 偏低 | 中枢性甲减 |
| 升高 | 正常 | 温和甲减 |
有些甲减病例伴随有血液中的肌酸激酶升高和活性梅升高。这些指标通常在甲减被完全治愈后消失。[7]胆固醇,低密度脂蛋白及脂蛋白a的水平也会上升。甲减对于血脂的影响目前没有被深入的研究。[22]
非常严重的甲减和粘液性水肿昏迷由于一些原因会伴随有低血钠和高抗利尿激素和急性肾功能恶化。[18]
如果在甲减诊断中触诊甲状腺没有感觉到任何肿块的,不要求进行甲状腺绘图。但是如果甲状腺感觉到异常,推荐进行绘图。[29]如果甲状腺过氧化物酶抗体存在,则意味着甲状腺小瘤是由于自體免疫性甲状腺炎造成的,但是如果还存在其它疑问,则推荐进行穿刺活检。[7]
如果TSH水平正常或偏低,血浆中T4水平偏低,建议怀疑是中枢性甲减。这时可能会存在其它特征,如月经周期异常,肾上腺激素异常。同时可能出现垂体肥大的迹象,如头痛和视线改变。中枢性甲减的病因有待深入研究。[9][29]
显性甲减[编辑]
主体性甲减的明显症状:TSH 水平偏高,T4 T3水平偏低。如果TSH水平多次高于5mIU/L,有相关甲减症状,T4稍低于标准值,则可以诊断为甲减。如果TSH高于10mIU/L,也可以诊断为甲减。[30]
温和甲减[编辑]
无临床症状:此类甲减是具有温和症状的甲减,主要表现为血浆中的高TSH水平和正常的甲状腺激素水平。[31][32]成年人的TSH水平高于5mIU/L低于10mIU/L。[30]温和甲减表现出来的症状多样并且典型的甲减症状通常难以被观察到。[31]患有温和甲减的人一部分会转变成明显的甲减,如果血液中检测到TPO抗体,转变的概率是4.3%,如果未检测到,概率是2.6%。[7]检测到TPO抗体的人应该更频繁的(比如每年)进行甲状腺功能检测。[29]
怀孕[编辑]
在孕期,由于更多的甲状腺激素绑定到甲状腺素结合球蛋白,更少的绑定到清蛋白上,所以游离态的甲状腺素水平比预期的要低。激素水平在孕期的各个阶段需要被修正,甲状腺激素水平需要用完整的水平替代检测的水平,TSH的水平可能也会比平常低,需要调整正常的范围来应对怀孕的各个阶段。[7][28]
在孕期,温和甲减的TSH水平被定义为2.5至10mIU/L和正常的甲状腺激素水平,高于10mlU/L的会被认为是明显的甲减,即使甲状腺激素水平正常。[28]TPO抗体是否存在对于治疗有很重要的作用,所以需要女性进行甲状腺功能测试。[7]
TPO抗体可能被认为与习惯性流产有关,就像轻微的甲状腺功能障碍会导致流产,[7]但是这个建议并不具有普遍性,[33]存在抗体可能无法预测未来的结果。[34]
预防[编辑]

甲减在人群中的预防可以采用向常规食物中添加碘元素,这种公共健康手段在一些甲减是常见病的国家减少了地方性儿童甲减。在多摄入富碘食物如乳制品和鱼类的同时,有些国家在食用盐中添加碘元素来预防甲减。[35]在世界健康组织的鼓励下,[36]已经有130个国家,世界上将近70%的人口食用碘盐。也有一些国家在面包中添加碘盐。除此之外,由于减少食盐摄入,碘缺乏在一些西方国家又重新出现。[35]
孕期和哺乳期的女性每天对碘的需求比其它女性多66%,所以即使采用上述公共卫生手段可能还是缺少碘。[35][37]世界健康组织推荐孕期和哺乳期的女性每天摄入250ug的碘。[38]许多女性可能无法从日常的食物中获取足够的碘,美国甲状腺协会建议这些女性每天口服150ug的碘。[28][39]
筛查[编辑]
在一些国家,通常用TSH的水平对新生儿进行甲减的筛查。这项措施可以提早发现并防止生长发育迟缓。[40]是世界上应用最广的筛查手段。[41]TSH的筛查是用来识别最常见的病因,辅助的T4测试则是用来检测中枢性甲减[21]。如果T4的筛查在出生的时候被使用,会发现中枢性甲减的比例在1:16000 到1:160000之间。考虑到这些儿童通常有脑垂体激素缺陷,早期的诊断会防止病情复杂化。[9]
对于成年人,在人口中大范围的筛查引起了争论。一些组织(如美国预防服务工作组)认为定期检查是不必要的,但是其它一些组织(如美国甲状腺协会)建议在一定年龄段中,两性或者女性间歇性的进行间检查。 目标人群筛查在一些常见甲减的场景中也许是合适的,如其它的自體免疫性甲减和强家族遗传的甲减,接触到了放射性碘,或者对脖子进行了辐射治疗,曾经有过甲状腺损伤,甲状腺本身异常,精神异常,摄入胺碘酮或者锂,以及有其它健康症状的人(如某些心脏和皮肤症状)。[7]建议患有唐氏综合症的人每年进行检查,因为他们有更高的风险患有甲状腺疾病。[42]
治疗[编辑]
激素替代[编辑]
大多数患有甲减或者甲状腺素缺乏的人采用人工合成的长效甲状腺素,左旋甲状腺素进行治疗。[14]在年轻人和健康的具有明显甲减症状的人中,全剂量的激素替代可以立刻使用。在年长的人和有心脏疾病的人,可以在初期采用小剂量以避免过量和其它风险。[7][24]小剂量对于那些温和甲减的人来说也是足够的,患有中枢性甲减的人需要高于平均水平的剂量。[7]
需要监控血液中游离的甲状腺素和TSH水平以判断剂量是否合适。监控需要在首次服药后或者更改剂量后的4-8周后进行。如果合适的剂量确定后,在没有症状改变的情况下可以在6-12个月后进行复查。对于患有central甲减的人,TSH水平并不是可靠的激素剂量判断标准,主要需要依靠游离态T4的的水平来判断。[7][9]左旋甲状腺素最好在早餐前的30-60分钟服用,或者在进食的4小时后,[7]因为食物中的一些物质如钙会抑制吸收。[43]现在没有直接促进甲状腺腺体分泌甲状腺素的方法。[14]
三碘甲状腺氯酸(合成T3)[编辑]
在左旋甲状腺素中添加三碘甲状腺氯酸被建议作为更好的控制症状的方法,但是没有被研究所证实。[14][8][44]在2007年,不列颠甲状腺协会声称T4和T3混合疗法与单纯的T4疗法有更高概率产生副作用并且治疗效果并没有改善。[14][45]类似的,美国治疗指南因为缺少证据,所以不建议混合疗法,虽然他们知道有些采用混合疗法的患者感觉更好。单独使用三碘甲状腺氯酸的疗法还没有足够的研究,所以不建议使用。另外由于它较短的半衰期,需要更频繁的服用。[7]
脱水动物甲状腺素[编辑]
脱水甲状腺素是从动物的甲状腺中进行提取,最常见的动物是猪。这是一种混合疗法,混合了T4和T3。[14]同时还含有降钙素(一种控制钙水平的激素),T1和T2. 这些并不在合成激素治疗药物中出现。[46]这种方式是曾经的主流疗法,但是现在已经不被采用,[14][8]不列颠甲状腺协会和美国专业指南均不建议使用。[7][45]
温和甲减[编辑]
很少的证据证明对于温和甲减的治疗是否有益,也很少证明是否存在过度治疗。温和甲减可能会逐渐增加患冠状动脉病的风险。[47]一份2007年的报告说没有找到激素替换疗法对血脂水平和左心室功能指标的提升。[48]
从2008年开始,一些英国和美国的建议认为正常人的TSH水平低于10mlU/L不需要进行治疗。[7][32][49]美国指南(American guidlines)建议只有在TSH水平低于10mIU/L,并同时存在甲减症状或者甲状腺素过氧化物酶抗体时,有心脏病史或者心脏病发病可能升高时,需要进行治疗。[7]
怀孕[编辑]
对于已知患有甲减的女性怀孕。建议严格检测血清中的TSH水平,应该服用左旋甲状腺素以维持TSH水平在每个妊娠期的正常范围内。第一个妊娠期的正常范围是低于2.5mIU/L,第二个妊娠期和第三个妊娠期低于3.0mIU/L。[14][28]全部的T4水平而不是游离态T4水平应该用来指导治疗。检测结果应该根据怀孕的不同时期进行解读。左旋甲状腺素的剂量在确认怀孕后通常需要提升。[7][24][28]
有TPO抗体的女性怀孕需要进行激素替代,无论TSH水平是否正常。特别是在有流产史和甲状腺技能减退史的情况下。[7]左旋甲状腺素可以减少早产和流产。对于温和甲减并且有TPO抗体的女性,[50]同样强烈建议进行激素补充,以防止温和甲减成为显性甲减。如果决定不治疗,则需要密切检测甲状腺功能,在怀孕的前20周内每4周检查一次。[7]如果不存在TPO抗体,则不建议治疗。[28]
流行病学[编辑]
在世界范围内大概有10亿人面临碘缺乏,但是并不确定导致了多少甲减。[10]在西方国家的基于大量人口在富碘食谱的研究,有0.3%-0.4%的人口有明显的甲减症状,4.3%-5.8%的人口有温和甲减。[7]在温和甲减的人群中,80%的TSH水平低于10mIU/L,这是需要治疗的界限。[32]患有温和甲减的儿童通常会回复正常的甲状腺功能,小部分会发展成明显的甲减。(可以通过检查抗体和TSH水平,脂泻症,和甲状腺肿来预测)[51]
女性比男性更容易患有甲减。基于大量人口的研究显示,女性的TSH水平高于10mIU/L的概率比男性高7倍,这部分人中每年大概有2-4%的概率发展成明显甲减。如果发现有TPO抗体,则风险更高。[7][32]温和甲减感染儿童的概率大概是2%,对于成年人来说,年龄越大的白种人患有温和甲减的风险越高。[31]对于患有唐氏综合症[21][42]和特纳综合症[21]的人来说,患有甲状腺功能异常的概率更高,通常都是患有甲减。
非常严重的甲减和粘液性水肿昏迷是罕见的,据估计发病概率大概是每年每百万人中有0.22个人会发病。大多数病例是年龄大于60岁的女性,尽管在任何年龄段均可能发病。[18]
大多数甲减是主体甲减,中枢性甲减大概每2万至8万人中会出现一例,在甲减人群中大概每千人出现一例。[9]
历史[编辑]
粘液水肿和甲状腺的联系是在19世纪晚期建立起来的,当时被移除甲状腺的人和动物在接受甲状腺组织移植时表现出改善的症状。在1811年,Bernarrd Courtois发现海藻中存在碘。[8]1820年, Jean-Francois Coindet.发现碘与甲状腺肿的大小有关系。Gaspard Adolphe Chatin在1852年证实甲状腺肿是由于碘缺乏造成的,Eugen Baumann 在1896年解释了碘对于甲状腺组织的作用。[52]
在1891年,英国物理学家 George Redmayne Murray 在口服绵羊甲状腺提取物不久后,[8][53]接受了皮下注射。[54]1914年提纯的甲状腺素出现,在1930年代,合成的甲状腺素出现,虽然脱水的动物甲状腺提取物仍然被广泛使用。左旋甲状腺素在1952年被发现。[8]
参考文献[编辑]
- ^ hypothyroidism. Dictionary.com Unabridged. Random House.
- ^ hypothyroidism - definition of hypothyroidism in English from the Oxford dictionary. OxfordDictionaries.com. [2016-01-20]. (原始内容存档于2014-01-10).
- ^ 3.00 3.01 3.02 3.03 3.04 3.05 3.06 3.07 3.08 3.09 3.10 Hypothyroidism. National Institute of Diabetes and Digestive and Kidney Diseases. March 2013 [5 March 2016]. (原始内容存档于5 March 2016).
- ^ 4.0 4.1 Preedy, Victor R.; Burrow, Gerard N.; Watson, Ronald Ross. Comprehensive Handbook of Iodine: Nutritional, Biochemical, Pathological and Therapeutic Aspects. Academic Press. 2009-03-17: 616. ISBN 978-0-08-092086-3 (英语).
- ^ Ferri, Fred F. Ferri's differential diagnosis : a practical guide to the differential diagnosis of symptoms, signs, and clinical disorders 2nd. Philadelphia, PA: Elsevier/Mosby. 2010: Chapter H. ISBN 978-0323076999.
- ^ 6.0 6.1 Syed, Sana. Iodine and the “Near” Eradication of Cretinism. Pediatrics. 2015-04-01, 135 (4). ISSN 0031-4005. PMID 25825529. doi:10.1542/peds.2014-3718 (英语).
- ^ 7.00 7.01 7.02 7.03 7.04 7.05 7.06 7.07 7.08 7.09 7.10 7.11 7.12 7.13 7.14 7.15 7.16 7.17 7.18 7.19 7.20 7.21 7.22 7.23 7.24 7.25 7.26 7.27 7.28 7.29 7.30 Garber, Jeffrey R.; Cobin, Rhoda H.; Gharib, Hossein; Hennessey, James V.; Klein, Irwin; Mechanick, Jeffrey I.; Pessah-Pollack, Rachel; Singer, Peter A.; Woeber for the American Association of Clinical Endocrinologists and American Thyroid Association Taskforce on Hypothyroidism in Adults, Kenneth A. Clinical Practice Guidelines for Hypothyroidism in Adults: Cosponsored by the American Association of Clinical Endocrinologists and the American Thyroid Association. Thyroid. 2012-12-01, 22 (12) [2022-10-29]. ISSN 1050-7256. PMID 22954017. doi:10.1089/thy.2012.0205. (原始内容存档于2022-07-16).
- ^ 8.0 8.1 8.2 8.3 8.4 8.5 8.6 Chakera, Ali J.; Pearce, Simon HS; Vaidya, Bijay. Treatment for primary hypothyroidism: current approaches and future possibilities. Drug Design, Development and Therapy. 2011-12-22, 6 [2022-10-29]. PMC 3267517
 . PMID 22291465. doi:10.2147/DDDT.S12894. (原始内容存档于2022-06-18) (英语).
. PMID 22291465. doi:10.2147/DDDT.S12894. (原始内容存档于2022-06-18) (英语).
- ^ 9.0 9.1 9.2 9.3 9.4 9.5 9.6 Persani, Luca. Central Hypothyroidism: Pathogenic, Diagnostic, and Therapeutic Challenges. The Journal of Clinical Endocrinology & Metabolism. 2012-09-01, 97 (9) [2022-10-29]. ISSN 0021-972X. PMID 22851492. doi:10.1210/jc.2012-1616. (原始内容存档于2022-06-15) (英语).
- ^ 10.0 10.1 Braverman, Lewis E.; Cooper, David. Werner & Ingbar's The Thyroid: A Fundamental and Clinical Text. Lippincott Williams & Wilkins. 2012-07-12: 552 [2020-03-03]. ISBN 978-1-4511-7141-9. (原始内容存档于2022-10-16) (英语).
- ^ Hypothyroidism. Merck Veterinary Manual, 10th edition (online version). 2012 [2013-12-25]. (原始内容存档于2012-08-23).
- ^ Mosby. Mosby's Medical Dictionary - E-Book. Elsevier Health Sciences. 2012-11-15: 887. ISBN 978-0-323-11258-1 (英语).
- ^ 13.0 13.1 13.2 13.3 13.4 Longo, DL; Fauci, AS; Kasper, DL; Hauser, SL; Jameson, JL; Loscalzo, J. 341: disorders of the thyroid gland. Harrison's principles of internal medicine 18th. New York: McGraw-Hill. 2011. ISBN 007174889X.
- ^ 14.0 14.1 14.2 14.3 14.4 14.5 14.6 14.7 Khandelwal, Deepak; Tandon, Nikhil. Overt and Subclinical Hypothyroidism: Who to Treat and How. Drugs. 2012-01, 72 (1). ISSN 0012-6667. PMID 22191793. doi:10.2165/11598070-000000000-00000 (英语).
- ^ Ärzteblatt, Deutscher Ärzteverlag GmbH, Redaktion Deutsches. Euthyroid Goiter With and Without Nodules (23.07.2012). Deutsches Ärzteblatt. [2022-10-29]. PMC 3441105
 . PMID 23008749. doi:10.3238/arztebl.2012.0506. (原始内容存档于2016-04-20) (德语).
. PMID 23008749. doi:10.3238/arztebl.2012.0506. (原始内容存档于2016-04-20) (德语).
- ^ Schilddrüsenunterfunktion (Hypothyreose). Apotheken Umschau. 2016-03-01 [2016-09-20]. (原始内容存档于2016-11-08).
- ^ Ebert, Ellen C. The Thyroid and the Gut. Journal of Clinical Gastroenterology. 2010-07, 44 (6). ISSN 0192-0790. PMID 20351569. doi:10.1097/MCG.0b013e3181d6bc3e (英语).
- ^ 18.0 18.1 18.2 Klubo-Gwiezdzinska, Joanna; Wartofsky, Leonard. Thyroid Emergencies. Medical Clinics of North America. Thyroid Disorders and Diseases. 2012-03-01, 96 (2). ISSN 0025-7125. PMID 22443982. doi:10.1016/j.mcna.2012.01.015 (英语).
- ^ van den Boogaard, Emmy; Vissenberg, Rosa; Land, Jolande A.; van Wely, Madelon; van der Post, Joris A.M.; Goddijn, Mariette; Bisschop, Peter H. Significance of (sub)clinical thyroid dysfunction and thyroid autoimmunity before conception and in early pregnancy: a systematic review. Human Reproduction Update. 2011-09-01, 17 (5) [2022-10-29]. ISSN 1460-2369. PMID 21622978. doi:10.1093/humupd/dmr024. (原始内容存档于2022-06-17) (英语).
- ^ Vissenberg, R.; van den Boogaard, E.; van Wely, M.; van der Post, J. A.; Fliers, E.; Bisschop, P. H.; Goddijn, M. Treatment of thyroid disorders before conception and in early pregnancy: a systematic review. Human Reproduction Update. 2012-07-01, 18 (4) [2022-10-29]. ISSN 1355-4786. PMID 22431565. doi:10.1093/humupd/dms007. (原始内容存档于2022-06-17) (英语).
- ^ 21.0 21.1 21.2 21.3 21.4 Counts, Debra; Varma, Surendra K. Hypothyroidism in Children. Pediatrics In Review. 2009-07-01, 30 (7) [2022-10-29]. ISSN 0191-9601. PMID 19570923. doi:10.1542/pir.30.7.251. (原始内容存档于2022-06-20) (英语).
- ^ 22.0 22.1 Pearce, EN. Update in lipid alterations in subclinical hypothyroidism. The Journal of Clinical endocrinology and Metabolism. Feb 2012, 97 (2): 326–33 [2014-09-13]. PMID 22205712. doi:10.1210/jc.2011-2532. (原始内容存档于2014-01-01).
- ^ 23.0 23.1 Brown, Rosalind S. Autoimmune Thyroiditis in Childhood (PDF). Journal of Clinical Research in Pediatric Endocrinology. 2012-11-15, 4 (4) [2022-10-29]. PMC 3608006
 . PMID 23154164. doi:10.4274/jcrpe.855. (原始内容存档 (PDF)于2022-05-26).
. PMID 23154164. doi:10.4274/jcrpe.855. (原始内容存档 (PDF)于2022-05-26).
- ^ 24.0 24.1 24.2 24.3 Gaitonde, David Y.; Rowley, Kevin D.; Sweeney, Lori B. Hypothyroidism: an update. American Family Physician. 2012-08-01, 86 (3) [2022-10-29]. ISSN 1532-0650. PMID 22962987. (原始内容存档于2022-10-20).
- ^ Stagnaro-Green, Alex. Approach to the Patient with Postpartum Thyroiditis. The Journal of Clinical Endocrinology & Metabolism. 2012-02, 97 (2) [2022-10-29]. ISSN 0021-972X. PMID 22312089. doi:10.1210/jc.2011-2576. (原始内容存档于2022-06-17) (英语).
- ^ Maia, Ana Luiza; Goemann, Iuri Martin; Meyer, Erika L Souza; Wajner, Simone Magagnin. Type 1 iodothyronine deiodinase in human physiology and disease. Journal of Endocrinology. 2011-06, 209 (3) [2022-10-29]. ISSN 0022-0795. PMID 21415143. doi:10.1530/JOE-10-0481. (原始内容存档于2018-06-02).
- ^ Cheng, Sheue-Yann; Leonard, Jack L.; Davis, Paul J. Molecular Aspects of Thyroid Hormone Actions. Endocrine Reviews. 2010-04-01, 31 (2) [2022-10-29]. ISSN 0163-769X. PMC 2852208
 . PMID 20051527. doi:10.1210/er.2009-0007. (原始内容存档于2022-10-26) (英语).
. PMID 20051527. doi:10.1210/er.2009-0007. (原始内容存档于2022-10-26) (英语).
- ^ 28.0 28.1 28.2 28.3 28.4 28.5 28.6 Stagnaro-Green, Alex; Abalovich, Marcos; Alexander, Erik; Azizi, Fereidoun; Mestman, Jorge; Negro, Roberto; Nixon, Angelita; Pearce, Elizabeth N.; Soldin, Offie P.; Sullivan, Scott; Wiersinga, Wilmar. Guidelines of the American Thyroid Association for the Diagnosis and Management of Thyroid Disease During Pregnancy and Postpartum. Thyroid. 2011-10, 21 (10) [2022-10-29]. ISSN 1050-7256. PMC 3472679
 . PMID 21787128. doi:10.1089/thy.2011.0087. (原始内容存档于2022-09-08) (英语).
. PMID 21787128. doi:10.1089/thy.2011.0087. (原始内容存档于2022-09-08) (英语).
- ^ 29.0 29.1 29.2 29.3 So, Michelle; MacIsaac, Richard J.; Grossmann, Mathis. Hypothyroidism. Australian Family Physician. 2012-08, 41 (8) [2022-10-29]. ISSN 0300-8495. PMID 23145394. (原始内容存档于2022-07-22).
- ^ 30.0 30.1 Dons, Robert F.; Jr, Frank H. Wians. Endocrine and Metabolic Disorders: Clinical Lab Testing Manual, Fourth Edition. CRC Press. 2009-06-17: 10. ISBN 978-1-4200-7936-4 (英语).
- ^ 31.0 31.1 31.2 Bona, Gianni; Prodam, Flavia; Monzani, Alice. Subclinical hypothyroidism in children: natural history and when to treat (PDF). Journal of Clinical Research in Pediatric Endocrinology. 2012-11-15, 4 (4) [2022-10-29]. PMC 3608012
 . PMID 23154159. doi:10.4274/jcrpe.851. (原始内容存档 (PDF)于2022-08-03).
. PMID 23154159. doi:10.4274/jcrpe.851. (原始内容存档 (PDF)于2022-08-03).
- ^ 32.0 32.1 32.2 32.3 Fatourechi, Vahab. Subclinical Hypothyroidism: An Update for Primary Care Physicians. Mayo Clinic Proceedings. 2009-01-01, 84 (1). ISSN 0025-6196. doi:10.4065/84.1.65 (英语).
- ^ Evaluation and treatment of recurrent pregnancy loss: a committee opinion. Fertility and Sterility. 2012-11-01, 98 (5). ISSN 0015-0282. PMID 22835448. doi:10.1016/j.fertnstert.2012.06.048 (英语).
- ^ Regan, L; Backos M; Rai, R. The investigation and treatment of couples with recurrent first-trimester and second-trimester miscarriage (PDF). Green-top Guideline No. 17. London: Royal College of Obstetricians and Gynaecologists. 2011-05-19 [26 December 2013]. (原始内容 (PDF)存档于2013年12月31日).
- ^ 35.0 35.1 35.2 Charlton, Karen; Skeaff, Sheila. Iodine fortification: why, when, what, how, and who?. Current Opinion in Clinical Nutrition and Metabolic Care. 2011-11, 14 (6). ISSN 1363-1950. PMID 21892078. doi:10.1097/MCO.0b013e32834b2b30 (英语).
- ^ World Health Organization, UNICEF, ICCIDD. Assessment of iodine deficiency disorders and monitoring their elimination (PDF) 3rd. Geneva: World Health Organization. 2008 [2014-09-23]. ISBN 9789241595827. (原始内容存档 (PDF)于2013-12-28).
- ^ e-Library of Evidence for Nutrition Actions (eLENA). Iodine supplementation during pregnancy. World Health Organization. 2014 [5 March 2014]. (原始内容存档于2014-03-06).
- ^ Reaching Optimal Iodine Nutrition in Pregnant and Lactating Women and Young Children (PDF). Joint Statement by the World Health Organization and United Nations Children's Fund. World Health Organization. 2007 [5 March 2014]. (原始内容存档 (PDF)于2014-03-06).
- ^ Becker, David V.; Braverman, Lewis E.; Delange, François; Dunn, John T.; Franklyn, Jayne A.; Hollowell, Joseph G.; Lamm, Steven H.; Mitchell, Marvin L.; Pearce, Elizabeth; Robbins, Jacob; Rovet, Joanne F. Iodine Supplementation for Pregnancy and Lactation—United States and Canada: Recommendations of the American Thyroid Association. Thyroid. 2006-10, 16 (10) [2022-10-29]. ISSN 1050-7256. PMID 17042677. doi:10.1089/thy.2006.16.949. (原始内容存档于2022-09-12) (英语).
- ^ American Academy of Pediatrics; Rose, SR; Section on Endocrinology and Committee on Genetics, American Thyroid Association; Brown, RS; Public Health Committee, Lawson Wilkins Pediatric Endocrine Society; Foley, T; Kaplowitz, PB; Kaye, CI; Sundararajan, S; Varma, SK. Update of newborn screening and therapy for congenital hypothyroidism. Pediatrics. Jun 2006, 117 (6): 2290–303 [2014-09-23]. PMID 16740880. doi:10.1542/peds.2006-0915. (原始内容存档于2019-06-29).
- ^ Pollitt, RJ. Newborn blood spot screening: new opportunities, old problems. Journal of Inherited Metabolic Disease. Jun 2009, 32 (3): 395–9. PMID 19412659. doi:10.1007/s10545-009-9962-0.
- ^ 42.0 42.1 Malt, EA; Dahl, RC; Haugsand, TM; et al. Health and disease in adults with Down syndrome. Tidsskrift for Den Norske Legeforening (Review). February 2013, 133 (3): 290–4 [2014-09-23]. PMID 23381164. doi:10.4045/tidsskr.12.0390. (原始内容存档于2013-12-03).
- ^ Cascorbi, I. Drug interactions--principles, examples and clinical consequences. Deutsches Ärzteblatt International (Review). August 2012, 109 (33–34): 546–55. PMC 3444856
 . PMID 23152742. doi:10.3238/arztebl.2012.0546.
. PMID 23152742. doi:10.3238/arztebl.2012.0546.
- ^ Escobar-Morreale, Héctor F.; Botella-Carretero, José I.; del Rey, Francisco Escobar; de Escobar, Gabriella Morreale. Treatment of Hypothyroidism with Combinations of Levothyroxine plus Liothyronine. The Journal of Clinical Endocrinology & Metabolism. 2005-08, 90 (8) [2022-10-29]. ISSN 0021-972X. doi:10.1210/jc.2005-0184. (原始内容存档于2022-06-16) (英语).
- ^ 45.0 45.1 British Thyroid Association Executive Committee. Armour Thyroid(USP) and combinedthyroxine/tri-iodothyronine as thyroid hormone replacement (PDF). British Thyroid Association. November 2007 [25 December 2013]. (原始内容 (PDF)存档于2008年12月3日).
- ^ Ebling PR. ESA Position Statement on Desiccated Thyroid or Thyroid Extract (PDF). Endocrine Society of Australia. 2011 [13 December 2013]. (原始内容 (PDF)存档于2014-01-26).
- ^ Ochs, N; Auer, R; Bauer, DC; et al. Meta-analysis: subclinical thyroid dysfunction and the risk for coronary heart disease and mortality. Annals of Internal Medicine (Meta-analysis). June 2008, 148 (11): 832–45. PMID 18490668. doi:10.7326/0003-4819-148-11-200806030-00225.
- ^ Villar, Heloisa Cerqueira Cesar Esteves; Saconato, Humberto; Valente, Orsine; Atallah, Álvaro N. Cochrane Metabolic and Endocrine Disorders Group , 编. Thyroid hormone replacement for subclinical hypothyroidism. Cochrane Database of Systematic Reviews. 2007-07-18, 2009 (1). PMC 6610974
 . PMID 17636722. doi:10.1002/14651858.CD003419.pub2 (英语).
. PMID 17636722. doi:10.1002/14651858.CD003419.pub2 (英语).
- ^ The Royal College of Physicians; The Association for Clinical Biochemistry; The Society for Endocrinology; The British Thyroid Association; et al. The Diagnosis and Management of Primary Hypothyroidism (PDF). 19 November 2008 [2013-06-16]. (原始内容 (pdf)存档于2013年12月7日).
- ^ Reid, Sally M; Middleton, Philippa; Cossich, Mary C; Crowther, Caroline A; Bain, Emily. Cochrane Pregnancy and Childbirth Group , 编. Interventions for clinical and subclinical hypothyroidism pre-pregnancy and during pregnancy. Cochrane Database of Systematic Reviews. 2013-05-31. doi:10.1002/14651858.CD007752.pub3 (英语).
- ^ Monzani, Alice; Prodam, Flavia; Rapa, Anna; Moia, Stefania; Agarla, Valentina; Bellone, Simonetta; Bona, Gianni. ENDOCRINE DISORDERS IN CHILDHOOD AND ADOLESCENCE: Natural history of subclinical hypothyroidism in children and adolescents and potential effects of replacement therapy: a review. European Journal of Endocrinology. 2013-01, 168 (1) [2022-10-29]. ISSN 0804-4643. PMID 22989466. doi:10.1530/EJE-12-0656. (原始内容存档于2022-06-16).
- ^ Leung, Angela; Braverman, Lewis; Pearce, Elizabeth. History of U.S. Iodine Fortification and Supplementation. Nutrients. 2012-11-13, 4 (11) [2014-09-23]. ISSN 2072-6643. PMC 3509517
 . PMID 23201844. doi:10.3390/nu4111740. (原始内容存档于2022-01-29) (英语).
. PMID 23201844. doi:10.3390/nu4111740. (原始内容存档于2022-01-29) (英语).
- ^ Fox, E. L. A Case of Myx dema Treated by Taking Extract of Thyroid by the Mouth. BMJ. 1892-10-29, 2 (1661). ISSN 0959-8138. PMC 2421284
 . PMID 20753901. doi:10.1136/bmj.2.1661.941 (英语).
. PMID 20753901. doi:10.1136/bmj.2.1661.941 (英语).
- ^ Murray, G. R. Note on the Treatment of Myx dema by Hypodermic Injections of an Extract of the Thyroid Gland of a Sheep. BMJ. 1891-10-10, 2 (1606). ISSN 0959-8138. PMC 2273741
 . PMID 20753415. doi:10.1136/bmj.2.1606.796 (英语).
. PMID 20753415. doi:10.1136/bmj.2.1606.796 (英语).
延伸閱讀[编辑]
- Hypothyroidism; a booklet for patients and their families (PDF). American Thyroid Association. 2013 [2013-12-25]. (原始内容 (PDF)存档于2013-06-12).
- UK Guidelines for the use of thyroid function tests (PDF). The Association for Clinical Biochemistry, British Thyroid Association and British Thyroid Foundation. 2006 [2013-12-25]. (原始内容 (PDF)存档于2013-11-17).
參見[编辑]
外部連結[编辑]
- 开放式目录计划中和Hypothyroidism相关的内容
- Hypothyroidism information for patients. American Thyroid Association. [2017-03-25]. (原始内容存档于2017-02-11).
- UK Guidelines for the use of thyroid function tests (PDF). The Association for Clinical Biochemistry, British Thyroid Association and British Thyroid Foundation. 2006 [2013-12-25]. (原始内容存档 (PDF)于2017-06-22).
- Alexander EK, Pearce EN, Brent GA, Brown RS, Chen H, Dosiou C, Grobman WA, Laurberg P, Lazarus JH, Mandel SJ, Peeters RP, Sullivan S. 2017 Guidelines of the American Thyroid Association for the Diagnosis and Management of Thyroid Disease During Pregnancy and the Postpartum. Thyroid. March 2017, 27 (3): 315–389. PMC 3472679
 . PMID 28056690. doi:10.1089/thy.2016.0457.
. PMID 28056690. doi:10.1089/thy.2016.0457.
| |||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||