卟啉
许多卟啉以与金属离子配合的形式存在于自然界中,如含有二氢卟吩与镁配位结构的叶绿素以及与铁配位的血红素。人体内卟啉积累过多时会造成卟啉病,也称紫质症。
性质
[编辑]-
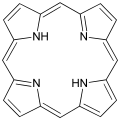
卟吩-最简单的卟啉
-
卟吩的空间填充模型
-
四苯基卟啉的结构
-
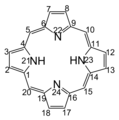
卟啉环的编号系统
卟啉环的编号方式见上图。习惯命名是将5,10,15,20位称为meso位(间),将1,4,6,9,11,14,16,19位称为alpha位(α),将2,3,7,8,12,13,17,18位称为beta位(β)。
卟啉的大分子环是一个24中心26电子的体系,符合休克尔规则中的4n+2通式,因此具有芳香性。卟啉自由碱的中心氮原子可以与+2或+3价的金属阳离子配位,两个氮上的氢原子被金属取代,生成金属卟啉。通常把它们及其衍生物称为金属卟啉化合物。其反应通式如下:
- 卟啉卟啉
四苯并四氮杂卟啉类化合物由苯酐与尿素在氯化亚铜存在下发生缩合制得,呈蓝色,一般称为酞菁。其分子中四个异吲哚环的氮原子可以与金属离子在中心发生配位,生成金属酞菁。金属酞菁化合物色泽鲜艳耐晒,耐热性能优良,着色力强,是很常用的颜料和染料。
以卟啉作为结构单元的超分子是目前分子器件研究的主要方向之一。meso-四苯基卟啉的氯化铁配合物(TPPFeCl)是一个有机合成试剂。卟啉的衍生物有:咕啉、二氢卟吩(2,3-二氢卟啉)、菌绿素、F430(镍四吡咯)等。
自然形成
[编辑]地卟啉,也称为岩卟啉,是一种地质来源的卟啉。[2]它们可能出现在原油、油页岩、煤或沉积岩中。[2][3]卟啉镍石可能是唯一的地卟啉矿物,因为卟啉很少单独出现并形成晶体。[4]
合成
[编辑]实验室合成
[编辑]
实验室中,卟啉通常是用取代醛类和吡咯在酸中的缩合反应来合成的,并且一般需要用路易斯酸催化。反应的产率不高,反应后会产生大量的副产物,可以通过柱色谱法除去。卟啉环与金属盐(如溴化亚铁)作用,可以得到相应的键联金属卟啉。
这个合成卟啉的方法一般被称为罗斯曼法(Rothemund)或阿德勒法(Adler)。1936年Rothemund首先合成四苯基卟啉(TPP)[6][7],他采用吡啶为溶剂,使苯甲醛和吡咯在封管中加热反应数十小时,产率极低,并且可以参与反应的苯甲醛衍生物很少。后来,这个方法被Adler和Longo作了深入研究[8],改为用丙酸作介质,使芳香醛与吡咯回流反应后,冷却、过滤,滤饼用热水和甲醇分别洗涤,真空干燥晶体,得到卟啉。与Rothemund的方法相比,这个改进法可以获得较高产率(20%)的卟啉,操作简单,适用的取代苯甲醛也较多,因此一直沿用至今。

间-四烷基卟啉可由相应醛(比烷基多一个碳)与吡咯缩合而得。回流反应后要用醌类(如DDQ)或其他氧化剂将产生的卟啉原氧化为卟啉。可用对甲苯磺酸作缩合的催化剂。
生物合成
[编辑]生物体内的卟啉合成以柠檬酸循环中的琥珀酰CoA与甘氨酸作原料。两者发生Claisen缩合并脱羧生成δ-氨基乙酰丙酸(ALA),然后两分子的δ-氨基乙酰丙酸缩合,生成含一个吡咯环的胆色素原(PBG)。胆色素原脱氨酶作用下,四分子的胆色素原反应得到羟甲基胆素(HMB),继续反应得到尿卟啉原Ⅲ,构建出四吡咯环系的框架。尿卟啉原Ⅲ之后又先后转化为粪卟啉原Ⅲ、原卟啉原Ⅸ和原卟啉Ⅸ,并在这里分出了血红素和叶绿素的合成系统。
在一些非光合生物(如动物、真菌、非光合原生生物以及细菌中的α-变形菌)中,卟啉合成的关键步骤是由琥珀酰CoA与甘氨酸合成δ-氨基乙酰丙酸。
| 酶 | 底物 | 产物 | 染色体 | EC | OMIM |
| δ-氨基乙酰丙酸合成酶 | 甘氨酸、琥珀酰CoA | δ-氨基乙酰丙酸 | 3p21.1 | 2.3.1.37 (页面存档备份,存于互联网档案馆) | 125290 (页面存档备份,存于互联网档案馆) |
| δ-氨基乙酰丙酸脱水酶 | δ-氨基乙酰丙酸 | 胆色素原 | 9q34 | 4.2.1.24 (页面存档备份,存于互联网档案馆) | 125270 (页面存档备份,存于互联网档案馆) |
| 胆色素原脱氨酶 | 胆色素原 | 羟甲基胆素 | 11q23.3 | 2.5.1.61 (页面存档备份,存于互联网档案馆) | 176000 (页面存档备份,存于互联网档案馆) |
| 尿卟啉原Ⅲ合成酶 | 羟甲基胆素 | 尿卟啉原Ⅲ | 10q25.2-q26.3 | 4.2.1.75 (页面存档备份,存于互联网档案馆) | 606938 (页面存档备份,存于互联网档案馆) |
| 尿卟啉原Ⅲ脱羧酶 | 尿卟啉原Ⅲ | 粪卟啉原Ⅲ | 1q34 | 4.1.1.37 (页面存档备份,存于互联网档案馆) | 176100 (页面存档备份,存于互联网档案馆) |
| 粪卟啉原Ⅲ氧化酶 | 粪卟啉原Ⅲ | 原卟啉原Ⅸ | 3q12 | 1.3.3.3 (页面存档备份,存于互联网档案馆) | 121300 (页面存档备份,存于互联网档案馆) |
| 原卟啉原Ⅸ氧化酶 | 原卟啉原Ⅸ | 原卟啉Ⅸ | 1q22 | 1.3.3.4 (页面存档备份,存于互联网档案馆) | 600923 (页面存档备份,存于互联网档案馆) |
| 亚铁螯合酶 | 原卟啉Ⅸ | 血红素 | 18q21.3 | 4.99.1.1 (页面存档备份,存于互联网档案馆) | 177000 (页面存档备份,存于互联网档案馆) |
参见
[编辑]参考资料
[编辑]- ^ 《汉语大字典》㗊字条目。
- ^ 2.0 2.1 Karl M. Kadish (编). The Porphyrin Handbook. Elsevier. 1999: 381 [2022-06-05]. ISBN 9780123932006. (原始内容存档于2022-06-05).
- ^ Zhang, Bo; Lash, Timothy D. Total synthesis of the porphyrin mineral abelsonite and related petroporphyrins with five-membered exocyclic rings. Tetrahedron Letters. September 2003, 44 (39): 7253. doi:10.1016/j.tetlet.2003.08.007.
- ^ Mason, G. M.; Trudell, L. G.; Branthaver, J. F. Review of the stratigraphic distribution and diagenetic history of abelsonite. Organic Geochemistry. 1989, 14 (6): 585. doi:10.1016/0146-6380(89)90038-7.
- ^ Falvo, RaeAnne E.; Mink, Larry M.; Marsh, Diane F. Microscale Synthesis and 1H NMR Analysis of Tetraphenylporphyrins. J. Chem. Educ.: 237.
- ^ P. Rothemund. A New Porphyrin Synthesis. The Synthesis of Porphin. J. Am. Chem. Soc. 1936, 58 (4): 625–627. doi:10.1021/ja01295a027.
- ^ P. Rothemund. Formation of Porphyrins from Pyrrole and Aldehydes. J. Am. Chem. Soc. 1935, 57 (10): 2010–2011. doi:10.1021/ja01313a510.
- ^ A. D. Adler, F. R. Longo, J. D. Finarelli, J. Goldmacher, J. Assour and L. Korsakoff. A simplified synthesis for meso-tetraphenylporphine. J. Org. Chem. 1967, 32 (2): 476–476. doi:10.1021/jo01288a053.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|




![{\displaystyle {\rm {)+[ML_{n}]^{2+}\rightarrow M(\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/df3fb79b6903aa7dba31a90c017a045ff205fa94)
