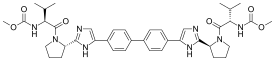
達卡他韋
 | |
| 臨床資料 | |
|---|---|
| 讀音 | /dəˈklætəsvɪər/ də-KLAT-əs-veer |
| 商品名 | Daklinza(坦克干) |
| AHFS/Drugs.com | Monograph |
| MedlinePlus | a615044 |
| 核准狀況 |
|
| 懷孕分級 |
|
| 給藥途徑 | 口服給藥 (片劑) |
| ATC碼 | |
| 法律規範狀態 | |
| 法律規範 |
|
| 藥物動力學數據 | |
| 生物利用度 | 67%[3] |
| 血漿蛋白結合率 | 99%[3] |
| 藥物代謝 | CYP3A4(細胞色素P450 3A4酶) |
| 生物半衰期 | 12–15小時 |
| 排泄途徑 | 糞便 (53%維持原有形式), 腎臟 |
| 識別資訊 | |
| |
| CAS號 | 1009119-64-5 |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| CompTox Dashboard (EPA) | |
| 化學資訊 | |
| 化學式 | C40H50N8O6 |
| 摩爾質量 | 738.89 g·mol−1 |
| 3D模型(JSmol) | |
| |
| |
達卡他韋(英語:Daclatasvir) 以Daklinza(坦克干)的品牌銷售,是一種抗病毒藥物,與其他藥物聯合以治療C型肝炎。[4]與其合併使用的藥物有索非布韋、利巴韋林和干擾素,取決於患者身上的C型肝炎病毒(HCV)類型,以及是否罹患肝硬化。[2]此藥物目前僅有透過口服方式給藥一種。[4]
達卡他韋與索非布韋聯合使用時,常見的副作用有頭痛、疲倦和噁心。[3]達卡他韋與索非布韋,加上利巴韋林聯合使用,最常見的副作用是頭痛、疲倦、噁心和溶血性貧血。[3]使用此藥物時,不可同時服用草藥貫葉連翹、抗生素利福平或治療癲癇病和神經性疼痛的藥物卡馬西平。[4]達卡他韋透過抑制HCV用來編碼的非結構蛋白NS5A而發揮作用。[2]
達卡他韋於2014年在歐盟獲准用於治療用途,並於2015年在美國和印度獲准使用。[5]它已被列於世界衛生組織基本藥物標準清單之中。[6]
開發此藥物的藥廠必治妥施貴寶正從通常不開立這種處方藥的國家將Daklinza撤出,並表示不會在這些國家強制執行其擁有的專利權。[7]
醫療用途
[編輯]達卡他韋於治療基因型 1、3或4型HCV感染時,會加入其他藥物進行聯合療法,合併的藥物包括索非布韋、利巴韋林和干擾素,根據患者的病毒基因型、是否患有肝硬化以及是否進行過肝臟移植而有不同的組合。[8][2][9]
目前尚不清楚達拉他韋是否會進入服用者分泌的乳汁,或是服用者進行母乳哺育時對嬰兒有任何影響。[3]
不良影響
[編輯]當達卡他韋與索非布韋及胺碘酮(一種抗心律不整藥)一起使用時,存在嚴重的心跳過緩風險。[3]
由於尚未將其作為單一藥物進行廣泛研究,尚不清楚單獨使用會產生哪些具體副作用。目前僅在與索非布韋,或是與索非布韋/利巴韋林聯合療法時有不良事件的報告。[3]
採聯合療法(索非布韋 + 達拉他韋)時,有>5%以上的患者中常發生的不良事件有頭痛和疲勞,在三重治療(達卡他韋 + 索非布韋 + 利巴韋林)時,最常見的不良事件 (>10%) 有頭痛、疲勞、噁心和溶血性貧血。[3]
達卡他韋可能會導致同時患有B型肝炎和C型肝炎的人,其B型肝炎重新被活化。歐洲藥品管理局 (EMA) 建議在開始使用達卡他韋治療之前,要對所有患者進行B型肝炎篩檢,以盡量減少B型肝炎再被活化的風險。[10]
交互作用
[編輯]服用達卡他韋時,不得同時使用會強力誘導細胞色素P450的藥物,因為會降低治療效果和產生抗藥性。[3]一些常見,會強力誘導細胞色素P450的藥物有地塞米松、苯妥英、卡馬西平、利福平和貫葉連翹(一種於歐美常見的草藥)。[3]
達卡他韋是細胞色素P450和p-糖蛋白的基質,因此含有前述兩種酵素的強力誘導劑或是抑制劑的藥物會干擾服用者體內的達卡他韋水平。[3]當達卡他韋與會影響細胞色素P450和p-糖蛋白的藥物同時使用時,需進行達卡他韋劑量調整。當達卡他韋與逆轉錄酶抑制劑一起服用時,需要增加達卡他韋的劑量以克服細胞色素P450的誘導作用。而與酮康唑等抗真菌藥物一起服用時,達拉他韋的劑量應予降低。達卡他韋目前與免疫抑制劑、類阿片藥物、抗憂鬱藥、鎮靜劑和心血管藥物同時使用時無需調整劑量。[11]
達卡他韋與胺碘酮及索非布韋同時使用可能會將心率嚴重減緩的風險升高。[3]
藥理學
[編輯]NS5A在HCV複製中的作用
[編輯]NS5A是一種鋅指(帶鋅的蛋白質二聚體),是HCV複製週期中的調節因子,含有一個氨基端雙親性螺旋和三個具有不同結合親和力的功能區段。 氨基端與細胞膜結合,對於複製複合物有重要作用。功能區段 1(胺基酸401-60012)是NS5A的RNA結合區,功能區段 2參與RNA複製。區段 3與病毒組裝相關。[12]
NS5A不僅與細胞膜、HCV複製複合物的其他非結構蛋白及病毒RNA結合,也與PI4KA等輔助因子結合。 PI4KA是一種激酶,可將肌醇環四位磷脂醯肌醇的羥基磷酸化。這種磷酸化會產生磷脂醯肌醇4-磷酸 (PI4P),PI4P是通常位於高基氏體上的對接位點。 PI4P對於招募參與脂類轉運的囊泡效應蛋白有其需要。因此PI4P對於維持高基氏體結構和高基氏體分泌非常重要。[13]
NS5A透過在功能區段 1上結合PI4KA,並在離開高基氏體的地方累積PI4P, 誘導膜網形成,這是一種透過招募脂質囊泡而從內質網生成的膜結構。 HCV的複製複合體位於這種網狀結構上。透過PI4P招募這些膜和脂滴,病毒體可在病毒RNA複製後加以組裝完成。.[14]
病毒體的RNA複製和組裝取決於兩種不同形式NS5A之間的比例。依NS5A的磷酸化率,可分為NS5A (p56) 和高度磷酸化的NS5A (p58)。 當p58的比率較高時,似乎會誘導HCV組裝,而當p58不足時,會導致RNA複製。但科學界對NS5A磷酸化的實際作用尚不清楚。[15][16]
然而,NS5A不僅會調節HCV複製和組裝,還可抑制細胞凋亡,因此受感染的細胞無法像正常細胞一樣會自行分解,而達到遏制感染進行的效果。由於少了細胞凋亡,細胞基因組內的突變也無法引發細胞死亡。而會促進腫瘤的生長。[15]
作用機轉
[編輯]NS5A在功能區段 1中包含有一結合空隙,達卡他韋可插入其中。由於達卡他韋的對稱和氨基酸相關結構,可與結合空隙的氨基酸之間發生氫鍵相互作用。導致NS5A的結構改變而喪失作用,並抑制病毒形成。[17]
PI4KA的募集以及接下來PI4P累積因NS5A的結構受改變而無法進行。新的脂滴和膜成分不再能被膜網中的PI4P招募,且膜網本身也無法持續。但值得一提的是達卡他韋並不會直接抑制PI4KA,因為觀察到在達卡他韋影響的細胞中,PI4P仍然存在於質膜和高基氏體中。達卡他韋也不抑制NS5A誘導的初始PI4KA離域,因為觀察到達卡他韋對僅表達NS5A的細胞內的NS5A功能並無影響。達拉他韋很可能僅抑制與HCV複製複合物內其他蛋白質相關的NS5A的功能,就像抑制RNA複製酶NS4B一樣。結論是此藥物可能僅在HCV多肽完整表達的情況下抑制PI4P過度累積。[18]
此現象與NS5A的功能區段 1的結構有關。據觀察,功能區段 1有兩種不同的構形。達卡他韋與其中之一結合,並將功能區段 1鎖定在該構像中。但NS5A仍然能夠結合PI4KA,這可為前面提到的未感染細胞中的NS5A仍有功能提供解釋。功能區段 1的第二種構像出現在未經藥物影響的細胞中,最有可能與PI4P的過度累積有關,而PI4P的過度累積才能達到複製複合物和膜網的形成和維持。因此PI4KA仍可與NS5A相互作用,但由於結構封鎖,NS5A無法像正常情況般有效活化PI4KA。[16]
抑制PI4P過度累積會導致膜網崩潰,並呈現一種由複製複合物蛋白質的大聚集結構。此外,NS5A似乎從膜網離域,進入胞質溶膠內的脂滴。[15]根據這項觀察結果,HCV複製複合物和病毒體外殼可能仍會形成,但受到達卡他韋的干預而受嚴重損害。[16]
此外也觀察到受達卡他韋治療的受HCV感染細胞,會缺乏過度磷酸化形式的NS5A (p58)。目前尚不清楚達卡他韋是否直接抑制p58形成,或僅為一種副作用。但少了p58可能對於抑制病毒組裝有重要作用。[16]
藥物動力學
[編輯]每日口服60毫克的達卡他韋一次,約4天後,藥物在人類受試者中達到穩態,給藥後約2小時出現濃度峰值。[3]口服給藥的生物利用度為67%。[3]達卡他韋主要經由肝臟酵素CYP3A4代謝,它也是p-糖蛋白的基質。[3]此藥物是種血漿蛋白結合物質。在服用多次達卡他韋的人中,血漿蛋白結合率約為99%,與使用劑量強度無關。[3]口服劑量60毫克和靜脈注射劑量100微克(μg)後的分佈體積為47升。[3]靜脈注射用的達卡他韋仍在試驗階段。
歷史
[編輯]達卡他韋是由必治妥施貴寶的科學家所發現,[17]然後開發出此藥物,並於2010年發布首次I期試驗結果。[17]
此藥物於2014年8月在歐洲、2015年7月在美國、2015年12月在印度獲准使用。它是NS5A抑制劑類別中首個進入市場的藥物。[5]
社會與文化
[編輯]此藥物已被被包含在世界衛生組織基本藥物標準清單之中。[6]
經濟學
[編輯]必治妥施貴寶於2014年12月宣布將根據各國的經濟發展程度,會以不同價格在當地銷售此藥物,並將授權其他藥廠製造通用名藥物,在開發中國家銷售。[19][20]
截至2016年1月,為期12週療程的用藥費用在美國約為63,000美元、在英國約為39,000美元、在法國約為37,000美元,而在埃及則約為525美元。[21]
研究
[編輯]已有測試,將達卡他韋與聚乙二醇干擾素及利巴韋林,[22]以及與其他有直接作用的抗病毒藥物(包括阿蘇那普韋和索非布韋)進行聯合治療。[23]
參見
[編輯]- ^ Prescription medicines: registration of new chemical entities in Australia, 2015. Therapeutic Goods Administration (TGA). 2022-06-21 [2023-04-10]. (原始內容存檔於2023-04-10).
- ^ 2.0 2.1 2.2 2.3 Daklinza film-coated tablets – Summary of Product Characteristics (SPC) - (eMC). Electronic Medicines Compendium. September 2016. (原始內容存檔於2016-11-09).
- ^ 3.00 3.01 3.02 3.03 3.04 3.05 3.06 3.07 3.08 3.09 3.10 3.11 3.12 3.13 3.14 3.15 3.16 3.17 Daklinza (daclatasvir) tablets, for oral useInitial U.S. Approval: 2015. DailyMed. 2019-10-16 [2021-11-19]. (原始內容存檔於2023-04-17).
- ^ 4.0 4.1 4.2 Daclatasvir Dihydrochloride. The American Society of Health-System Pharmacists. [2016-12-06]. (原始內容存檔於2016-11-05).
- ^ 5.0 5.1 Hepatitis C Treatment Snapshots: Daclatasvir (PDF). amFAR TreatAsia. February 2016. (原始內容存檔 (PDF)於2016-09-03).
- ^ 6.0 6.1 World Health Organization. World Health Organization model list of essential medicines: 21st list 2019. Geneva: World Health Organization. 2019. hdl:10665/325771
 . WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
. WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
- ^ Important information about the discontinuation of Daklinza. Bristol Myers Squibb. 2020-03-09 [2020-06-19]. (原始內容存檔於2020-06-19).
- ^ Daklinza, INN-daclatasvir (PDF).[永久失效連結]
- ^ Pol S, Corouge M, Vallet-Pichard A. Daclatasvir-sofosbuvir combination therapy with or without ribavirin for hepatitis C virus infection: from the clinical trials to real life. Hepatic Medicine: Evidence and Research. March 2016, 8: 21–6. PMC 4786064
 . PMID 27019602. doi:10.2147/HMER.S62014
. PMID 27019602. doi:10.2147/HMER.S62014  .
.
- ^ Direct-acting antivirals indicated for treatment of hepatitis C (interferon-free). European Medicines Agency (EMA). 2018-09-17 [2020-02-04]. (原始內容存檔於2020-02-03).
- ^ Garimella T, You X, Wang R, Huang SP, Kandoussi H, Bifano M, et al. A Review of Daclatasvir Drug-Drug Interactions. Advances in Therapy. November 2016, 33 (11): 1867–1884. PMC 5083780
 . PMID 27664109. doi:10.1007/s12325-016-0407-5.
. PMID 27664109. doi:10.1007/s12325-016-0407-5.
- ^ Alvisi G, Madan V, Bartenschlager R. Hepatitis C virus and host cell lipids: an intimate connection. RNA Biology. 2011, 8 (2): 258–69. PMID 21593584. S2CID 912438. doi:10.4161/rna.8.2.15011.
- ^ Burke JE. Structural Basis for Regulation of Phosphoinositide Kinases and Their Involvement in Human Disease. Molecular Cell. September 2018, 71 (5): 653–673. PMID 30193094. doi:10.1016/j.molcel.2018.08.005
 .
.
- ^ Bishé B, Syed G, Siddiqui A. Phosphoinositides in the hepatitis C virus life cycle. Viruses. October 2012, 4 (10): 2340–58. PMC 3497055
 . PMID 23202467. doi:10.3390/v4102340
. PMID 23202467. doi:10.3390/v4102340  .
.
- ^ 15.0 15.1 15.2 Pawlotsky JM. NS5A inhibitors in the treatment of hepatitis C. Journal of Hepatology. August 2013, 59 (2): 375–82. PMID 23567084. doi:10.1016/j.jhep.2013.03.030
 .
.
- ^ 16.0 16.1 16.2 16.3 Chukkapalli V, Berger KL, Kelly SM, Thomas M, Deiters A, Randall G. Daclatasvir inhibits hepatitis C virus NS5A motility and hyper-accumulation of phosphoinositides. Virology. February 2015, 476: 168–179. PMC 4323755
 . PMID 25546252. doi:10.1016/j.virol.2014.12.018.
. PMID 25546252. doi:10.1016/j.virol.2014.12.018.
- ^ 17.0 17.1 17.2 Belema M, Meanwell NA. Discovery of daclatasvir, a pan-genotypic hepatitis C virus NS5A replication complex inhibitor with potent clinical effect. Journal of Medicinal Chemistry. June 2014, 57 (12): 5057–71. PMID 24749835. doi:10.1021/jm500335h.
- ^ Chukkapalli, Vineela; Berger, Kristi L. Daclatasvir inhibits hepatitis C virus NS5A motility and hyper-accumulation of phosphoinositides (PDF). Virology. 2014-12-26, 476 (2015): 168–179 [2024-02-01]. (原始內容存檔 (PDF)於2024-02-01).
- ^ Edwards DJ, Coppens DG, Prasad TL, Rook LA, Iyer JK. Access to hepatitis C medicines. Bulletin of the World Health Organization. November 2015, 93 (11): 799–805. PMC 4622162
 . PMID 26549908. doi:10.2471/BLT.15.157784. (原始內容存檔於2016-11-09).
. PMID 26549908. doi:10.2471/BLT.15.157784. (原始內容存檔於2016-11-09).
- ^ MSF Briefing Document May 2015 (PDF). Médecins Sans Frontières/Doctors Without Borders. [2016-11-09]. (原始內容 (PDF)存檔於2017-01-18).
- ^ Hill A, Simmons B, Gotham D, Fortunak J. Rapid reductions in prices for generic sofosbuvir and daclatasvir to treat hepatitis C. Journal of Virus Eradication. January 2016, 2 (1): 28–31. PMC 4946692
 . PMID 27482432. doi:10.1016/S2055-6640(20)30691-9.
. PMID 27482432. doi:10.1016/S2055-6640(20)30691-9.
- ^ Peng Q, Li K, Cao MR, Bie CQ, Tang HJ, Tang SH. Daclatasvir combined with peginterferon-α and ribavirin for the treatment of chronic hepatitis C: a meta-analysis. SpringerPlus. 15 September 2016, 5 (1): 1569. PMC 5023653
 . PMID 27652142. doi:10.1186/s40064-016-3218-x
. PMID 27652142. doi:10.1186/s40064-016-3218-x  .
.
- ^ Sulkowski MS, Gardiner DF, Rodriguez-Torres M, Reddy KR, Hassanein T, Jacobson I, et al. Daclatasvir plus sofosbuvir for previously treated or untreated chronic HCV infection. The New England Journal of Medicine. January 2014, 370 (3): 211–21. PMID 24428467. doi:10.1056/NEJMoa1306218
 .
.
外部連結
[編輯]- Daclatasvir. Drug Information Portal. U.S. National Library of Medicine. [2024-02-11]. (原始內容存檔於2017-01-24).
- Daclatasvir dihydrochloride. Drug Information Portal. U.S. National Library of Medicine. [2024-02-11]. (原始內容存檔於2021-12-04).
