紅血球生成素
紅血球生成素(英語:Erythropoietin,簡稱EPO),或稱促紅血球生成素,是一種醣蛋白激素,其控制紅血球生成,或紅血球的產生。在骨髓中它是紅血球前體細胞的一種細胞因子(蛋白質信號傳導分子)。人類的促紅細胞生成素有34kDa的分子量。人體的促紅血球生成素由肝臟和腎合成分泌。嬰幼兒時期主要由肝臟合成,成年後主要由腎臟合成。它同時具有其他的生物功能。例如對大腦對神經受損的反應其重要作用,同時也參與傷口癒合過程。
促紅血球生成素因為層出不窮的禁藥事件而為公眾所知。注射人工合成的紅血球生成激素刺激劑(ESA)可以提高運動員的成績。這種藥物與人體自身合成的促紅血球生成素有微小的差別,比較容易被檢測出。可是後來,新版禁藥可以與自身DNA結合,變得難以檢驗出來。
歷史
[編輯]血液學家 Dr. John Adamson 和腎臟專家Dr. Joseph W. Eschbach在1970年代,研究了綿羊和其它動物的許多腎衰竭例子和紅血球生成激素在血紅血球形成所扮演的角色。這兩個科學家建立了這一原則「在骨髓中紅血球生成激素刺激血紅血球的製造」,根據這個發現為治療人類貧血症奠定了基礎。
在1980年代,Adamson, Eschbach和其他科學家在美國西北腎臟中心進行了Epogen(由安進公司通過遺傳工程人工合成的紅血球生成激素)的臨床試驗。這個試驗非常成功,其結果被發表在1987年1月底新英格蘭醫學期刊。
1989年,美國食品藥品監督管理局(FDA)批准了Epogen在臨床上的使用。
調節血紅血球
[編輯]EPO是由腎皮質的纖維母細胞生成的。其調節被認為是依賴於血氧的反饋機制。EPO的轉錄因子,缺氧誘導因子(HIFs)在有氧狀態下被羥基化且被蛋白酶所分解。[1]
臨床使用
[編輯]被用於治療的EPO是通過DNA重組技術在哺乳動物細胞的細胞培養下產生的。它被用來治療由於慢性腎病所導致的,或者由於放療和化療治療癌症所導致的貧血症。
慢性腎病所導致的貧血症
[編輯]在進行透析治療(第5期慢性腎病的患者在進行EPO治療時需要補充鐵質。[2]在美國透析病人大多會給Epogen,其他國家會給不同品牌的紅血球生成激素。
除了透析患者,EPO也被用來治療沒有做透析治療的慢性腎病所導致的貧血(第3,4期慢性腎病和做工腎移植的患者)。有兩類(3個品牌的)EPO用於慢性腎病(無透析)貧血症的治療,他們是:
- epoetin (Procrit(also known as Eprex), NeoRecormon)
- darbepoetin (Aranesp).
- PDpoetin(an erythropoietin produced in Iran by Pooyesh Darou Pharmaceuticals)
美國市場品牌:
- epoetin (Procrit and Epogen)
治療癌症所導致的貧血症
[編輯]2008年3月,美國食品藥品監督管理局(FDA)的顧問團支持為了癌症患者而在市場上保留安進公司和強生公司的紅血球生成激素刺激劑(ESA)。這是由於FDA認為一些研究結果顯示,服用抗貧血藥物的化療病人有增加死亡和腫瘤生長的危險。根據FDA的數據,各類癌症都有增加,包括乳腺癌,淋巴癌,宮頸癌,頭,頸,和非小細胞的肺癌。[3]
危重病人的貧血症
[編輯]市場上有2種EPO(3個品牌)可以用於危重病人的貧血症治療。它們是
- epoetin (Procrit(also known as Eprex), NeoRecormon)
- darbepoetin (Aranesp).
- PDpoetin(an erythropoietin produced in Iran by Pooyesh Darou pharmaceuticals)
最近的隨機對照臨床試驗[4]顯示EPO並不改變危重病人的輸血次數。令人吃驚的是接受EPO治療的危重病人有較低的死亡率。統計顯示,這個結果在29天有了顯著性差異但是這種差異在140天後就不是很顯著了。由於外傷而入住重症監護病房(ICU)的病人的死亡率有最為顯著的變化。作者們對這種死亡率的降低的可能性的病原學的原因提出了幾種猜測。血栓的增加,外傷病人的死亡率的降低,以及外科病人不明顯的死亡率的降低,可能是EPO的促凝血效果導致的。無論如何,這個研究建議將來的研究方向是哪種危重病人能夠受益於EPO的治療,如果EPO的治療真能夠給危重病人帶來益處的話,因為在大量的臨床試驗中,EPO導致血栓的發生非常的明顯,這使得EPO的治療大打折扣。總之,在EPO治療時應該認真權衡其益處和壞處,再有針對性的治療。
副作用
[編輯]由於EPO影響了紅血球的數量,健康者使用會導致心臟負擔加重,從而增加了心臟衰竭的風險。[需要可靠醫學來源]
作為興奮劑使用
[編輯]作為興奮劑,紅血球生成激素刺激劑(ESA)長久以來被用於耐力性比賽,如賽馬、拳擊、自行車、划船、長跑、競走、雪鞋行走、越野滑雪、冬季兩項、三項全能等運動項目。因為在這些項目中紅血球輸氧量往往決定了成績好壞。服用該禁藥後,可為肌肉輸送更多的氧氣,從而增強耐力。在該禁藥合成之前,有人會將自己的血液提前抽出,處理後待比賽前1-7天將紅血球輸回體內,但這樣既麻煩亦危險,故1990年代逐漸被禁藥替代。服用該禁藥除了違反體育精神外,也因為紅血球增多,血液更粘稠,而導致高血壓,提高栓塞和中風的風險。
1990年代該禁藥據信被廣泛使用,但一時找不到檢測的方法。在世界反興奮劑組織的支持下,法國反興奮劑實驗室的科學家研發出檢測手段,可以通過尿檢分辨出合成藥物與人體自身分泌物質的微小差別。2002年鹽湖城冬奧會首次有該藥物在大賽中被檢出。該興奮劑的使用終於得到遏制。然而,有些口服藥物可以穩定缺氧誘導轉錄因子(英語:hypoxia-inducible transcription factors),活化紅血球生成素基因,從而刺激內源促紅血球生成素分泌,這些藥物目前尚無法檢測。
相關條目
[編輯]相關圖象
[編輯]-
EPO hematopoiesis (German)
-
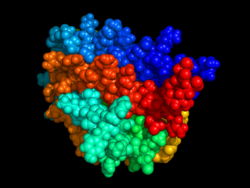
EPO structure
-
EPO sales
-
Epo blotting
參考資料
[編輯]- ^ Jelkmann, W. Erythropoietin after a century of research: younger than ever. Eur J Haematol. 2007, 78 (3): 183–205. PMID 17253966. doi:10.1111/j.1600-0609.2007.00818.x.
- ^ Macdougall IC, Tucker B, Thompson J, Tomson CR, Baker LR, Raine AE. A randomized controlled study of iron supplementation in patients treated with erythropoietin. Kidney Int. 1996, 50 (5): 1694–9. PMID 8914038. doi:10.1038/ki.1996.487.
- ^ Aaron Smith. FDA panel gives surprise OK to Amgen and J&J. CNN. (原始內容存檔於2011-08-09).
- ^ Howard L. Corwin et al., 「Efficacy and Safety of Epoetin Alfa in Critically Ill Patients,」 N Engl J Med 357, no. 10 (September 6, 2007): 965-976, http://content.nejm.org/cgi/content/abstract/357/10/965 (頁面存檔備份,存於互聯網檔案館) (accessed September 6, 2007).
延伸閱讀
[編輯]- Takeuchi M, Kobata A. Structures and functional roles of the sugar chains of human erythropoietins.. Glycobiology. 1992, 1 (4): 337–46. PMID 1820196. doi:10.1093/glycob/1.4.337.
- Semba RD, Juul SE. Erythropoietin in human milk: physiology and role in infant health.. Journal of human lactation : official journal of International Lactation Consultant Association. 2002, 18 (3): 252–61. PMID 12192960.
- Ratcliffe PJ. From erythropoietin to oxygen: hypoxia-inducible factor hydroxylases and the hypoxia signal pathway.. Blood Purif. 2003, 20 (5): 445–50. PMID 12207089. doi:10.1159/000065201.
- Westenfelder C. Unexpected renal actions of erythropoietin.. Exp. Nephrol. 2003, 10 (5-6): 294–8. PMID 12381912. doi:10.1159/000065304.
- Becerra SP, Amaral J. Erythropoietin--an endogenous retinal survival factor.. N. Engl. J. Med. 2002, 347 (24): 1968–70. PMID 12477950. doi:10.1056/NEJMcibr022629.
- Genc S, Koroglu TF, Genc K. Erythropoietin and the nervous system.. Brain Res. 2004, 1000 (1-2): 19–31. PMID 15053948. doi:10.1016/j.brainres.2003.12.037.
- Fandrey J. Oxygen-dependent and tissue-specific regulation of erythropoietin gene expression.. Am. J. Physiol. Regul. Integr. Comp. Physiol. 2004, 286 (6): R977–88. PMID 15142852. doi:10.1152/ajpregu.00577.2003.
- Juul S. Recombinant erythropoietin as a neuroprotective treatment: in vitro and in vivo models.. Clinics in perinatology. 2004, 31 (1): 129–42. PMID 15183662. doi:10.1016/j.clp.2004.03.004.
- Buemi M, Caccamo C, Nostro L; et al. Brain and cancer: the protective role of erythropoietin.. Med Res Rev. 2005, 25 (2): 245–59. PMID 15389732. doi:10.1002/med.20012.
- Sytkowski AJ. Does erythropoietin have a dark side? Epo signaling and cancer cells.. Sci. STKE. 2007, 2007 (395): pe38. PMID 17636183. doi:10.1126/stke.3952007pe38.
外部連結
[編輯]- NYT (頁面存檔備份,存於互聯網檔案館) 1987 announcement of Epogen's clinical success
- Patient information on Epogen (頁面存檔備份,存於互聯網檔案館)
- Patient information on Aranesp (頁面存檔備份,存於互聯網檔案館)
- Patient information on Procrit (頁面存檔備份,存於互聯網檔案館)