立方烷
| 立方烷 | |||
|---|---|---|---|
| |||
| |||
| IUPAC名 Pentacyclo[4.2.0.02,5.03,8.04,7]octane 五环[4.2.0.02,5.03,8.04,7]辛烷 | |||
| 别名 | 五环辛烷 | ||
| 识别 | |||
| CAS号 | 277-10-1 | ||
| ChemSpider | 119867 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | TXWRERCHRDBNLG-UHFFFAOYAL | ||
| ChEBI | 33014 | ||
| 性质 | |||
| 化学式 | C8H8 | ||
| 摩尔质量 | 104.15 g·mol⁻¹ | ||
| 密度 | 1.29 g/cm3 | ||
| 熔点 | 133.5 °C(407 K)([1]) | ||
| 沸点 | 161.6 °C(435 K)([1]) | ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
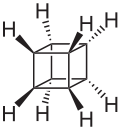
立方烷[2](英语:Cubane)是一种人工合成的烷烃,又称五环辛烷,化学式为C8H8,外观为有光泽的晶体。八个碳原子对称地排列在立方体的八个角上。此烷烃属于柏拉图烃的一种。立方烷于1964年由芝加哥大学的Dr. Philip Eaton与Thomas W. Cole首先合成。[3]在他们合成出立方烷之前,人们曾一度认为其不可合成,因为碳碳键的键角均为90度,张力过大而不稳定。不过当此物质被合成出以后,人们发现它在动力学上很稳定。立方烷生成热、密度等均很大,因而备受瞩目[4]。
立方烷的衍生物用途也较为广泛。如立方烷的八个顶点全被硝化后得到的八硝基立方烷是一种高能量密度的炸药[5]。多异氰基立方烷亦是高能量密度材料[4]。
结构
[编辑]立方烷分子结构为立方体型,8个顶角处各有一个碳原子,另各有一个氢原子与之相连。碳原子采用变形的sp3杂化,C-C键键长155.1pm,大于一般的碳碳单键。[6]:99
合成路线
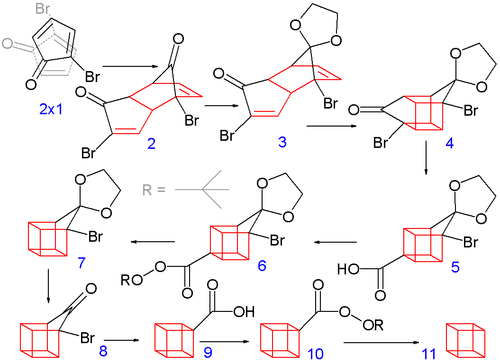
[编辑]1964年的立方烷有机合成[3][7]比较经典,其起始原料是2-环戊烯酮(即第一部分中的化合物1.1):
| 第一部分:合成立方烷的前体2-溴代环戊二烯酮 |
|---|
在溶剂四氯化碳中,N-溴代丁二酰亚胺上的溴原子取代了2-环戊烯酮烯丙位上的氢,生成化合物1.2,然后在正戊烷 - 二氯甲烷混合溶剂中将其进一步溴化得到三溴代物1.3,后者再在乙醚中被二甲胺消除两分子溴化氢便可得到2-溴代环戊二烯酮1.4。[3][7]
| 第二部分:合成立方烷 |
|---|
在第二部分中,2.1首先自发地二聚为2.2,这是一个迪尔斯-阿尔德反应,与环戊二烯二聚为双环戊二烯较为相似。因为每个溴原子都需要与另一溴原子以及羰基保持最小的位阻,另外生成内型产物的过渡态中有次级轨道作用[8]:347[注 1],所以这步反应只生成内型产物,这是后续步骤成功的前提。接着在溶剂苯中,用对甲苯磺酸催化,以乙二醇保护两个羰基,使其成为缩酮。其中一个被保护的羰基在盐酸水溶液的作用下会被选择性去保护,而得到2.3。
在下一步中,内型产物2.3(两个碳碳双键较为接近)通过光化学[2+2]环加成反应形成了笼状化合物2.4。在氢氧化钾的作用下,α-溴代酮通过法沃斯基重排而缩环,转变为羧酸2.5。随后,在氯化亚砜的作用下将羧基转为酰氯,后者与过氧化叔丁醇反应,在吡啶中生成了叔丁基过氧酯2.6。将2.6加热后可进行脱羧反应变为2.7。同样地,将另一个羰基去保护,得到2.8,然后以相同的手法通过法沃斯基重排得到2.9,再脱羧得到2.10与2.11,最后在甲醇溶液中析出结晶而得到产品。[3][7]
反应
[编辑]立方烷可以通过金属离子催化的σ迁移反应转变为楔形烷[9][10]。
在铑催化剂下,立方烷会转变成三环辛二烯,后者在50–60 °C下分解成环辛四烯。[11]
参见
[编辑]- 其他柏拉图烃:
- 名称独特的化学物质列表
注释
[编辑]参考资料
[编辑]- ^ 1.0 1.1 Biegasiewicz, Kyle; Griffiths, Justin; Savage, G. Paul; Tsanakstidis, John; Priefer, Ronny. Cubane: 50 years later. Chemical Reviews. 2015, 115 (14): 6719–6745. PMID 26102302. doi:10.1021/cr500523x.
- ^ 國家教育研究院樂詞網--立方烷. terms.naer.edu.tw. [2023-05-27]. (原始内容存档于2023-05-27).
- ^ 3.0 3.1 3.2 3.3 Cubaneand Thomas W. Cole. Philip E. Eaton and Thomas W. Cole J. Am. Chem. Soc.; 1964; 86(15) pp 3157 - 3158; doi:10.1021/ja01069a041
- ^ 4.0 4.1 张骥 肖鹤鸣. 多异氰基立方烷生成热的理论研究——高能量密度材料(HEDM)的寻求. 《中国科学:B辑》. 2001 (6). 493-498.. [2014-08-19]. (原始内容存档于2020-04-10).
- ^ 郑剑. 硝基立方烷及其氮杂衍生物的能量特性计算研究. 《固体火箭技术》. 1995 (1). 45-53.. [2014-08-19]. (原始内容存档于2020-04-10).
- ^ 周公度. 《化学中的多面体》. 北京大学出版社. 2009年6月. ISBN 9787301092149.
- ^ 7.0 7.1 7.2 The Cubane System Philip E. Eaton and Thomas W. Cole J. Am. Chem. Soc.; 1964; 86(5) pp 962 - 964; doi:10.1021/ja01059a072
- ^ 8.0 8.1 邢其毅等. 《基础有机化学》(第三版)上册. 高等教育出版社. 2005年6月. ISBN 9787040166378.
- ^ Smith, Michael B.; March, Jerry. March's Advanced Organic Chemistry
 5th. John Wiley & Sons. 2001: 1459. ISBN 0-471-58589-0.
5th. John Wiley & Sons. 2001: 1459. ISBN 0-471-58589-0.
- ^ Kindler, K.; Lührs, K. Studien über den Mechanismus chemischer Reaktionen, XXIII. Hydrierungen von Nitrilen unter Verwendung von Terpenen als Wasserstoffdonatoren. Chem. Ber. 1966, 99: 227–232. doi:10.1002/cber.19660990135.
- ^ Cassar, Luigi; Eaton, Philip E.; Halpern, Jack. Catalysis of symmetry-restricted reactions by transition metal compounds. Valence isomerization of cubane. Journal of the American Chemical Society. 1970, 92 (11): 3515–3518 [2023-02-04]. ISSN 0002-7863. doi:10.1021/ja00714a075. (原始内容存档于2023-02-04) (英语).
| ||||||||||||||||||||||||||||||||