硫化鈉
外觀
| 硫化鈉 | |
|---|---|

| |
| |
| 別名 | Sodium sulfide |
| 識別 | |
| CAS號 | 1313-82-2 1313-84-4(九水) |
| PubChem | 237873 |
| ChemSpider | 14120 |
| SMILES |
|
| InChI |
|
| InChIKey | GRVFOGOEDUUMBP-UHFFFAOYAP |
| UN編號 | 1385(無水) 1849(水合物) |
| EINECS | 215-211-5 |
| ChEBI | 76208 |
| RTECS | WE1905000 |
| 性質 | |
| 化學式 | 無水:Na2S 九水:Na2S · 9H2O |
| 摩爾質量 | 無水:78.046 g/mol 九水:240.182 g·mol⁻¹ |
| 外觀 | 無色潮解固體 |
| 熔點 | 1180 °C (無水) |
| 溶解性(水) | 可溶 |
| 相關物質 | |
| 其他陰離子 | 氧化鈉、硒化鈉、碲化鈉、釙化鈉 |
| 其他陽離子 | 硫化鋰、硫化鉀、硫化銣、硫化銫 |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
硫化鈉是一種無機鹽,化學式為Na2S,通常以九水合物Na2S·9H2O的形式存在。無水物和九水合物都是無色可溶的固體,在水溶液中水解呈強鹼性。露置在空氣中時,硫化鈉會放出有臭雞蛋氣味的劇毒硫化氫氣體。
性質
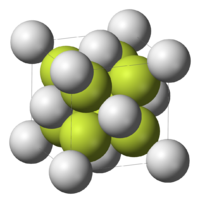
[編輯]Na2S有反螢石結構,Na+取代了CaF2中F−的位置,S2−則取代了Ca2+的位置。在溶液中S2−會強烈水解,分別生成HS−和H2S,而使溶液呈強鹼性:
- S2− + H2O → HS− + OH−
- HS− + H2O ⇌ H2S + OH−
硫化鈉能溶解硫生成多硫化鈉(Na2Sx)。
生產
[編輯]工業上由焦炭(高溫轉爐、1373K)還原Na2SO4來製備Na2S。[1]
- Na2SO4 + 4C → Na2S + 4CO
也可通過氫氣(沸騰爐、1373K)還原Na2SO4來製備Na2S。
- Na2SO4 + 4H2 → Na2S + 4H2O
實驗室中可由鈉和硫在氨中或萘的存在下於四氫呋喃中反應來製備無水硫化鈉。[2]
- 2Na + S → Na2S
- H2S + 2NaOH → Na2S + 2H2O
安全
[編輯]Na2S及其水合物有毒,使用時需注意。其水溶液呈強鹼性,會腐蝕皮膚,且會與酸迅速反應放出劇毒硫化氫氣體。 離子方程式: S2- +2H+ =H2S↑
參見
[編輯]參考資料
[編輯]- ^ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ^ J.-H. So and P. Boudjouk. N. G. Russell , 編. Hexamethyldisilathiane. Inorganic Syntheses. 1992. doi:10.1002/9780470132609.ch11.
