胞质溶胶:修订间差异
JimGrassroot(留言 | 贡献) |
JimGrassroot(留言 | 贡献) |
||
| 第62行: | 第62行: | ||
通过在细胞质中积累{{le|渗透保护剂|Osmoprotectant}}例如{{le|甜菜碱|Betaine}}或[[海藻糖]],细胞可以处理更大的渗透变化<ref name=Lang/>。 这些分子中的一些可以使细胞在完全干燥的情况下存活,并使生物体进入称为[[隱生]]的假死状态<ref>{{cite journal |vauthors=Sussich F, Skopec C, Brady J, Cesàro A |title=Reversible dehydration of trehalose and anhydrobiosis: from solution state to an exotic crystal? |journal=Carbohydr. Res. |volume=334 |issue=3 |pages=165–76 |date=August 2001 |pmid=11513823 |doi=10.1016/S0008-6215(01)00189-6}}</ref>。 在这种状态下,细胞溶质和渗透保护剂变成玻璃状固体,有助于稳定蛋白质和细胞膜免受干燥的破坏作用<ref>{{cite journal |vauthors=Crowe JH, Carpenter JF, Crowe LM |title=The role of vitrification in anhydrobiosis |journal=Annu. Rev. Physiol. |volume=60 |issue= |pages=73–103 |year=1998 |pmid=9558455 |doi=10.1146/annurev.physiol.60.1.73}}</ref>。 |
通过在细胞质中积累{{le|渗透保护剂|Osmoprotectant}}例如{{le|甜菜碱|Betaine}}或[[海藻糖]],细胞可以处理更大的渗透变化<ref name=Lang/>。 这些分子中的一些可以使细胞在完全干燥的情况下存活,并使生物体进入称为[[隱生]]的假死状态<ref>{{cite journal |vauthors=Sussich F, Skopec C, Brady J, Cesàro A |title=Reversible dehydration of trehalose and anhydrobiosis: from solution state to an exotic crystal? |journal=Carbohydr. Res. |volume=334 |issue=3 |pages=165–76 |date=August 2001 |pmid=11513823 |doi=10.1016/S0008-6215(01)00189-6}}</ref>。 在这种状态下,细胞溶质和渗透保护剂变成玻璃状固体,有助于稳定蛋白质和细胞膜免受干燥的破坏作用<ref>{{cite journal |vauthors=Crowe JH, Carpenter JF, Crowe LM |title=The role of vitrification in anhydrobiosis |journal=Annu. Rev. Physiol. |volume=60 |issue= |pages=73–103 |year=1998 |pmid=9558455 |doi=10.1146/annurev.physiol.60.1.73}}</ref>。 |
||
细胞质基质中的低浓度钙允许[[钙]]离子在{{le|钙信号传送|Calcium signaling}中起[[第二信使系统|第二信使]]的作用。 在这里,诸如[[激素]]或[[动作电位]]的信号打开钙通道,使[[钙]]涌入细胞质基质<ref>{{cite journal |author=Berridge MJ |title=Elementary and global aspects of calcium signalling |journal=J. Physiol. |volume=499 |issue= Pt 2|pages=291–306 |date=1 March 1997|pmid=9080360 |pmc=1159305 |doi=10.1113/jphysiol.1997.sp021927 |url=http://www.jphysiol.org/cgi/pmidlookup?view=long&pmid=9080360 }}</ref> 。 细胞质基质钙的这种突然增加激活了其他信号分子,如[[钙调蛋白]]和[[蛋白激酶C]]<ref>{{cite journal |vauthors=Kikkawa U, Kishimoto A, Nishizuka Y |title=The protein kinase C family: heterogeneity and its implications |journal=Annu. Rev. Biochem. |volume=58 |pages=31–44 |year=1989 |pmid=2549852 |doi=10.1146/annurev.bi.58.070189.000335}}</ref>。 其他离子如氯离子和钾也可能在细胞质基质中具有信号传导功能,但这些并不十分清楚<ref>{{cite journal |vauthors=Orlov SN, Hamet P |title=Intracellular monovalent ions as second messengers |journal=J. Membr. Biol. |volume=210 |issue=3 |pages=161–72 |date=April 2006 |pmid=16909338 |doi=10.1007/s00232-006-0857-9}}</ref>。 |
|||
=== 大分子 === |
=== 大分子 === |
||
那些没有与[[细胞膜]]或[[细胞骨架]]结合的蛋白质分子溶解在细胞质基质中。 细胞中的蛋白质含量非常高,接近200 mg / ml,占细胞质基质体积的20-30%<ref name=Ellis>{{cite journal |author=Ellis RJ |title=Macromolecular crowding: obvious but underappreciated |journal=Trends Biochem. Sci. |volume=26 |issue=10 |pages=597–604 |date=October 2001 |pmid=11590012 |doi=10.1016/S0968-0004(01)01938-7}}</ref>。 然而,准确测量蛋白质在完整细胞中溶解在细胞质基质中的程度是困难的,因为一些蛋白质似乎与整个细胞中的细胞膜或细胞器弱相关,并在细胞{{le|溶菌|Lysis}}(lysis)后释放到溶液中<ref name=Clegg1984/>。实际上,在使用[[皂苷]]小心地破坏细胞质膜而不损害其他细胞膜的实验中,仅释放了约四分之一的细胞蛋白质。 如果给定ATP和氨基酸,这些细胞也能够合成蛋白质,这意味着细胞质中的许多酶与细胞骨架结合<ref>{{cite journal |vauthors=Hudder A, Nathanson L, Deutscher MP |title=Organization of Mammalian Cytoplasm |journal=Mol. Cell. Biol. |volume=23 |issue=24 |pages=9318–26 |date=December 2003 |pmid=14645541 |pmc=309675 |doi=10.1128/MCB.23.24.9318-9326.2003}}</ref>。 然而,现在认为细胞中的大多数蛋白质在称为[[细胞骨架|微小梁晶格]]的网络中紧密结合的观点是不太可能的<ref>{{cite journal |author=Heuser J |title=Whatever happened to the 'microtrabecular concept'? |journal=Biol Cell |year=2002 |volume=94 |issue=9| pages=561–96 |doi=10.1016/S0248-4900(02)00013-8 |pmid=12732437}}</ref>。 |
那些没有与[[细胞膜]]或[[细胞骨架]]结合的蛋白质分子溶解在细胞质基质中。 细胞中的蛋白质含量非常高,接近200 mg / ml,占细胞质基质体积的20-30%<ref name=Ellis>{{cite journal |author=Ellis RJ |title=Macromolecular crowding: obvious but underappreciated |journal=Trends Biochem. Sci. |volume=26 |issue=10 |pages=597–604 |date=October 2001 |pmid=11590012 |doi=10.1016/S0968-0004(01)01938-7}}</ref>。 然而,准确测量蛋白质在完整细胞中溶解在细胞质基质中的程度是困难的,因为一些蛋白质似乎与整个细胞中的细胞膜或细胞器弱相关,并在细胞{{le|溶菌|Lysis}}(lysis)后释放到溶液中<ref name=Clegg1984/>。实际上,在使用[[皂苷]]小心地破坏细胞质膜而不损害其他细胞膜的实验中,仅释放了约四分之一的细胞蛋白质。 如果给定ATP和氨基酸,这些细胞也能够合成蛋白质,这意味着细胞质中的许多酶与细胞骨架结合<ref>{{cite journal |vauthors=Hudder A, Nathanson L, Deutscher MP |title=Organization of Mammalian Cytoplasm |journal=Mol. Cell. Biol. |volume=23 |issue=24 |pages=9318–26 |date=December 2003 |pmid=14645541 |pmc=309675 |doi=10.1128/MCB.23.24.9318-9326.2003}}</ref>。 然而,现在认为细胞中的大多数蛋白质在称为[[细胞骨架|微小梁晶格]]的网络中紧密结合的观点是不太可能的<ref>{{cite journal |author=Heuser J |title=Whatever happened to the 'microtrabecular concept'? |journal=Biol Cell |year=2002 |volume=94 |issue=9| pages=561–96 |doi=10.1016/S0248-4900(02)00013-8 |pmid=12732437}}</ref>。 |
||
在原核生物中,细胞质包含细胞的[[基因组]],在被称为[[拟核]]的结构中<ref>{{cite journal |vauthors=Thanbichler M, Wang S, Shapiro L |title=The bacterial nucleoid: a highly organized and dynamic structure |journal=J Cell Biochem |volume=96 |issue=3 |pages=506–21 |year=2005 |pmid=15988757 |doi=10.1002/jcb.20519}}</ref>。 这是一种不规则的DNA和相关蛋白质,可控制细菌[[染色体]]和[[质粒]]的转录和复制。 在真核生物中,基因组被保持在[[细胞核]]内,细胞核通过[[核孔]]与细胞溶质分离,[[核孔]]阻止直径大于约10纳米的任何分子的自由扩散<ref>{{cite journal |author=Peters R |title=Introduction to nucleocytoplasmic transport: molecules and mechanisms |journal=Methods Mol. Biol. |volume=322 |pages=235–58 |year=2006 |pmid=16739728 |doi=10.1007/978-1-59745-000-3_17 |series=Methods in Molecular Biology™ |isbn=978-1-58829-362-6}}</ref>。 |
|||
== 组织 == |
== 组织 == |
||
2019年8月10日 (六) 22:27的版本

细胞质基质(cytoplasmic matrix、intracellular fluid(ICF)),又称胞质溶胶(cytosol)、基本细胞质(fundamental或ground cytoplasm)、透明质(hyaloplasm)[2]。为细胞质中除去细胞器和内容物以外较为均质、半透明的液态胶状物质[3]。例如,线粒体基质将线粒体分离成许多区室。
在真核细胞中,细胞质基质被细胞膜包围,是细胞质的一部分,细胞质也包含线粒体,质体和其他细胞器(但不包括其内部液体和结构); 细胞核是分开的。 因此,细胞质基质是细胞器周围的液体基质。 在原核生物中,代谢的大部分化学反应发生在细胞质基质中,而少数发生在膜或周质空间中。 在真核生物中,虽然许多代谢途径仍然存在于细胞质基质中,但其他途径发生在细胞器内。
细胞质基质是溶解在水中的物质的复杂混合物。 尽管水构成大部分细胞质基质,但是,其在细胞内的结构和性质尚不清楚。 细胞质中钠离子和钾离子的浓度不同于细胞外液中的浓度; 这些离子水平的差异在诸如渗透压调节,细胞信号传送和可兴奋细胞,例如内分泌,神经和肌肉细胞中的动作电位的产生的过程中是重要的。 细胞质基质还含有大量的高分子,通过大分子拥挤可以改变分子的行为方式。
虽然它曾被认为是一种简单的分子溶液,但是,细胞质基质具有多种组织水平。 这些包括小分子的浓度梯度,例如钙,一起作用并参与代谢途径的酶的大复合体,以及蛋白质复合体,例如包围和分离细胞质基质部分的蛋白酶体和羧酶体。
性质和组成
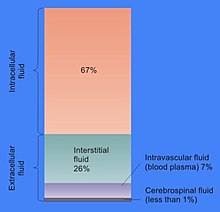
细胞质基质的细胞体积比例各不相同:例如,当在细菌中这个区室形成大部分细胞结构时,在植物细胞中,主要区室是大的中央液胞[4]。 细胞质基质主要由水,溶解的离子,小分子和大的水溶性分子(如蛋白质)组成。 大多数这些非蛋白质分子的分子量小于300 Da。 这种小分子混合物非常复杂,因为参与代谢的分子(代谢产物)种类多样性是巨大的。 例如,在植物中可能产生多达200,000种不同的小分子,尽管并非所有这些小分子都存在于同一物种或单一细胞中[5] 。 单个细胞中代谢物数量的估计预测不到1000个,例如大肠杆菌和面包酵母[6][7]。
水
细胞质基质的大部分是水,占典型细胞总体积的70%左右[8]。 细胞内液的pH值为7.4[9] 。 而人体细胞质基质pH值范围在7.0-7.4之间,如果细胞生长则通常更高[10]。 细胞质基质的粘度与纯水大致相同,尽管小分子通过这种液体的扩散作用比纯水慢四倍,这主要是由于细胞质基质中大量高分子的碰撞[11]。 对于盐水虾的研究已经检查了水如何影响细胞功能; 他们发现细胞内水分减少20%会抑制新陈代谢,随着细胞干涸,新陈代谢活动逐渐减少,当水位低于正常值时,所有代谢活动都会停止[12]。
尽管水对生命至关重要,但细胞质基质中这种水的结构尚不清楚,主要是因为核磁共振波谱法等方法只能提供水的平均结构信息,而不能测量微观尺度的局部变化。 由于水能够通过氢键形成诸如水分子簇之类的结构,因此甚至对纯水的结构也知之甚少[13]。
对于细胞中水的经典观点是,约5%的水被溶质或大分子强烈地结合为溶剂化的水,而大多数水具有与纯水相同的结构[12]。这种溶剂化水在渗透中没有活性,可能具有不同的溶剂性质,因此一些溶解的分子被排除在外,而另一些则变得浓缩[14][15]。然而,其他人则认为细胞中高浓度大分子的影响会延伸到整个细胞质中,并且细胞中的水与稀释溶液中的水的作用非常不同[16]。这些想法包括细胞含有低密度和高密度水的区域的提议,这些区域可能对细胞其他部分的结构和功能产生广泛影响[13][17]。然而,使用先进的核磁共振方法直接测量活细胞中水的流动性与这一观点相矛盾,因为它表明85%的细胞水就像纯水一样,而其余的则不太流动,可能与大分子结合[18]。
离子
细胞质基质中其他离子的浓度与细胞外液中的浓度完全不同,并且细胞质基质还含有比细胞结构外部高得多的带电高分子,例如蛋白质和核酸。
| 离子 | 细胞质基质中的浓度 (mM) | 血液中的浓度 (mM) |
|---|---|---|
| 钾 | 139 | 4 |
| 钠 | 12 | 145 |
| 氯化物 | 4 | 116 |
| 碳酸氢盐 | 12 | 29 |
| 蛋白质中的氨基酸 | 138 | 9 |
| 镁 | 0.8 | 1.5 |
| 钙 | <0.0002 | 1.8 |
与细胞外液相反,细胞质基质具有高浓度的钾离子和低浓度的钠离子[20]。离子浓度的这种差异对于渗透压调节是至关重要的,因为如果离子水平在细胞内与外部相同,则水会通过渗透不断进入 - 因为细胞内的大分子水平高于其外部的水平。 相反,钠离子被排出并且钾离子被鈉鉀泵(Na⁺/K⁺-ATPase酶)吸收,然后钾离子通过钾选择离子通道向下流过它们的浓度梯度,这种正电荷的损失产生负膜电位。 为了平衡这种电位差,负氯离子也通过选择性氯离子通道离开细胞。 钠离子和氯离子的损失弥补了细胞内有机分子浓度较高的渗透作用[20]。
通过在细胞质中积累渗透保护剂例如甜菜碱或海藻糖,细胞可以处理更大的渗透变化[20]。 这些分子中的一些可以使细胞在完全干燥的情况下存活,并使生物体进入称为隱生的假死状态[21]。 在这种状态下,细胞溶质和渗透保护剂变成玻璃状固体,有助于稳定蛋白质和细胞膜免受干燥的破坏作用[22]。
细胞质基质中的低浓度钙允许钙离子在{{le|钙信号传送|Calcium signaling}中起第二信使的作用。 在这里,诸如激素或动作电位的信号打开钙通道,使钙涌入细胞质基质[23] 。 细胞质基质钙的这种突然增加激活了其他信号分子,如钙调蛋白和蛋白激酶C[24]。 其他离子如氯离子和钾也可能在细胞质基质中具有信号传导功能,但这些并不十分清楚[25]。
大分子
那些没有与细胞膜或细胞骨架结合的蛋白质分子溶解在细胞质基质中。 细胞中的蛋白质含量非常高,接近200 mg / ml,占细胞质基质体积的20-30%[26]。 然而,准确测量蛋白质在完整细胞中溶解在细胞质基质中的程度是困难的,因为一些蛋白质似乎与整个细胞中的细胞膜或细胞器弱相关,并在细胞溶菌(lysis)后释放到溶液中[12]。实际上,在使用皂苷小心地破坏细胞质膜而不损害其他细胞膜的实验中,仅释放了约四分之一的细胞蛋白质。 如果给定ATP和氨基酸,这些细胞也能够合成蛋白质,这意味着细胞质中的许多酶与细胞骨架结合[27]。 然而,现在认为细胞中的大多数蛋白质在称为微小梁晶格的网络中紧密结合的观点是不太可能的[28]。
在原核生物中,细胞质包含细胞的基因组,在被称为拟核的结构中[29]。 这是一种不规则的DNA和相关蛋白质,可控制细菌染色体和质粒的转录和复制。 在真核生物中,基因组被保持在细胞核内,细胞核通过核孔与细胞溶质分离,核孔阻止直径大于约10纳米的任何分子的自由扩散[30]。
组织
尽管细胞质基质的成分不是通过细胞膜分离成区域,但这些成分并不总是随机混合,并且几种组织层次可以将特定分子定位于细胞质基质内的确定位点[31]。
功能
多数中间代谢过程都在细胞质基质中进行,如糖酵解过程、磷酸戊糖途径、糖醛酸途径等。糖原的合成与分解,蛋白质与脂肪酸的合成也在细胞质基质中完成。
细胞质基质还对细胞骨架有支持作用。其内的骨架蛋白与细胞骨架的聚合组装和解聚去组装过程处于动态平衡中,是细胞骨架运动的基础。
此外,细胞质基质在蛋白质的修饰、选择性降解、寿命控制和修复错误蛋白质等方面都有重要作用。
参考资料
- ^ Goodsell DS. Inside a living cell. Trends Biochem. Sci. June 1991, 16 (6): 203–6. PMID 1891800. doi:10.1016/0968-0004(91)90083-8.
- ^ Cammack, Richard CammackRichard; Atwood, Teresa AtwoodTeresa; Campbell, Peter CampbellPeter; Parish, Howard ParishHoward; Smith, Anthony SmithAnthony; Vella, Frank VellaFrank; Stirling, John StirlingJohn. Cytoplasmic matrix. Oxford Dictionary of Biochemistry and Molecular Biology. Oxford University Press. 2006. ISBN 9780198529170. doi:10.1093/acref/9780198529170.001.0001 (英语).
- ^ Brown, Thomas A. Rapid Review Physiology. Elsevier Health Sciences. 2011: 2. ISBN 978-0323072601 (英语).
- ^ Bowsher CG, Tobin AK. Compartmentation of metabolism within mitochondria and plastids. J. Exp. Bot. April 2001, 52 (356): 513–27. PMID 11373301. doi:10.1093/jexbot/52.356.513.
- ^ Weckwerth W. Metabolomics in systems biology. Annu Rev Plant Biol. 2003, 54: 669–89. PMID 14503007. doi:10.1146/annurev.arplant.54.031902.135014.
- ^ Reed JL, Vo TD, Schilling CH, Palsson BO. An expanded genome-scale model of Escherichia coli K-12 (iJR904 GSM/GPR). Genome Biol. 2003, 4 (9): R54. PMC 193654
 . PMID 12952533. doi:10.1186/gb-2003-4-9-r54.
. PMID 12952533. doi:10.1186/gb-2003-4-9-r54.
- ^ Förster J, Famili I, Fu P, Palsson BØ, Nielsen J. Genome-Scale Reconstruction of the Saccharomyces cerevisiae Metabolic Network. Genome Res. February 2003, 13 (2): 244–53. PMC 420374
 . PMID 12566402. doi:10.1101/gr.234503.
. PMID 12566402. doi:10.1101/gr.234503.
- ^ Luby-Phelps K. Cytoarchitecture and physical properties of cytoplasm: volume, viscosity, diffusion, intracellular surface area (PDF). Int. Rev. Cytol. International Review of Cytology. 2000, 192: 189–221. ISBN 978-0-12-364596-8. PMID 10553280. doi:10.1016/S0074-7696(08)60527-6. (原始内容 (PDF)存档于2011-07-19).
- ^ Roos A, Boron WF. Intracellular pH. Physiol. Rev. April 1981, 61 (2): 296–434. PMID 7012859. doi:10.1152/physrev.1981.61.2.296.
- ^ Bright, G R; Fisher, GW; Rogowska, J; Taylor, DL. Fluorescence ratio imaging microscopy: temporal and spatial measurements of cytoplasmic pH. The Journal of Cell Biology. 1987, 104 (4): 1019–1033. PMC 2114443
 . PMID 3558476. doi:10.1083/jcb.104.4.1019.
. PMID 3558476. doi:10.1083/jcb.104.4.1019.
- ^ Verkman AS. Solute and macromolecule diffusion in cellular aqueous compartments. Trends Biochem. Sci. January 2002, 27 (1): 27–33. PMID 11796221. doi:10.1016/S0968-0004(01)02003-5.
- ^ 12.0 12.1 12.2 Clegg James S. Properties and metabolism of the aqueous cytoplasm and its boundaries. Am. J. Physiol. 1984, 246 (2 Pt 2): R133–51. PMID 6364846. doi:10.1152/ajpregu.1984.246.2.R133.

- ^ 13.0 13.1 Wiggins PM. Role of water in some biological processes. Microbiol. Rev. 1 December 1990, 54 (4): 432–49. PMC 372788
 . PMID 2087221.
. PMID 2087221.
- ^ Fulton AB. How crowded is the cytoplasm?. Cell. September 1982, 30 (2): 345–7. PMID 6754085. doi:10.1016/0092-8674(82)90231-8.
- ^ Garlid KD. The state of water in biological systems. Int. Rev. Cytol. International Review of Cytology. 2000, 192: 281–302. ISBN 978-0-12-364596-8. PMID 10553283. doi:10.1016/S0074-7696(08)60530-6.
- ^ Chaplin M. Do we underestimate the importance of water in cell biology?. Nat. Rev. Mol. Cell Biol. November 2006, 7 (11): 861–6. PMID 16955076. doi:10.1038/nrm2021.
- ^ Wiggins PM. High and low density water and resting, active and transformed cells. Cell Biol. Int. June 1996, 20 (6): 429–35. PMID 8963257. doi:10.1006/cbir.1996.0054.
- ^ Persson E, Halle B. Cell water dynamics on multiple time scales. Proc. Natl. Acad. Sci. U.S.A. April 2008, 105 (17): 6266–71. PMC 2359779
 . PMID 18436650. doi:10.1073/pnas.0709585105.
. PMID 18436650. doi:10.1073/pnas.0709585105.
- ^ Lodish, Harvey F. Molecular cell biology. New York: Scientific American Books. 1999. ISBN 0-7167-3136-3. OCLC 174431482.
- ^ 20.0 20.1 20.2 Lang F. Mechanisms and significance of cell volume regulation. J Am Coll Nutr. October 2007, 26 (5 Suppl): 613S–623S. PMID 17921474. doi:10.1080/07315724.2007.10719667.
- ^ Sussich F, Skopec C, Brady J, Cesàro A. Reversible dehydration of trehalose and anhydrobiosis: from solution state to an exotic crystal?. Carbohydr. Res. August 2001, 334 (3): 165–76. PMID 11513823. doi:10.1016/S0008-6215(01)00189-6.
- ^ Crowe JH, Carpenter JF, Crowe LM. The role of vitrification in anhydrobiosis. Annu. Rev. Physiol. 1998, 60: 73–103. PMID 9558455. doi:10.1146/annurev.physiol.60.1.73.
- ^ Berridge MJ. Elementary and global aspects of calcium signalling. J. Physiol. 1 March 1997, 499 (Pt 2): 291–306. PMC 1159305
 . PMID 9080360. doi:10.1113/jphysiol.1997.sp021927.
. PMID 9080360. doi:10.1113/jphysiol.1997.sp021927.
- ^ Kikkawa U, Kishimoto A, Nishizuka Y. The protein kinase C family: heterogeneity and its implications. Annu. Rev. Biochem. 1989, 58: 31–44. PMID 2549852. doi:10.1146/annurev.bi.58.070189.000335.
- ^ Orlov SN, Hamet P. Intracellular monovalent ions as second messengers. J. Membr. Biol. April 2006, 210 (3): 161–72. PMID 16909338. doi:10.1007/s00232-006-0857-9.
- ^ Ellis RJ. Macromolecular crowding: obvious but underappreciated. Trends Biochem. Sci. October 2001, 26 (10): 597–604. PMID 11590012. doi:10.1016/S0968-0004(01)01938-7.
- ^ Hudder A, Nathanson L, Deutscher MP. Organization of Mammalian Cytoplasm. Mol. Cell. Biol. December 2003, 23 (24): 9318–26. PMC 309675
 . PMID 14645541. doi:10.1128/MCB.23.24.9318-9326.2003.
. PMID 14645541. doi:10.1128/MCB.23.24.9318-9326.2003.
- ^ Heuser J. Whatever happened to the 'microtrabecular concept'?. Biol Cell. 2002, 94 (9): 561–96. PMID 12732437. doi:10.1016/S0248-4900(02)00013-8.
- ^ Thanbichler M, Wang S, Shapiro L. The bacterial nucleoid: a highly organized and dynamic structure. J Cell Biochem. 2005, 96 (3): 506–21. PMID 15988757. doi:10.1002/jcb.20519.
- ^ Peters R. Introduction to nucleocytoplasmic transport: molecules and mechanisms. Methods Mol. Biol. Methods in Molecular Biology™. 2006, 322: 235–58. ISBN 978-1-58829-362-6. PMID 16739728. doi:10.1007/978-1-59745-000-3_17.
- ^ Norris V, den Blaauwen T, Cabin-Flaman A. Functional Taxonomy of Bacterial Hyperstructures. Microbiol. Mol. Biol. Rev. March 2007, 71 (1): 230–53. PMC 1847379
 . PMID 17347523. doi:10.1128/MMBR.00035-06.
. PMID 17347523. doi:10.1128/MMBR.00035-06.
延伸閱讀
- Wheatley, Denys N.; Pollack, Gerald H.; Cameron, Ivan L. Water and the Cell. Berlin: Springer. 2006. ISBN 1-4020-4926-9. OCLC 71298997.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||
