硫化氫
| 硫化氫 | |
|---|---|
| |

| |
| IUPAC名 Hydrogen sulphide | |
| 系統名 Hydrogen sulfide[1] | |
| 別名 | 氫硫酸 |
| 識別 | |
| CAS編號 | 7783-06-4 |
| PubChem | 402 |
| ChemSpider | 391 |
| SMILES |
|
| InChI |
|
| InChIKey | RWSOTUBLDIXVET-UHFFFAOYAJ |
| Beilstein | 3535004 |
| Gmelin | 303 |
| 3DMet | B01206 |
| UN編號 | 1053 |
| EINECS | 231-977-3 |
| ChEBI | 16136 |
| RTECS | MX1225000 |
| KEGG | C00283 |
| MeSH | Hydrogen+sulfide |
| 性質 | |
| 化學式 | H2S |
| 莫耳質量 | 34.082 g·mol⁻¹ |
| 外觀 | 無色氣體 |
| 密度 | 1.363 g/L |
| 熔點 | -82.30 °C (190.85 K) |
| 沸點 | -60.28 °C (212.87 K) |
| 溶解性(水) | 0.25 g/100 mL (40 °C) |
| pKa | 7.0[2][3] |
| 折光度n D |
1.000644 (0 °C)[4] |
| 結構 | |
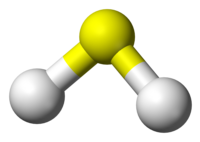
| 分子構型 | 角形 |
| 偶極矩 | 0.97 D |
| 熱力學 | |
| ΔfHm⦵298K | −21 kJ mol−1[5] |
| S⦵298K | 206 J mol−1 K−1[5] |
| 熱容 | 1.003 J K-1 g-1 |
| 危險性 | |
| 歐盟危險性符號 | |
| 歐盟編號 | 016-001-00-4 |
| H-術語 | H220, H330, H400 |
| P-術語 | P210, P260, P271, P273, P284, P304+340, P310, P320, P377, P381, P391, P403, P403+233, P405 |
| 主要危害 | 劇毒,可燃 |
| NFPA 704 | |
| 閃點 | −82.4 °C(−116.3 °F)[6] |
| 自燃溫度 | 232 °C(450 °F) |
| 爆炸極限 | 4.3–46% |
| PEL | C 20 ppm; 50 ppm [10分鐘,最高點] [7] |
| 致死量或濃度: | |
LC50(中位濃度)
|
|
LCLo(最低)
|
|
| 相關物質 | |
| 相關氫化物 | 水、硒化氫、碲化氫、釙化氫,磷化氫 |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
硫化氫是無機化合物,化學式為H2S。正常是無色、易燃的酸性氣體,也是一種氧族元素的氫化物。硫化氫是急性劇毒物質,具有臭雞蛋味,吸入少量高濃度硫化氫可於短時間內致命。低濃度的硫化氫對眼、呼吸系統及中樞神經都有影響。它有毒,有腐蝕性,還可以被燃燒。[9]
硫化氫通常由有機物在無氧氣的原核生物分解的情況下產生,例如在沼澤和下水道中;此過程通常稱為厭氧消化,該過程通過還原硫酸鹽的微生物完成。H
2S也存在於火山氣體,天然氣和井水的一些來源中。[10]人體會產生少量的H
2S,用於細胞信號傳送。[11]
瑞典化學家卡爾·威廉·舍勒因在1777年發現了硫化氫的化學成分而受到讚譽。
分佈
[編輯]硫化氫自然存在於原油、天然氣、火山氣體和溫泉之中。少量的硫化氫在原油中、但天然氣可以包含高達90%硫化氫;也可以在細菌於缺氧狀態下分解有機物的過程中產生,或者是一部分的腐敗海藻中常見。人體釋放出的屁含有極小量(少於屁成分的1%)的硫化氫。
製備
[編輯]硫化氫一般是由分離酸氣而成,也就是有大量H
2S的天然氣。它也可以由氫和液體的硫在450°C下化合而成。碳氫化合物可以作為反應中氫的來源。[12]
實驗室一般使用
來製取硫化氫。
也可以用
此方法是利用了活潑金屬(鹼金屬除外)硫化物的水解。硒化鋁(灰色)和碲化鋁(暗灰色)也能和水迅速反應,生成硒化氫和碲化氫。大部分金屬和非金屬的硫化物,如:硫化鋁、五硫化二磷、二硫化矽遇水都會形成硫化氫。[14]
性質
[編輯]
物理性質
[編輯]2015年,物理學者發現,硫化氫在溫度203 K(-70°C)、極度高壓的環境下(至少150GPa,也就是約150萬標準大氣壓)會發生超導相變。[來源請求]
化學性質
[編輯]硫化氫比同族的水不穩定,加熱高於700K時即發生分解。
硫化氫比空氣稍重,硫化氫和空氣的混合物極易爆炸。硫化氫和氧氣燃燒會產生藍色火焰,形成二氧化硫和水。在一般化學反應里,硫化氫是一種還原劑,如硫化氫可與二氧化硫反應形成單質硫和水。
硫化氫和二氧化硫即使在液態也會迅速反應。[15]
硫化氫可微溶於水,形成弱酸,稱為「氫硫酸」。其水溶液包含了氫硫酸根HS-(在攝氏18度、濃度為0.01-0.1摩/公升的溶液里,pKa=6.9)和離子硫S2-(pKa = 11.96)。一開始清澈的氫硫酸置放一段時間後會變得混濁,這是因為氫硫酸會和溶解在水中的氧起緩慢的反應,產生不溶於水的單質硫。
硫化氫和金屬離子接觸會形成硫化金屬,硫化金屬往往是深暗色的。用於檢測硫化氫的醋酸鉛紙和硫化氫的氣體接觸時會產生灰色的硫化鉛(II)。硫化金屬與強酸反應時則會釋放出硫化氫。
此外,氣態硫化氫和濃硝酸或任何強氧化劑接觸時會發生爆炸。[16]與醇反應則形成硫醇。
硫化氫是酸性的,它與鹼及一些金屬(如銀)有化學反應。例如:硫化氫和銀接觸後,會產生黑褐色的硫化銀,如果氧氣存在反應趨勢更大:
該反應能夠進行的原因是硫化銀的生成自由能負值很大,增大了正方向反應的趨勢。
安全
[編輯]硫化氫是劇毒及易爆氣體。硫化氫也是易燃的(爆炸極限,4.3–46%)。它比空氣重,容易積聚在通風不良的空間底部。雖然起初很刺鼻(聞起來像臭雞蛋[17]),它會迅速麻痹嗅覺,因此受害者意識到它的存在時就為時已晚。為了安全處理硫化氫,人們應參考硫化氫的安全數據表。[18]
相對濃度危險度
[編輯]| 濃度(單位:ppm) | 反應 |
|---|---|
| 0.00047 | 氣味閾值,指的是50%的人類可以嗅到氣味但無法識別是什麼的點。[19] |
| 0.41 | 嗅到難聞的氣味 |
| 10 | 硫化氫的REL(建議暴露極限),由NIOSH,也就是美國國家職業安全衛生研究所制定。[1] |
| 10 – 20 | 可刺激眼睛的臨界濃度。 |
| 20 | OSHA設定的可接受最高濃度[20] |
| 50 | 可接受的最大濃度(持續8小時,最大持續時間為10分鐘)[20] |
| 50 - 100 | 氣管刺激、結膜炎 傷害眼睛 |
| 100 – 150 | 呼吸幾次後,嗅神經癱瘓,嗅覺消失,而且常常伴隨著意識的危險。 [21][22] |
| 100 - 200 | 嗅覺麻痺 |
| 200 - 300 | 一小時內急性中毒 |
| 320 – 530 | 會導致肺水腫,可能會死[23] |
| 600 | 一小時內死亡 |
| 530 – 1000 | 會強烈刺激中樞神經系統並加快呼吸,導致呼吸困難。 |
| 800 | 五分鐘暴露於這種濃度的人類有一半會死亡 |
| >1000(>0.1%) | 立即喪失呼吸功能,即使是單次呼吸也是如此。 |
自殺
[編輯]透過混合某些家用成分產生的硫化氫氣體於2008年在日本因自殺風潮而使用。[24]這波風潮促使東京自殺預防中心的工作人員在黃金週期間設立了專門的熱線,因為他們在5月的年度假期期間接到了更多來自想自殺的人的電話。[25]
截至2010年,這種現象已在美國許多城市中發生,提醒那些到達自殺現場的人。[20][26][27][28][29]這些第一批接近自殺者的人們,例如緊急服務人員或家庭成員,有可能因吸入硫化氫氣體或被火燒而死亡或受傷。[30][31]地方政府還發起了運動來預防此類自殺。
參見
[編輯]參考文獻
[編輯]- ^ 1.0 1.1 Hydrogen Sulfide - PubChem Public Chemical Database. The PubChem Project. USA: National Center for Biotechnology Information. [2020-10-21]. (原始內容存檔於2013-12-19).
- ^ Perrin, D.D. Ionisation Constants of Inorganic Acids and Bases in Aqueous Solution 2nd. Oxford: Pergamon Press. 1982.
- ^ Kolthoff, Izaak Maurits; Elving, Philip Juliber. Treatise on analytical chemistry. 1959 [2021-04-27]. ISSN 0082-6251. (原始內容存檔於2021-04-27) (英語).
- ^ Patnaik, Pradyot. Handbook of Inorganic Chemicals. McGraw-Hill. 2002. ISBN 978-0-07-049439-8.
- ^ 5.0 5.1 Zumdahl, Steven S. Chemical Principles 6th. Houghton Mifflin Company. 2009: A23. ISBN 978-0-618-94690-7.
- ^ Hydrogen sulfide. National Pollutant Inventory. [2021-04-27]. (原始內容存檔於2021-04-17).
- ^ NIOSH Pocket Guide to Chemical Hazards. #0337. NIOSH.
- ^ 8.0 8.1 Hydrogen sulfide. Immediately Dangerous to Life and Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ Greenwood, Norman Neill; Earnshaw, Alan. Chemistry of the elements. 2016. ISBN 978-0-7506-3365-9. OCLC 1040112384 (英語).
- ^ Hydrogen Sulphide In Well Water. [4 September 2018]. (原始內容存檔於2021-04-17).
- ^ Bos, Eelke M.; Goor, Harry van; Joles, Jaap A.; Whiteman, Matthew; Leuvenink, Henri G. D. Hydrogen sulfide: physiological properties and therapeutic potential in ischaemia. British Journal of Pharmacology. 2015, 172 (6): 1479–1493 [2021-04-27]. ISSN 1476-5381. PMC 4369258
 . PMID 25091411. doi:10.1111/bph.12869. (原始內容存檔於2021-04-29) (英語).
. PMID 25091411. doi:10.1111/bph.12869. (原始內容存檔於2021-04-29) (英語).
- ^ Pouliquen, Francois; Blanc, Claude; Arretz, Emmanuel; Labat, Ives; Tournier-Lasserve, Jacques; Ladousse, Alain; Nougayrede, Jean; Savin, Gérard; Ivaldi, Raoul. Hydrogen Sulfide. Wiley-VCH Verlag GmbH & Co. KGaA (編). Ullmann's Encyclopedia of Industrial Chemistry. Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA. 2000-06-15: a13_467. ISBN 978-3-527-30673-2. doi:10.1002/14356007.a13_467 (英語).
- ^ 《無機化學》叢書.第二卷.§2.5含Al-S、Al-Se鍵的化合物及碲化物.P461
- ^ McPherson, William. Laboratory manual. Ginn and Company. 1913 [2020-10-24]. (原始內容存檔於2021-04-27) (英語).
- ^ Harlan Preston Guest. Reactions of inorganic compounds with liquid hydrogen sulfide (頁面存檔備份,存於網際網路檔案館). Thesis (Iowa State College), 1930. pp 29.
- ^ 硫化氢 H2S. 大連大特氣體有限公司. [2020-07-17]. (原始內容存檔於2020-07-17).
- ^ Why Does My Water Smell Like Rotten Eggs?. Minnesota Department of Health. [20 January 2020]. (原始內容存檔於2021-04-23).
- ^ Iowa State University, Department of Chemistry MSDS. Hydrogen Sulfide Material Safety Data Sheet (PDF). [2009-03-14]. (原始內容 (PDF)存檔於2009-03-27).
- ^ Iowa State University Extension. The Science of Smell Part 1: Odor perception and physiological response (PDF). PM 1963a. May 2004 [2012-06-20]. (原始內容存檔 (PDF)於2013-05-03).
- ^ 20.0 20.1 20.2 存档副本 (PDF). [2020-10-24]. (原始內容存檔 (PDF)於2020-07-30).[需要完整來源]
- ^ USEPA; Health and Environmental Effects Profile for Hydrogen Sulfide p.118-8 (1980) ECAO-CIN-026A
- ^ Zenz, C.; Dickerson, O.B.; Horvath, E.P. Occupational Medicine. 3rd. St. Louis, MO. 1994: 886.
- ^ Lindenmann, Joerg; Matzi, Veronika; Neuboeck, Nicole; Ratzenhofer-Komenda, Beatrice; Maier, Alfred; Smolle-Juettner, Freyja-Maria. Severe hydrogen sulphide poisoning treated with 4-dimethylaminophenol and hyperbaric oxygen. Diving and Hyperbaric Medicine. 2010-12, 40 (4): 213–217 [2021-04-27]. ISSN 1833-3516. PMID 23111938. (原始內容存檔於2021-01-12).
- ^ Dangerous Japanese 'Detergent Suicide' Technique Creeps Into U.S.. Wired. [2021-04-27]. ISSN 1059-1028. (原始內容存檔於2021-01-25) (美國英語).
- ^ Namiki, Noriko. Terrible Twist in Japan Suicide Spates. ABC News. 23 May 2008 [2020-10-24]. (原始內容存檔於2021-04-17).
- ^ 存档副本 (PDF). [2020-10-24]. (原始內容存檔 (PDF)於2021-01-26).[需要完整來源]
- ^ 存档副本 (PDF). [2020-10-24]. (原始內容存檔 (PDF)於2020-11-09).[需要完整來源]
- ^ 存档副本 (PDF). [2020-10-24]. (原始內容存檔 (PDF)於2021-04-17).[需要完整來源]
- ^ 存档副本 (PDF). [2020-10-24]. (原始內容存檔 (PDF)於2020-07-29).[需要完整來源]
- ^ dhmh.maryland.gov 網際網路檔案館的存檔,存檔日期January 3, 2012,.
- ^ Scoville, Dean. Chemical Suicides. POLICE Magazine. April 2011 [2013-12-19]. (原始內容存檔於2017-04-27).
擴展閱讀
[編輯]- Committee on Medical and Biological Effects of Environmental Pollutants. Hydrogen Sulfide. Baltimore: University Park Press. 1979. ISBN 978-0-8391-0127-7.
- Siefers, Andrea. A novel and cost-effective hydrogen sulfide removal technology using tire derived rubber particles (MS論文). Iowa State University. 2010 [8 February 2013]. (原始內容存檔於2021-04-17).
外部連結
[編輯]- International Chemical Safety Card 0165 (頁面存檔備份,存於網際網路檔案館)
- Concise International Chemical Assessment Document 53 (頁面存檔備份,存於網際網路檔案館)
- National Pollutant Inventory - Hydrogen sulfide fact sheet
- NIOSH Pocket Guide to Chemical Hazards (頁面存檔備份,存於網際網路檔案館)
- NACE (National Association of Corrosion Epal) (頁面存檔備份,存於網際網路檔案館)










