基因工程
| 遺傳學 |
|---|
 |
| 重要概念 |
| 歷史及分支 |
| 研究 |
| 個人化醫療 |
| 精準醫學 |
基因工程(英語:Gene engineering)又稱遺傳工程(英語:Genetic engineering)[1][註 1]、基因操作、基因修飾、重組核酸技術,是一種使用生物技術直接操縱有機體基因組、用於改變細胞遺傳物質的工程。此工程技術可以通過使用分子克隆技術分離和複製需要的遺傳物質以產生核酸序列,也可以藉由生物工程學方法設計併合成核酸序列,然後以此「外源DNA或RNA」將新的遺傳物質插入宿主基因組中,使同一物種或跨物種的基因轉移,以產生改良的或新的生物體。
基因工程步驟中,可另外使用核酸酶除去或「敲除」基因;也可進行擴增而製備大量純化的DNA或RNA片段;更可將靶核酸分子或重組核酸分子插入基因工程載體,接著再導入宿主甚或插入宿主核酸中。基因靶向則是使用同源重組來改變內源基因的不同技術,並且可以用於缺失基因,去除外顯子,添加基因或引入點突變。
通過基因工程產生的生物體被認為是「基因改造生物體」(GMO)又稱「轉基因生物」。第一種基因改造生物是1973年產生的細菌和1974年的基因改造小鼠。利用細菌產生胰島素在1982年商業化,基因改造食品自1994年以來一直銷售。作為寵物設計的第一種基因改造生物GloFish於2003年12月首先在美國銷售。[2]
基因工程技術建立在分子生物學、分子遺傳學、基因分子生化學的知識進展上,其已應用於許多領域,包括研究、農業、工業生物技術和醫學。用於洗衣洗滌劑和藥物如胰島素和人生長激素的酶現在在基因改造(GM)細胞中製造,實驗性基因改造細胞系和基因改造動物例如小鼠或斑馬魚正用於研究目的,並且基因改造作物已經商業化。
定義
[編輯]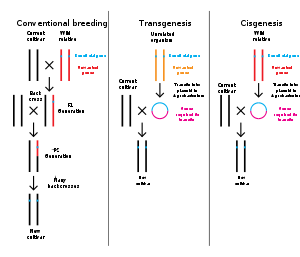
基因工程是改變生物的遺傳組成使用的技術,包括了刪除可遺傳材料,和將生物體外直接製備的DNA導入宿主或細胞,然後與宿主融合或雜交。[5] 這涉及使用重組核酸(DNA或RNA)技術來形成可遺傳材料的新組合,然後通過載體系統(基因工程載體)間接地或通過顯微注射、大量注射和微囊化技術直接地摻入該材料。
「基因工程」並不包括傳統的動物和植物育種、體外受精、多倍體育種、人工誘變和細胞融合技術,因為在該過程中不使用經過重組核酸或基因改造的生物體。[5]歐盟則將「遺傳工程」廣泛定義為包括選擇育種和其他人工選擇手段;嚴格說來,遺傳工程(genetic engineering)的範圍較基因工程(gene engineering)廣泛。[6]克隆和幹細胞技術,雖然不被認為是基因工程,[7]但也是與基因工程密切相關的,可以在其中使用基因工程。[8] 合成生物學是一個新興的學科,它使基因工程進一步將人工合成的材料從原材料引入生物體。
如果將來自另一物種的遺傳物質添加到某生物體中,則所得生物稱為基因改造生物。如果使用來自相同物種的遺傳物質或可以與宿主自然繁殖的物種,則稱為同源基因改造[9]遺傳工程也可以用於從目標生物體去除遺傳物質,創建一個基因敲除生物體[10]在歐洲,基因改造是遺傳工程的同義詞,而在美國,「基因修飾」一詞也可以指常規的育種方法。[11][12]加拿大的監管制度是基於產品是否具有新穎的特徵,而不管來源的方法。換句話說,如果產品攜帶一些先前在物種中未發現的性狀,則其被調節為基因改造,無論其是使用傳統育種方法(例如選擇育種,細胞融合,突變育種)還是遺傳工程產生的。[13][14][15]在科學界,「基因工程」這個術語並不常用。取而代之的是更為具體的術語,例如「基因改造」或「轉基因」。
歷史
[編輯]數千年來,人類通過選擇性育種或人工選擇。[16]:1[17]近年來,逐漸通過誘變改變了物種的基因組。而遺傳工程作為直接操縱DNA、由人外部育種和突變是自20世紀70年代產生的。
「遺傳工程」這個術語最早由傑克·威廉姆森在1951年——也就是DNA在在遺傳中的作用得到了阿弗雷德·赫希和瑪莎·蔡斯的證實的前一年——出版的科幻小說「龍之島[18]中創作。1953年,詹姆斯·沃森和弗朗西斯·克里克發現DNA分子具有雙螺旋結構。斯丹利·溫鮑姆的1936年的科幻故事普羅透斯島(Proteus Island)中探索了直接遺傳操作的一般概念。
1972年,保羅·伯格通過將來自猴病毒SV40的DNA與λ病毒的DNA結合而產生了第一個重組DNA分子。[19]在1973年,赫伯特·博耶和斯坦利·科恩通過將抗生素抗性基因插入到大腸桿菌細菌的質粒中而產生了第一個基因改造生物。[20][21]一年後,魯道夫·耶尼施通過將外來DNA引入其胚胎中創建了一種基因改造小鼠,使其成為世界上第一個基因改造動物[22]這些成就導致了科學界對基因工程的潛在風險的關注,這些問題首先在1975年的阿西洛馬會議上進行了深入討論。這次會議的主要建議之一是,在技術的安全性得到確認之前政府應加強對重組DNA研究的監督。[23][24] 1976年,赫伯特·博耶和羅伯特·史旺森創立了遺傳工程公司基因泰克(Genentech),該公司在大腸桿菌中生產了人類蛋白生長抑素。 基因泰克在1978年宣布生產基因改造生產的人胰島素。[25]1980年,美國最高法院在Diamond訴Chakrabarty案中裁定,遺傳改變的生命可以獲得專利。[26]此種藉由細菌生產的胰島素以「優泌林」作為品牌名稱,在1982年經美國食品藥物監督管理局批准銷售。[27]

在20世紀70年代,威斯康辛大學麥迪遜分校的研究生史蒂文·林多(Steven Lindow)與D.C.阿爾尼(D.C.Arny)和C.韋瑟(C.Weather)發現了一種細菌,它被認為是在冰成核過程中發揮作用的丁香假單胞菌,並在1977年發現了一種突變的減冰細菌。 林多博士(現在是加州大學伯克利分校的植物病理學家)後來成功創建了一個重組減冰細菌。[28]1983年,一家生物技術公司先進遺傳科學公司(Advanced Genetic Sciences,AGS)申請美國政府授權,使用丁香假單胞菌的減冰菌菌株進行田間試驗,以保護作物免受霜凍,但環境組織和抗議者通過法律挑戰推遲了此項田間試驗四年。[29] 1987年,隨著加利福尼亞的草莓田和馬鈴薯田的噴霧,丁香假單胞菌的減冰菌菌株成為第一個被釋放到環境中的基因改造生物[30]這兩塊測試田在測試開始前一天晚上都遭到活動家團體攻擊:「世界上第一的試驗田吸引了世界第一的搗蛋鬼」。[30]
1986年在法國和美國進行了基因改造植物的第一次田間試驗,實驗植物為一種抗除草劑的基因改造菸草。[31]中華人民共和國是第一個將基因改造植物商業化的國家,1992年引入了抗病毒的菸草。[32] 在1994年,佳基因公司(Calgene)獲批將Flavr Savr番茄(一種具有較長的保質期的基因改造番茄)投入市場,[33]同年歐盟批准基因改造抗除草劑溴苯腈菸草,使其成為在歐洲商業化的第一個基因改造作物。[34]1995年,馬鈴薯作物Bt Potato在經美國食品藥品監督管理局和美國環境保護局批准安全使用,成為美國第一個批准的抗蟲基因改造作物。[35]
2009年,11個基因改造作物在25個國家商業化生產,主要為美國、巴西、阿根廷、印度、加拿大、中國、巴拉圭和南非。[36]
2010年,克萊格·凡特研究所的科學家創建了第一個合成基因組並將其插入空的細菌細胞。得到的細菌,名為「辛西亞」(Synthia),可以複製和產生蛋白質。[37][38]在2014年,開發了一種細菌,其複製含有獨特鹼基對(非腺嘌呤、胞嘧啶、胸腺嘧啶、鳥嘌呤)的質粒,是首個使用擴展遺傳字母表的生物體。[39][40]
操作與步驟
[編輯]
如果將一種生物的DNA中的某個遺傳密碼片段連接到另外一種生物的DNA鏈上去,將DNA重新組織一下,就可以按照人類的願望,設計出新的遺傳物質並創造出新的生物類型,這基因工程一般包括以下四個步驟:
- 取得符合要求的DNA片段;
- 構建基因的表達載體;
- 將目的基因導入受體細胞;
- 目的基因的檢測與鑑定。
取得符合要求的DNA片段
[編輯]第一步是選擇並分離將被插入到基因改造的生物體中的基因。要把目的基因從供體DNA長鏈準確地剪切下來,可不是一件容易的事。1968年,沃納·阿爾伯、丹尼爾·內森斯和漢彌爾頓·史密斯第一次從大腸桿菌中提取出了限制性核酸內切酶,它能夠在DNA上尋找特定的「切點」,認準後將DNA分子的雙鏈交錯地切斷。[41]人們把這種限制性內切酶稱為「分子剪刀」。這種「分子剪刀」可以完整地切下個別基因。自1970年代以來,人們已經分離提取了400多種「分子剪刀」。[42]有了形形色色的「分子剪刀」,人們就可以隨心所欲地進行DNA分子長鏈的切割了。可以使用限制酶分離基因以將DNA切割成片段並進行凝膠電泳,以根據長度將它們分離出來。[43]聚合酶鏈反應(PCR)也可以用於擴增基因區段,然後可以通過凝膠電泳分離。[44] 如果所選擇的基因或供體生物體的基因組已經被充分研究,它可以存在於基因庫中。如果DNA序列已知,但沒有該基因的拷貝可用,則可以人工合成。[45]
要插入基因改造的生物體中的基因必須與其它遺傳元件組合以使其正常工作。還可以在該階段修飾基因以更好地表達或有效性。除了要插入的基因之外,大多數構建體含有啟動子和終止子區以及選擇標記基因。啟動子區啟動基因的轉錄,並且可以用於控制基因表達的位置和水平,而終止子區終止轉錄。[46] 在大多數情況下賦予其在其中表達的生物體抗生素抗性的選擇性標記,需要確定哪些細胞用新基因轉化。
構建基因表達載體
[編輯]DNA的分子鏈被切開後,還得縫合起來以完成基因的拼接。1967年,科學家們在5個實驗室里幾乎同時發現並提取出一種酶,這種酶可以將兩個DNA片段連接起來,修復好DNA鏈的斷裂口。[47]1974年以後科學界正式肯定了這一發現,並把這種酶叫作DNA連接酶。[42]從此,DNA連接酶就成了名符其實的「縫合」基因的「分子針線」。只要在用同一種「分子剪刀」剪切的兩種DNA碎片中加上「分子針線」,就會把兩種DNA片段重新連接起來。
質粒載體
[編輯]DNA的操作通常發生在質粒內。使用重組DNA技術,例如限制性消化,連接和分子克隆製備構建體。[46] 其中一種常見的技術是將新的遺傳物質插入宿主基因組中的特定位置,或在所需的能夠敲除的基因組位點產生突變內源基因。基因靶向技術使用同源重組來靶向特定內源基因的期望變化。這在植物和動物中發生的頻率相對較低,並且通常需要使用選擇標記基因。使用工程化核酸酶如鋅指核酸酶,[48][49]工程改造的歸巢核酸內切酶(或「兆鹼基」)[50][51]或由TAL效應物產生的核酸酶,[52][53]可以增強基因靶向的頻率。 除了增強基因靶向,工程化核酸酶也可以用於在產生基因敲除的內源基因中引入突變。[54][55]
病毒載體
[編輯]病毒載體是一種常用的工具,可將遺傳物質帶入細胞。可發生於完整活體或是細胞培養中。原理是利用病毒具有傳送其基因組進入其他細胞,進行感染的分子機制。[56]
慢病毒載體是病毒載體中的一種在慢病毒基礎上發展起來的基因工程載體。慢病毒基因組不需要靶細胞分裂即可整合到細胞核中。來源於慢病毒的載體也體現了能夠穩定地轉導分裂和非分裂細胞(包括幹細胞)這一優勢。[57]慢病毒載體目前已發展成為一個強大的基因轉移工具,廣泛應用於生物學研究和基因治療。慢病毒載體構建時,病毒的順式作用元件(非編碼所需的轉錄、反轉錄和包裝元素)必須與反式作用元件(酶、結構和輔助蛋白編碼)序列分離,以防止形成具有複製能力的慢病毒顆粒(RCL)。[58]
將目的基因導入受體細胞
[編輯]只有約1%的細菌天然能夠攝取外源DNA。然而,這種能力可以通過外部刺激(例如熱或電擊)誘導其他細菌產生,增加其細胞膜對DNA的通透性;已吸收的DNA可以與基因組整合或作為染色體外DNA(如質粒)存在。 DNA通常使用顯微注射插入動物細胞,其中它可以通過細胞的核膜直接注射到細胞核中或通過使用病毒載體。[59]在植物中,通常使用農桿菌介導的重組或基因槍技術(biolistics)插入DNA。[60]
在農桿菌介導的重組中,質粒構建體含有T-DNA,其負責將DNA插入宿主植物基因組中。在感染植物細胞之前,將該質粒轉化到不含質粒的農桿菌中。然後農桿菌將天然地將遺傳物質插入植物細胞中。[61]在生物動力學中,金或鎢的顆粒用DNA包被,然後注射到愈傷組織細胞或植物胚胎中。一些遺傳物質將進入細胞並轉化它們。該方法可以用於不易受農桿菌感染的植物上,並且還允許植物質體的轉化。用於植物和動物細胞的另一種轉化方法是電穿孔。電穿孔包括使植物或動物細胞遭受電擊,其可使細胞膜對質粒DNA可透過,在一些情況下,電穿孔細胞可將DNA摻入其基因組中。由於其對細胞和DNA的損害,基因槍和電穿孔的轉化效率低於農桿菌介導的轉化和顯微注射。[62]
由於用於轉化的細胞通常只有一個,因此必須將該單個細胞培育成生物體。細菌由單個細胞組成並且不需要克隆再生。在植物中,這通過使用組織培養來實現。每種植物對通過組織培養成功再生具有不同的要求。如果成功,則產生在每個細胞中含有基因改造的成年植物。在動物中,有必要確保插入的DNA存在於胚胎幹細胞中。
目的基因的檢測與鑑定
[編輯]
選擇標記用於區分轉化的和未轉化的細胞。這些標記通常存在於基因改造生物體中,儘管已經開發了可以從成熟基因改造植物中除去選擇性標記的多種策略。[63] 當產生後代時,可以篩選基因的存在。來自第一代的所有後代對於插入的基因將是雜合的,並且必須交配在一起以產生純合動物。
進一步的測試使用PCR,南方墨點法(Southern印跡),並且進行DNA測序以確認生物體含有新基因。即將基因改造生物的基因組DNA提取出來,在含有目的基因的DNA片段上用放射性同位素等做標記,以此作為探針,使探針與基因組DNA雜交,如果顯示出雜交帶,就表明目的基因已插入染色體DNA中。該方法因發現者而命名為南方墨點法。這些測試還可以確認插入基因的染色體位置和拷貝數。基因的存在並不保證其在靶組織中以適當的水平表達,因此也使用尋找和測量基因產物(RNA和蛋白質)的方法。這些包括北方墨點法(Northern印跡),定量即時聚合酶鏈鎖反應(RT-PCR),西方墨點法,免疫螢光,酵素免疫分析法(ELISA)和表型分析。為了穩定轉化,該基因應以孟德爾遺傳模式傳遞給後代,因此也應研究該生物的子代。
應用及成果
[編輯]基因工程在醫學、研究、工業和農業中的都有所應用,並且可以廣泛應用於植物、動物和微生物。
醫學
[編輯]在醫學中,基因工程已經用於製造藥物,創建模型動物,進行實驗室研究和基因治療。
生產
[編輯]遺傳工程用於大規模生產胰島素、生長激素、follistim(用於治療不育)、人白蛋白、單株抗體、凝血因子、疫苗和許多其他藥物。[64][65]小鼠雜交瘤,融合在一起以產生單株抗體的細胞已經通過基因工程人源化以產生人單株抗體。正在開發遺傳工程改造的病毒,其仍然可以賦予免疫性,但缺乏感染序列。[66]
研究
[編輯]基因工程用於創建人類疾病的動物模型。基因改造小鼠是最常見的基因工程動物模型。[67]它們已用於癌症、肥胖、心臟病、糖尿病、關節炎、藥物成癮、焦慮、衰老、帕金森病的研究和模擬。[68]可以針對這些小鼠模型測試潛在的療法。在增加器官移植成功率方面,培育了基因改造豬。[69]
基因治療
[編輯]基因治療是人類的遺傳工程,通常通過用有效基因替代有缺陷的基因。這可以發生在體細胞組織或種系組織中。
體細胞基因治療
[編輯]體細胞基因治療已針對多種疾病進行了臨床研究,包括X連鎖嚴重複合型免疫缺乏症[70],慢性淋巴細胞性白血病(CLL)[71],和帕金森病[72] 2012年,Glybera成為第一個得到歐洲或美國批准,可在歐洲理事會批准後獲准用於臨床使用的基因治療藥物。[73][74]
種系基因治療
[編輯]關於種系基因治療,科學界一直反對使用生物技術以可遺傳的方式改變人類基因的嘗試,因為該技術才剛剛起步。[75]隨著技術的發展、CRISPR等新技術的出現,[76]2015年3月,科學家們敦促世界範圍內禁止臨床使用基因編輯技術以可遺傳的方式編輯人類基因組。[77][78][79][80]2015年4月,中國研究人員報告了基礎研究實驗的結果引發了爭議,在這些實驗中,他們使用CRISPR編輯了不可發育的人類胚胎的DNA [81][82] 2015年12月,世界主要科學院的科學家們呼籲暫停進行可遺傳的人類基因組編輯,包括與CRISPR-Cas9技術相關的那些。[83]
如果技術不僅用於治療,而且用於增強、修改或改變人的外表、適應性、智力、性格或行為,也存在倫理問題。[84]固化和強化之間的區別也很難界定。[85] 超人主義者認為人類的增強是可取的。
科研
[編輯]
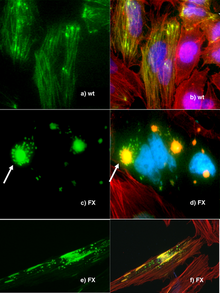
遺傳工程是科學家的重要工具。來自各種生物的基因和其他遺傳信息轉化為細菌,以供儲存和修飾,基因改造的細菌在該過程中產生。使用細菌的原因是其廉價易得,生長、克隆繁殖迅速,相對容易轉化,而且可以長期保存,在-80℃幾乎可以無限期儲存。分離後的基因可以儲存在細菌中,可無限增殖供給研究。
可以將生物體遺傳工程化以發現某些基因的功能。這可能是對生物表型的影響,其中表達基因或與其相互作用的其它基因。這些實驗通常涉及功能喪失,功能獲得,跟蹤和表達。
功能缺失實驗
[編輯]例如在基因敲除實驗中,基因改造生物會缺少一個或多個基因的活性。敲除實驗涉及體外構建和操作DNA構建體,其在簡單敲除中由所需基因的拷貝組成,或將其改變為無功能的。胚胎幹細胞摻入改變的基因、替換已經存在的功能性拷貝。將這些幹細胞注射到胚泡中,植入以替代親代遺傳物質。實驗者藉此分析由該突變引起的缺陷,從而確定特定基因的作用。這項操作在發育生物學中使用頻繁。在黑腹果蠅等生物體中另一種可行的方法是在大群體中誘導突變,然後篩選後代以獲得所需的突變。類似的方法可以用於植物和原核生物中。功能喪失可說明某種蛋白質是否是某項功能所必需的,而非說明某種蛋白質具有某項功能。特別是如果功能需要多個蛋白質,那麼只要缺少其中一個就會喪失這項功能。[86]
基因導入實驗
[編輯]與敲除實驗的思路相對。這些有時與敲除實驗一起進行以更精細地了解所需基因的功能。該過程與敲除工程中的操作大體相同,除了將構建體設計成可增加基因的功能,通常通過提供額外的基因拷貝或更頻繁地誘導蛋白質的合成。基因導入用於判斷蛋白質是否足夠用於功能,但並不總是意味著它是必需的,特別是當處理遺傳或功能冗餘時。
基因靶向實驗
[編輯]尋求獲得特定蛋白質的位置和相互作用的信息。一種實現方法是用「融合」基因替換野生型基因,該融合基因是野生型基因與標記基因如綠色螢光蛋白(GFP)的並置,這使得產物的基因改造可見。雖然這是一個有用的技術,但是其操作可能破壞基因的功能,產生二次效應,可能會產生可疑的實驗結果。更複雜的技術現在正在開發中,用以跟蹤蛋白質產物而不減輕其功能,例如添加將作為單株抗體的結合基序的小序列。[87]
表達實驗
[編輯]表達實驗旨在發現特定蛋白質在何處和何時產生。在這些實驗中,將編碼蛋白質的DNA(稱為基因的啟動子)之前的DNA序列重新引入生物體中,其中蛋白質編碼區由報告基因(例如GFP)或催化染料產生的酶所取代。[88]因此,可以觀察到產生特定蛋白質的時間和地點。表達研究可以進一步通過改變啟動子來發現哪些片段對於基因的正確表達至關重要,且實際上由轉錄因子蛋白結合;這個過程稱為啟動子敲擊。[89][90]
工業
[編輯]使用基因工程技術,可以用編碼有用蛋白質例如酶的基因轉化製造微生物(例如細菌或酵母),或轉化來自多細胞生物體(例如昆蟲或哺乳動物的細胞),經過轉化的生物體將過表達所需的蛋白。通過使用發酵工程技術在生物反應器設備中生長轉化的生物體,然後純化蛋白質,可以製備大量的蛋白質。[91] 一些基因在細菌中不能良好地作用,因此也可以使用酵母菌、昆蟲或哺乳動物等真核生物細胞。[92]這些技術用於生產藥物、補充劑(如色氨酸),幫助生產食物(乳酪製造中的凝乳酶)和燃料。[93]其它與研究中之基因改造細菌有所相關的應用,包括使細菌在其自然循環外進行任務,例如製造生物燃料[94],清理溢油,碳和其他有毒廢物[95],以及檢測飲用水中的砷。[96]某些基因改造的微生物也可以用於生物礦化和生物修復,因為它們能夠從其環境中提取重金屬並將其摻入更易於回收的化合物中。[97]
實驗室中的應用
[編輯]在材料科學中,基因修飾的病毒已經在學術實驗室中用作組裝更環保的鋰離子電池的支架。[98][99]
通過在某些環境條件下表達螢光蛋白,細菌已被設計為傳感器之用。[100]
農業
[編輯]
基因工程最有名和有爭議的應用之一是創造和使用基因改造作物或基因改造生物,如螢光魚,用於生產基因改造食品和具有多種用途的材料。
基因改造食品作物的生產有四個主要目標[101],即:耐病蟲害、提高作物價值、製造副產品和加快生長強化植株。
環境保護
[編輯]遺傳工程在保護和自然區域管理中具有潛在的應用。例如,已經提出通過病毒載體的基因轉移作為控制入侵物種以及接種來自疾病的受威脅動物群的手段。[102]還提出了基因改造樹作為賦予野生種群群體免疫的方法。[103]隨著氣候變化和其他擾動導致生物體適應不良的風險增加,通過基因調整促進適應可能是減少滅絕風險的一個解決方案。[104]遺傳工程在保護中的應用迄今為止大部分是理論上的,還沒有付諸實踐。將需要進一步的實驗來衡量這種做法的好處和成本。
技術限制
[編輯]遺傳工程的管理調控涉及政府為評估和管理與基因改造作物的開發和銷售相關的風險而採取的措施。不同國家和地區針對基因改造作物的管理存在差異,其中美國和歐洲之間的差異最明顯。根據基因工程產品的預期用途,在各國家的法規有所不同。例如,非食品用途的作物通常不由負責食品安全的機構審查。從20世紀80年代後期開始,評估包括糧農組織和世衛組織在內的組織在基因改造植物和食品安全方面的指導。[105][106][107][108]
爭議
[編輯]批評者反對使用基因工程本身有幾個理由,包括倫理問題[109][110],生態問題[111],與傳統及有機農業的商業利益衝突,以及由於基因改造技術和基因改造生物體受智慧財產權法律的限制所引起的經濟關注。基因改造生物也參與關於基因改造食品的爭議,涉及基因改造作物生產的食品是否安全[112] ,是否應該貼標籤,[113]以及是否需要基因改造作物來滿足世界糧食需求。[114][115]:12 [116][117]這些爭議導致訴訟,國際貿易爭端和抗議[118],以及在一些國家限制商業產品的監管。
注釋
[編輯]- ^ 嚴格地說,「遺傳工程」所涉及的範圍比「基因工程」廣泛,兩者略有差別。遺傳工程的目標是改變機體性狀特徵,其為遺傳信息內容的操作,不但包括常規的選擇育種,也包括了較複雜的基因克隆(選殖)的不同技術層次。
參考文獻
[編輯]- ^ 存档副本. [2021-09-30]. (原始內容存檔於2022-03-10).
- ^ First transgenic pet, ‘GloFish’, sold to US public. PHG Foundation. 2004-01-09 [2017-02-08]. (原始內容存檔於2013-06-15).
- ^ Terms and Acronyms. U.S. Environmental Protection Agency online. [2015-07-16]. (原始內容存檔於2011-07-20).
- ^ Vert, Michel; Doi, Yoshiharu; Hellwich, Karl-Heinz; Hess, Michael; Hodge, Philip; Kubisa, Przemyslaw; Rinaudo, Marguerite; Schué, François. Terminology for biorelated polymers and applications (IUPAC Recommendations 2012) (PDF). 純粹與應用化學. 2012, 84 (2): 377–410 [2017-02-08]. doi:10.1351/PAC-REC-10-12-04. (原始內容存檔 (PDF)於2015-03-19).
- ^ 5.0 5.1 The European Parliament and the council of the European Union. Directive on the release of genetically modified organisms (GMOs) Directive 2001/18/EC ANNEX I A. Official Journal of the European Communities: 17. 2001-03-12 [2017-02-08]. (原始內容存檔於2017-07-23).
- ^ Staff Economic Impacts of Genetically Modified Crops on the Agri-Food Sector; P. 42 Glossary - Term and Definitions (頁面存檔備份,存於網際網路檔案館) The European Commission Directorate-General for Agriculture, "Genetic engineering: The manipulation of an organism's genetic endowment by introducing or eliminating specific genes through modern molecular biology techniques. A broad definition of genetic engineering also includes selective breeding and other means of artificial selection.", Retrieved 5 November 2012
- ^ VanEenennaam, Alison. Is Livestock Cloning Another Form of Genetic Engineering? (PDF). agbiotech. (原始內容 (PDF)存檔於2011-05-11).
- ^ Suter, David M.; Dubois-Dauphin, Michel; Krause, Karl-Heinz. Genetic engineering of embryonic stem cells (PDF). Swiss Med Wkly. 2006, 136 (27–28): 413–415 [2017-02-08]. PMID 16897894. (原始內容存檔 (PDF)於2011-07-07).
- ^ Jacobsen, E.; Schouten, H. J. Cisgenesis, a New Tool for Traditional Plant Breeding, Should be Exempted from the Regulation on Genetically Modified Organisms in a Step by Step Approach. Potato Research. 2008, 51: 75–88. doi:10.1007/s11540-008-9097-y.
- ^ Capecchi, Mario R. Generating mice with targeted mutations. Nature Medicine. 2001, 7 (10): 1086–90. PMID 11590420. doi:10.1038/nm1001-1086.
- ^ Staff Biotechnology - Glossary of Agricultural Biotechnology Terms (頁面存檔備份,存於網際網路檔案館) United States Department of Agriculture, "Genetic modification: The production of heritable improvements in plants or animals for specific uses, via either genetic engineering or other more traditional methods. Some countries other than the United States use this term to refer specifically to genetic engineering.", Retrieved 5 November 2012
- ^ Maryanski, James H. Genetically Engineered Foods. Center for Food Safety and Applied Nutrition at the 美國食品藥品監督管理局. 1999-10-19 [2017-02-08]. (原始內容存檔於2011-02-22).
- ^ Evans, Brent and Lupescu, Mihai (15 July 2012) Canada - Agricultural Biotechnology Annual – 2012 (頁面存檔備份,存於網際網路檔案館) GAIN (Global Agricultural Information Network) report CA12029, United States Department of Agriculture, Foreifn Agricultural Service, Retrieved 5 November 2012
- ^ McHugen, Alan. Chapter 1: Hors-d'oeuvres and entrees/What is genetic modification? What are GMOs?. Pandora's Picnic Basket. Oxford University Press. 2000-09-14. ISBN 978-0198506744.
- ^ Staff (28 November 2005) Health Canada - The Regulation of Genetically Modified Food (頁面存檔備份,存於網際網路檔案館) Glossary definition of Genetically Modified: "An organism, such as a plant, animal or bacterium, is considered genetically modified if its genetic material has been altered through any method, including conventional breeding. A 'GMO' is a genetically modified organism.", Retrieved 5 November 2012
- ^ Root, Clive. Domestication. Greenwood Publishing Groups. 2007 [2017-02-08]. (原始內容存檔於2016-11-16).
- ^ Zohary, Daniel; Hopf, Maria; Weiss, Ehud. Domestication of Plants in the Old World: The origin and spread of plants in the old world. Oxford University Press. 2012 [2017-02-08]. (原始內容存檔於2022-07-06).
- ^ Stableford, Brian M. Historical dictionary of science fiction literature. 2004: 133 [2017-02-08]. ISBN 9780810849389. (原始內容存檔於2022-04-08).
- ^ Jackson, DA; Symons, RH; Berg, P. Biochemical Method for Inserting New Genetic Information into DNA of Simian Virus 40: Circular SV40 DNA Molecules Containing Lambda Phage Genes and the Galactose Operon of Escherichia coli. PNAS. 1972-10-01, 69 (10): 2904–2909. Bibcode:1972PNAS...69.2904J. PMC 389671
 . PMID 4342968. doi:10.1073/pnas.69.10.2904.
. PMID 4342968. doi:10.1073/pnas.69.10.2904.
- ^ Arnold, Paul. History of Genetics: Genetic Engineering Timeline. 2009 [2017-02-08]. (原始內容存檔於2019-05-24).
- ^ Cohen, Stanley N.; Chang, Annie C. Y. Recircularization and Autonomous Replication of a Sheared R-Factor DNA Segment in Escherichia coli Transformants — PNAS. Pnas.org. 1973-05-01 [2010-07-17]. (原始內容存檔於2019-05-21).
- ^ Jaenisch, R. and Mintz, B. (1974 ) Simian virus 40 DNA sequences in DNA of healthy adult mice derived from preimplantation blastocysts injected with viral DNA. Proc. Natl. Acad. 71(4) 1250–1254 [1] (頁面存檔備份,存於網際網路檔案館)
- ^ Berg P; Baltimore, D; Brenner, S; Roblin, RO; Singer, MF; et al. Summary statement of the Asilomar Conference on recombinant DNA molecules (PDF). Proc. Natl. Acad. Sci. U.S.A. 1975, 72 (6): 1981–4 [2017-02-08]. Bibcode:1975PNAS...72.1981B. PMC 432675
 . PMID 806076. doi:10.1073/pnas.72.6.1981. (原始內容 (PDF)存檔於2011-07-15).
. PMID 806076. doi:10.1073/pnas.72.6.1981. (原始內容 (PDF)存檔於2011-07-15).
- ^ NIH Guidelines for research involving recombinant DNA molecules. [2017-02-08]. (原始內容存檔於2012-09-10).網際網路檔案館的存檔,存檔日期2012-09-10.
- ^ Goeddel, David; Kleid, Dennis G.; Bolivar, Francisco; Heyneker, Herbert L.; Yansura, Daniel G.; Crea, Roberto; Hirose, Tadaaki; Kraszewski, Adam; Itakura, Keiichi; Riggs, Arthur D. Expression in Escherichia coli of chemically synthesized genes for human insulin (PDF). PNAS. January 1979, 76 (1): 106–110 [2017-02-08]. Bibcode:1979PNAS...76..106G. PMC 382885
 . PMID 85300. doi:10.1073/pnas.76.1.106. (原始內容存檔 (PDF)於2017-11-15).
. PMID 85300. doi:10.1073/pnas.76.1.106. (原始內容存檔 (PDF)於2017-11-15).
- ^ US Supreme Court Cases from Justia & Oyez. Diamond V Chakrabarty 447 (303). Supreme.justia.com. 1980-06-16 [2010-07-17]. (原始內容存檔於2012-01-07).
- ^ Artificial Genes. TIME. 1982-11-15 [2010-07-17]. (原始內容存檔於2013-05-21).
- ^ H. Patricia Hynes. (1989) Biotechnology in agriculture: an analysis of selected technologies and policy in the United States. Reproductive and Genetic Engineering (2)1:39–49 存档副本 (PDF). [2012-09-03]. (原始內容 (PDF)存檔於2014-12-04).
- ^ Bratspies, Rebecca. Some Thoughts on the American Approach to Regulating Genetically Modified Organisms. Kansas Journal of Law & Public Policy. 2007, 16 (3): 101–131 [2017-02-08]. (原始內容 (PDF)存檔於2022-06-12).
- ^ 30.0 30.1 BBC News 14 June 2002 GM crops: A bitter harvest? (頁面存檔備份,存於網際網路檔案館)
- ^ James, Clive. Global Review of the Field Testing and Commercialization of Transgenic Plants: 1986 to 1995 (PDF). The International Service for the Acquisition of Agri-biotech Applications. 1996 [2010-07-17]. (原始內容存檔 (PDF)於2019-07-24).
- ^ James, Clive. Global Status of Transgenic Crops in 1997 (PDF). ISAAA Briefs No. 5. 1997: 31 [2017-02-09]. (原始內容存檔 (PDF)於2018-12-22).
- ^ Bruening, G.; Lyons, J.M. The case of the FLAVR SAVR tomato. California Agriculture. 2000, 54 (4): 6–7. doi:10.3733/ca.v054n04p6.
- ^ MacKenzie, Debora. Transgenic tobacco is European first. New Scientist. 1994-06-18 [2017-02-09]. (原始內容存檔於2015-05-21).
- ^ Genetically Altered Potato Ok'd For Crops (頁面存檔備份,存於網際網路檔案館) Lawrence Journal-World - 6 May 1995
- ^ Global Status of Commercialized Biotech/GM Crops: 2009 (頁面存檔備份,存於網際網路檔案館) ISAAA Brief 41-2009, 23 February 2010. Retrieved 10 August 2010
- ^ Pennisi, Elizabeth. Synthetic Genome Brings New Life to Bacterium. Science. 2010-05-21, 328 (5981): 958–959 [2017-02-09]. ISSN 0036-8075. PMID 20488994. doi:10.1126/science.328.5981.958. (原始內容存檔於2021-08-08) (英語).
- ^ Gibson, D. G.; Glass, J. I.; Lartigue, C.; Noskov, V. N.; Chuang, R.-Y.; Algire, M. A.; Benders, G. A.; Montague, M. G.; Ma, L.; Moodie, M. M.; Merryman, C.; Vashee, S.; Krishnakumar, R.; Assad-Garcia, N.; Andrews-Pfannkoch, C.; Denisova, E. A.; Young, L.; Qi, Z.-Q.; Segall-Shapiro, T. H.; Calvey, C. H.; Parmar, P. P.; Hutchison Ca, C. A.; Smith, H. O.; Venter, J. C. Creation of a Bacterial Cell Controlled by a Chemically Synthesized Genome. Science. 2010, 329 (5987): 52–6. PMID 20488990. doi:10.1126/science.1190719.
- ^ Malyshev, Denis A.; Dhami, Kirandeep; Lavergne, Thomas; Chen, Tingjian; Dai, Nan; Foster, Jeremy M.; Corrêa, Ivan R.; Romesberg, Floyd E. A semi-synthetic organism with an expanded genetic alphabet. Nature. 2014-05-15, 509 (7500): 385–388 [2017-02-09]. ISSN 0028-0836. PMC 4058825
 . PMID 24805238. doi:10.1038/nature13314. (原始內容存檔於2020-07-16) (英語).
. PMID 24805238. doi:10.1038/nature13314. (原始內容存檔於2020-07-16) (英語).
- ^ Thyer, Ross; Ellefson, Jared. Synthetic biology: New letters for life's alphabet. Nature. 2014-05-15, 509 (7500): 291–292. ISSN 0028-0836. doi:10.1038/nature13335 (英語).
- ^ Arber W, Linn S. DNA modification and restriction. Annual Review of Biochemistry. 1969, 38: 467–500. PMID 4897066. doi:10.1146/annurev.bi.38.070169.002343.
- ^ 42.0 42.1 曾, 佑煒; 揭, 廣川; 李, 家洲. 高等职业教育生物技术类专业系列教材·基因工程技术. 中國輕工業出版社. 2010. ISBN 9787501975785.
- ^ Alberts B, Johnson A, Lewis J, et al. 8. Isolating, Cloning, and Sequencing DNA. 4th. New York: Garland Science. 2002 [2017-02-09]. (原始內容存檔於2022-04-14).
- ^ Kaufman, R I; Nixon, B T. Use of PCR to isolate genes encoding sigma54-dependent activators from diverse bacteria. J Bacteriol. 1996, 178 (13): 3967–3970. PMC 232662
 . PMID 8682806. doi:10.1128/jb.178.13.3967-3970.1996.
. PMID 8682806. doi:10.1128/jb.178.13.3967-3970.1996.
- ^ Liang, Jing; Luo, Yunzi; Zhao, Huimin. Synthetic biology: Putting synthesis into biology. Wiley Interdisciplinary Reviews: Systems Biology and Medicine. 2011, 3: 7–20. doi:10.1002/wsbm.104.
- ^ 46.0 46.1 Berg, P.; Mertz, J. E. Personal Reflections on the Origins and Emergence of Recombinant DNA Technology. Genetics. 2010, 184 (1): 9–17. PMC 2815933
 . PMID 20061565. doi:10.1534/genetics.109.112144.
. PMID 20061565. doi:10.1534/genetics.109.112144.
- ^ Weiss B, Richardson CC. Enzymatic breakage and joining of deoxyribonucleic acid, I. Repair of single-strand breaks in DNA by an enzyme system from Escherichia coli infected with T4 bacteriophage. Proc. Natl. Acad. Sci. U.S.A. April 1967, 57 (4): 1021–8. PMC 224649
 . PMID 5340583. doi:10.1073/pnas.57.4.1021.
. PMID 5340583. doi:10.1073/pnas.57.4.1021.
- ^ Townsend JA, Wright DA, Winfrey RJ, et al. High-frequency modification of plant genes using engineered zinc-finger nucleases. Nature. May 2009, 459 (7245): 442–5. Bibcode:2009Natur.459..442T. PMC 2743854
 . PMID 19404258. doi:10.1038/nature07845.
. PMID 19404258. doi:10.1038/nature07845.
- ^ Shukla VK, Doyon Y, Miller JC, et al. Precise genome modification in the crop species Zea mays using zinc-finger nucleases. Nature. May 2009, 459 (7245): 437–41. Bibcode:2009Natur.459..437S. PMID 19404259. doi:10.1038/nature07992.
- ^ Grizot S, Smith J, Daboussi F, et al. Efficient targeting of a SCID gene by an engineered single-chain homing endonuclease. Nucleic Acids Res. September 2009, 37 (16): 5405–19. PMC 2760784
 . PMID 19584299. doi:10.1093/nar/gkp548.
. PMID 19584299. doi:10.1093/nar/gkp548.
- ^ Gao H, Smith J, Yang M, et al. Heritable targeted mutagenesis in maize using a designed endonuclease. Plant J. January 2010, 61 (1): 176–87. PMID 19811621. doi:10.1111/j.1365-313X.2009.04041.x.
- ^ Christian M, Cermak T, Doyle EL, et al. TAL Effector Nucleases Create Targeted DNA Double-strand Breaks. Genetics. July 2010, 186 (2): 757–61. PMC 2942870
 . PMID 20660643. doi:10.1534/genetics.110.120717.
. PMID 20660643. doi:10.1534/genetics.110.120717.
- ^ Li T, Huang S, Jiang WZ, et al. TAL nucleases (TALNs): hybrid proteins composed of TAL effectors and FokI DNA-cleavage domain. Nucleic Acids Res. August 2010, 39 (1): 359–72. PMC 3017587
 . PMID 20699274. doi:10.1093/nar/gkq704.
. PMID 20699274. doi:10.1093/nar/gkq704.
- ^ Ekker, S.C. Zinc finger-based knockout punches for zebrafish genes. Zebrafish. 2008, 5 (2): 1121–3. PMC 2849655
 . PMID 18554175. doi:10.1089/zeb.2008.9988.
. PMID 18554175. doi:10.1089/zeb.2008.9988.
- ^ Geurts AM, Cost GJ, Freyvert Y, et al. Knockout rats via embryo microinjection of zinc-finger nucleases. Science. July 2009, 325 (5939): 433. Bibcode:2009Sci...325..433G. PMC 2831805
 . PMID 19628861. doi:10.1126/science.1172447.
. PMID 19628861. doi:10.1126/science.1172447.
- ^ Goff, S.; Berg, P. Construction of hybrid viruses containing SV40 and λ phage DNA segments and their propagation in cultured monkey cells. Cell. 1976, 9 (4): 695–705. PMID 189942. doi:10.1016/0092-8674(76)90133-1.
- ^ Naldini L. Lentiviruses as gene transfer agents for delivery to non-dividing cells.. Curr Opin Biotechnol. 1989, (9). PMID 9821272. doi:10.1016/S0958-1669(98)80029-3.
- ^ 戴勝蘭,湯正好,臧國慶. Application of lentiviral vectors in genetic engineering. International Journal of Epidemiology and Infectious Disease.
- ^ Chen, I; Dubnau, D. DNA uptake during bacterial transformation. Nat. Rev. Microbiol. 2004, 2 (3): 241–9. PMID 15083159. doi:10.1038/nrmicro844.
- ^ Head, Graham; Hull, Roger H; Tzotzos, George T. Genetically Modified Plants: Assessing Safety and Managing Risk. London: Academic Pr. 2009: 244. ISBN 0-12-374106-8.
- ^ Gelvin, S. B. Agrobacterium-Mediated Plant Transformation: The Biology behind the "Gene-Jockeying" Tool. Microbiology and Molecular Biology Reviews. 2003, 67 (1): 16–37, table of contents. PMC 150518
 . PMID 12626681. doi:10.1128/MMBR.67.1.16-37.2003.
. PMID 12626681. doi:10.1128/MMBR.67.1.16-37.2003.
- ^ Darbani, Behrooz; Farajnia, Safar; Toorchi, Mahmoud; Zakerbostanabad, Saeed; Noeparvar, Shahin; Stewart, Jr., C. Neal. DNA-Delivery Methods to Produce Transgenic Plants. Science Alert. 2010. (原始內容存檔於2019-05-24).
- ^ Hohn, Barbara; Levy, Avraham A; Puchta, Holger. Elimination of selection markers from transgenic plants. Current Opinion in Biotechnology. 2001, 12 (2): 139–43. PMID 11287227. doi:10.1016/S0958-1669(00)00188-9.
- ^ Avise, John C. The hope, hype & reality of genetic engineering: remarkable stories from agriculture, industry, medicine, and the environment. Oxford University Press US. 2004: 22 [2017-02-09]. ISBN 978-0-19-516950-8. (原始內容存檔於2022-04-08).
- ^ Engineering algae to make complex anti-cancer 'designer' drug. PhysOrg. 2012-12-10 [2013-04-15]. (原始內容存檔於2022-04-14).
- ^ Rodriguez, Luis L.; Grubman, Marvin J. Foot and mouth disease virus vaccines. Vaccine. 2009, 27: D90–4. PMID 19837296. doi:10.1016/j.vaccine.2009.08.039.
- ^ Background: Cloned and Genetically Modified Animals. Center for Genetics and Society. 2005-04-14 [2017-02-09]. (原始內容存檔於2016-11-23).
- ^ Knockout Mice. Nation Human Genome Research Institute. 2009 [2017-02-09]. (原始內容存檔於2018-12-16).
- ^ GM pigs best bet for organ transplant. Medical News Today. 2003-09-21 [2017-02-09]. (原始內容存檔於2011-05-10).
- ^ Fischer, Alain; Hacein-Bey-Abina, Salima; Cavazzana-Calvo, Marina. 20 years of gene therapy for SCID. Nature Immunology. 2010, 11 (6): 457–60. PMID 20485269. doi:10.1038/ni0610-457.
- ^ Ledford, Heidi. Cell therapy fights leukaemia. Nature. 2011. doi:10.1038/news.2011.472.
- ^ Lewitt, Peter A; Rezai, Ali R; Leehey, Maureen A; Ojemann, Steven G; Flaherty, Alice W; Eskandar, Emad N; Kostyk, Sandra K; Thomas, Karen; Sarkar, Atom; Siddiqui, Mustafa S; Tatter, Stephen B; Schwalb, Jason M; Poston, Kathleen L; Henderson, Jaimie M; Kurlan, Roger M; Richard, Irene H; Van Meter, Lori; Sapan, Christine V; During, Matthew J; Kaplitt, Michael G; Feigin, Andrew. AAV2-GAD gene therapy for advanced Parkinson's disease: A double-blind, sham-surgery controlled, randomised trial. The Lancet Neurology. 2011, 10 (4): 309–19. PMID 21419704. doi:10.1016/S1474-4422(11)70039-4.
- ^ Gallagher, James. (2 November 2012) BBC News – Gene therapy: Glybera approved by European Commission (頁面存檔備份,存於網際網路檔案館). Bbc.co.uk. Retrieved on 15 December 2012.
- ^ Richards, Sabrina. Gene Therapy Arrives in Europe. The Scientist. [2012-11-16]. (原始內容存檔於2012-11-18).
- ^ 1990 The Declaration of Inuyama. 2001-08-05 [2017-02-10]. (原始內容存檔於2001-08-05).
- ^ Smith KR, Chan S, Harris J. Human germline genetic modification: scientific and bioethical perspectives. Arch Med Res. 2012 Oct;43(7):491-513. doi: 10.1016/j.arcmed.2012.09.003. PMID 23072719
- ^ Wade, Nicholas. Scientists Seek Ban on Method of Editing the Human Genome. 紐約時報. 2015-03-19 [2015-03-20]. (原始內容存檔於2022-05-26).
- ^ Pollack, Andrew. A Powerful New Way to Edit DNA. 紐約時報. 2015-03-03 [2015-03-20]. (原始內容存檔於2020-12-13).
- ^ Baltimore, David; Berg, Paul; Botchan, Dana; Charo, R. Alta; Church, George; Corn, Jacob E.; Daley, George Q.; Doudna, Jennifer A.; Fenner, Marsha; Greely, Henry T.; Jinek, Martin; Martin, G. Steven; Penhoet, Edward; Puck, Jennifer; Sternberg, Samuel H.; Weissman, Jonathan S.; Yamamoto, Keith R. A prudent path forward for genomic engineering and germline gene modification. 科學 (期刊). 2015-03-19, 348: 36–8 [2015-03-20]. PMC 4394183
 . PMID 25791083. doi:10.1126/science.aab1028. (原始內容存檔於2015-03-28).
. PMID 25791083. doi:10.1126/science.aab1028. (原始內容存檔於2015-03-28).
- ^ Lanphier, Edward; Urnov, Fyodor; Haecker, Sarah Ehlen; Werner, Michael; Smolenski, Joanna. Don’t edit the human germ line. 自然 (期刊). 2015-03-26, 519: 410–411 [2015-03-20]. PMID 25810189. doi:10.1038/519410a. (原始內容存檔於2015-03-22).
- ^ Kolata, Gina. Chinese Scientists Edit Genes of Human Embryos, Raising Concerns. 紐約時報. 2015-04-23 [2015-04-24]. (原始內容存檔於2020-12-14).
- ^ Liang, Puping; et al. CRISPR/Cas9-mediated gene editing in human tripronuclear zygotes. Protein & Cell. 2015-04-18, 6: 363–72 [2015-04-24]. PMC 4417674
 . PMID 25894090. doi:10.1007/s13238-015-0153-5. (原始內容存檔於2017-11-15).
. PMID 25894090. doi:10.1007/s13238-015-0153-5. (原始內容存檔於2017-11-15).
- ^ Wade, Nicholas. Scientists Place Moratorium on Edits to Human Genome That Could Be Inherited. 紐約時報. 2015-12-03 [2015-12-03]. (原始內容存檔於2021-01-12).
- ^ Bergeson, Emilie R. The Ethics of Gene Therapy. 1997 [2017-02-10]. (原始內容存檔於2018-06-15).
- ^ Hanna, Kathi E. Genetic Enhancement. National Human Genome Research Institute. [2017-02-10]. (原始內容存檔於2017-04-10).
- ^ Ralf Reski (1998): Physcomitrella and Arabidopsis: the David and Goliath of reverse genetics. Trends Plant in Science 3, 209-210
- ^ (英文)Botstein D, Fink GR. Yeast: an experimental organism for modern biology. Science. 1988, 240 (4858): 1439–1443. PMID 3287619.
- ^ Kamvysselis, M. (2003). Computational molecular genomics: genes, regulation, evolution. (Doctoral Dissertation). Retrieved from http://web.mit.edu/manoli/www/thesis/Intro.html (頁面存檔備份,存於網際網路檔案館)
- ^ Chalfie, M., & Kain, S. (2005) Methods of Biological Analyses, Green Fluorescent Protein: Properties, Applications, and Protocols. Wiley.
- ^ Matsukura, S., Stellato, C., Plitt, J. R., Bickel, C., Miura, K., Georas, S. N., Casolaro, V., Schleimer, R. P. (1999). "Activation of Eotaxin Gene Transcription by NF-κB and STAT6 in Human Airway Epithelial Cells". J Immunol 163:6876-6883. PubMed 10586089 (頁面存檔備份,存於網際網路檔案館).
- ^ Applications of Genetic Engineering. Microbiologyprocedure. [2010-07-09]. (原始內容存檔於2011-07-14).
- ^ Biotech: What are transgenic organisms?. Easyscience. 2002 [2010-07-09]. (原始內容存檔於2010-05-27).
- ^ Savage, Neil. Making Gasoline from Bacteria: A biotech startup wants to coax fuels from engineered microbes. Technology Review. 2007-08-01 [2015-07-16]. (原始內容存檔於2020-04-09).
- ^ Summers, Rebecca (24 April 2013) Bacteria churn out first ever petrol-like biofuel (頁面存檔備份,存於網際網路檔案館) New Scientist, Retrieved 27 April 2013
- ^ Applications of Some Genetically Engineered Bacteria. [2010-07-09]. (原始內容存檔於2010-11-27).
- ^ Sanderson, Katherine (24 February 2012) New Portable Kit Detects Arsenic In Wells (頁面存檔備份,存於網際網路檔案館) Chemical and Engineering News, Retrieved 23 January 2013
- ^ Reece, Jane B.; Urry, Lisa A.; Cain, Michael L.; Wasserman, Steven A.; Minorsky, Peter V.; Jackson, Robert B. Campbell Biology Ninth Edition. San Francisco: Pearson Benjamin Cummings. 2011: 421. ISBN 0-321-55823-5.
- ^ New virus-built battery could power cars, electronic devices. Web.mit.edu. 2009-04-02 [2010-07-17]. (原始內容存檔於2014-03-01).
- ^ Hidden Ingredient In New, Greener Battery: A Virus. Npr.org. [2010-07-17]. (原始內容存檔於2019-05-24).
- ^ Researchers Synchronize Blinking 'Genetic Clocks' -- Genetically Engineered Bacteria That Keep Track of Time. ScienceDaily. 2010-01-24 [2017-02-10]. (原始內容存檔於2019-05-20).
- ^ Magaña-Gómez, JA; de la Barca, A.M. Risk assessment of genetically modified crops for nutrition and health. Nutr. Rev. 2009, 67 (1): 1–16. PMID 19146501. doi:10.1111/j.1753-4887.2008.00130.x.
- ^ Angulo, E.; Cooke, B. First synthesize new viruses then regulate their release? The case of the wild rabbit. Molecular Ecology. 2002, 11: 2703–9. PMID 12453252. doi:10.1046/j.1365-294X.2002.01635.x.
- ^ Adams; et al. The Case for Genetic Engineering of Native and Landscape Trees against Introduced Pests and Diseases. Conservation Biology. 2002-08-02, 16: 874–879 [2016-05-16]. doi:10.1046/j.1523-1739.2002.00523.x. (原始內容存檔於2017-11-11).
- ^ Thomas; et al. Ecology: Gene tweaking for conservation. Nature. 2013-09-25, 501: 485–6 [2016-05-16]. PMID 24073449. doi:10.1038/501485a. (原始內容存檔於2021-04-29).
- ^ WHO (1987): Principles for the Safety Assessment of Food Additives and Contaminants in Food, Environmental Health Criteria 70 (頁面存檔備份,存於網際網路檔案館). World Health Organization, Geneva
- ^ WHO (1991): Strategies for assessing the safety of foods produced by biotechnology, Report of a Joint FAO/WHO Consultation. World Health Organization, Geneva ISBN 9789241561457. PDF download library.health.go.ug/download/file/fid/790 here]
- ^ WHO (1993): Health aspects of marker genes in genetically modified plants, Report of a WHO Workshop (頁面存檔備份,存於網際網路檔案館). World Health Organization, Geneva
- ^ WHO (1995): Application of the principle of substantial equivalence to the safety evaluation of foods or food components from plants derived by modern biotechnology, Report of a WHO Workshop (頁面存檔備份,存於網際網路檔案館). World Health Organization, Geneva
- ^ Wendell D. Zalta EN , 編. The Ethics of Clinical Research. The Stanford Encyclopedia of Philosophy (Fall 2012 Edition). 2009-01-30 [2017-02-10]. (原始內容存檔於2022-04-14).
- ^ Segal C. Alleged ethics violations surface in Tufts-backed study. Tufts Daily. 2012-09-17 [2017-02-10]. (原始內容存檔於2022-04-14).
- ^ Piñeyro-Nelson A, Van Heerwaarden J, Perales HR, Serratos-Hernández JA, Rangel A, Hufford MB, Gepts P, Garay-Arroyo A, Rivera-Bustamante R, Alvarez-Buylla ER. Transgenes in Mexican maize: molecular evidence and methodological considerations for GMO detection in landrace populations. Molecular Ecology. February 2009, 18 (4): 750–61. PMC 3001031
 . PMID 19143938. doi:10.1111/j.1365-294X.2008.03993.x.
. PMID 19143938. doi:10.1111/j.1365-294X.2008.03993.x.
- ^ Marden E. Risk and Regulation: U.S. Regulatory Policy on Genetically Modified Food and Agriculture. 44 B.C.L. Rev. 733. 2003 [2017-02-10]. (原始內容存檔於2019-11-08).
By the late 1990s, public awareness of GM foods reached a critical level and a number of public interest groups emerged to focus on the issue. One of the early groups to focus on the issue was Mothers for Natural Law ("MFNL"), an Iowa-based organization that aimed to ban GM foods from the market....The Union of Concerned Scientists ("UCS"), an alliance of 50,000 citizens and scientists, has been another prominent voice on the issue.... As the pace of GM products entering the market increased in the 1990s, UCS became a vocal critic of what it saw as the agency's collusion with industry and failure to fully take account of allergenicity and other safety issues.
- ^ Consumer Attitudes Survey 2007, A benchmark survey of consumers' attitudes to food issues. Food Standards Australia New Zealand. January 2008 [2012-11-05]. (原始內容存檔於2011-02-17).
- ^ Raney T, Pingali P. Sowing a Gene Revolution. Scientific American. September 2007 [2014-10-26]. (原始內容存檔於2022-03-10).
- ^ Lal R, Hobbs PR, Uphoff N, Hansen DO (編). Sustainable Agriculture and the International Rice-Wheat System. CRC Press. 2004 [2013-05-12]. ISBN 9780824754914. (原始內容存檔於2020-09-17).
- ^ Kiers ET, Leakey RR, Izac AM, Heinemann JA, Rosenthal E, Nathan D, Jiggins J. Ecology. Agriculture at a crossroads. Science. April 2008, 320 (5874): 320–1. PMID 18420917. doi:10.1126/science.1158390.
- ^ Agriculture at a Crossroads (c) 2009" (PDF). International Assessment of Agricultural Knowledge, Science and Technology for Development. [2016-02-11]. (原始內容 (PDF)存檔於2014-11-30).
- ^ Stutz B. Wanted: GM Seeds for Study. Seed Magazine. 2010-07-01 [2017-02-10]. (原始內容存檔於2010-07-05).
參見
[編輯]外部連結
[編輯]| 關於基因工程 的圖書館資源 |
- GMO Safety - Information about research projects on the biological safety of genetically modified plants.
- GMO-compass, news on GMO en EU

