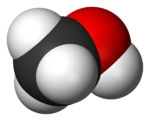
醚


乙醚是一種常見的醚類,它常用於有機溶劑與醫用麻醉劑。由於其在化學中的常用性(乙醚是最常用的醚類溶劑),我們還有時將乙醚直接簡稱為「醚」。結構最簡單的醚類是二甲醚 。醚類化合物的應用常見於有機化學和生物化學,它們還可作為糖類和木質素的連接片段。
結構和化學鍵
[編輯]醚的結構通式為:R-O-R(R')、Ar-O-R或Ar-O-Ar(Ar')(R=烴基,Ar=芳烴基)。醚的鍵角約為110°,C-O鍵長為140pm,C-O鍵的旋轉能壘的能量很小,而水、醇與醚分子中氧的鍵合能力也與此相似。根據價鍵理論,氧原子的雜化狀態是sp3。
氧原子的電負度比碳更強,因此與氧連接的α氫原子酸性強於碳連接的α氫原子,然而其酸性比不上羰基α氫原子。
分類
[編輯]醚可以根據醚鍵是否成環分為直鏈醚和環醚兩大類。
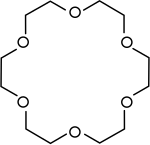
分子中含有多個乙烯氧基(-CH2CH2O-)結構單元的大環醚稱為冠醚。冠醚是一種大環多醚,因分子形狀類似王冠而得名。
在直鏈醚中,氧原子所連結的兩個烴基相同者被稱為單醚,不同者被稱為混醚,若含芳基者則被稱為芳香醚。
命名
[編輯]| 外部圖片連結 | |
|---|---|
醚的普通命名法是於烴基後加上「醚」字,習慣上對稱醚的「二」字可省略。醚的兩個不同基團排列順序通常是:先小基團後大則為:苯基或芳烴基在前。英文命名則按字母順序。
遇到複雜的直鏈氧時,使用烴氧基(如烷氧基、烯氧基、苯氧基等)官能團命名。例如,「1,2-二(1-丙烯氧基)乙烷」(1,2-di(1-propenoxy)ethane)、「1,2-雙(烯丙氧基)乙烷」(1,2-Bis(allyloxy)ethane)等等。
環醚則使用氧雜環命名法命名,但氧雜環丙烷通常用環氧基作用到烷烴的方式命名。遇到對稱的冠醚時,還可命名為 x-冠-y,x代表環總原子數,y代表環中氧原子數。
物理性質
[編輯]醚分子不能互相形成氫鍵,因此它們具有和醇類相比較低的沸點。醚具有微弱的極性,這是由於醚官能團中碳氧碳的鍵角約110度,而碳氧之間的極性差異沒有抵消(不同於二硫化碳之類的線型分子)。醚類極性不如醇、酯與酰胺類化合物,但是強於烯烴的極性。醚氧原子的孤電子對使它有可能與水分子形成氫鍵。
環狀醚類比如四氫呋喃和1,4-二噁烷能與水混溶,這是因為這類醚分子的氧原子比起烷基醚(鏈狀醚)來說更暴露於分子之外,所以極性比起後者更大。
| 常見烷基醚的理化數據 | |||||
|---|---|---|---|---|---|
| 醚 | 結構 | 熔點(°C) | 沸點 (°C) | 一升水當中的溶解度 H2O | 偶極矩 (D) |
| 甲醚 | CH3-O-CH3 | -138.5 | -23.0 | 70 g | 1,30 |
| 甲乙醚 | CH3-O-CH2CH3 | -113 | 7.4 | ||
| 乙醚 | CH3CH2-O-CH2CH3 | -116.3 | 34.4 | 6.9 g | 1.14 |
| 正丁醚 | C8H18O | −95 | 141 | 0.3 | |
| 叔丁醚 | C8H18O | −61 | 107.2 | ||
| 甲基叔丁基醚 | C5H12O | −109 | 55.2 | 42 | |
| 四氫呋喃 | O(CH2)4 | -108.4 | 66.0 | 互溶 | 1.74 |
| 二氧六環 | O(C2H4)2O | 11.8 | 101.3 | 互溶 | 0.45 |
反應
[編輯]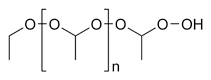
醚類總體來說化學活性都較低,但強於烷烴(環氧化物、酮、縮醛參見各自條目)。
與醚相關的重要反應講解如下:[3]
醚的裂解
[編輯]雖然醚不能輕易的發生水解反應,但於酸性條件下(如:氫溴酸或氫碘酸),可斷裂為醇。鹽酸條件下,斷裂醚的速度非常慢。如:甲醚製備溴化甲烷:
- ROCH3 + HBr → CH3Br + ROH
該類反應都是通過鎓中間體進行,如:[RO(H)CH3]+Br-.
有些醚類能於三溴化硼條件中迅速分解,有時還可用更強的路易斯酸如:三氯化鋁反應,製備溴代烷烴。[4]這些都取決於取代基的不同,還有些醚類可在特定的試劑中發生裂解,如非常強的鹼。
過氧化物
[編輯]臨近氧原子,含有CH基團的一級醚或二級醚易形成有機過氧化物,如:乙醚過氧化物。該反應需要氧氣(或者空氣)參與,且在光、金屬和醛的催化下加速反應。得到的過氧化物在高溫或高濃度下具爆炸性,因此操作二異丙基醚、四氫呋喃等醚類溶劑大多都不可蒸乾,而廠商在分裝醚類試劑也會放入一些穩定劑,防止大量產生過氧化物。
作為路易斯鹼
[編輯]醚類可作為路易斯鹼及布侖斯惕鹼。強酸與醚發生反應,可提供給醚氧原子一個質子,從而形成:「鎓離子」,如:乙醚可以與三氟化硼形成絡合物(BF3.OEt2) 。醚還可與二價鎂絡合成格氏試劑。多聚醚都可與鹼金屬離子牢固的結合。
α-鹵化反應
[編輯]該反應類似於醚的α氫原子發生過氧化的反應,如:單質氯製備α-氯化醚的反應。
合成
[編輯]醚在實驗室條件下可通過許多方法合成,以下枚舉數種。
醇的脫水
[編輯]- 2 R-OH → R-O-R +H2O(高溫下)
該反應過程需要高溫(通常在125°C)。該反應還需要酸的催化(通常為硫酸)。上述方法對於製備對稱醚來說有效,但對於不對稱醚卻無能為力,如:乙醚易於通過此法製備,環醚也同樣可用此方法製備(分子內脫水)。另外此方法還會引入一定的副產物,如分子內脫水產物:
- R-CH2-CH2(OH) → R-CH=CH2 + H2O
另外此法只能合成一些簡單的醚,對於複雜的分子醚類分子不太試用。對於複雜分子則需要更溫和的條件來合成。
威廉森醚合成
[編輯]- R-ONa + R'-X → R-O-R' + NaX
該反應稱作:威廉姆遜合成。該反應通過用強鹼處理醇,形成醇鹽,而後與帶有合適離去基團的烴類分子反應。這裏的離去基團包括:碘、溴等鹵素,或磺酸酯。該方法對於芳香鹵代烴一般不適用(如:溴苯,參見Ullmann縮合)。該方法還只局限於一級鹵代烴才可得到較好的收率,對於二級鹵代烴與三級鹵代烴則由於太易生成E2消除產物而不適用。
在相似的反應中,烷基鹵代烴還可與酚負離子發生親核取代反應。R-X雖不能與醇反應,但酚卻能夠進行該反應(酚酸性遠高於醇),它可通過一個強鹼,如:氫化鈉先形成酚負離子再進行反應。酚可取代鹵代烴中的X離去基團,形成酚醚的結構,該過程為SN2機理。
- C6H5OH + OH- → C6H5-O- + H2O
- C6H5-O- + R-X → C6H5OR
Ullmann二芳醚合成
[編輯]Ullmann二芳醚合成的反應很類似於威廉姆遜反應,不同之處在於底物是芳香鹵代烴。該反應需要催化劑才能進行,如:銅。
醇對於烯烴的親電加成反應
[編輯]醇可與活化後的烯烴進行親電加成:
- R2C=CR2+ R-OH → R2CH-C(-O-R)-R2
該反應需要酸催化,三氟醋酸汞(Hg(OCOCF3)2)常可作為這種反應的催化劑,反應生成具有弗拉基米爾·瓦西里耶維奇·馬爾科夫尼科夫(Markovnikov)立體化學的醚類。使用相似的反應條件,四氫吡喃醚(THP)可作為一種醇的保護基。
製備環氧化合物
[編輯]環氧化合物通常由烯烴氧化製備。在工業生產中,最重要的環氧化合物是:環氧乙烷,它通過乙烯和氧氣製備。其他的過氧化合物還可通過以下方法製備:
重要的醚
[編輯]
|
環氧乙烷 | 最小的環狀醚。 |
| 甲醚 | 一種新型的可再生替代燃料,可以和十六烷以一定的比例混合作為柴油內燃機的燃料。 | |
| 乙醚 | 一種常用的低沸點溶劑 (沸點:34.6°C),早期用作麻醉劑。可以用作啟動柴油發動機的燃料。 | |

|
二甲氧基乙烷(DME) | 一種高沸點溶劑 (沸點為 85°C)。 |

|
二氧六環 | 一種高沸點的環狀的醚 (沸點為101.1°C)。 |

|
四氫呋喃(THF) | 一種環狀醚類,是有機合成當中極性最大醚類溶劑之一。 |

|
茴香醚(苯甲醚) | 一種「芳香醚」,是大茴香種子精油的主要組分。 |
|
冠醚 | 環狀多聚醚用來做相轉移催化劑。 |

|
聚乙二醇(PEG) | 一種線形的多聚醚,可以用作化妝品添加劑或者藥物材料(其具有高水溶性,可以讓一些非水溶性分子大大增加水溶性)。 |
參考文獻
[編輯]- ^ 國際純化學和應用化學聯合會,化學術語概略,第二版。(金皮書)(1997)。在線校正版: (2006–) "ethers"。doi:10.1351/goldbook.E02221
- ^ ([//web.archive.org/web/20230311001802/https://pubchem.ncbi.nlm.nih.gov/compound/2-_Phenoxy_prop-2-enoxy_methyl_oxirane 頁面存檔備份,存於互聯網檔案館) 2-[苯氧基(丙-2-烯氧基)甲基]氧雜環丙烷 - PubChem]
- ^ Heitmann, Wilhelm; Strehlke, Günther; Mayer, Dieter. Ethers, Aliphatic. Wiley-VCH Verlag GmbH & Co. KGaA (編). Ullmann's Encyclopedia of Industrial Chemistry. Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA. 2000-06-15: a10_023. ISBN 978-3-527-30673-2. doi:10.1002/14356007.a10_023 (英語).
- ^ J. F. W. McOmie and D. E. West (1973). "3,3'-Dihydroxylbiphenyl". Org. Synth.; Coll. Vol. 5: 412.
外部連結
[編輯]- ILPI page about ethers.
- An Account of the Extraordinary Medicinal Fluid, called Aether (頁面存檔備份,存於互聯網檔案館), by M. Turner, circa 1788, from Project Gutenberg
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||
| |||||||
| ||||||||||||