磷
磷(英语:Phosphorus;源于拉丁语:Phosphorum),是一种化学元素,化学符号为P,原子序数为15,原子量为30.973761998 u。[6]
性状
[编辑]磷是一种易起化学反应的、有毒的氮族非金属元素。它的化学反应活性和毒性取决于形态不同而有所区别。
- 紫磷
- 化学结构为层状,但与黑磷不同。
- 化学式一般写为。
化学性质
[编辑]白烟:
在有催化剂存在的情况下,白磷、红磷和水经过几步反应生成H3PO4、H2及很少量的H3PO3和PH3:
发现
[编辑]
在化学史上第一个发现磷元素的人,当推十七世纪的一个德国汉堡商人亨尼格·布兰德(Henning Brand,约1630年~约1710年)。他是一个相信炼金术的人,在三十年战争时他担任初级军官,战争结束后成为玻璃工匠的学徒。后来他娶了一位有钱人的女儿。丰饶的嫁妆让他从此不愁吃穿,所以他开始追求他真正的兴趣,也就是寻找贤者之石。当时的社会相信贤者之石要透过炼金术才能制成,可以把所有东西变成黄金,甚至可以让人长生不老。
然而,反复的实验失败终究还是花光了他的所有积蓄。更不幸的是他妻子也过世了。之后他又娶了另一位女人,这位后来娶的妻子不只带给他财富让他可以继续实验,也给他一个儿子可以在实验室帮他的忙。
由于他相信人体本身就是一种炼金术,因为从嘴巴吃进去的跟排泄出来的物质完全不一样。所以他使用尿作了大量实验。1669年,他在一次实验中,将砂、木炭、石灰等和尿混合,加热蒸馏,虽没有得到黄金,而竟意外地得到一种十分美丽的物质,它色白质软,能在黑暗的地方放出闪烁的亮光,于是波兰特给它取了个名字,叫“冷光”,这就是今日称之为白磷的物质。波兰特对制磷之法,起初极守秘密,不过,他发现这种新物质的消息立刻传遍了德国。[8]
德国化学家孔克尔曾用尽种种方法想打听出这一秘密的制法,终于探知这种所谓发光的物质,是由尿里提取出来的,于是他也开始用尿做试验,经过苦心摸索,终于在1678年也告成功。他是把新鲜的尿蒸馏,待蒸到水分快干时,取出黑色残渣,放置在地窑里,使它腐烂,经过数日后,他将黑色残渣取出,与两倍于“尿渣”重的细砂混合。一起放置在曲颈瓶中,加热蒸馏,瓶颈则接连盛水的收容器。起初用微火加热,继用大火干馏,及至尿中的挥发性物质完全蒸发后,磷就在收容器中凝结成为白色蜡状的固体。后来,他为介绍磷,曾写过一本书,名叫《论奇异的磷质及其发光丸》。
在磷元素的发现上,英国化学家罗伯特·波义耳差不多与孔克尔同时,用与他相近的方法也制得了磷。波义耳的学生汉克维茨(Codfrey Hanckwitz)曾用这种方法在英国制得较大量的磷,作为商品运到欧洲其他国家出售。他在1733年曾发表论文,介绍制磷的方法,不过说得十分含糊,以后,又有人从动物骨质中发现了磷。
名称由来
[编辑]由于单质磷在空气中会自燃或缓慢氧化而放热发光,因此磷的拉丁文名称Phosphorum来源于希腊文Φωσφόρος的拉丁化,原指“启明星”,意为“光亮”。
而在中文里,磷的本字为粦,根据晋代《博物志》记载,“战鬬死亡之处,有人马血,积中为粦,著地入艸木,如霜露不可见。有触者,著人体后有光,拂拭即散无数,又有吒声如鬻豆。舛者,人足也。言光行著人。”可见上部"米"字乃代表鬼火之"炎"字转写,下部"舛"字则指人足部。
“磷”字本与“粦”无关,如司马相如在作赋时将其与"嶙"、"粼"混用,指光亮。南朝时期的字典《玉篇》中记载为云母之意。本作为鬼火之源的"粦"后加石字偏旁以作为其元素性质之辨,指鬼火之源所含的元素。此与"磷"之原来诸义皆有所不同。
分布
[编辑]磷在地壳中的含量为0.09%。磷不以单质存在,通常在磷酸盐中天然存在,尤其是磷灰石。磷也存在于生物体当中,是原生质的基本成分。
制备
[编辑]磷的现代制法是将磷酸钙与砂(主要成分为二氧化硅)及焦炭一起放在电炉中加热。为使反应式易于理解,可写成两步如下:
同位素
[编辑]已发现磷的同位素共有13种,包括磷27至磷39,其中只有磷31是稳定的,其他同位素都带有放射性。
化合物
[编辑]含氧酸
[编辑]磷的含氧酸非常丰富,结构较为复杂,且大多具有商业价值。这些含氧酸都有和氧相连的氢原子,可以体现酸性,也有些有不体现酸性的直接连在磷上的氢原子。纵然许多磷的含氧酸已经被合成,但仅有以下几种是较常见的。其中的三种——次磷酸、亚磷酸和磷酸尤为重要。
| 名称 | 化学式 | 磷的氧化数(化合价) | 结构式 | N元酸 | 化合物形态 |
|---|---|---|---|---|---|
| 次磷酸 | +1 |  |
1 | 酸、盐 | |
| 亚磷酸 | +3 |  |
2 | 酸、盐 | |
| 偏亚磷酸 | +3 |  |
1 | 盐 | |
| 原亚磷酸(与亚磷酸为互变异构体) | +3 |  |
3 | 酸、盐 | |
| 连二磷酸 | +4 | 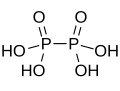 |
4 | 酸、盐 | |
| n(聚)偏磷酸 | +5 | 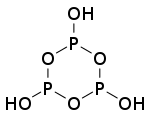   |
n | 盐(n=3、4、6) | |
| 磷酸(正磷酸) | +5 |  (n聚磷酸n=1时) (n聚磷酸n=1时) |
3 | 酸、盐 | |
| n(聚)磷酸 | +5 |  |
n+2 | 酸、盐(n=1-6) | |
| 焦磷酸 | +5 |  (n聚磷酸n=2时) (n聚磷酸n=2时) |
4 | 酸、盐 | |
| 三磷酸 | +5 | 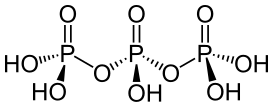 (n聚磷酸n=3时) (n聚磷酸n=3时) |
5 | 盐 |
磷(V)化合物
[编辑]含氧化合物
[编辑]最常见的磷化合物是磷酸盐(),它是一个呈四面体的阴离子。[9]其一个很重要的作用是用作化肥。磷酸根离子是(正)磷酸的共轭碱。磷酸是一个三元酸,所以它可以逐步转变为以下三种共轭碱:
- Ka1= 7.25×10−3
- Ka2= 6.31×10−8
- Ka3= 3.98×10−13
磷酸及其衍生物有聚合成链或环而形成键的倾向。目前已知的聚磷酸衍生物已经有很多,比如ATP。它们通过磷酸氢盐(例如和)脱水得到。例如,下列缩合反应在工业上非常广泛地用于生产三磷酸钠(俗称五钠):
十氧化四磷(P4O10)是磷酸的酸酐。它是白色的固体,与水反应非常剧烈。
和两种化合物具有共同点:它们都较不稳定,且都是白色或浅色的。和的空间构型都是五角双锥,并且它们都是路易斯酸。后者可以形成离子,它和互为等电子体。至于另外两种磷的卤化物和都是极不稳定的。而磷最主要的卤氧化物是三氯氧磷(),它的空间构型是四面体型的。
以往一直认为磷(V)化合物中磷的d轨道参与了杂化。然而经过计算机大量计算,事实并非如此:磷只用了s和p轨道杂化[10]。这可用分子轨道理论来解释。
含硫化合物
[编辑]磷酸根中的氧可以被硫取代,如硫代磷酸。
多种硫化磷也是已知的。
用途
[编辑]磷可用于安全火柴、烟花、燃烧弹和化肥,还可以保护金属表面免于腐蚀。
磷酸的用途也十分广泛。
对人体的影响
[编辑]磷是骨骼和牙齿的构成材料之一。正常成年人骨中的含磷总量约为600~900克,人体每100毫升全血中含磷35-45毫克。磷能保持人体内代谢平衡,在调节能量代谢过程中发挥重要作用。它是生命物质核苷酸的基本成分。它参与体内的酸碱平衡的调节,参与体内脂肪的代谢。
磷缺乏可以出现低磷血症,引起红细胞、白细胞、血小板的异常,软骨病。磷过多将导致高磷血症,使血液中血钙降低导致骨质疏松。
短时间内摄取一定分量的白磷单质,可造成急性白磷中毒。
参考文献
[编辑]- ^ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip J. H.; Gröning, Manfred; Holden, Norman E.; Meijer, Harro A. J. Standard atomic weights of the elements 2021 (IUPAC Technical Report). Pure and Applied Chemistry. 2022-05-04. ISSN 1365-3075. doi:10.1515/pac-2019-0603 (英语).
- ^ cf. "Memoir on Combustion in General (页面存档备份,存于互联网档案馆)" Mémoires de l'Académie Royale des Sciences 1777, 592–600. from Henry Marshall Leicester and Herbert S. Klickstein, A Source Book in Chemistry 1400–1900 (New York: McGraw Hill, 1952)
- ^ webelements. [2013-09-01]. (原始内容存档于2008-05-12).
- ^ Ellis, Bobby D.; MacDonald, Charles L. B. Phosphorus(I) Iodide: A Versatile Metathesis Reagent for the Synthesis of Low Oxidation State Phosphorus Compounds. Inorganic Chemistry. 2006, 45 (17): 6864–74. PMID 16903744. doi:10.1021/ic060186o.
- ^ Magnetic susceptibility of the elements and inorganic compounds 互联网档案馆的存档,存档日期2012-01-12., in Lide, D. R. (编), CRC Handbook of Chemistry and Physics 86th, Boca Raton (FL): CRC Press, 2005, ISBN 0-8493-0486-5
- ^ 夏征农、陈至立 (编). 《辞海》第六版彩图本. 上海: 上海辞书出版社. 2009年: 第3227页. ISBN 9787532628599.
- ^ 无机化学丛书.第四卷.P195.张青莲 主编
- ^ TodayIFoundOut.com, Matt Blitz-. How One Man’s Love of Urine Led to the Discovery of Phosphorus. Gizmodo. [2020-02-06]. (原始内容存档于2020-02-06) (美国英语).
- ^ D. E. C. Corbridge "Phosphorus: An Outline of its Chemistry, Biochemistry, and Technology" 5th Edition Elsevier: Amsterdam 1995. ISBN 978-0-444-89307-9.
- ^ Kutzelnigg, W. Chemical Bonding in Higher Main Group Elements (PDF). Angewandte Chemie Int. (English) Ed. 1984, 23 (4): 272–295 [2014-04-27]. doi:10.1002/anie.198402721. (原始内容存档 (PDF)于2020-04-16).
外部链接
[编辑]- 元素磷在洛斯阿拉莫斯国家实验室的介绍(英文)
- EnvironmentalChemistry.com —— 磷(英文)
- 元素磷在The Periodic Table of Videos(诺丁汉大学)的介绍(英文)
- 元素磷在Peter van der Krogt elements site的介绍(英文)
- WebElements.com – 磷(英文)



























![{\displaystyle {\ce {2Na2[(HO)PO3] + Na[(HO)2PO2] -> Na5[O3P-O-P(O)2-O-PO3] + 2H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/52711a40d6a0e31fd31153f5630d880711fce8ab)






