鎝
在鎝發現以前,德米特里·門得列夫就已經預測了它的許多性質。在他的週期表中,門得列夫把這種尚未發現的元素叫做「類錳」,符號為Em。1937年,鎝成為第一個由人工合成而發現的元素。它的英文名來自希臘語τεχνητός,意為「人造」。
鎝的短壽命同位素鎝-99m具有γ放射性,廣泛用於核醫學。鎝-99僅具有β放射性。商業上,鎝的長壽命同位素是反應爐中鈾-235分裂的副產物,可以從用過燃料中提取得到。鎝的半衰期較短,因此1952年在壽命超過十億年的紅巨星中鎝的發現證明恆星可以合成重元素。
歷史
[編輯]搜尋43號元素
[編輯]根據早期的元素週期律,許多研究者急於找到和命名第43號元素,其較低的原子序數似乎顯示它應當比其他未知元素更容易發現。1828年,德國化學家哥特弗雷德·威爾海姆·奧桑(Gottfried Wilhelm Osann)相信他在鉑礦裏發現了43號元素,並命名為Polinium。但後來證明那只不過是不純的銥。1846年,有人聲稱發現了元素ilmenium,但後來被證明是不純的鈮。1847年,有人說發現了新元素Pelopium,但也只是鈮和鉭的混合物。[6][7]
在門得列夫的元素週期表中,元素鉬(原子序為42)與釕(原子序為44)之間有一個空白。1871年,門得列夫預言這個當時尚未發現的元素應當排在錳之下,因此與錳有相似的化學性質。門得列夫把它叫做「類錳」。[8]
1877年,俄羅斯化學家謝爾蓋·柯恩(Serge Kern)稱在鉑礦裏發現了43號元素,並以英國化學家杭弗瑞·戴維(Sir Humphry Davy)的名字命名為Davyum,但最後發現它是銥、銠和鐵的混合物。1896年發現的Lucium最後被確定為釔。1908年,日本化學家小川正孝在方釷石中發現了一種新元素,並稱之為「日本素」(Nipponium)。2004年,日本有學者重新檢驗了小川正孝家族保留下來的方釷石樣品。X-射綫譜證明,該樣品中不含43號元素,而是含有與其同族的75號元素錸。小川正孝可能是發現錸的第一人。[9]
1925年,德國化學家瓦爾特·諾達克、奧托·伯格和伊達·諾達克稱他們發現了75號元素和43號元素,並將43號元素根據諾達克家族的發源地命名為Masurium。[10]他們用電子流轟擊鈮鐵礦石,然後通過對X-射綫波長的分析發現了新元素。[11]因該小組的發現無法重現,他們的發現沒有受到廣泛承認。[12][13]但直到1933年還有人把43號元素叫做Masurium。[14][15]1980年商務印書館的《新華詞典》中,將鎷作為該元素Masurium的中文譯名。至今,1925年諾達克等人是否真正發現了鎝還存在爭議。[15][16]
鎝的正式發現
[編輯]1936年12月,義大利巴勒莫大學的卡羅·佩里爾(Carlo Perrier)和埃米利奧·吉諾·塞戈雷(Emilio Segrè)終於證實了43號元素的存在。[17]1936年中,塞戈雷在美國先後訪問了哥倫比亞大學和勞倫斯伯克利國家實驗室。他向迴旋加速器的發明者歐內斯特·勞倫斯要一些迴旋加速器上帶有放射性的廢棄部件。於是勞倫斯寄給他了一些曾用做迴旋加速器偏向板的鉬箔。
塞戈雷在同事佩里爾的協助下,用化學方法證明鉬箔的放射性來源於一種原子序數為43的新元素。他們成功的分離出了鎝的同位素鎝-95m和鎝-97。[18][19]巴勒莫大學當局希望他們把新元素以巴勒莫的拉丁文名稱Panormus命名為「Panormium」。[18] 1947年,43號元素根據希臘語τεχνητός命名為鎝,意為「人造」。[7][10]塞戈雷再度訪問美國。他和格倫·西奧多·西博格一起分離了鎝的介穩態同位素鎝-99m。現在這種同位素被廣泛用於許多核醫學診斷中。[20]
1952年,美國天文學者保羅·麥裏爾在S-型紅巨星的光譜中觀察到了鎝的發射譜綫。[21]這些星體的年齡是鎝最長壽同位素半衰期的幾千倍。這意味著它們還在通過核反應產生鎝。當時,恆星通過核合成產生重元素只是一個假說。此觀測無疑給這一假說提供了證據。[19]近來,有觀測表明重元素是在s-過程中通過中子俘獲生成的。[22]
自發現以來,人們一直在搜索自然界中的鎝。1962年,有人從比屬剛果的瀝青鈾礦中分離出了鎝-99。其含量極低,每公斤鈾礦僅含有0.2納克鎝,[22]是鈾-238自發分裂的產物。有證據表明,加彭奧克洛天然核子反應爐曾產生大量的鎝-99,但在過去億萬年中已經幾乎全部衰變為釕-99。[22]
性質
[編輯]物理性質
[編輯]鎝是一種銀灰色放射性金屬,外觀與鉑相似。粉狀時呈灰色。純金屬鎝的晶型為六方最密堆積。在原子發射光譜中,鎝的特徵譜綫位於363.3、403.1、426.2、429.7和485.3納米。[23]
金屬鎝具有順磁性。在溫度降到7.46 K時,純金屬鎝的單晶成為二型超導體(type-II superconductor)。[b]在這個溫度以下,鎝具有很高的倫敦穿透深度,在所有金屬中僅次於鈮。[25]
化學性質
[編輯]在元素週期表中,鎝處在第五週期和第七族,位於錳和錸之間。根據元素週期律,其化學性質應介於這兩種元素之間。但鎝比較不活潑,容易形成共價鍵,不易生成陽離子。這些性質上鎝與錳不同,而更接近於錸。[26]鎝常見的氧化數有+4、+5和+7。[27]金屬鎝能溶於王水、硝酸和濃硫酸,但不溶於鹽酸。[28]
同位素
[編輯]鎝沒有穩定的同位素,即所有同位素都具有放射性。在元素週期表中,鎝是沒有穩定同位素的元素中原子序最小的;下一個沒有穩定同位素的元素是鉕,其原子序數為61。[27]鎝和鉕是液滴模型的特例,而相鄰元素(鉬及釕)的穩定性也連帶影響了鎝的穩定性。根據馬陶赫同量異位素規則,若兩個在週期表上相鄰的元素各有一個質量數彼此相等的同位素的話,其中一個必然會有放射性[29][30],而和鎝相鄰的鉬與釕都有對β衰變穩定、且質量數位於照理來說鎝的同位素會對β衰變穩定的質量範圍內的同位素,因而造成鎝沒有穩定的同位素。
即使中子數為偶數,原子核中質子數為奇數的核種仍要比質子數為偶數的更不穩定。[31]因此對於原子序數(即質子數)為奇數的元素來說,一般其穩定同位素較少。而前述的鎝和鉕的原子序數皆為奇數,本身可能擁有的穩定同位素數量便少於相鄰的偶數元素,再加上馬陶赫同量異位素規則的影響,造成鎝和鉕可能擁有穩定同位素的質量數被相鄰元素佔去,因而成為原子序數小於83(鉍)的元素中唯二沒有穩定同位素的元素。
鎝最穩定的同位素分別是鎝-97(半衰期為421萬年)、鎝-98(半衰期為420萬年)、鎝-99(半衰期為21.11萬年)。[1]除了上述同位素,鎝還有34種同位素,質量數在86到122之間。[1]這些同位素的半衰期都不超過一個小時,鎝-93(半衰期為2.73小時)、鎝-94(4.88小時)、鎝-95(20小時)和鎝-96(4.3天)除外。[32]
比鎝-98輕的鎝同位素衰變時以電子俘獲為主,產物是鉬(原子序為42);[33]鎝-98及更重的同位素衰變時則以β衰變為主,產物是釕(原子序為44)。唯一的例外是鎝-100:它既可以俘獲電子生成鉬,也可以發生β衰變生成釕。[33][34]
鎝還有很多亞穩態同位素,也稱為核同質異能素。以鎝-97m(97mTc;「m」代表「介穩態」)最為穩定,半衰期為91天。[32]鎝-95m半衰期次之(61天)。鎝-99m半衰期為6.01小時。它會釋放出γ射線,轉變成鎝-99。[32]
鎝-99是核子反應爐中鈾-235和鈽-239分裂的主要產物之一,因此是最常見、最易得的鎝同位素。一克鎝-99每秒鐘衰變6.2×108次(即0.62GBq/克)。[35]
化合物
[編輯]氫化物和氧化物
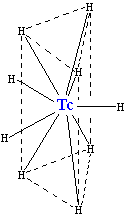
[編輯]鎝和氫氣反應生成鎝氫化物陰離子TcH2−
9,其晶體結構跟錸氫化物ReH2−
9類似。六個氫原子組成一個三稜柱,鎝位於三稜柱的體心位置。另外三個氫原子位於通過中心鎝原子並與上、下底面平行的平面上,和上、下底面的氫原子呈交錯構象(gauche)。九個氫原子不等同,但是在電子結構上非常相似。鎝在這個離子中的配位數是九。這是鎝化合物的最高配位數。[36]
金屬鎝在潮濕空氣中會漸漸失去光澤。[27]粉狀鎝在氧氣中可以燃燒。現已製得兩種鎝的氧化物:TcO2和Tc2O7。鎝可以被氧化成過鎝酸離子TcO−
4。[35][27]
在400–450 °C,鎝可以被氧化成淺黃色的七氧化二鎝:
- 4 Tc + 7 O2 → 2 Tc2O7
此化合物的結構中心對稱,共有兩種不同的鎝-氧鍵,鍵長分別為167 pm和184 pm。[37]
- Tc2O7 + 2 NaOH → 2 NaTcO4 + H2O
過鎝酸可以通過Tc2O7和水或氧化性酸反應來製備。可用的酸包括硝酸、濃硫酸、王水和硝酸與鹽酸的混酸。深紅色的過鎝酸是強酸,易吸水。和過錳酸(MnO−
4)不同,過鎝酸是一種弱氧化劑。因為水溶性好,過鎝酸鹽是臨床上常用的鎝試劑和催化劑。[40]
過鎝酸陰離子是正四面體結構:四個氧原子在四面體的四角,鎝原子位於四面體的中心。在濃硫酸中,過鎝酸會轉化成八面體結構的異過鎝酸(technetic(VII) acid)TcO3(OH)(H2O)2。[41]
硫化物、硒化物和碲化物
[編輯]鎝有多種硫化物。鎝可以和硫直接起反應生成TcS2。Tc2S7則是通過過鎝酸與硫化氫的反應製備:
- 2 HTcO4 + 7 H2S → Tc2S7 + 8 H2O
在這個反應中鎝(VII)被還原成四價,過量的硫生成雙硫鍵。七硫化二鎝是聚合物,結構為(Tc3(µ3–S)(S2)3S6)n,類似於鉬的硫化物 Mo3(µ3–S)(S2)62–.[42]
- Tc2S7 → 2 TcS2 + 3 S

鹵化物
[編輯]鎝能形成包括四氯化鎝、六氟化鎝在內的多種鹵化物,有關綜述參見文獻。[44]
碳化鎝和鎝的正交晶相
[編輯]金屬鎝中如果有少量碳雜質,會使由部分鎝由六方密堆積轉變成為正交晶系結構。當含碳量超過15-17%時,轉變趨於完全,生成立方晶系的碳化鎝,化學式近似為Tc6C。其結構不會再隨碳含量增加而變化。[45]
簇合物和有機錯合物
[編輯]鎝有幾種已知的簇合物,包括Tc4、Tc6、Tc8和Tc13。[46][47]較穩定的Tc6和Tc8簇合物擁有稜柱型結構。垂直方向上的鎝原子以三鍵相連接,水平方向的則以單鍵連接。每個鎝原子有六個鍵,剩餘價電子通過直立鍵同一個鹵素原子,或者通過橋鍵與兩個鹵素原子相連接,比如氯和溴。[48]
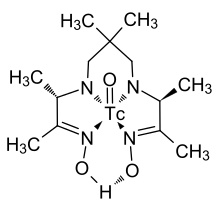
鎝可以形成衆多的有機錯合物。因為它們在核醫學方面的重要性,對鎝錯合物的研究較為充分。羰基鎝Tc2(CO)10為白色固體。[50]此化合物中,兩個鎝原子之間的化學鍵很弱,每個鎝原子與五個羰基以八面體結構鍵合。鎝-鎝鍵鍵長為303 pm,[51][52]比金屬鎝中原子間距(272pm)長得多。和鎝同族的錳和錸也可形成類似的羰基化合物。[53]
右圖中所示的有機鎝錯合物在核醫學中應用廣泛。其鎝-氧雙鍵垂直於環平面。這個氧原子也可以被氮原子替換。[54]
存象和生產
[編輯]
地殼中僅含有極微量天然鎝,是鈾礦自發分裂的產物。據估計,一公斤鈾礦含有一納克鎝。[19][55][56]某些S型、M型和N型紅巨星的吸收光譜中有鎝的特徵吸收。[28][57]這種紅巨星被戲稱為「鎝星」(technetium stars)。[58]
分裂核廢料
[編輯]每年大量的鎝被人類從用過燃料中分離提取出來。反應爐中1克鈾-235分裂可以產生27毫克鎝-99,產額為6.1%。[35]如果以鈾-233為燃料,鎝-99產額為4.9%;如果以鈽-239為燃料,鎝-99產額為6.21%。[59]據估計,從1983年到1994年,人類反應爐中一共產生了78噸鎝,是地球上鎝最主要的來源。[60][61]其中只有一小部分用於商業用途。[c]
鈾-235和鈽-239的分裂都可以產生鎝-99。因此,鎝-99不但存在於核廢料中,也存在於分裂核武器爆炸後產生的放射性落下灰中。在用過燃料貯存過程中,鎝-99的放射性在104到106年之間將居主導地位。[60]據估算,1945年到1994年間大氣層核試驗一共向環境釋放了250公斤鎝。[60][63]截至1986年,人類核子反應爐一共排放了1600公斤鎝,主要是在用過燃料再處理過程中排放的;大部分進入海洋。隨著再處理技術的發展,反應爐鎝的排放逐漸減少。到2005年,最主要的排放源是英國謝拉斐爾德再處理厰(Sellafield Ltd)。據估計,1995年到1999年,該廠一共向愛爾蘭海排放了900公斤鎝。[61]2000年後,法律規定該廠每年只能排放140公斤鎝。[64]該廠的排放導致某些海產品含有微量的鎝。比如,英國坎布里亞郡西部捕獲的歐洲龍蝦和魚含有1 Bq/公斤的鎝。[65][66][d]
鎝的商業用途
[編輯]以鈾或鈽為燃料的核子反應爐一直不停地產生介穩態核種鎝-99m。但用過燃料都要經過數年冷卻,到再處理的時候鉬-99和鎝-99m已經完全衰變了。經過鈽鈾提取(PUREX)之後的液料含有高濃度的鎝(以TcO−
4形式存在),基本上全部是鎝-99,鎝-99m已經消失殆盡。[68]
絕大部分醫用鎝-99m是在反應爐裏輻照高濃縮鈾(鈾-235含量超過20%)靶子,然後在再處理厰分離出鉬-99,[69]最後在醫院提取由鉬-99衰變而生成的鎝-99m。[70][71]在鎝-99m製備機中,含有鉬-99的鉬酸(MoO2−
4)被吸附在酸性氧化鋁上,裝載到一個帶有放射線防護屏的色譜柱中。這種機器又被稱為「鎝奶牛」,有時也叫做「鉬奶牛」。鉬-99半衰期為66小時,比較便於運輸。用鹽水(氯化鈉水溶液)做淋洗劑,便可將含有鎝-99m的過鎝酸鹽淋洗下來。
和從分裂產物中提取鉬-99相比,通過輻照高濃縮鈾的方法大大減化了化學分離的步驟。此法的缺點是需要高濃縮鈾-235,會引起諸多的安全問題,比如核材料走私、核擴散等。[72][73]
世界上近三分之二的鎝由兩座反應爐提供:加拿大曹爾克河實驗室的國家研究通用反應爐和荷蘭核研究和咨詢集團的帕滕反應爐。這兩座反應爐建於1960年代,都已經接近退役期限。加拿大擬建的兩座「多功能應用物理晶格實驗」反應爐本來計劃生產超過全世界總需求一倍的鎝,但在2008年在試車成功後被封堆,整個計劃取消。這給鎝將來的供應前景帶來了巨大的不確定性。[74]
2009年8月,曹爾克河實驗室反應爐開始封堆維修,計劃於2010年4月再次運行。2010年2月19日,帕滕反應爐開始了為期六個月的封堆維修。每年千百萬人需要鎝-99m,供應缺口迫使一些醫生重新啓用20年前的老技術。[75]令人稍感寬慰的是,波蘭瑪利亞研究反應爐宣佈開發了一種製備鎝-99m的新技術。[76]曹爾克河實驗室反應爐於2010年8月重新啓動.一個月後帕滕反應爐也再次運轉。[77]鎝-99m的供應危機暫時得以緩解。
廢物處理
[編輯]鎝-99的半衰期長,容易形成易溶於水的過鎝酸鹽(TcO−
4)。這些對於核廢料的長期儲存和處理以及減少排放不利。在再處理工廠中,許多提取和分離分裂產物的過程和工藝主要針對陽離子,比如銫-137和鍶-90,類似過鎝酸鹽的放射性陰離子則暢通無阻。在現有的陸地埋藏方案中,最大的問題是水污染。過鎝酸鹽和碘離子(I−
)溶解性好,不易被土壤、岩石和礦物吸附,很有可能隨水遷移。比較而言,鈽、鈾和銫更容易被土壤吸附。通過某些微生物活動,鎝可以在一些環境富集,比如在湖底沉積物中。[78]因此,鎝的環境化學是相當活躍的研究領域。[79]
還有一種處理方式是核嬗變。歐洲核子研究組織(CERN)已經證明鎝-99的嬗變可行。用中子流轟擊金屬鎝-99生成短壽命產物鎝-100(半衰期為16秒),後者經過β衰變變成釕-100(穩定同位素)。這個方法對鎝-99靶的純度要求很高。如果靶中有微量錒系元素,比如鋂或者鋦,它們會在中子的轟擊下分裂,生成具有高放射性的分裂產物。該方法還可能生成釕-106(半衰期為374天)。它的存在會延長分離釕-100之前所需要的冷卻時間。[80]
從用過燃料中分離鎝-99是個漫長過程。在再處理工藝中,它出現在鈾和鈽回收後的高放射性廢液中。經過幾年的冷卻後,該廢液的放射性下降到一定程度之後,鎝-99可以用幾種化學萃取方法回收,產生高純度的金屬鎝。[81]
中子活化
[編輯]鉬-98經中子活化後可生成鉬-99,然後衰變成鎝-99m。[82]其它鎝同位素在分裂中產額較低,一般通過中子輻照前體同位素製備。比如,鎝-97是用中子轟擊釕-96生產。[83]
粒子加速器
[編輯]1971年,有人在醫用回旋加速器用22兆電子伏特質子轟擊鉬-100(純度>99.5%)靶子,通過反應100Mo(p,2n)99mTc製備鎝-99m。[84]2010年代鎝的短缺讓人們重新審視此法。[75]使用加速器,還可以通過(n,2n)或(γ,n)反應從鉬-100製備鉬-99,進而得到鎝-99m。[85][86][87]
應用
[編輯]核醫學和生物學
[編輯]
鎝-99m半衰期較短(6.01小時),並釋放出容易檢測的軟γ射線(140千電子伏特),因此在核醫學上用於人體示蹤劑。[19][35]截止2000年,含有鎝-99m的常見放射性藥物有31種,用於大腦、心肌、甲狀腺、肺、肝、膽囊、腎、骨骼、血液等器官和腫瘤的造影和功能性研究。[88]
鎝-95m半衰期稍長,為61天。它也可以用做植物和牲畜等的示蹤劑,以及研究鎝在環境中的遷移。[89]
工業及化學應用
[編輯]鎝-99是一種純β放射線源,釋放出低能量β粒子。它的半衰期很長,所以放射線變化很緩慢。從放射性廢物中提取的鎝可以達到很高的化學純度和同位素純度。因此,鎝-99是美國國家標準技術研究所(NIST)認證的標準β放射線源,用於儀器校準。[90]有人提議將鎝-99用於光電器件和納米級的核電池。[91]
同錸和鈀類似,鎝也可以作為催化劑。對某些反應,比如異丙醇脫氫反應,鎝的催化活性比錸和鈀高得多。但是,其放射性限制了它在催化上的應用。[92]
過鎝酸鉀在很低的濃度(55 ppm)就可以防止鋼鐵的銹蝕,甚至在250 °C仍有抗銹的能力。[93]因此,過鎝酸鹽可能可以用作鋼鐵的防銹劑。但是鎝的放射性決定了鎝防銹劑只能用於封閉體系。[94]鉻酸鹽CrO2−
4也能防銹,但其有效濃度是過鎝酸鉀的10倍。在一個實驗中,一塊碳鋼被浸泡在過鎝酸鹽水溶液中20年仍沒有銹蝕。[93]過鎝酸鹽防銹的機理尚不明確,但似乎是在鋼鐵表面形成了一層保護層。一種理論認為,過鎝酸鹽和鋼鐵的表面發生反應,生成了一薄層緻密的二氧化鎝,保護鋼鐵不受氧化。這個理論可以解釋為什麽鐵粉能從水中吸附過鎝酸離子。但當過鎝酸離子濃度下降到某一最小濃度時,鐵粉對該離子的吸附停止。高濃度干擾離子的存在也會抑制鐵粉對過鎝酸離子的吸附。[95]
如上所述,鎝的放射性限制了它作為防銹劑的實際應用。有人提議把過鎝酸鹽用於沸水堆鋼鐵構件的腐蝕防護,但是此建議未獲採用。[95]
鎝的安全使用
[編輯]在生物體內鎝沒有任何已知的功能。[28]鎝的化學毒性似乎比較小。連續幾個星期給小白鼠餵飼含有15微克/克鎝的食物,其血液、體重、器官重量和進食量未觀察到顯著的變化。[96]鎝的放射毒性取決於鎝化合物組成、放射線類型和鎝同位素的半衰期。[97]
使用所有鎝同位素都必須謹慎。最大的健康風險是吸入帶有鎝同位素的灰塵,可以致肺癌。最常見的同位素鎝-99釋放出低能量β粒子,甚至無法貫穿實驗室的玻璃器皿。因此和鎝化合物接觸時,手套箱基本沒有必要,通風櫥便可以很好的消除其危害。[98]
註釋
[編輯]參考資料
[編輯]- ^ 1.0 1.1 1.2 Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S.; Audi, G. The NUBASE2020 evaluation of nuclear properties (PDF). Chinese Physics C. 2021, 45 (3): 030001. doi:10.1088/1674-1137/abddae.
- ^ Arblaster, John W. Selected Values of the Crystallographic Properties of Elements. Materials Park, Ohio: ASM International. 2018. ISBN 978-1-62708-155-9.
- ^ John E. Ellis. Metal Carbonyl Anions: from [Fe(CO)4]2- to [Hf(CO)6]2- and Beyond†. Organometallics. 2003, 22 (17): 3322–3338. doi:10.1021/om030105l (英語).
- ^ Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4.
- ^ HTc(CO)5中含有Tc(–1),見此[3]。此來源[4]錯誤報告了Tc(–3)的存在。
- ^ Kobell, V. Ueber eine eigenthümliche Säure, Diansäure, in der Gruppe der Tantal- und Niob- verbindungen. Journal für Praktische Chemie. 1860, 79 (1): 291–303. doi:10.1002/prac.18600790145.
- ^ 7.0 7.1 Holden, N. E. History of the Origin of the Chemical Elements and Their Discoverers. Brookhaven National Laboratory. [2009-05-05]. (原始內容存檔於2011-07-21).
- ^ Jonge, F. A. A.; Pauwels, EK. Technetium, the missing element. European Journal of Nuclear Medicine. 1996, 23 (3): 336–44. PMID 8599967. doi:10.1007/BF00837634.
- ^ Yoshihara, H. K. Discovery of a new element 'nipponium': re-evaluation of pioneering works of Masataka Ogawa and his son Eijiro Ogawa. Atomic spectroscopy (Spectrochim. Acta, Part B). 2004, 59 (8): 1305–1310. Bibcode:2004AcSpe..59.1305Y. doi:10.1016/j.sab.2003.12.027.
- ^ 10.0 10.1 van der Krogt, P. Elentymolgy and Elements Multidict, "Technetium". [2009-05-05]. (原始內容存檔於2010-01-23).
- ^ Emsley 2001,第423頁
- ^ Armstrong, J. T. Technetium. Chemical & Engineering News. 2003 [2009-11-11]. doi:10.1021/cen-v081n036.p110. (原始內容存檔於2008-10-06).
- ^ Nies, K. A. Ida Tacke and the warfare behind the discovery of fission. 2001 [2009-05-05]. (原始內容存檔於2009-08-09).
- ^ Weeks, M. E. The discovery of the elements. XX. Recently discovered elements. Journal of Chemical Education. 1933: 161–170.
- ^ 15.0 15.1 Armstrong, J. T. Technetium. Chemical & Engineering News. 2003 [2013-03-21]. doi:10.1021/cen-v081n036.p110. (原始內容存檔於2008-10-06).
- ^ Zingales, R. From Masurium to Trinacrium: The Troubled Story of Element 43. Journal of Chemical Education. 2005, 82 (2): 221–227 [2013-03-21]. Bibcode:2005JChEd..82..221Z. doi:10.1021/ed082p221. (原始內容存檔於2006-09-13).
- ^ Heiserman 1992,第164頁
- ^ 18.0 18.1 Perrier, C.; Segrè, E. Technetium: The Element of Atomic Number 43. Nature. 1947, 159 (4027): 24. Bibcode:1947Natur.159...24P. PMID 20279068. doi:10.1038/159024a0.
- ^ 19.0 19.1 19.2 19.3 Emsley, J. Nature's Building Blocks: An A-Z Guide to the Elements. New York: Oxford University Press. 2001: 422–425. ISBN 0-19-850340-7.
- ^ Chapter 1.2: Early Days at the Berkeley Radiation Laboratory. The transuranium people: The inside story. University of California, Berkeley & Lawrence Berkeley National Laboratory. 2000: 15 [2013-03-21]. ISBN 1-86094-087-0. (原始內容存檔於2007-01-24).
- ^ Merrill, P. W. Technetium in the stars. Science. 1952, 115 (2992): 479–89 [484]. Bibcode:1952Sci...115..479.. doi:10.1126/science.115.2992.479.
- ^ 22.0 22.1 22.2 Schwochau 2000,第7–9頁
- ^ Lide, David R. Line Spectra of the Elements. The CRC Handbook. CRC press. 2004–2005: 10–70 (1672). ISBN 978-0-8493-0595-5.
- ^ Schwochau 2000,第96頁
- ^ Autler, S. H. Technetium as a Material for AC Superconductivity Applications (PDF). Proceedings of the 1968 Summer Study on Superconducting Devices and Accelerators. [2009-05-05]. (原始內容 (PDF)存檔於2011-05-14).
- ^ Greenwood 1997,第1044頁
- ^ 27.0 27.1 27.2 27.3 Husted, R. Technetium. Periodic Table of the Elements. Los Alamos National Laboratory. 2003-12-15 [2009-10-11]. (原始內容存檔於2021-05-05).
- ^ 28.0 28.1 28.2 Hammond, C. R. The Elements. Handbook of Chemistry and Physics 81st. CRC press. 2004. ISBN 0-8493-0485-7.
- ^ Thyssen, Pieter; Binnemans, Koen; Shinohara, Hisanori; Saito, Yahachi; Gulay, Lubomir D.; Daszkiewicz, Marek; Yan, Chun-Hua; Yan, Zheng-Guan; Du, Ya-Ping. Gschneider, Karl A., Jr.; Bünzli, Jean-Claude; Pecharsky, Vitalij K. , 編. Handbook on the Physics and Chemistry of Rare Earths. Amsterdam, The Netherlands: Elsevier. 2011: 66 [January 14, 2012]. ISBN 978-0-444-53590-0. (原始內容存檔於2022-07-15).
- ^ Holleman, Arnold Frederik; Wiberg, Egon, Wiberg, Nils , 編, Inorganic Chemistry, 由Eagleson, Mary; Brewer, William翻譯, San Diego/Berlin: Academic Press/De Gruyter: 84, 2001, ISBN 0-12-352651-5
- ^ Clayton, D. D. Principles of stellar evolution and nucleosynthesis: with a new preface. University of Chicago Press. 1983: 547. ISBN 0-226-10953-4.
- ^ 32.0 32.1 32.2 Holden, N. E. Lide. D. R. , 編. Handbook of Chemistry and Physics 87th. Boca Raton, Florida: CRC Press, Taylor & Francis Group. 2006: 11–88–11–89. ISBN 0-8493-0487-3.
- ^ 33.0 33.1 NNDC contributors. Sonzogni, A. A. , 編. Chart of Nuclides. New York: National Nuclear Data Center, Brookhaven National Laboratory. 2008 [2009-11-11]. (原始內容存檔於2008-05-22).
- ^ Lide, David R. (編). Table of the isotopes. The CRC Handbook of Chemistry and Physics. CRC press. 2004–2005.
- ^ 35.0 35.1 35.2 35.3 Rimshaw, S. J. Hampel, C. A. , 編. The Encyclopedia of the Chemical Elements. New York: Reinhold Book Corporation. 1968: 689–693.
- ^ Schwochau 2000,第146頁
- ^ Krebs, B. Technetium(VII)-oxid: Ein Übergangsmetalloxid mit Molekülstruktur im festen Zustand. Angewandte Chemie. 1969, 81 (9): 328–329. doi:10.1002/ange.19690810905.
- ^ Herrell, A. Y.; Busey, R. H.; Gayer, K. H. Technetium(VII) Oxide, in Inorganic Syntheses XVII. 1977: 155–158. ISBN 0-07-044327-0.
- ^ Schwochau 2000,第108頁
- ^ Schwochau 2000,第127–136頁
- ^ Poineau, Frederic; et al. Speciation of heptavalent technetium in sulfuric acid: structural and spectroscopic studies (PDF). Dalton Transactions. 2010, 39 (37): 8616–8619 [2013-03-21]. PMID 20730190. doi:10.1039/C0DT00695E. (原始內容 (PDF)存檔於2017-03-05).
- ^ Lukens, W. W.; et al. Evolution of Technetium Speciation in Reducing Grout Waste Forms (PDF). Environmental Science & Technology. 2005, 39 (20): 8064–8070 [2013-03-21]. PMID 16295876. doi:10.1021/es050155c. (原始內容 (PDF)存檔於2012-04-24).
- ^ Schwochau 2000,第112–113頁
- ^ Poineau, Frederic; Johnstone, Erik V.; Czerwinski, Kenneth R.; Sattelberger, Alfred P. Recent Advances in Technetium Halide Chemistry. Accounts of Chemical Research (American Chemical Society (ACS)). 2014-01-07, 47 (2): 624–632. ISSN 0001-4842. doi:10.1021/ar400225b.
- ^ German, K. E.; et al. Tc Carbide and New Orthorhombic Tc Metal Phase (PDF). Journal of Nuclear and Radiochemical Sciences. 2005, 39 (20): 211–214.[永久失效連結]
- ^ Cotton 1999,第985頁
- ^ Löwdin, P.-O.; Brändas, E.; Kryachko, E. S. Fundamental world of quantum chemistry: a tribute to the memory of Per-Olov Löwdin 2. Springer. 2003: 479. ISBN 1-4020-1286-1.
- ^ German, K. E.; Kryutchkov, S. V. Polynuclear Technetium Halide Clusters. Russian Journal of Inorganic Chemistry. 2002, 47 (4): 578–583.
- ^ 3,3,9,9-Tetramethyl-4,8-diazaundecane-2,10-dione dioximato-oxotechnetium(V) [TcO(pnao)]; Schwochau 2000,第176頁
- ^ Hileman, J. C.; Huggins, D. K.; Kaesz, H. D. Technetium carbonyl. Journal of the American Chemical Society. 1961, 83 (13): 2953–2954. doi:10.1021/ja01474a038.
- ^ Bailey, M. F.; Dahl, Lawrence F. The Crystal Structure of Ditechnetium Decacarbonyl. Inorganic Chemistry. 1965, 4 (8): 1140–1145. doi:10.1021/ic50030a011.
- ^ Wallach, D. Unit cell and space group of technetium carbonyl, Tc2(CO)10. Acta Crystallographica. 1962, 15 (10): 1058. doi:10.1107/S0365110X62002789.
- ^ Schwochau 2000,第286, 328頁
- ^ Jurisson, S.; Schlemper, E. O.; Troutner, D. E.; Canning, L. R.; Nowotnik, D. P.; Neirinckx, R. D. Synthesis, characterization, and x-ray structural determinations of technetium(V)-oxo-tetradentate amine oxime complexes. Inorganic Chemistry. 1986, 25 (4): 543–549. doi:10.1021/ic00224a031.
- ^ Dixon, P.; Curtis, David B.; Musgrave, John; Roensch, Fred; Roach, Jeff; Rokop, Don. Analysis of Naturally Produced Technetium and Plutonium in Geologic Materials. Analytical Chemistry. 1997, 69 (9): 1692–9. PMID 21639292. doi:10.1021/ac961159q.
- ^ Curtis, D.; Fabryka-Martin, June; Dixon, Paul; Cramer, Jan. Nature's uncommon elements: plutonium and technetium. Geochimica et Cosmochimica Acta. 1999, 63 (2): 275. Bibcode:1999GeCoA..63..275C. doi:10.1016/S0016-7037(98)00282-8.
- ^ Moore, C.E. Technetium in the Sun. Science (New York, N.Y.). 1951, 114 (2951): 59–61. Bibcode:1951Sci...114...59M. PMID 17782983. doi:10.1126/science.114.2951.59.
- ^ Branch, David; Peery, Benjamin F. A search for ²⁶A1 in the spectra of technetium stars. Publications of The Astronomical Society of The Pacific. 1970, 82 (489): 1060–1064.
- ^ Schwochau 2000,第374–404頁
- ^ 60.0 60.1 60.2 Yoshihara, K. Technetium in the Environment. K. Yoshihara and T. Omori (編). Topics in Current Chemistry: Technetium and Rhenium 176. Berlin Heidelberg: Springer-Verlag. 1996: 17–35. ISBN 978-3-540-59469-7. doi:10.1007/3-540-59469-8_2.
- ^ 61.0 61.1 Garcia-Leon, M. 99Tc in the Environment: Sources, Distribution and Methods (PDF). Journal of Nuclear and Radiochemical Sciences. 2005, 6 (3): 253–259 [2013-03-21]. (原始內容 (PDF)存檔於2012-03-05).
- ^ Hammond, C. R. The Elements. Handbook of Chemistry and Physics 81st. CRC press. 2004. ISBN 0-8493-0485-7.
- ^ Desmet, G.; Myttenaere, C. Technetium in the environment. Springer. 1986: 69. ISBN 0-85334-421-3.
- ^ Tagami, K. Technetium-99 Behaviour in the Terrestrial Environment — Field Observations and Radiotracer Experiments (PDF). Journal of Nuclear and Radiochemical Sciences. 2003, 4: A1–A8. (原始內容 (PDF)存檔於2012-03-13).
- ^ Szefer, P.; Nriagu, J. O. Mineral components in foods. CRC Press. 2006: 403. ISBN 0-8493-2234-0.
- ^ Harrison, J. D.; Phipps, A. Gut transfer and doses from environmental technetium. J. Radiol. Prot. 2001, 21 (1): 9–11. Bibcode:2001JRP....21....9H. PMID 11281541. doi:10.1088/0952-4746/21/1/004.
- ^ Francis, A. J.; Dodge, C. J.; Meinken, G. E. Biotransformation of pertechnetate by Clostridia. Radiochimica Acta. 2002, 90 (9–11_2002): 791–797 [2022-11-13]. doi:10.1524/ract.2002.90.9-11_2002.791. (原始內容存檔於2022-11-13).
- ^ Schwochau 2000,第39頁
- ^ Moore, P.W. Technetium-99 in generator systems. (PDF). Journal of nuclear medicine : official publication, Society of Nuclear Medicine. April 1984, 25 (4): 499–502 [2012-05-11]. PMID 6100549. (原始內容 (PDF)存檔於2020-11-04).
- ^ US 3799883,Hirofumi Arino,「Silver coated charcoal step」,發行於March 26, 1974,指定於Union Carbide Corporation
- ^ Committee on Medical Isotope Production Without Highly Enriched Uranium. Medical Isotope Production Without Highly Enriched Uranium. National Academies Press. 2009: vii [2009-08-27]. ISBN 0-309-13040-9. (原始內容存檔於2019-07-10).
- ^ Lützenkirchen, K.-R. Nuclear forensics sleuths trace the origin of trafficked material. Los Alamos National Laboratory. [2009-11-11]. (原始內容存檔於2013-02-16).
- ^ Snelgrove, J. L.; et al. Development and Processing of LEU Targets for Mo-99 Production (PDF). 1995 [2009-05-05]. (原始內容 (PDF)存檔於2021-04-28).
- ^ Thomas, Gregory S.; Maddahi, Jamshid. The technetium shortage. Journal of Nuclear Cardiology. 2010, 17 (6): 993–8. PMID 20717761. doi:10.1007/s12350-010-9281-8.
- ^ 75.0 75.1 Guérin, B.; Tremblay, S.; Rodrigue, S.; Rousseau, J.A.; Dumulon-Perreault, V.; Lecomte, R.; van Lier, J.E.; Zyuzin, A.; van Lier, E.J. Cyclotron production of 99mTc: an approach to the medical isotope crisis. (PDF). Journal of nuclear medicine : official publication, Society of Nuclear Medicine. April 2010, 51 (4): 13N–6N [2012-05-11]. PMID 20351346. (原始內容 (PDF)存檔於2020-10-28).
- ^ Wals, M. L. New Source Of an Isotope In Medicine Is Found. New York Times. 2010-02-16 [2013-03-21]. (原始內容存檔於2020-11-09).
- ^ Shaw, Gina. Medical Isotope Shortage Nearing End—For Now. Clinical Oncology News. October 2010 [2010-11-02]. (原始內容存檔於2020-09-18).
- ^ German, Konstantin E.; Firsova, E.V. Bioaccumulation of Tc, Pu, and Np on Bottom Sediments in Two Types of Freshwater Lakes of the Moscow Oblast. Russ. Radiochemistry. 2003, 45 (6): 250–6 [2013-03-21]. doi:10.1023/A:1026008108860. (原始內容存檔於2019-07-10).
- ^ Shaw, G. Radioactivity in the terrestrial environment. Elsevier. 2007: 147. ISBN 0-08-043872-5.
- ^ Altomare, P; et al. Alternative disposal concepts for high-level and transuranic radioactive waste disposal. US Environmental Protection Agency. 1979 [2013-03-21]. (原始內容存檔於2013-06-01).
- ^ Schwochau 2000,第87–96頁
- ^ Manual for reactor produced radioisotopes (PDF). IAEA. [2009-08-27]. (原始內容 (PDF)存檔於2011-05-21).
- ^ Kelly, J. J. Effluent and environmental radiation surveillance: a symposium. ASTM International. 1980: 91.
- ^ Beaver, J.E.; Hupf, H.B. Production of 99mTc on a Medical Cyclotron: a Feasibility Study (PDF). Journal of Nuclear Medicine. November 1971, 12 (11): 739–41 [2013-03-21]. PMID 5113635. (原始內容 (PDF)存檔於2020-10-28).
- ^ Scholten, Bernhard; Lambrecht, Richard M.; Cogneau, Michel; Vera Ruiz,, Hernan; Qaim,, Syed M. Excitation functions for the cyclotron production of 99mTc and 99Mo. Applied Radiation and Isotopes. 1999-05-25, 51 (1): 69–80. doi:10.1016/S0969-8043(98)00153-5.
- ^ Takács, S.; Szűcs, Z.; Tárkányi, F.; Hermanne, A.; Sonck, M. Evaluation of proton induced reactions on 100Mo: New cross sections for production of 99mTc and 99Mo. Journal of Radioanalytical and Nuclear Chemistry. 2003-01-01, 257 (1): 195–201. doi:10.1023/A:1024790520036.
- ^ Celler, A.; Hou, X.; Bénard, F.; Ruth, T. Theoretical modeling of yields for proton-induced reactions on natural and enriched molybdenum targets. Physics in Medicine and Biology. 2011-09-07, 56 (17): 5469–5484. Bibcode:2011PMB....56.5469C. PMID 21813960. doi:10.1088/0031-9155/56/17/002.
- ^ Schwochau 2000,第414頁
- ^ Schwochau 2000,第12–27頁
- ^ Schwochau 2000,第87頁
- ^ University Research Program in Robotics REPORT (PDF). University of Florida. 2006-11-30 [2007-10-12]. (原始內容存檔 (PDF)於2019-07-10).
- ^ Schwochau 2000,第87–90頁
- ^ 93.0 93.1 Emsley 2001,第425頁
- ^ EPA: 402-b-04-001b-14-final (PDF). US Environmental Protection Agency. July 2004 [2008-08-04]. (原始內容存檔 (PDF)於2014-03-08).
- ^ 95.0 95.1 Schwochau 2000,第91頁
- ^ Desmet, G.; Myttenaere, C.; Commission of the European Communities. Radiation Protection Programme, France. Service d'études et de recherches sur l'environnement, United States. Dept. of Energy. Office of Health and Environmental Research. Technetium in the environment. Springer, 1986. 1986-05-31: 392–395. ISBN 0-85334-421-3.
- ^ Schwochau 2000,第371–381頁
- ^ Schwochau 2000,第40頁
引用書目
[編輯]- Cotton, F. A.; Wilkinson, G.; Murillo, C. A.; Bochmann, M. Advanced Inorganic Chemistry 6th. New York: John Wiley & Sons, Inc. 1999. ISBN 0-471-19957-5.
- Emsley, J. Nature's Building Blocks: An A-Z Guide to the Elements. Oxford, England, UK: Oxford University Press. 2001. ISBN 0-19-850340-7.
- Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Oxford: Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4.
- Heiserman, D. L. Element 43: Technetium. Exploring Chemical Elements and their Compounds. New York: TAB Books. 1992. ISBN 0-8306-3018-X.
- Schwochau, K. Technetium: chemistry and radiopharmaceutical applications. Wiley-VCH. 2000. ISBN 3-527-29496-1.
參考書目
[編輯]- B.J. Wilson (編). The radiochemical Manual 2nd. 1966. ISBN 0-7058-1768-7.(英文)
- Scerri, E.R. The Periodic Table, Its Story and Its Significance. Oxford University Press,. 2007 [2013-03-21]. ISBN 0-19-530573-6. (原始內容存檔於2013-04-08).(英文)
- Choppin, G.; Liljenzin, J-O; Rydberg, J. Nuclear Mass and Stability. Radiochemistry and nuclear chemistry 3rd. Butterworth-Heinemann. 2002: 41–57. ISBN 978-0-7506-7463-8.(英文)
外部連結
[編輯]- 元素鎝在洛斯阿拉莫斯國家實驗室的介紹(英文)
- EnvironmentalChemistry.com —— 鎝(英文)
- 元素鎝在The Periodic Table of Videos(諾丁漢大學)的介紹(英文)
- 元素鎝在Peter van der Krogt elements site的介紹(英文)
- WebElements.com – 鎝(英文)
- WebElements.com – Technetium (頁面存檔備份,存於網際網路檔案館), and EnvironmentalChemistry.com – Technetium(英文)
- Nudat 2 (頁面存檔備份,存於網際網路檔案館) 美國布魯克黑文國家實驗室國家核數據中心的核種圖表(英文)
- Nuclides and Isotopes (頁面存檔備份,存於網際網路檔案館) Fourteenth Edition: Chart of the Nuclides, General Electric Company, 1989(英文)
- Chemistry in its element podcast(MP3)取自皇家化學學會的《化學世界》雜誌(Chemistry World): Technetium(英文)



