弥漫性毒性甲状腺肿
此條目需要补充更多来源。 (2020年5月18日) |
| 弥漫性毒性甲状腺肿 | |
|---|---|
| 又称 | Flajani–Basedow–Graves disease |
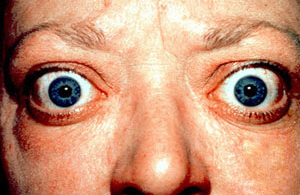 | |
| 患者出現典型的眼球凸出症狀 | |
| 类型 | 甲状腺功能亢进症、疾病 |
| 分类和外部资源 | |
| 醫學專科 | 內分泌學 |
| ICD-9-CM | 242.00 |
| OMIM | 275000 |
| MedlinePlus | 000358 |
| eMedicine | 120619、920283 |
弥漫性毒性甲状腺肿(英語:Toxic diffuse goiter),又稱格里夫氏症(英語:Graves' disease),為一種主要侵犯甲狀腺的自體免疫性疾病[1]。此病為導致甲状腺功能亢进症最常見的原因[2],且會導致甲状腺肿。症狀及徵象可能包含急躁易怒、肌肉無力、睡眠障礙、心跳过速、怕熱、腹瀉,以及體重減輕。其他症狀可能包含脛前皮膚增厚,以及葛瑞夫茲氏眼病變造成的眼球凸出。約25%至80%的患者有眼睛相關的症狀[1][3]。
目前造成此病的機制仍未明朗,可能與遺傳或環境因素有關[4]。家族中有罹患該病者的罹病機率較大[1]。若雙胞胎其中一人罹病,另一人罹病機率可能高達30%[5]。該疾病的發作原因可能包含壓力、感染,或是分娩[3]。患有其他自體免疫疾病者如1型糖尿病或類風濕性關節炎罹患此病的機率也較高。抽菸會增加罹病機率,且可能使眼部疾病惡化。造成弥漫性毒性甲状腺肿的自體抗體稱為甲狀腺刺激免疫球蛋白(thyroid stimulating immunoglobulin,TSI),與促甲状腺激素(TSH)功能相仿。TSI會導致甲狀腺製造過多甲状腺激素。該疾病能透過血液檢測與碘同位素的吸收狀況來檢測[1]。通常血液測試會發現血中T3和T4升高,TSH則下降,碘同位素攝取量及TSI則上升[3]。
治療方法有三種:碘-131、藥物,以及甲狀腺手術。放射治療會讓患者口服碘-131,由於甲狀腺具有濃縮碘的功能,藉此殺死過盛的甲狀腺。摧毀甲狀腺後所造成的甲狀腺機能低下症需藉由額外補充甲状腺激素治療。其他治療藥物包含β受体阻滞剂,以及甲巰咪唑(methimazole)等甲狀腺抑制劑等可以緩解部分症狀,另外也可以選擇手術移除甲狀腺。疾病造成的眼部問題需額外治療[1]。
弥漫性毒性甲状腺肿大約發生於0.5%的男性以及3%的女性[2],女性的發生率為男性的7.5倍[1]。疾病好發於40至60歲,但其實有可能發生於各年齡層[5]。該疾病在美國為甲狀腺機能亢進最主要的原因(約五至八成)[1][3]。該疾病的別名格里夫氏症乃紀念1835年羅伯特·格里夫描述此疾病,但其實更早之前就有相關紀錄[5]。
历史
[编辑]1825年Parry首次报告,1835年和1840年Graves和Basedow先后发表详细报告,因此,本病被称为“Parry病”、“Graves病”或“Basedow病”[6]。
流行病学
[编辑]好发于20~40岁,男女比例1:8。具有家族遗传的倾向,可能与某些人類白細胞抗原表型有关。伴发其它自體免疫性疾病的风险增加。碘摄入量增加(如食用加碘盐,胺碘酮治疗等)亦增加Graves病患病率[7]。
病理学
[编辑]甲状腺
[编辑]
- 大体观:甲状腺弥漫对称增大,表面光滑,质软,包膜完整,切面呈分叶状,颜色灰红。为确保手术安全,术前常常采用碘剂等治疗[8],此时,甲状腺较治疗前体积变小,质地变实。
- 镜下观:滤泡上皮组织肥大呈高柱状,增生活跃,细胞彼此叠呈乳头状,并有小滤泡形成。上皮细胞周边的胶质出现吸收空泡;滤泡腔内胶质变少、变稀薄,严重者胶质可消失。间质内毛细血管扩张、充血,淋巴细胞浸润(以T细胞为主,伴少量B细胞和浆细胞),常伴生發中心形成。对于择期手术切除的标本,受术前抗甲状腺治疗的影响,滤泡上皮细胞变矮,增生减轻;吸收空泡减少,胶质增多、增浓;间质中毛细血管充血减轻,淋巴细胞减少[9][10]。
甲状腺外器官
[编辑]- 眶周出现大量糖胺聚糖沉积,淋巴细胞浸润,纤维化;眼肌水肿,在疾病后期,可出现纤维化。
- 真皮糖胺聚糖沉积,淋巴细胞浸润。
- 全身淋巴系统增生,胸腺、脾脏增大。
- 心脏肥大;可出现缺血性改变,尤其是合并冠心病时。
- 肝细胞变性、坏死,久病者肝组织纤维化,乃至肝硬化。
发病机制
[编辑]患者体内出现针对甲状腺滤泡上皮细胞TSH受体的自身抗体,称为“TSH受体抗体”(TSH receptor antibodies,TRAb)。根据TRAb与TSH受体结合后的效应,可以细分为:
- TSH受体刺激性抗体(TSH receptor stimulation antibody,TSAb):与TSH受体结合后,模拟TSH的效应,导致滤泡上皮细胞增生、功能亢进,是Graves病的致病抗体。
- TSH受体刺激阻断性抗体(TSH receptor stimulation-blocking antibody,TSBAb):与TSH受体结合,自身没有使TSH受体激动的能力,反而阻断TSH或TSAb与受体的结合,因此,最后的结果是甲状腺萎缩,功能降低。
此外,机体还存在针对甲状腺的其他自身抗体。
Graves病出现突眼的原因可能有:
- 单纯性突眼:甲状腺毒症导致交感神经兴奋性增高。
- Graves眶病(旧名:Graves眼病):针对滤泡上皮细胞的T细胞可能与眼球球后组织有交叉反应性,在T细胞分泌的细胞因子作用下成纤维细胞分泌过多黏多糖,并导致纤维化。
临床表现
[编辑]典型表现
[编辑]- 弥漫性甲状腺肿:大部分患者有程度不等的弥漫性、对称性甲状腺肿,质地不等,无压痛。甲状腺上下极可触及震颤,闻及血管杂音,反映血流量增加。少数病例甲状腺不肿大,或呈不对称性肿大。
- 甲状腺毒症:神经系统、循环系统、消化系统功能亢进,高代谢综合征等。
- 眼征(Graves眶病):
- 单纯性突眼:包括轻度突眼(突眼度在 19 ~ 20 毫米),上睑挛缩,Stellwag征,von Graefe征,Joffroy征,Mobius征。
- 浸润性眼征:显著突眼,眼球活动受限甚至固定,眼睑水肿、闭合不全,结膜充血、水肿,角膜溃疡,全眼炎甚至失明。
- 皮肤损害:白人多见,多发生于胫骨前下1/3处(故又名“胫前黏液性水肿”),也可见于足背、踝关节、肩部、手背或手术疤痕处,偶见于面部,多为对称分布。早期皮肤增厚、变粗,广泛出现大小不得、边界清楚的棕红色、红褐色或暗紫色斑块或结节,表面及周围皮肤可有毛发增生、增粗、毛囊角化,伴感觉减退或过敏。后期皮损常融合,覆盖灰色疣状物,似象腿。
- 其它:
- 造血系统:淋巴细胞、单核细胞可增多。血小板生存时间降低,甚至可出现血小板减少。缺铁性贫血。
- 骨骼肌:除甲状腺毒症本身造成的甲状腺毒性周期性瘫痪、甲亢性肌病外,还可能伴发同属自體免疫性疾病范畴的重症肌无力。
- 肾上腺皮质激素:机体对皮质激素需求增强,在疾病早期肾上腺皮质功能活跃;在重症患者(尤其是甲状腺风暴)时,常有肾上腺皮质功能相对或绝对不全。
- 指端粗厚(acropachy):指甲邻近游离边缘部分与甲床分离,指端软组织肿胀,呈杵状,掌指骨骨膜下新骨形成,多见于吸烟者。这一体征本身不会给病人带来明显影响,然而,指端粗厚反映强烈的自體免疫(如TRAb滴度高),预示着皮肤损害和眶病反复的风险很高[7]。
特殊情况
[编辑]亚临床甲亢
[编辑]仅TSH水平下降而甲状腺激素水平正常,对健康的影响有:
- 部分患者发展为临床甲亢。
- 心血管系统处于高动力状态。
- 骨质疏松。
需在2~4个月内复查,以确定TSH降低是一过性还是持续性。
甲状腺风暴
[编辑]多种原因导致的甲状腺毒症的急性加重。原有症状加重,并出现与疾病程度不相称的高热。可以危及生命,需要紧急处置。
妊娠期甲亢
[编辑]妊娠与甲亢的相互作用包括:
- 妊娠头3个月,人绒毛膜促性腺激素水平达到高峰,其与TSH有一定的交叉反应,可以激动TSH受体,形成妊娠一过性甲状腺毒症(gestational transient thyrotoxicosis,GTT)。
- 生理性免疫抑制作用随妊娠时间延长而逐渐增强,Graves病可出现自发好转。相反,产后随着生理性免疫抑制的解除,Graves病易于发生。
- 妊娠期间甲状腺素结合球蛋白水平增高,可引起总T4、总T3增高,此时诊断甲状腺毒症,依赖于游离T4、游离T3和TSH。
- 妊娠期间,母体的基础代谢率存在生理性增高,心血管负担加重,此时若合并甲亢,则有叠加作用。
- 甲亢可引起流产、早产、死产、妊娠高血压综合征等。
- 母体的TSAb可透过胎盘,引起胎儿或新生儿甲亢。
甲状腺毒症性心脏病
[编辑]- 心律不整:以房性异位心律多见,如房性期前收缩、心房颤动,可为阵发性,亦可为持续性,发生率大约是8%,男性更多见。由于甲状腺激素具有正性传导作用,因此,心房颤动时心室率较难控制[7]。某些抗心律失常药(如胺碘酮),可影响甲状腺功能[11]。
- 心脏扩大:病程长而病情重者可有心脏结构改变。如果没有合并其它心脏疾病,在甲亢控制后多数可以恢复正常。
- 心脏衰竭:
- 年轻、无心脏基础疾病的患者,主要是心功能无法满足高动力的需要,并非泵衰竭,称为“高排出量型心力衰竭”,随着甲亢控制,心力衰竭可以恢复。
- 老年,合并心脏基础疾病者,常常是泵衰竭。而且,心脏症状常常掩盖甲状腺毒症表现,因此,顽固性心力衰竭患者应常规行甲状腺功能检查。
辅助检查
[编辑]- 自身抗体:TRAb阳性,并以TSAb活性为主。经治疗后,如果患者的抗体滴度明显下降乃至正常,此时停药复发的可能性较小。此外,还可以出现低滴度的其它抗甲状腺自身抗体,如抗甲狀腺自體抗體(TPOAb)、抗甲状腺球蛋白抗体(TgAb)等。
- 甲状腺激素测定:T4和/或T3水平升高,可明确存在甲状腺毒症。如果患者不存在影响甲状腺素结合蛋白的因素,那么总T4和总T3的测定精度、稳定性和重复性优于游离T4和游离T3;如果合并影响甲状腺素结合蛋白的因素,则参考游离T4和游离T3[6]。可伴有rT3水平升高。
- TSH测定:下降。如果仅有TSH水平下降而甲状腺激素水平正常,应考虑亚临床甲亢或危重患者合并甲亢[12]。
- 甲状腺超声检查:弥漫性或局灶性回声减低,低回声处血流信号增强;甲状腺上动脉和腺体内动脉流速显著加快、阻力降低。在放射性核素检查受限制时,可借助血流增快间接推断甲状腺功能亢进[13]。
- 131I摄取率:在诊断Graves病方面,已被TSH测定取代[6]。目前主要用于甲状腺毒症的鉴别诊断(属于甲亢的,131I摄取量增多,高峰前移;属于非甲亢的,131I摄取率降低),以及计算131I治疗时放射性同位素的剂量。
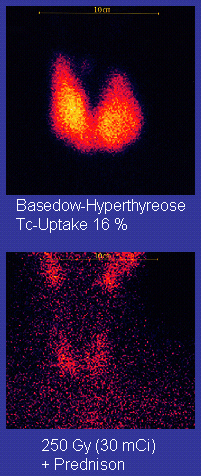
- 甲状腺放射性核素扫描:主要用于鉴别多结节性毒性甲状腺肿、甲状腺自主高功能腺瘤。前者核素分布不均匀,增强区和减弱区灶性分布。而高功能腺瘤处核素富集,呈热结节,其余区域因受负反馈抑制而成冷结节。Graves病则均匀增强。近1~2个月内摄碘过多(如应用含碘造影剂、胺碘酮、食用海产品等),可能导致假性摄取下降;如未能追问到相应病史,或者病史有矛盾,可检查尿碘浓度[13]。
诊断
[编辑]甲亢的诊断
[编辑]- 甲状腺激素水平增高,TSH水平降低。
- 高代谢综合征。
具备上述两点即可明确甲亢。需注意:
- 淡漠型甲亢往往以消瘦或心房颤动为首要表现,高代谢综合征的其它表现并不明显。
- 仅TSH水平下降而甲状腺激素水平正常者,应考虑亚临床甲亢或危重患者合并甲亢[12]。
Graves病的诊断
[编辑]- 确诊甲亢。
- 甲状腺弥漫性肿大(触诊和超声检查证实,少数病例无甲状腺肿大)。
- 眼征。
- 皮肤损害。
- TRAb、TSAb、TPOAb、TgAb等阳性。
1、2是必须条件,3~5为辅助条件。
鉴别诊断
[编辑]甲状腺毒症原因的鉴别
[编辑]主要与破坏性甲状腺毒症(如无症状性甲状腺炎、亚急性甲状腺炎等)鉴别,主要根据病史、甲状腺体征和131I摄取率。
甲亢原因的鉴别
[编辑]主要与多结节性毒性甲状腺肿、甲状腺自主高功能腺瘤鉴别,主要借助甲状腺放射性核素扫描和超声检查。
治疗
[编辑]目前暂无针对病因的特效治疗。主要通过抑制甲状腺功能,或者破坏甲状腺组织达到减少甲状腺激素产生的目的。
抗甲状腺药
[编辑]常用抗甲状腺药主要抑制甲状腺过氧化物酶,从而抑制甲状腺激素的合成和释放。此外,还可能有免疫调节作用,可以减轻自體免疫。由于甲状腺激素储备丰富,因此,需要数周时间才逐渐显示疗效。抗甲状腺药可分为:
- 硫脲类:代表药是丙硫氧嘧啶(propylthiouracil,PTU)。起效较快,且可抑制T4在外周转化为T3;蛋白结合率高,不易透过胎盘和乳腺,可在妊娠和哺乳时使用。但是,半衰期短,需要频繁给药。
- 咪唑类:代表药是甲巯咪唑(methimazole,MMI):半衰期长,可以每日服药一次,而且效能比丙硫氧嘧啶高。在美国,甲巯咪唑被推荐为药物治疗的首选方案,除非患者处于甲状腺危象或妊娠/哺乳状态[13]。
抗甲状腺药是基础的治疗手段,适应证包括:
- 病情轻~中度。
- 甲状腺轻~中度肿大。
- 手术前和131I治疗前的准备。
- 20岁以下。
- 不宜手术者。
- 术后复发但又不宜131I治疗者。
禁忌征:
- 中性粒细胞计数低于0.5×109。
- 转氨酶>5×ULN。
- 既往应用任一种抗甲状腺药后出现严重不良反应。
副作用:
- 皮疹:发生率大约在4%~5%[6]。轻微的皮疹可以加用抗组胺药;如果皮疹仍持续存在,可以改用另一种抗甲状腺药,或考虑手术、131I治疗;如果发生严重的过敏反应,不宜再换用另一种抗甲状腺药[13]。
- 粒细胞减少:由于Graves病本身也可能导致白细胞减少,因此,在抗甲状腺药治疗前应该常规检测血常规,以便随访时对比。如果治疗前,患者的中性粒细胞计数低于0.5×109,则为抗甲状腺药的禁忌征。治疗过程中是否需要定期复查血常规仍有争议。在中华人民共和国的临床实践中,血常规是定期复查的项目之一[6]。美国的学者则认为粒细胞缺乏的发生率很低(约0.2%~0.5%),且为突然发生,因此,定期检测血常规意义不大;再加上一旦发生粒细胞缺乏,患者常常有咽痛、发热等表现,因此,推荐患者在出现咽痛、发热时立即复查血常规,不推荐定期复查血常规[7][13]。
- 肝损害:丙硫氧嘧啶的肝损害发生率较甲巯咪唑高,少数患者可发展至致死性肝衰竭。常规监测肝功能是必须的,尤其是治疗的头6个月。然而,临床医师必须意识到,药物诱发的肝衰竭可在毫无征兆的情况下突然发生,因此,当患者出现恶心、呕吐、乏力、黄疸、大便颜色变浅、皮肤瘙痒等症状时,应及时检测肝功能。对于转氨酶的轻度升高,原因可能是甲状腺毒症,也可能是药物,鉴别诊断需靠动态监测肝功能变化。当转氨酶>3×ULN并持续1周以上时,应停用丙硫氧嘧啶,并且每周至少复查肝功能一次,如恢复不理想,应请肝病科/消化科医师会诊。对于丙硫氧嘧啶引起的轻度肝损害,也可以换用甲巯咪唑。
停药指证:主要根据症状、体征,一般认为抗甲状腺药维持治疗18~24个月可以停药。抗甲状腺药对病因(自體免疫)没有根治作用,所以,停药后复发率高,可达50%~60%[6]。鉴于此,若患者对抗甲状腺药耐受良好,也可以长期服药治疗[7][13];不过,服药超过18个月,似乎已无法再降低复发率[13]。出现下列情况时预示Graves病可能治愈:
- TRAb(或TSAb)转阴。
- 甲状腺明显缩小。
停药后仍需每1~3个月复查甲状腺功能,至少持续6~12个月,以便发现早期复发;此外,患者如果发现自己出现Graves病的表现,应及时就诊[13]。
131I治疗
[编辑]机制:131I释放β粒子破坏组织。由于只有甲状腺能够富集131I,因此,甲状腺外组织基本不受影响。 适应证:
- 甲状腺肿Ⅱ度以上。
- 合并白细胞减少、血小板减少或全血细胞减少。
- 合并甲状腺毒症性心脏病或其它心脏病。
- 合并糖尿病。
- 合并自主功能性甲状腺结节。
- 老年。
- 抗甲状腺药治疗禁忌或失败。
- 术后复发。
相对适应证:
- 儿童、青少年,抗甲状腺药治疗失败而又因拒绝或存在禁忌无法手术的。
- 合并肝、肾等脏器功能损害的。
- Graves眶病。
禁忌证:妊娠和哺乳期。
并发症:本疗法已有60余年经验,已证实治疗剂量下的131I暴露不存在致癌风险,不影响患者生育能力,不增加遗传缺陷发生率(前提是不在妊娠期使用,并且治疗后6个月内避孕),不伤害甲状腺外组织、器官。治疗成功率高,仅少数患者要在3~6个月后接受第二次治疗,个别患者需多次接受治疗[6][7][12]。
- Graves眶病加重:对轻度和稳定的中、重度病例仍可安全地接受131I单独治疗。进展期患者则需在治疗前后加用糖皮质激素,必要时可待Graves眶病控制后再接受131I治疗。此外,吸烟可增加131I治疗后Graves眶病加重的风险,并降低糖皮质激素的保护作用,因此,131I治疗前最好戒烟[7]。
- 放射性甲状腺炎:在治疗后短期内出现,通常比较轻微。由于甲状腺激素释放增加,可能导致病情一过性加重。
- 甲状腺功能减退症:最主要的并发症,而且几乎无法避免。在治疗后逐渐显现,确诊后需终生服用甲状腺激素进行替代治疗。由于替代剂量的甲状腺激素几乎没有副作用,终生甲状腺激素替代治疗优于抗甲状腺药治疗,因此,在美国,131I治疗是最受青睐的选择[6][12][13]。
- 甲状旁腺功能亢进症:罹患风险终生增加,因此,需要定期监测血钙水平[7]。
适应证:
- 中度以上甲亢。
- 腺体较大,伴有压迫症状。
- 胸骨后甲状腺肿。
- 合并多结节性甲状腺肿。
- 抗甲状腺药治疗后复发,或无法坚持长期服药。
- 131I后复发。
禁忌证:
- 症状较轻者。
- 青少年。
- 老年人。
- 合并严重器质性疾病不能耐受手术者。
由于甲亢与妊娠存在不利的相互影响,妊娠早、中期并非手术的禁忌证。 并发症:术后呼吸困难和窒息、喉返神经损伤、喉上神经损伤、甲状旁腺功能减退症、甲状腺危象。
其它治疗
[编辑]- 低碘饮食:减少甲状腺激素合成的原料。
- 碘剂:借助Wolff-Chaikoff效应迅速抑制甲状腺激素的释放,并能减轻甲状腺肿大、充血。不过,碘剂的抗甲状腺作用仅能维持2周左右,随后表现为促甲状腺作用,因此,仅限于甲状腺危象或术前的治疗,并必须配合抗甲状腺药。
- β阻滞药:减轻交感兴奋性,T4在外周转化为T3。常用普萘洛尔;如果合并气道痉挛性疾病,可以选用选择性β1阻滞药。
- 碳酸锂:抑制TRAb与TSH受体结合,从而抑制甲状腺激素的释放。副作用较多,目前已少用。
- 碘番酸、碘泊酸钠:可抑制T4在外周转化为T3,用药24小时内T3平均降幅可达62%,可用于甲状腺危象、重症甲亢、不耐受硫脲类和新生儿甲亢。由于碘番酸、碘泊酸钠可抑制甲状腺对碘的摄取,如果需行131I治疗,应待停药7天后进行[7]。
- 其它:如高氯酸钾等,现已少用。
特殊情况的处理
[编辑]- 甲状腺风暴:应紧急处置,包括治疗诱因,并予丙硫氧嘧啶(次选甲巯咪唑)、碘剂(次选碳酸锂)、普萘洛尔、皮質醇,加强支持治疗。效果不理想时可以考虑血液净化治疗。
- 妊娠前发现甲亢:在甲亢控制前,不宜妊娠。如果接受131I治疗,则应在治疗结束6个月后再考虑妊娠。
- 妊娠期甲亢:
- 如采用药物治疗,首选丙硫氧嘧啶,只需维持甲状腺激素水平在正常上限即可,以避免丙硫氧嘧啶剂量过大导致胎儿甲状腺功能减退;同时,妊娠也需要维持较高水平的甲状腺激素。随着妊娠的继续,由于生理性免疫抑制作用增强,丙硫氧嘧啶往往可以减量;相反,产后随着生理性免疫抑制的解除,Graves病容易复发,而且药物剂量需要增加。一般不宜应用普萘洛尔。
- 如接受手术治疗,通常可先予丙硫氧嘧啶,待妊娠4~6个月时手术。
- 131I治疗是禁忌。
- 哺乳期甲亢:
- 药物治疗首选丙硫氧嘧啶。
- 亦可考虑手术治疗。
- 131I治疗是禁忌。
- 甲状腺毒症性心脏病:
- 尽早开始足量抗甲状腺药。
- 甲状腺毒症控制后,尽早开始大剂量131I治疗。加强β阻滞药治疗,以防止放射性甲状腺炎期间甲状腺毒症一过性加重影响心脏。131I治疗应不断监测甲状腺激素和TSH水平,根据情况调整抗甲状腺药或甲状腺素的剂量,以维持甲状腺功能在正常范围,避免临床或亚临床甲亢或甲减。
- 如抗甲状腺药治疗后病情好转,可以耐受手术,亦可考虑手术治疗。
- β阻滞药:控制心动过速,以及心动过速诱发的心力衰竭。可合用洋地黄制剂,以对抗β阻滞药的负性变力作用。
- 心房颤动可采用β阻滞药和/或洋地黄控制,甲亢控制后可以实施电转律。
- 心力衰竭的治疗与普通心力衰竭相同,包括限制钠盐摄入、利尿等,只是治疗难度更大。
参考文献
[编辑]- ^ 1.0 1.1 1.2 1.3 1.4 1.5 1.6 Graves' Disease. National Institute of Diabetes and Digestive and Kidney Diseases. 2012-08-10 [2015-04-02]. (原始内容存档于2015-04-02).
- ^ 2.0 2.1 Burch, Henry B.; Cooper, David S. Management of Graves Disease: A Review. JAMA. 2015-12-15, 314 (23). ISSN 0098-7484. doi:10.1001/jama.2015.16535 (英语).
- ^ 3.0 3.1 3.2 3.3 Brent, Gregory A. Graves' Disease. New England Journal of Medicine. 2008-06-12, 358 (24). ISSN 0028-4793. doi:10.1056/NEJMcp0801880 (英语).
- ^ Menconi, Francesca; Marcocci, Claudio; Marinò, Michele. Diagnosis and classification of Graves' disease. Autoimmunity Reviews. Diagnostic criteria in Autoimmune diseases. 2014-04-01, 13 (4). ISSN 1568-9972. doi:10.1016/j.autrev.2014.01.013 (英语).
- ^ 5.0 5.1 5.2 Nikiforov, Yuri E.; Biddinger, Paul W.; Nikiforova, Lester D.R.; Biddinger, Paul W. Diagnostic pathology and molecular genetics of the thyroid 2nd. Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins. 2012: 69 [2017-04-09]. ISBN 9781451114553. (原始内容存档于2022-04-11).
- ^ 6.0 6.1 6.2 6.3 6.4 6.5 6.6 6.7 陆再英; 钟南山. 内科学. 北京: 人民卫生出版社. 2008. ISBN 978-7-117-09652-2.
- ^ 7.0 7.1 7.2 7.3 7.4 7.5 7.6 7.7 7.8 Stephen J. McPhee; Maxine A. Papadakis. Current Medical Diagnosis & Treatment 2011. US: McGraw-Hill LANGE. 2011. ISBN 978-0-07-170055-9.
- ^ 8.0 8.1 吴在德; 吴肇汉. 外科学. 北京: 人民卫生出版社. 2008. ISBN 978-7-117-09621-8.
- ^ 李甘地; 来茂德. 病理学. 北京: 人民卫生出版社. 2001. ISBN 7-117-04073-4.
- ^ Vinay Kumar; Abul K. Abbas. Robbins and Cotran Pathologic Basis of Disease. Pennsylvania: Elsevier. 2005. ISBN 0-8089-2302-1.
- ^ 赛诺菲安万特(sanofi aventis)公司. 可达龙 [Cordarone®]详细药物处方信息. 美迪医讯. [2011-11-29]. (原始内容存档于2021-09-19) (中文(中国大陆)).
- ^ 12.0 12.1 12.2 12.3 Hyperthyroidism - Endocrine and Metabolic Disorders. Merck Manuals Professional Edition. [2022-10-27]. (原始内容存档于2023-01-28) (美国英语).
- ^ 13.0 13.1 13.2 13.3 13.4 13.5 13.6 13.7 13.8 Bahn, Rebecca S.; Burch, Henry B.; Cooper, David S.; Garber, Jeffrey R.; Greenlee, M. Carol; Klein, Irwin; Laurberg, Peter; McDougall, I. Ross; Montori, Victor M.; Rivkees, Scott A.; Ross, Douglas S. Hyperthyroidism and Other Causes of Thyrotoxicosis: Management Guidelines of the American Thyroid Association and American Association of Clinical Endocrinologists. Endocrine Practice. 2011-05-01, 17 (3). ISSN 1530-891X. PMID 21700562. doi:10.4158/EP.17.3.456 (英语).
