酰胺




酰胺在自然界中广泛存在,并在科学技术中有重要应用。蛋白质中的肽键便以酰胺结构相连接。工业上重要的化工材料,如尼龙、芳纶、克维拉、特瓦纶等都是含酰胺结构单体聚合成的合成纤维。许多药物也都包含酰胺结构,它帮助维持刚性结构并抵抗水解,如对乙酰氨基酚、青霉素、LSD等[3]。一些低分子量的酰胺,是常用的有机溶剂,如DMF和DMAc。
命名
[编辑]酰胺可以看作羧酸被氨基或胺取代后衍生的产物,因此可以将酸字改为酰胺来命名,英文命名时将-ic acid改为-amide[4],例如:
 |
 |

|
| 乙酰胺 | 异丁(基)酰胺 | 乙二酰二胺 |
当酰胺中的氮上连有多个烃基时,则需要将氮上取代基写在某酰之前,并用N-来表示其位置(在没有歧义时可省略),例如:
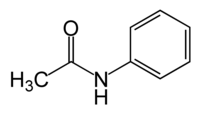 |
 |
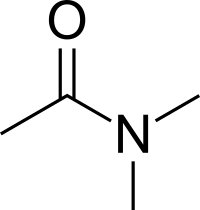
|
| 乙酰苯胺 | N,N-二甲基甲酰胺 | 二甲基乙酰胺 |
二元羧酸被氨(或胺)基取代时,称为“某二酰胺”,英文命名时将词尾-dioic acid改为-diamide;当两个羧基被同一个氨(或胺)基取代得到环状化合物时,称为“某二酰亚胺”,英文命名时将词尾改为-imide;当胺上的烃基与酰胺的碳原子首尾相连形成环状化合物时,称为“某内酰胺”,英文命名时将词尾改为-lactam[5],例如:
 |
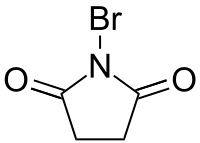 |

|
| 丁二酰胺 | N-溴代丁二酰亚胺 | 4-丁内酰胺 |
酰胺根据其N上取代程度,可分为伯(一级)酰胺、仲(二级)酰胺和叔(三级)酰胺[6]。
结构
[编辑]
酰胺中的C-N键较胺中的C-N键要短,一方面是因为酰胺中C-N键的碳是用sp2杂化轨道与氮成键,而胺中C-N键的碳是用sp3杂化轨道与氮成键,s成分较少[7];另一方面是因为氮上孤对电子在羰基上离域,在碳、氮和氧间形成共轭体系,从而使C-N键具有某些双键性质。因此,酰胺中的N、O、C位于同一平面,限制了围绕酰基的旋转[8][9]。
酰胺结构有以下的共振式:
性质
[编辑]除甲酰胺外,大部分具有RCONH2结构的酰胺为白色固体,这是因为分子间形成了氢键[10][11]。在羧酸衍生物中,酰胺具有最强的稳定性,其水解最难发生,一般需要在强酸性或碱性条件下回流。相较于胺类,酰胺表现出较弱的碱性,低级的酰胺可溶于水,例如DMF和DMAc便是很好的非质子极性溶剂,且可以与水混溶[10]。能与酸反应成盐,其质子化发生在氧原子上,酰胺的碱性要弱于胺,但强于酯、酮和羧酸,酰亚胺上的氢原子有弱酸性[12][13]。
蛋白质和肽是含有酰胺键的重要生物分子。一些生物碱中也含有酰胺结构[14]。
合成
[编辑]酰胺可以通过羧酸与胺偶联制备,直接反应需要高温将水赶出体系[15]:

酰胺可以通过酯、酸酐(卢米埃尔-巴比耶方法)或酰氯(肖滕-鲍曼反应)与胺反应来合成。多肽合成中通过偶联剂(如HATU、HOBt、PyBOP)来合成酰胺[16]。一些试剂,如Sheppard酰胺化试剂,被用来构建酰胺和亚胺结构[17][18]。
| 反应 | 底物 | 备注 |
|---|---|---|
| 亲核酰基取代反应 | 酰氯或酸酐 | 试剂:氨或胺 |
| Beckmann重排 | 环酮 | 试剂:肟和酸催化 |
| Schmidt反应 | 酮 | 试剂:叠氮酸 |
| 腈的控制水解[19] | 腈 | 试剂:水和酸催化 |
| Willgerodt–Kindle反应 [20] | 芳基烷基酮 | 硫和吗啉 |
| Passerini反应 | 异腈、酮(或醛)和羧酸 | 极性溶剂(如水或甲醇) |
| Ugi反应 | 异腈、羧酸、伯胺和酮(或醛) | |
| Bodroux反应[21][22] | 羧酸和格氏试剂的胺类衍生物(如IMgNHR) | 
|
| Chapman重排[23][24] | 芳基亚氨基醚 | 对N,N-二芳基亚胺,反应机理为分子内芳香族亲核取代反应[25]  |
| Ritter反应[26] | 腈、烷基化试剂如(异丁烯、叔丁醇)和强酸。 | 在浓酸作用下,腈与碳正离子发生加成反应得到仲酰胺,Ritter反应能在叔碳处构建一根C-N键。 |
| 末端烯烃的光化学加成[27] | 末端烯烃和甲酰胺 | 甲酰胺对末端单烯烃的自由基同系化反应,得到反马氏加成产物。 |
| 羧酸衍生物的氨解[28][29][30][31] | 酯、酰卤、酰胺和酸酐 | 羧酸衍生物可以与氨反应,形成酰胺,称为氨解。 |
其他反应
[编辑]有机钌化合物催化胺的脱氢酰化,该反应通过醇脱氢产生的醛,与胺形成半胺醛,随后二次脱氢得到酰胺,该反应的副产物为氢气[32] :
酰胺与胺反应生成新的酰胺的反应称为酰胺交换反应,该反应进行地非常缓慢,需要路易斯酸 [33]和有机金属催化剂[34]催化:
- RC(O)NR'2 + HNR"2 → RC(O)NR"2 + HNR'2
反应
[编辑]
酰胺的酸性水解机理[35] 
酰胺的酸性与碱性水解
酰胺会发生与酯相似的反应,但其反应性弱于酯。酰胺在热碱或强酸条件下会发生水解,酸性水解会产生对应羧酸和铵离子,碱性水解会产生对应胺和羧酸根离子。由于酰胺的水解条件相较于酯、酰卤更强烈,因此该反应不需要催化,也不可逆。
| 反应 | 产物 | 反应条件 |
|---|---|---|
| 脱水 | 腈 | P2O5; 苯磺酰氯; TFAA+py[36] |
| 霍夫曼重排 | 少一个碳原子的伯胺 | 溴+氢氧化钠 |
| 还原[37] | 胺和醛 | i) LAH ii) H+/H2O |
| Vilsmeier–Haack反应 | 醛 | POCl3,芳香族底物 |
| Bischler–Napieralski反应 | 环亚胺 | POCl3,SOCl2等 |
参见
[编辑]参阅书籍
[编辑]- 邢其毅等. 《基础有机化学》第三版 上册. 高等教育出版社. 2005a.
- 邢其毅等. 《基础有机化学》第三版 下册. 高等教育出版社. 2005b.
参考文献
[编辑]- ^ 国际纯化学和应用化学联合会,化学术语概略,第二版。(金皮书)(1997)。在线校正版: (2006–) "amides"。doi:10.1351/goldbook.A00266
- ^ Chapter 21: Amides and Imides. Nomenclature of Organic Compounds. Advances in Chemistry 126 (Washington, American Chemical Society). 1974: 166–173. ISBN 9780841201910. doi:10.1021/ba-1974-0126.ch021.
- ^ Boonen, Jente; Bronselaer, Antoon; Nielandt, Joachim; Veryser, Lieselotte; De Tré, Guy; De Spiegeleer, Bart. Alkamid database: Chemistry, occurrence and functionality of plant N-alkylamides (PDF). Journal of Ethnopharmacology. 2012, 142 (3): 563–590 [2022-07-12]. PMID 22659196. doi:10.1016/j.jep.2012.05.038. hdl:1854/LU-2133714
 . (原始内容 (PDF)存档于2022-07-14).
. (原始内容 (PDF)存档于2022-07-14).
- ^ 邢其毅等 2005a,第69-70页.
- ^ 邢其毅等 2005a,第70页.
- ^ Organic Chemistry IUPAC Nomenclature. Rules C-821. Amides http://www.acdlabs.com/iupac/nomenclature/79/r79_540.htm 互联网档案馆的存档,存档日期21 January 2011.
- ^ 邢其毅等 2005b,第599页.
- ^ Ivana Antol; Mirjana Eckert-Maksic; Hans Lischka. Ab Initio MR-CISD Study of Gas-Phase Basicity of Formamide in the First Excited Singlet State. The Journal of Physical Chemistry A. 2004, 108 (46): 10317–10325. doi:10.1021/jp048087o.
- ^ Yuko Otani; Osamu Nagae; Yuji Naruse; Satoshi Inagaki; Masashi Ohno; Kentaro Yamaguchi; Gaku Yamamoto; Masanobu Uchiyama; Tomohiko Ohwada. An Evaluation of Amide Group Planarity in 7-Azabicyclo[2.2.1]heptane Amides. Low Amide Bond Rotation Barrier in Solution. J. Am. Chem. Soc. 2003, 125 (49): 15191–15199. doi:10.1021/ja036644z.
- ^ 10.0 10.1 邢其毅等 2005b,第600页.
- ^ Sayan Bagchi; Yung Sam Kim; Adam K. Charnley; Amos B. Smith; Robin M. Hochstrasser. Two-Dimensional Infrared Investigation of N-Acetyl Tryptophan Methyl Amide in Solution. The Journal of Physical Chemistry B. 2007, 111 (11): 3010–3018. doi:10.1021/jp067348m.
- ^ 邢其毅等 2005b,第623-624页.
- ^ A. R. Goldfarb; A. Mele; N. Gutstein. Basicity of the Amide Bond. J. Am. Chem. Soc. 1955, 77 (23): 6194–6196. doi:10.1021/ja01628a031.
- ^ Yang Han; Tao Hou; Zi-Hui Zhang; Yao-Dong Wang; Jun-Xiang Cheng; Han Zhou; Ji-Xia Wang; Jia-Tao Feng; Yan-Fang Liu; Zhi-Mou Guo; Xin-Miao Liang. Structurally diverse isoquinoline and amide alkaloids with dopamine D2 receptor antagonism from Corydalis bungeana. Fitoterapia. 2022, 159: 105175. ISSN 0367-326X. doi:10.1016/j.fitote.2022.105175.
- ^ Montalbetti, Christian A. G. N.; Falque, Virginie. Amide bond formation and peptide coupling. Tetrahedron. 14 November 2005, 61 (46): 10827–10852. doi:10.1016/j.tet.2005.08.031.
- ^ Valeur, Eric; Bradley, Mark. Amide bond formation: beyond the myth of coupling reagents. Chem. Soc. Rev. 2009, 38 (2): 606–631. PMID 19169468. S2CID 14950926. doi:10.1039/B701677H.
- ^ Tris(2,2,2-trifluoroethyl) borate 97% | Sigma-Aldrich. www.sigmaaldrich.com. [2016-09-22].
- ^ Sabatini, Marco T.; Boulton, Lee T.; Sheppard, Tom D. Borate esters: Simple catalysts for the sustainable synthesis of complex amides. Science Advances. 2017-09-01, 3 (9): e1701028. Bibcode:2017SciA....3E1028S. PMC 5609808
 . PMID 28948222. doi:10.1126/sciadv.1701028.
. PMID 28948222. doi:10.1126/sciadv.1701028.
- ^ Wenner, Wilhelm. Phenylacetamide. Organic Syntheses. 1952, 32: 92. doi:10.15227/orgsyn.032.0092.
- ^ Karl Kindler. Studien über den Mechanismus chemischer Reaktionen. Erste Abhandlung. Reduktion von Amiden und Oxydation von Aminen. Liebigs Annalen. 1923, 431 (1): 187–230. doi:10.1002/jlac.19234310111.
- ^ Bodroux F. Bull. Soc. Chim. France. 1905, 33: 831.
- ^ Bodroux reaction. Institute of Chemistry, Skopje, Macedonia. [23 May 2007]. (原始内容存档于24 September 2015).
- ^ Schulenberg, J. W.; Archer, S. The Chapman Rearrangement 14. 1965: 1–51. ISBN 978-0471264187. doi:10.1002/0471264180.or014.01.
- ^ Chapman, Arthur William. CCLXIX.—Imino-aryl ethers. Part III. The molecular rearrangement of N-phenylbenziminophenyl ether. Journal of the Chemical Society, Transactions. 1925, 127: 1992–1998. doi:10.1039/CT9252701992.
- ^ March, Jerry. Advanced organic Chemistry, Reactions, mechanisms and structure 3rd. 1966. ISBN 978-0-471-85472-2.
- ^ Adams, Rodger; Krimen, L.I.; Cota, Donald J. Organic Reaction Volume 17. London: John Wiley & Sons, Inc. 1969: 213–326. ISBN 9780471196150. doi:10.1002/0471264180.
- ^ Monson, Richard. Advanced Organic Synthesis: Methods and Techniques (PDF). New York: Academic Press. 1971: 141 [2022-07-26]. ISBN 978-0124336803. (原始内容 (PDF)存档于2021-11-04).
- ^ Corson, B. B.; Scott, R. W.; Vose, C. E. Cyanoacetamide. Organic Syntheses. 1941, 1: 179. doi:10.15227/orgsyn.009.0036.
- ^ Jacobs, W. A. Chloroacetamide. Organic Syntheses. 1941, 1: 153. doi:10.15227/orgsyn.007.0016.
- ^ Kleinberg, J.; Audrieth, L. F. Lactamide. Organic Syntheses. 1955, 3: 516. doi:10.15227/orgsyn.021.0071.
- ^ 邢其毅等 2005b,第612-614页.
- ^ Gunanathan, C.; Ben-David, Y.; Milstein, D. Direct Synthesis of Amides from Alcohols and Amines with Liberation of H2. Science. 2007, 317 (5839): 790–2. Bibcode:2007Sci...317..790G. PMID 17690291. S2CID 43671648. doi:10.1126/science.1145295.
- ^ T. A. Dineen; M. A. Zajac; A. G. Myers. Efficient Transamidation of Primary Carboxamides by in situ Activation with N,N-Dialkylformamide Dimethyl Acetals. J. Am. Chem. Soc. 2006, 128 (50): 16406–16409. PMID 17165798. doi:10.1021/ja066728i.
- ^ Emma L. Baker; Michael M. Yamano; Yujing Zhou; Sarah M. Anthony; Neil K. Garg. A two-step approach to achieve secondary amide transamidation enabled by nickel catalysis. Nature Communications. 2016, 7: 11554. Bibcode:2016NatCo...711554B. PMC 4876455
 . PMID 27199089. doi:10.1038/ncomms11554.
. PMID 27199089. doi:10.1038/ncomms11554.
- ^ Smith, Michael B.; March, Jerry, Advanced Organic Chemistry: Reactions, Mechanisms, and Structure 6th, New York: Wiley-Interscience, 2007, ISBN 978-0-471-72091-1
- ^ 美国专利第5,935,953号
- ^ 邢其毅等 2005b,第618-620页.





