氯化鈣:修订间差异
| 第116行: | 第116行: | ||
| accessdate = 9 August 2006}}</ref>。 |
| accessdate = 9 August 2006}}</ref>。 |
||
== 医学和生物学的应用 == |
|||
*[[生物学]][[基因工程]]:廣泛應用於生物醫學實驗緩衝液<ref>{{cite web|url= http://www.labome.cn/综述/试剂/54|title=氯化钙|accessdate=2010-01-20|work=来邦网}}</ref><ref>[http://www.guidechem.com/cas-100/10043-52-4.html 氯化鈣字典-Guidechem.com]</ref>, 将目的基因导入受体细胞过程中,可以使用氯化钙增加受体细胞膜的通透性,使得质粒更容易地导入。 |
|||
在[[生物学]]和医学的研究中,氯化钙广泛应用于配制生物医学实验所需的缓冲液,比如在研究一种新的钾离子通道复合物的激活剂时用CaCl<sub>2</sub>配制用于被分离的卵母细胞的ND96贮存液<ref>{{cite journal|title=Discovery of a novel activator of KCNQ1-KCNE1 K<sup>+</sup> channel complexes.|journal=PLoS One|year=2009|volume=4|issue1|pages=e4236|pmid=19156197|doi=10.1371/journal.pone.0004236}}</ref>,在研究鸟苷酰环化酶C对中脑多巴胺神经元的功能时采用CaCl<sub>2</sub>进行脑片制备实验<ref>{{cite journal|journal=Science|title=Role for the membrane receptor guanylyl cyclase-C in attention deficiency and hyperactive behavior.|volume=333|year=2011|issue=6049|pages=1642-1646|doi=10.1126/science.1207675|pmid= 21835979|}}</ref>,在研究细菌和古细菌中用于抵御氟毒性的氟核糖开关时采用CaCl<sub>2</sub>以1mmol/L的浓度进行串联标记实验等<ref>{{cite journal|title=Widespread genetic switches and toxicity resistance proteins for fluoride.|author=Baker JL, Sudarsan N, Weinberg Z, Roth A, Stockbridge RB, Breaker RR.|Science|year= 2012|volume=335|issue=6065|pages=233-5|pmid= 22194412|doi=10.1126/science.1215063}}</ref>。 |
|||
在将目的基因导入受体细胞过程中,可以使用氯化钙增加受体细胞膜的通透性,使得质粒更容易地导入。 |
|||
*无水氯化钙和它的水合物都是容易潮解的白色固体,是常用的[[干燥剂]],无水或含水较少者,干燥的效能较高。由于氯化钙是中性的,因此它可以干燥酸性或碱性气体。然而,氯化钙却不适合干燥氨气,这是因为会生成CaCl<sub>2</sub>·8NH<sub>3</sub> |
*无水氯化钙和它的水合物都是容易潮解的白色固体,是常用的[[干燥剂]],无水或含水较少者,干燥的效能较高。由于氯化钙是中性的,因此它可以干燥酸性或碱性气体。然而,氯化钙却不适合干燥氨气,这是因为会生成CaCl<sub>2</sub>·8NH<sub>3</sub> |
||
*六[[水合物]]CaCl<sub>2</sub>·6H<sub>2</sub>O与冰混合,可以用作[[致冷剂]];如依1.44:1比率搅和,可得-54.9℃的冷冻混合物。 |
*六[[水合物]]CaCl<sub>2</sub>·6H<sub>2</sub>O与冰混合,可以用作[[致冷剂]];如依1.44:1比率搅和,可得-54.9℃的冷冻混合物。 |
||
2012年8月25日 (六) 05:35的版本
| Calcium Chloride | |
|---|---|

| |
| |
| IUPAC名 氯化钙 | |
| 别名 | 氯化钙 E509 |
| 识别 | |
| CAS号 | 10043-52-4 10043-52-4 (无水) 22691-02-7 (一水合物) 10035-04-8 (二水合物) 25094-02-4 (四水合物) 7774-34-7 (六水合物) |
| PubChem | 24854 |
| ChemSpider | 23237 |
| SMILES |
|
| InChI |
|
| InChIKey | UXVMQQNJUSDDNG-NUQVWONBAG |
| EINECS | 233-140-8 |
| ChEBI | 3312 |
| RTECS | EV9800000 |
| DrugBank | DB01164 |
| 性质 | |
| 化学式 | CaCl2 |
| 摩尔质量 | 110.98 g/mol(无水) 128.999 g/mol(一水合物) 147.014 g/mol(二水合物) 183.045 g/mol(四水合) 219.08 g/mol(六水合物) g·mol⁻¹ |
| 外观 | 白色粉末 易潮解 |
| 氣味 | 无臭 |
| 密度 | 2.15 g/cm3(无水) 1.835 g/cm3(二水合物) 1.83 g/cm3(四水合物) 1.71 g/cm3(六水合物) |
| 熔点 | 772 °C(无水) 260 °C(一水合物) 176 °C(二水合物) 45.5 °C(四水合物) 30 °C(六水合物)[1] |
| 沸点 | 1935 °C (无水) |
| 溶解性(水) | 74.5 g/100mL (20 °C) 59.5 g/100 mL (0 °C) |
| 溶解性 | 溶于丙酮、乙酸 |
| pKa | 8-9(无水) 6.5-8.0(六水合物) |
| 折光度n D |
1.52 |
| 结构 | |
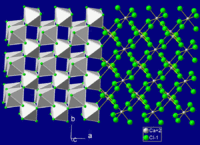
| 晶体结构 | 正交晶系(变形金红石),oP6 三方晶系(六水合物) |
| 空间群 | Pnnm, No. 58 |
| 配位几何 | 正八面体, 6配位 |
| 危险性 | |
| 欧盟危险性符号 | |
| 警示术语 | R:R36 |
| 安全术语 | S:S2, S22, S24 |
| 欧盟编号 | 017-013-00-2 |
GHS危险性符号
| |
| H-术语 | H319, H316, H302 |
| P-术语 | P264, P280, P270, P305+351+338, P337+313, P301+312, P330, P501 |
| NFPA 704 | |
| 致死量或浓度: | |
LD50(中位剂量)
|
1000 mg/kg (口服,小鼠) |
| 相关物质 | |
| 其他阴离子 | 氟化钙 溴化钙 碘化钙 |
| 其他阳离子 | 氯化铍 氯化镁 氯化锶 氯化锶 氯化镭 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
氯化钙,一种由氯元素和钙元素构成的盐,化學式为CaCl
2。它是典型的离子型卤化物,室温下是固体。它常见的应用包括制冷设备所用的盐水、道路的融冰剂和干燥剂。因为它在空气中易吸收水分发生潮解,所以无水氯化钙必须储藏在密封的、不漏气的容器中。
化学性质
由于氯化鈣可溶于水,故可作为溶液中钙离子的来源。这个性质使得它可用于置换溶液中的某些特定离子。比如溶液中的磷酸根就能用氯化钙置换成氯离子:
- 3 CaCl2(aq) + 2 K3PO4(aq) → Ca3(PO4)2 (s) + 6 KCl (aq)
熔融的氯化钙电解可制出鈣单质和氯气:
- CaCl2 → Ca(s) + Cl2(g)↑
氯化钙的溶解焓为-176.2cal/g,所以无水氯化钙在水中溶解时会释放出大量的热。[2][3]
无水氯化钙有潮解性,当氯化钙的晶体结构中积累了足够多的水分后固体会溶解形成溶液。
制备
- Ca(OH)2 + 2 NH4Cl → CaCl2 + 2 NH3 + 2 H2O
- CaCO3(s) + 2 HCl(aq) → CaCl2(aq) + CO2(g) + H2O (l)
北美地区2002年的氯化钙消费量达到168.7万吨(折合37亿磅)[4],陶氏化学公司在密歇根州的生产工厂拥有约占全美国35%的氯化钙生产能力。[5]
分布
二水合氯化钙构成了稀有的蒸发岩矿物sinjarite[6][7],蒸发岩矿物南极石则是以矿物形式存在于自然界中的六水合氯化钙[8],其他与氯化钙有关的矿物包括同样非常稀有的氯钾钙石[9][10]。
应用
干燥剂
无水氯化钙常作为干燥剂填充干燥管,用氯化钙干燥过的巨藻(或称海草灰)可用来生产纯碱。氯化钙还可作为有机液体和气体的干燥剂和脱水剂,用于氮气、氧气、氢气、氯化氢、二氧化硫等气体的干燥,但不能用来干燥乙醇和氨,因为乙醇和氨气分别会与氯化钙反应生成醇合物CaCl2·4C2H5OH和氨合物CaCl2·8NH3[11]。无水氯化钙还可被制成家用产品用作空气吸湿剂,无水氯化钙作为吸水剂已被FDA批准在包扎急救时使用,以确保创口处的干燥[12]。
无水氯化钙的吸湿性还被应用在了保持道路表面的湿润,借此控制道路上的灰尘扬起[13]。
医学和生物学的应用
在生物学和医学的研究中,氯化钙广泛应用于配制生物医学实验所需的缓冲液,比如在研究一种新的钾离子通道复合物的激活剂时用CaCl2配制用于被分离的卵母细胞的ND96贮存液[14],在研究鸟苷酰环化酶C对中脑多巴胺神经元的功能时采用CaCl2进行脑片制备实验[15],在研究细菌和古细菌中用于抵御氟毒性的氟核糖开关时采用CaCl2以1mmol/L的浓度进行串联标记实验等[16]。
在将目的基因导入受体细胞过程中,可以使用氯化钙增加受体细胞膜的通透性,使得质粒更容易地导入。
- 无水氯化钙和它的水合物都是容易潮解的白色固体,是常用的干燥剂,无水或含水较少者,干燥的效能较高。由于氯化钙是中性的,因此它可以干燥酸性或碱性气体。然而,氯化钙却不适合干燥氨气,这是因为会生成CaCl2·8NH3
- 六水合物CaCl2·6H2O与冰混合,可以用作致冷剂;如依1.44:1比率搅和,可得-54.9℃的冷冻混合物。
參考資料
- ^ Pradyot Patnaik. Handbook of Inorganic Chemicals.. McGraw-Hill. 2002. ISBN 0-07-049439-8.
- ^ A. V. Kustov, M. B. Berezin and B. D. Berezin. Enthalpies and heat capacities of dissolution for calcium chloride and sodium oxalate. Russian Journal of Inorganic Chemistry. 2007, 52 (1): 129–130. 已忽略文本“doi: 10.1134/S0036023607010238” (帮助)
- ^ CALCIUM CHLORIDE HANDBOOK (PDF).
- ^ Calcium Chloride SIDS Initial Assessment Profile, UNEP Publications, SIAM 15, Boston, October 22–25, 2002, page 11.
- ^ Calcium Chloride Chemical Profile, The Innovation Group, www.the-innovation-group.com, printed September 9, 2005.
- ^ Zeki A. Aljubouri and Salim M. Aldabbagh. Sinjarite, a New Mineral from Iraq. Mineralogical Magazine. 1980, 43 (329): 643–646. doi:10.1180/minmag.1980.043.329.13.
- ^ Michael Fleischer, Louis J. Cabri, George Y. Cao and Adolf Pabst. New Mineral Names (PDF). American Mineralogist. 1980, 65: 1065–1070.
- ^ Tetsuya Torii, Joyo Ossaka. Antarcticite: A New Mineral, Calcium Chloride Hexahydrate, Discovered in Antarctica. Science. 1965, 149 (3687): 975–977. doi:10.1126/science.149.3687.975.
- ^ Palache, C., H. Berman, and C. Frondel (1951) Dana’s system of mineralogy,(7th edition), v. II, 91–92.
- ^ Chlorocalcite (PDF).
- ^ Dr. P. B. Saxena. I.I.T. Chemistry. Publisher Krishna Prakashan Media. : 283.
- ^ CPG 7117.02. FDA Compliance Articles. US Food and Drug Administration. 1995 [3 December 2007]. 已忽略未知参数
|month=(建议使用|date=) (帮助) - ^ Dust: Don't Eat It! Control It!. Road Management & Engineering Journal. US Roads (TranSafety Inc.). 1 June 1998 [9 August 2006].
- ^ Discovery of a novel activator of KCNQ1-KCNE1 K+ channel complexes.. PLoS One. 2009, 4: e4236. PMID 19156197. doi:10.1371/journal.pone.0004236. 已忽略文本“issue1” (帮助)
- ^ Role for the membrane receptor guanylyl cyclase-C in attention deficiency and hyperactive behavior.. Science. 2011, 333 (6049): 1642–1646. PMID 21835979. doi:10.1126/science.1207675.
- ^ Baker JL, Sudarsan N, Weinberg Z, Roth A, Stockbridge RB, Breaker RR. Widespread genetic switches and toxicity resistance proteins for fluoride. 335 (6065): 233–5. 2012. PMID 22194412. doi:10.1126/science.1215063. 已忽略文本“Science” (帮助)
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


