五氯化钽
| 五氯化钽 | |
|---|---|
| |
| IUPAC名 Tantalum(V) chloride Tantalum pentachloride | |
| 识别 | |
| CAS号 | 7721-01-9(TaCl5) 17499-29-5(Ta2Cl10) |
| PubChem | 24394 |
| SMILES |
|
| InChI |
|
| EINECS | 231-755-6 |
| 性质 | |
| 化学式 | TaCl5 |
| 摩尔质量 | 358.213 g/mol g·mol⁻¹ |
| 外观 | 白色单斜晶体[1] |
| 密度 | 3.68 g/cm3 |
| 熔点 | 216 °C(489 K) |
| 沸点 | 239.4 °C(513 K) |
| 溶解性(水) | 反应 |
| 溶解性 | 氯仿、CCl4 |
| 磁化率 | +140.0×10−6 cm3/mol |
| 结构 | |
| 晶体结构 | 单斜, mS72 |
| 空间群 | C2/m, No. 12 |
| 热力学 | |
| ΔfHm⦵298K | -858.98 kJ/mol |
| S⦵298K | 221.75 J K−1 mol−1 |
| 危险性 | |
| 闪点 | 不可燃 |
| 致死量或浓度: | |
LD50(中位剂量)
|
1900 mg/kg (大鼠,口服) |
| 相关物质 | |
| 其他阴离子 | 五氟化钽 五溴化钽 五碘化钽 |
| 其他阳离子 | 四氯化钒 五氯化铌 |
| 相关化学品 | 三氯化钽, 四氯化钽 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
五氯化钽是一种无机化合物,化学式 TaCl5。它是一种白色粉末,是研究钽化合物的开端。它会水解成三氯氧化钽(TaOCl3)甚至是五氧化二钽(Ta2O5);这就要求使用空气隔绝技术在无水条件下进行合成和操作。
结构[编辑]
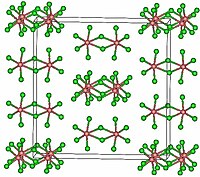
TaCl5 是一种单斜晶体,空间群 C2/m。[2]十个氯原子处在两个八面体顶点的位置。两个钽原子在八面体的中间,由两个桥接配体氯连接而成。二聚体结构保留在非络合溶剂中,并在很大程度上保持熔融状态。但是,气态的 TaCl5 是单体。这个单体的形状是三角双锥,就和PCl5一样。[3]
物理性质[编辑]
五氯化钽在芳香烃的溶解度是按照以下趋势升高的:
这反映在于溶液的颜色从浅黄色到橙色的加深。相较于芳香烃,五氯化钽的溶解度在环己烷和四氯化碳中较少。还已知五氯化钽的这种溶液是不良的电导体,表明几乎没有电离。通过升华纯化TaCl5,可得到白色针状固体。
制备[编辑]
五氯化钽可以由钽和氯气在 170 至 250 °C之间直接化合而成。这个反应也可以用HCl,不过要在400 °C下反应。[4]
- 2 Ta + 5 Cl2 → 2 TaCl5
- 2 Ta + 10 HCl → 2 TaCl5 + 5 H2
在240 °C,五氧化二钽和氯化亚砜反应也可以得到五氯化钽。
- Ta2O5 + 5 SOCl2 → 2 TaCl5 + 5 SO2
五氯化钽是可以购买的,不过样本里会有少量的氯氧化钽 (TaOCl3)。这是五氯化钽水解而成的。
反应[编辑]
TaCl5 是亲电体,类似AlCl3。它会和路易斯碱反应,形成加合物。[5]
加合物[编辑]
TaCl5 可以和醚形成稳定的加合物:
- TaCl5 + R2O → TaCl5(OR2) (R = Me, Et)
TaCl5 也可以和五氯化磷和氯氧化磷反应。后者是一个加合物,连接氧原子:
- TaCl5 + PCl5 → [PCl+
4][TaCl−
6] - TaCl5 + OPCl3 → [TaCl5(OPCl3)]
五氯化钽会和叔胺反应,生成加合物晶体。
- TaCl5 + 2 R3N → [TaCl5(NR3)]
取代反应[编辑]
五氯化钽会和三苯基氧化膦反应,生成氯氧化物:
- TaCl5 + 3 OPPh3 → [TaOCl3(OPPh3)]x ...
TaCl5 和有氢氧基的化合物如:醇、苯酚和羧酸反应,形成氯化氢和有 Ta–O 键的化合物:
- TaCl5 + 3 HOEt → TaCl2(OEt)3 + 3 HCl
用氨来吸收HCl,五个氯原子都会被替换,形成 Ta(OEt)5。同样的, TaCl5 会和甲醇锂在甲醇中反应,形成甲氧基化合物:
- TaCl5 + 4 LiOMe → Ta(OMe)4Cl + 4 LiCl
和胺,醇的反应[编辑]
氨会取代 TaCl5 的大部分氯原子,形成簇合物。用伯胺或仲胺取代氯原子的速率较慢,不过用二烷基胺基锂反应可以取代五个氯原子,例如制备五(二甲基胺基)钽的反应:
- TaCl5 + 5 LiNMe2 → Ta(NMe2)5
五氯化物与醇反应,生成醇盐。如制备五乙醇钽所示,此类反应通常在碱的存在下进行:
- 10 EtOH + Ta2Cl10 + 10 NH3 → Ta2(OEt)10 + 10 NH4Cl
五氯化钽会被氮杂环如:吡啶还原。
还原[编辑]
还原五氯化钽会形成中性或阴离子的簇合物,如: [Ta6Cl18]4− 和 [Ta6Cl14](H2O)4。[6]

参考资料[编辑]
- ^ Lide, David R. (编), CRC Handbook of Chemistry and Physics 87th, Boca Raton, FL: CRC Press, 2006, ISBN 0-8493-0487-3
- ^ Rabe, Susanne; Müller, Ulrich. Crystal structure of tantalum pentachloride, (TaCl5)2. Z. Kristallogr. - New Cryst. Struct. 2000, 215 (1): 1–2. doi:10.1515/ncrs-2000-0102
 .
.
- ^ F. Fairbrother. The Chemistry of Niobium and Tantalum
 . Elsevier. 1967.
. Elsevier. 1967.
- ^ Young, Ralph C.; Brubaker, Carl H. Reaction of Tantalum with Hydrogen Chloride, Hydrogen Bromide and Tantalum Pentachloride; Action of Hydrogen on Tantalum Pentachloride. Journal of the American Chemical Society. 1952, 74 (19): 4967. doi:10.1021/ja01139a524.
- ^ F. A. Cotton, G. Wilkinson, Advanced Inorganic Chemistry (4th ed.), Wiley, New York, 1980.
- ^ Duraisamy, Thirumalai; Hay, Daniel N. T.; Messerle, Louis. Octahedral Hexatantalum Halide Clusters. Inorganic Syntheses. 2014, 36: 1–8. doi:10.1002/9781118744994.ch1.
- ^ Thaxton, C. B.; Jacobson, R. A. The Crystal Structure of H2(Ta6Cl18)(H2O)6. Inorganic Chemistry. 1971, 10: 1460–1463. doi:10.1021/ic50101a029.
扩展阅读[编辑]
- Ozin, G. A.; Walton, R. A. Vibrational spectra and structures of the 1:1 complexes of niobium and tantalum, pentachlorides and tantalum pentabromide with aceto-, perdeuterioaceto-, and propionitriles in the solid and solution states and a vibrational analysis of the species MX5, NC·CY3 (Y = H or D). J. Chem. Soc. A. 1970: 2236–2239. doi:10.1039/j19700002236.
- Bullock, J. I.; Parrett, F. W.; Taylor, N. J. Some metal halide–phosphorus halide–alkyl halide complexes. Part II. Reactions with niobium and tantalum pentachlorides and tungsten hexachloride. J. Chem. Soc., Dalton Trans. 1973, (5): 522–524. doi:10.1039/DT9730000522.
- Đorđević, C.; Katović, V. Co-ordination complexes of niobium and tantalum. Part VIII. Complexes of niobium(IV), niobium(V), and tantalum(V) with mixed oxo, halogeno, alkoxy, and 2,2′-bipyridyl ligands. J. Chem. Soc. A. 1970: 3382–3386. doi:10.1039/j19700003382.
- Cowley, A.; Fairbrother, F.; Scott, N. The halides of niobium (columbium) and tantalum. Part V. Diethyl ether complexes of the pentachlorides and pentabromides; the solubility of tantalum pentaiodide in ether. J. Chem. Soc. 1958: 3133–3137. doi:10.1039/JR9580003133.
外部链接[编辑]
| 维基共享资源上的相关多媒体资源:五氯化钽 |
| ||||||||||||||||||||||||
