卤素
卤素(英语:Halogen)是指在元素周期表中同属第17族(旧称ⅦA族)的六种元素:氟(F)、氯(Cl)、溴(Br)、碘(I)、砹(At)和鿬(Ts),砹和鿬有极强放射性,且鿬属于人造元素。
卤素是类化学性质非常活泼的元素,能和许多金属形成盐类。卤素原子序越大,熔沸点越高;电负性与第一电离能越低,越不活泼;常温常压(300K、10万Pa)的密度越高。卤族是唯一在常温常压有固液气三态元素的族。在标准状况,氟和氯是气体,溴是液体,碘、砹、鿬[1]是固体。
历史
[编辑]含氟矿物萤石在1529年就已知。早期化学家就已知氟化合物里有种未知元素,但无法分离。在1860年,英国化学家George Gore用电流流过氢氟酸的方法并可能产生了氟气,但他当时无法证明自己的结果。1886年,巴黎化学家亨利·莫瓦桑电解了溶于无水氟化氢的氟化氢钾,成功分离出氟。[2]
炼金术士和早期化学家早已知道盐酸,但1774年卡尔·威廉·舍勒加热盐酸和二氧化锰时才发现氯单质,他称之为dephlogisticated muriatic acid,也就是氯在这33年来的名字。1807年,咸夫里·戴维研究了氯,发现它是化学元素。氯气在第一次世界大战期间用作化学武器。根据不同的污染浓度,氯气会灼伤人体内外的组织,尤其是肺部,使人呼吸困难或无法呼吸。[2]
安托万·巴拉尔在1820年代将氯气通入卤盐水样品发现了溴。他最初提议为新元素命名为muride,但法兰西学术院将该元素改名为bromine(溴)。[2]
贝尔纳·库尔图瓦发现了碘。他通常将海藻灰与水煮沸来生成氯化钾,用以生产硝石。然而,在1811年,他在产物加入硫酸,发现产物生成紫色烟雾,这些烟雾凝结成黑色晶体。他怀疑这些晶体是新元素,因此将样品发给其他化学家来调查。约瑟夫·路易·盖-吕萨克证明了它是新元素,也就是今天的碘。[2]
1931年,弗雷德·艾利森自称用磁光机器发现了85号元素,并将其命名为Alabamine,但他的发现是错误的。1937年,拉真达拉·德(Rajendralal De)自称在矿石发现85号元素,并称其为dakine,但他的发现也是错误。霍里亚·胡卢贝伊和伊维特·哥舒瓦在1939年用光谱学尝试发现85号元素也未成功。瓦尔特·明德尔于同年尝试寻找由钋β衰变生成类似碘的元素。85号元素今天称为砹,于1940年由戴尔·R·科森、肯尼斯·罗斯·麦肯齐和埃米利奥·塞格雷成功合成,他们用α粒子轰击铋来合成砹。[2]
2010年,由核物理学家尤里·奥加涅相领导的团队,包含来自杜布纳联合原子核研究所、橡树岭国家实验室、劳伦斯利佛摩国家实验室和范德堡大学的科学家用钙-48轰击锫-249原子合成出鿬-294。截至2024年3月,鿬是最新发现的化学元素。
命名
[编辑]卤素可和很多金属形成氟化钙、氯化钠、溴化银、碘化钾等盐类,英文halogen来自希腊语halos(盐)和gennan(形成)两词。中文卤的原意是盐碱地。所有已发现卤素的英文名都以ine结尾。
1811年,德国化学家Johann Schweigger提议用halogen一名,意为“成盐者”,是希腊文αλς(als,意为盐)和γενειν(genein,意为产生),代替汉弗里·戴维提出的chlorine一名来称呼氯元素;[3]不过,1826年,瑞典化学家约恩斯·贝尔塞柳斯提议把halogen一词改为指代氟、氯和碘元素,这些元素与碱金属形成化合物时,会产生类似海盐的物质。[4][5]
所有卤素名的结尾都有ine后缀。氟的名字来自拉丁语fluere,意为“流动”,它由矿物萤石衍生而来,而萤石在金属加工中用作助焊剂。氯的名字来自希腊文的chloros,意为黄绿色。溴的名字来自希腊文的bromos,意思是恶臭。碘的名字来自希腊文iodes,意为紫色。砹的名字来自希腊文的astatos,意为不稳定。鿬的名字则来自美国的田纳西州。[2][6]
分布
[编辑]卤素在自然界以化合态广泛存在(极不稳定的砹和鿬除外)。氯的存在范围最广,其余卤素的含量按氟、溴、碘、砹、鿬顺序减少(砹在自然界只有痕量,鿬则不在自然界出现)。
| 卤素 | 分布状况[7] |
|---|---|
| 氟 | 在萤石、冰晶石、氟磷灰石等矿物出现(地壳质量分数:0.065%) |
| 氯 | 火成岩、沉积岩、海水、盐湖(地壳质量分数:0.031%;海水含量每升20克) |
| 溴 | 岩石、海水、矿井水(地壳质量分数:0.00016%;海水含量每升0.065克) |
| 碘 | 海水(含量5×10⁻⁸%)、智利硝石(含量0.02%~1%) |
| 砹 | 在某些含放射物质的地方,由其他放射性核素衰变生成(含量:少于1克)[8] |
| 鿬 | 以粒子加速器人工合成(含量:0克) |
性质
[编辑]物理
[编辑]|
名称 |
主化合价 |
单质沸点,℃ | |||||
|---|---|---|---|---|---|---|---|
| 氟 | F | 0.071 | -1 | 气体 | 0.0017 | -219.62 | -188.12 |
| 氯 | Cl | 0.099 | -1,+1,+2,+3,+4,+5,+6,+7 | 气体 | 0.0032 | -101.5 | -34.04 |
| 溴 | Br | 0.114 | -1,+1,+3,+4,+5,+7 | 液体 | 3.1028 | -7.3 | 58.8 |
| 碘 | I | 0.133 | -1,+1,+3,+5,+7 | 固体 | 4.933 | 113.7 | 184.3 |
| 砹 | At | 0.150 | -1,+1,+3,+5,+7 | 固体 | 6.2-6.5(推测)[9] | 302 | 337? |
| 鿬 | Ts | 0.156-0.157(推算)[10] | -1,+1,+3,+5(推测)[1] | 固体(推测)[1][10] | 7.1-7.3(推测)[10] | 350-550(推测)[11] | 610(推测)[11] |
化学
[编辑]通常来说,液态卤素分子的沸点均高于对应的烃链,主要是卤素分子比烷链更电极化,而分子电极化增强分子间的连接力(正电极与负电极的相互吸引),我们需要对液体提供更多能量才能使其蒸发。
卤素单质都是双原子分子,亦很易挥发。卤素的电子构型均为ns² np⁵,它们获取一粒电子以达到稳定结构的趋势极强烈,化学性质很活泼,在自然状态不能以单质存在,一般以-1价即卤离子(X⁻)形式在溶液及矿物出现。
| Z | 元素 | 核电外子构型 | 电子排布[注解 1] |
|---|---|---|---|
| 9 | 氟 | 2,7 | [He] 2s² 2p⁵ |
| 17 | 氯 | 2,8,7 | [Ne] 3s² 3p⁵ |
| 35 | 溴 | 2,8,18,7 | [Ar] 3d¹⁰ 4s² 4p⁵ |
| 53 | 碘 | 2,8,18,18,7 | [Kr] 4d¹⁰ 5s² 5p⁵ |
| 85 | 砹 | 2,8,18,32,18,7 | [Xe] 4f¹⁴ 5d¹⁰ 6s² 6p⁵ |
| 117 | 鿬 | 2,8,18,32,32,18,7(预测) | [Rn] 5f¹⁴ 6d¹⁰ 7s² 7p⁵(预测)[1] |
| 卤素 | 分子 | 结构 | 模型 | d(X−X),pm (气态) |
d(X−X),pm (固态) |
|---|---|---|---|---|---|
| 氟 | F₂ | 143 | 149 | ||
| 氯 | Cl₂ | 199 | 198 | ||
| 溴 | Br₂ |  |
228 | 227 | |
| 碘 | I₂ |  |
266 | 272 |
无机反应
[编辑]氧化
[编辑]卤素单质都是氧化剂,氧化力从氟到鿬依次降低。碘单质氧化力较弱,三价铁离子可以把碘离子氧化为碘。卤素能与部分金属、非金属单质直接化合。卤素与水也能氧化还原:
- 2X₂+2H₂O → 4H⁺+4X⁻+O₂
氟与水反应剧烈,氯受光照与水缓慢反应,碘不反应。
歧化反应
[编辑]卤素单质在碱中易歧化:
- X₂+2OH⁻(冷)→ X⁻+XO⁻+H₂O
- 3X₂+6OH⁻(热)→ 5X⁻+XO₃⁻+3H₂O
但在酸中很易逆反应:
- 5X⁻+XO₃⁻+6H⁺ → 3X₂+3H₂O
这反应是制取溴和碘单质流程的最后一步。
氢化物
[编辑]卤素的氢化物叫卤化氢,为共价化合物;其溶液叫氢卤酸,它们在水中都以离子形式存在,且都是酸。一般而言氢氟酸(pKa=3.20)是弱酸。氢氯酸(即盐酸)、氢溴酸、氢碘酸都是典型的强酸,酸度从HCl到HI依次增强,它们的pKa均为负数。至于氢砹酸则为氢卤酸中最强的酸,但它极易分解为氢与砹单质。[12]
氧化物
[编辑]卤素的氧化物都是酸酐。二氧化氯(ClO₂)等偶氧化态氧化物是混酐。
| 卤素 | X₂O | X₂O₂ | X₂O₃ | XO₂ | X₂O₅ | X₂O₆ | X₂O₇ |
|---|---|---|---|---|---|---|---|
| 氟 | OF₂ | O₂F₂ | |||||
| 氯 | Cl₂O | ClO | Cl₂O₃ | ClO₂ | Cl₂O₅ | Cl₂O₆ | Cl₂O₇ |
| 溴 | Br₂O | Br₂O₃ | BrO₂ | Br₂O₅ | |||
| 碘 | I₂O₅ |
含氧酸
[编辑]卤素(除了氟,氟只有-1价)可显示多种价态,正价态一般都出现在其含氧酸根。
以氯为例:
卤素含氧酸多数只在溶液中,少数盐以固态存在,如碘酸盐和高碘酸盐。HXO(X为Cl、Br、I)、HIO₃和HXO₄(X为Cl、Br、I)分子在气相十分稳定,可用质谱和其他方法研究。卤素含氧酸见下表[13]290-291。
| 氟的含氧酸 | 氯的含氧酸 | 溴的含氧酸 | 碘的含氧酸 | |
|---|---|---|---|---|
| HXO(次卤酸) | HFO | HClO | HBrO | HIO |
| HXO₂(亚卤酸) | HClO₂ | HBrO₂ | HIO₂ | |
| HXO₃(卤酸) | HClO₃ | HBrO₃ | HIO₃ | |
| HXO₄(高卤酸) | HClO₄ | HBrO₄ | HIO₄ | |
| 其他 | H₇I₅O₁₄ | |||
| 其他 | H₅IO₆ |
互卤化物
[编辑]只由两种卤素形成的化合物叫互卤化物,较电正的元素呈正氧化态,氧化态为奇数。卤素的价电子数是奇数,周围与奇数粒其它卤原子成键比较稳定(如IF₇)。互卤化物都能水解。
| 卤素 | 氟 | 氯 | 溴 | 碘 | 砹 |
|---|---|---|---|---|---|
| 氟 | |||||
| 氯 | |||||
| 溴 | |||||
| 碘 | |||||
| 砹 |
其他无机化学性质
[编辑]| F₂ | Cl₂ | Br₂ | I₂ | |
|---|---|---|---|---|
| 和铁反应 | FeF₃ | FeCl₃ | FeBr₃ | FeI₂(碘的氧化力较弱) |
| 和氢氧化钠反应 | NaF+OF₂ | NaCl+NaClO 加热反应则生成NaCl+NaClO₃ |
NaBr+NaBrO 加热反应则生成NaBr+NaBrO₃ |
NaI+NaIO₃ |
| 和硫反应 | SF₆ 也会产生SF₄ |
S₂Cl₂ 在催化剂的作用下产生SCl₂ 低温下和低价硫的氯化物作用产生SCl₄ |
S₂Br₂ | 不反应 |
有机反应
[编辑]在有机化学,卤族元素经常作为决定有机化合物化学性质的官能团存在,常用X表示,如R-X是含卤原子的烃类。
卤素的物理特性和化学特性明显区分于与它对应的烃链的主要原因,在于卤素原子(如F、Cl、Br、I)与碳原子的连接,即碳-卤的连接,明显不同于烃链碳-氢连接。
- 卤原子通常较电负,碳-卤连接比碳-氢连接更加电极化,但仍然是共价键。
- 卤原子体积和质量通常较碳原子大,碳-卤连接的偶极子矩(Dipole Moment)和连接能量(Bonding Energy)远大于碳-氢,碳-卤的连接力(Bonding strength)远小于碳-氢连接。
- 卤原子脆弱的p轨道(Orbital)与碳原子稳定的sp³轨道相连接,碳-卤连接不甚稳定。
卤素最常见的有机化学反应为亲核取代反应(nucleophilic substitution),通常的化学式如:
Nu:⁻+R-X → R-Nu+X⁻
“Nu:⁻”在这里代表亲核负离子,离子越亲核,产率和化学反应速度越可观。
“X”在这里代表卤素原子,如F、Cl、Br、I,若X⁻所对应的酸(即HX)为强酸,那么产率和反应的速度将非常可观,如果若X⁻所对应的酸为弱酸,则产率和反应的速度均会下降。
合成有机卤化物
[编辑]加成反应可在未饱和烃链加入卤素,此为最简单的方式,如:
CH₃-CH₂-CH=CH₂+HBr → CH₃-CH₂-CHBr−CH₃
不经催化,产率也可达90%以上。
Karasch方式
[编辑]如想将溴加在烃链第一粒碳原子,可用Karasch方式:
CH₃-CH₂-CH=CH₂+HBr → CH₃-CH₂-CH₂-CH₂-Br+H₂O
以双氧水催化,产率90%以上。
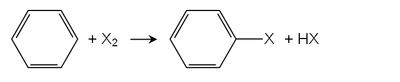
由苯合成卤化物则必须有催化剂,如:
催化剂:三卤化铝或三卤化铁(X为对应卤素)
产率较高。
由醇合成卤化物,必须用好的亲核试剂,强酸作为催化剂以提高产率和速度:CH₃-CH₂-CH₂-CH₂-OH+Br⁻ ⇌ CH₃-CH₂-CH₂-CH₂-Br+H₂O
催化剂:H⁺
生产
[编辑]
含氟矿物萤石年开采约六百万公吨。氢氟酸年产约40万吨。由在磷酸生产中作为副产物产生的氢氟酸可制得氟气。氟气年产约15000公吨。[2]
石盐是最常用于开采氯的矿物,但光卤石和钾石盐等矿物也可用于开采氯。每年还有约四千万吨的氯气以电解卤盐水的方法产生。[2]
溴年产约45万吨,一半来自美国,35%来自以色列,其余多来自中国。溴过去是在自然卤盐水添加硫酸和漂白粉生产;现代以赫伯特·亨利·道发明的电解法生产。溴也可由氯气通入海水,然后将空气通入海水生产。[2]
2003年全球碘产量约2.2万公吨,智利生产四成、日本生产三成,另外少量由俄罗斯和美国生产:248。碘以前从海带提取出来,直到1950年代,现代以其他方式生产。产生碘的一种方法是将二氧化硫与硝酸盐矿石混合,其中含有一些碘酸盐。碘也可以从天然气田中提取。[2]
砹在铀矿天然出现,但仅作为次要衰变产物痕量生成,且生成后会快速衰变,通常要在粒子加速器以α粒子轰击铋原子合成。[2]
用途
[编辑]氟最大的用途是在核燃料循环生产六氟化铀,每年消耗近7000吨。首先二氧化铀与氢氟酸反应生成四氟化铀,然后以氟气氟化四氟化铀生成六氟化铀[14],可通过气体扩散法或者气体离心法浓缩铀[15][16]。每年大约有6000吨氟用于生产惰性电介质六氟化硫,该物质可以用于高压变压器与断路器,这样就不必在充油设备中使用危险的多氯联苯了[17]。电子产品中会使用一些氟化合物:在化学气相沉积中会使用六氟化钨或六氟化铼,在等离子蚀刻中会使用聚四氟乙烯[18][19][20][16]。此外氟也可用于牙齿护理、制药及在血液中携带氧气等。
氯可作为较便宜的消毒剂,一般的自来水及游泳池就常用它消毒,但氯气颇难溶、甚毒、会放出特殊气味,且易生成有致癌风险的三卤甲烷等有机氯化合物,中、美等国常改用二氧化氯(ClO₂)、氯胺或臭氧等代替氯气作为水的消毒剂。除了用于消毒,氯气也是一种重要的化工原料,用于制造盐酸和漂白粉、制造氯代烃。也可以用于制造多种农药、制造氯仿等有机溶剂。此外氯气还广泛用于造纸、纺织、有机合成、金属冶炼等行业,也有作为化学武器的纪录。
许多种的有机溴化物在工业上有其应用,其中一部分是由溴制备而来,另一部分则是由溴化氢制备而来。溴化合物在工业可用于阻燃剂、汽油添加剂、钻井液和化工原料等,用途十分广泛。
碘化物的主要用途包括做为催化剂、动物食物添加品、稳定剂、染剂、着色剂、颜料、药品、清洁卫生(碘酒)、照片与卤素灯泡等;其他小众用途为除雾、种云,和在分析化学中的多种用途。此外其放射同位素碘131可用于医学造影及放射治疗。
砹的同位素皆非常不稳定,但砹-211用于核医学。[21]刚制成的砹-211须马上用,不然其总量在7.2小时之后就会减半。砹-211会释放α粒子,或经电子捕获衰变成释放α粒子的钋-211,可用于α粒子靶向治疗。[21]
鿬只能用粒子加速器人工合成,极难制备,单次造出的量极少(至多几颗原子),生成后又会很快衰变,故没有任何商业用途,仅用于学术研究。
生物学作用及防护
[编辑]氟并非人类或者其它哺乳动物必须的元素。有人认为少量的氟可能对增加骨强度有益,但该理论尚未确立。日常环境有很多微量氟的来源,只有人工饮食能使人缺氟[22][23]。至于吸入大量氟气对人体来说是剧毒,会刺激眼、皮肤、呼吸道粘膜。
和氟相似,大量氯气对人体来说也是剧毒,可损害人体全身器官及神经系统,但氯离子是人体必需的矿物质,在人体中为代谢作用很重要的物质,胃中生成盐酸和细胞泵的功能皆需要氯,饮食中主要的来源是餐桌上的氯化钠,血液中过低或高浓度的氯为电解质失调的实例,在没有其他异常的情况下很少发生低氯血症。
溴在人体中还未找到已知功能,但有机溴化合物的确自然存在。海中的有机物是有机溴化合物的主要来源,例如海藻和骨螺等。溴会腐蚀及毒害人体,刺激皮肤及呼吸道粘膜等,且伤害神经系统及肠胃道等。
碘是人体必需的矿物质,用以制造甲状腺素以调控细胞代谢、神经性肌肉组织发展与成长(特别是在出生胎儿的脑部)[24]。缺碘症[25][26]是造成可避免性脑损害疾病最常见的因素,全世界估计有五千万人深受影响。
砹和鿬没有生物学功能。虽然依元素周期律,卤素越往下越低毒,砹和鿬会比氟、氯、溴、碘低毒,但其极强放射可能引发辐射中毒,砹和鿬极可能有毒,但只会出现在受管制的辐射区域,绝大多数人不可能摄入砹和鿬(除非是在核电厂附近,某些铀同位素衰变会产生砹)。
注解
[编辑]参考文献
[编辑]- ^ 1.0 1.1 1.2 1.3 Haire, Richard G. Transactinides and the future elements. Morss; Edelstein, Norman M.; Fuger, Jean (编). The Chemistry of the Actinide and Transactinide Elements 3rd. Dordrecht, The Netherlands: Springer Science+Business Media. 2006: 1724, 1728. ISBN 1-4020-3555-1.
- ^ 2.00 2.01 2.02 2.03 2.04 2.05 2.06 2.07 2.08 2.09 2.10 Emsley, John. Nature's Building Blocks. 2011. ISBN 978-0199605637.
- ^ Schweigger, J.S.C. Nachschreiben des Herausgebers, die neue Nomenclatur betreffend [Postscript of the editor concerning the new nomenclature]. Journal für Chemie und Physik. 1811, 3 (2): 249–255 [2020-11-01]. (原始内容存档于2020-04-23) (德语). On p. 251, Schweigger proposed the word "halogen": "Man sage dafür lieber mit richter Wortbildung Halogen (da schon in der Mineralogie durch Werner's Halit-Geschlecht dieses Wort nicht fremd ist) von αλς Salz und dem alten γενειν (dorisch γενεν) zeugen." (One should say instead, with proper morphology, "halogen" (this word is not strange since [it's] already in mineralogy via Werner's "halite" species) from αλς [als] "salt" and the old γενειν [genein] (Doric γενεν) "to beget".)
- ^ In 1826, Berzelius coined the terms Saltbildare (salt-formers) and Corpora Halogenia (salt-making substances) for the elements chlorine, iodine, and fluorine. See: Berzelius, Jacob. Årsberättelser om Framstegen i Physik och Chemie [Annual Report on Progress in Physics and Chemistry] 6. Stockholm, Sweden: P.A. Norstedt & Söner. 1826: 187 [2020-11-01]. (原始内容存档于2020-04-23) (瑞典语). From p. 187: "De förre af dessa, d. ä. de electronegativa, dela sig i tre klasser: 1) den första innehåller kroppar, som förenade med de electropositiva, omedelbart frambringa salter, hvilka jag derför kallar Saltbildare (Corpora Halogenia). Desse utgöras af chlor, iod och fluor *)." (The first of them [i.e., elements], the electronegative [ones], are divided into three classes: 1) The first includes substances which, [when] united with electropositive [elements], immediately produce salts, and which I therefore name "salt-formers" (salt-producing substances). These are chlorine, iodine, and fluorine *).)
- ^ The word "halogen" appeared in English as early as 1832 (or earlier). See, for example: Berzelius, J.J. with A.D. Bache, trans., (1832) "An essay on chemical nomenclature, prefixed to the treatise on chemistry," (页面存档备份,存于互联网档案馆) The American Journal of Science and Arts, 22: 248–276 ; see, for example p. 263. (页面存档备份,存于互联网档案馆)
- ^ Elements 113, 115, 117, and 118 are now formally named nihonium (Nh), moscovium (Mc), tennessine (Ts), and oganesson (Og). IUPAC. 2016-11-30 [2016-11-30]. (原始内容存档于2018-07-29).
- ^ 北京师范大学、华中师范大学、南京师范大学无机化学教研室。无机化学(第四版)。北京:高等教育出版社。第454页.
- ^ Hollerman, Arnold. Inorganic Chemistry. Berlin: Academic Press. 2001: 423 [2019-12-21]. ISBN 0123526515. (原始内容存档于2013-12-26).
- ^ Bonchev, Danail; Kamenska, Verginia. Predicting the properties of the 113–120 transactinide elements. The Journal of Physical Chemistry (ACS Publications). 1981, 85 (9): 1177–86 [2019-10-10]. doi:10.1021/j150609a021. (原始内容存档于2013-12-20).
- ^ 10.0 10.1 10.2 Bonchev, Danail; Kamenska, Verginia. Predicting the Properties of the 113–120 Transactinide Elements. J. Phys. Chem. 1981, 85: 1177–1186.
- ^ 11.0 11.1 How Much Do You Know About the Element Tennessine?. www.thoughtco.com. [November 12, 2021]. (原始内容存档于2023-07-09).
- ^ Fairbrother, Peter, "Re: Is hydroastitic acid possible?" (页面存档备份,存于互联网档案馆), accessed July 3, 2009.
- ^ 《无机化学》丛书。第六卷.2.6.4卤素含氧酸及其盐.P
- ^ Jaccaud et al. 2000,第392页.
- ^ Jaccaud et al. 2000,第382页.
- ^ 16.0 16.1 Villalba, Ayres & Schroder 2008.
- ^ Aigueperse et al. 2000,第430页.
- ^ Jaccaud et al. 2000,第391–392页.
- ^ El-Kareh 1994,第317页.
- ^ Arana et al. 2007.
- ^ 21.0 21.1 Vértes, Attila; Nagy, Sándor; Klencsár, Zoltán. Handbook of Nuclear Chemistry 4. Springer. 2003: 337 [2019-11-09]. ISBN 978-1-4020-1316-4. (原始内容存档于2014-01-08).
- ^ Nielsen 2009.
- ^ Olivares & Uauy 2004.
- ^ Gropper SS, Groff JL, et al.(2005)Advanced Nutrition and Human Metabolism, 4th ed., pp. 468-473. Wardswirth, ISBN 978-0-534-55986-1
- ^ iodine deficiency disorder. [2018-11-12]. (原始内容存档于2012-10-18).
- ^ [1](页面存档备份,存于互联网档案馆)
参见
[编辑]| 左方一族: | 卤素 第17族(ⅦA) |
右方一族: |
| 氧族元素 | 稀有气体 |