胺基酸
此條目可參照英語維基百科相應條目來擴充,此條目在對應語言版為高品質條目。 (2024年6月22日) |
此條目需要補充更多來源。 (2020年4月6日) |

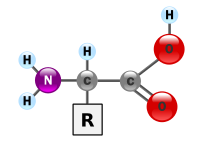



胺基酸(英語:amino acid)是生物學上重要的有機化合物,由胺基(-NH2)和羧基(-COOH)的官能團,以及連到每一個胺基酸的側鏈組成。胺基酸是構成蛋白質的基本單位,賦予蛋白質特定的分子結構形態,使其分子具有生化活性(biochemical activity)。蛋白質是生物體重要的生物活性分子(bioactive molecule),包括催化新陳代謝的酶(又稱「酵素」)。
在人工合成胺基酸成功以前,胺基酸主要來源於蛋白質水解,而天然蛋白質水解所得的胺基酸大多為α-胺基酸,所以在生化領域「胺基酸」默認指α-胺基酸。至於β、γ、δ……ω等的胺基酸在生化研究中用途較少,大都用於有機合成、石油化工、醫療等方面。
不同的胺基酸脫水縮合形成肽(peptide),其縮合產生的醯胺鍵稱肽鍵。肽雖然和蛋白質在化學本質上除了聚合的長度外沒什麼不同,但是往往不像蛋白質有多級構造與特異功能。
歷史
[編輯]1800年代初期,人們就發現了幾種胺基酸[1][2]。1806年,法國化學家發現了天門冬醯胺,這是第一種被發現的胺基酸。1810年,胱胺酸被發現。1820年,甘胺酸和白胺酸被發現。1935年,蘇胺酸被發現[3][4]。
基本結構
[編輯]在化學中,胺基酸指的是結構中含有胺基(-NH2 )和羧基(-COOH)的有機化合物。根據胺基連結在羧酸中碳原子的位置,可分為α、β、γ、δ……等等的胺基酸:α胺基酸的胺基和羧基連在同一個碳原子上,β胺基酸的胺基和羧基連在相鄰的碳原子上,以此類推。 在生物學中,胺基酸通常特指α胺基酸,即胺基和羧基直接連接在同一個-CH-結構上的胺基酸,其通式是H2NCHRCOOH(R代表某種有機取代基)。
蛋白質經水解後,即生成20種胺基酸,如甘胺酸(Glycine)、丙胺酸(Alanine)、纈胺酸(Valine)、亮胺酸(Leucine)、異亮胺酸(Isoleucine)、苯丙胺酸(Phenylalanine)、色胺酸(Tryptophan)、酪胺酸(Tyrosine)、天門冬胺酸(Aspartate)、組織胺酸(Histidine)、天門冬醯胺(Asparagine)、麩胺酸(Glutamate)、賴胺酸(Lysine)、谷胺醯胺(Glutamine)、甲硫胺酸(Methionine)、精胺酸(Arginine)、絲胺酸(Serine)、蘇胺酸(Threonine)、半胱胺酸(Cysteine)、脯胺酸(Proline)等等。
分類
[編輯]根據其結合基團不同。可分為脂肪族胺基酸、芳香族胺基酸、雜環胺基酸、無環胺基酸(acyclic)、鹼性胺基酸、含硫胺基酸、含羥基(醇)胺基酸、含碘胺基酸等。
理化特性
[編輯]
- 天然的胺基酸都是無色結晶。熔點約在230℃以上,熔融時分解並放出CO2;都能溶於強酸或強鹼溶液中,除胱胺酸、酪胺酸、二碘甲狀腺素外,均易溶於水;除脯胺酸和羥脯胺酸外,均難溶於乙醇和乙醚。
- 具有兩性。有鹼性[二元胺基一元羧酸,例如賴胺酸(lysine)];酸性[一元胺基二元羧酸,例如穀胺酸(Glutamic acid)];中性[一元胺基一元羧酸,例如丙胺酸(Alanine)]三種類型。大多數胺基酸都呈顯不同程度的酸性或鹼性,呈顯中性的較少。所以既能與酸結合成鹽,也能與鹼結合成鹽。
- 除甘胺酸外,因不對稱碳的關係,胺基酸呈旋光性。特別地,在生物化學上,以甘油醛為基準依分子的絕對構型又分:D型和L型。組成天然蛋白質的胺基酸,都屬L型。
構成天然蛋白質的20種常見胺酸列表
[編輯]| 縮寫 | 縮寫 | 全名 | 中文譯名 | 結構 | 支鏈 | 分子量 | 等電點 | 解離常數 (羧基) |
解離常數 (胺基) |
pKr(R) | 其他 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| A | Ala | Alanine | 丙胺酸 | 
|
疏水性 | 89.09 | 6.11 | 2.35 | 9.87 | ||
| C | Cys | Cysteine | 半胱胺酸 | 
|
親水性 | 121.16 | 5.05 | 1.92 | 10.70 | 8.37 | |
| D | Asp | Aspartate | 天門冬胺酸 | 
|
酸性 | 133.10 | 2.85 | 1.99 | 9.90 | 3.90 | |
| E | Glu | Glutamate | 麩胺酸 | 酸性 | 147.13 | 3.15 | 2.10 | 9.47 | 4.07 | ||
| F | Phe | Phenylalanine | 苯丙胺酸 | 
|
疏水性 | 165.19 | 5.49 | 2.20 | 9.31 | ||
| G | Gly | Glycine | 甘胺酸 | 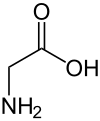
|
疏水性 | 75.07 | 6.06 | 2.35 | 9.78 | 沒有旋光性 | |
| H | His | Histidine | 組胺酸 | 
|
鹼性 | 155.16 | 7.60 | 1.80 | 9.33 | 6.04 | |
| I | Ile | Isoleucine | 異白胺酸 | 
|
疏水性 | 131.17 | 6.05 | 2.32 | 9.76 | ||
| K | Lys | Lysine | 離胺酸 | 鹼性 | 146.19 | 9.60 | 2.16 | 9.06 | 10.54 | ||
| L | Leu | Leucine | 白胺酸 | 
|
疏水性 | 131.17 | 6.01 | 2.33 | 9.74 | ||
| M | Met | Methionine | 甲硫胺酸 | 疏水性 | 149.21 | 5.74 | 2.13 | 9.28 | 蛋白質合成時第一個胺基酸, 可能在轉譯過程被移除 | ||
| N | Asn | Asparagine | 天門冬醯胺 | 
|
親水性 | 132.12 | 5.41 | 2.14 | 8.72 | ||
| P | Pro | Proline | 脯胺酸 | 
|
疏水性 | 115.13 | 6.30 | 1.95 | 10.64 | 會破壞蛋白質α螺旋結構 | |
| Q | Gln | Glutamine | 麩醯胺酸 | 親水性 | 146.15 | 5.65 | 2.17 | 9.13 | |||
| R | Arg | Arginine | 精胺酸 | 鹼性 | 174.20 | 10.76 | 1.82 | 8.99 | 12.48 | ||
| S | Ser | Serine | 絲胺酸 | 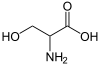
|
親水性 | 105.09 | 5.68 | 2.19 | 9.21 | ||
| T | Thr | Threonine | 蘇胺酸 | 
|
親水性 | 119.12 | 5.60 | 2.09 | 9.10 | ||
| V | Val | Valine | 纈胺酸 | 
|
疏水性 | 117.15 | 6.00 | 2.39 | 9.74 | ||
| W | Trp | Tryptophan | 色胺酸 | 疏水性 | 204.23 | 5.89 | 2.46 | 9.41 | |||
| Y | Tyr | Tyrosine | 酪胺酸 | 親水性 | 181.19 | 5.64 | 2.20 | 9.21 | 10.46 |
標準胺基酸
[編輯]共20種,是組成生命體中的蛋白質的主要單元,第21和第22種胺基酸,硒半胱胺酸和吡咯離胺酸,分別用通常的終止密碼子UGA和UAG編碼,出現在少數蛋白質中。
主要化學性質
[編輯]以下的分子量是根據各元素的同位素在自然界的豐度所做的平均值。此外由於形成肽鍵時,會減少一個水分子,因此蛋白質中單一胺基酸的分子量,比下表數值少了18.01524 Da。
| 胺基酸 | 分子量(Da) | pI | pK1(α-COOH) | pK2(α-+NH3) |
|---|---|---|---|---|
| 丙胺酸 | 89.09404 | 6.01 | 2.35 | 9.87 |
| 半胱胺酸 | 121.15404 | 5.05 | 1.92 | 10.70 |
| 硒半胱胺酸 | 169.06 | |||
| 天冬胺酸 | 133.10384 | 2.85 | 1.99 | 9.90 |
| 谷胺酸 | 147.13074 | 3.15 | 2.10 | 9.47 |
| 苯丙胺酸 | 165.19184 | 5.49 | 2.20 | 9.31 |
| 甘胺酸 | 75.06714 | 6.06 | 2.35 | 9.78 |
| 組胺酸 | 155.15634 | 7.60 | 1.80 | 9.33 |
| 異亮胺酸 | 131.17464 | 6.05 | 2.32 | 9.76 |
| 賴胺酸 | 146.18934 | 9.60 | 2.16 | 9.06 |
| 吡咯離胺酸 | 255.31 | |||
| 亮胺酸 | 131.17464 | 6.01 | 2.33 | 9.74 |
| 甲硫胺酸 | 149.20784 | 5.74 | 2.13 | 9.28 |
| 天冬醯胺 | 132.11904 | 5.41 | 2.14 | 8.72 |
| 脯胺酸 | 115.13194 | 6.30 | 1.95 | 10.64 |
| 谷胺醯胺 | 146.14594 | 5.65 | 2.17 | 9.13 |
| 精胺酸 | 174.20274 | 10.76 | 1.82 | 8.99 |
| 絲胺酸 | 105.09344 | 5.68 | 2.19 | 9.21 |
| 蘇胺酸 | 119.12034 | 5.60 | 2.09 | 9.10 |
| 纈胺酸 | 117.14784 | 6.00 | 2.39 | 9.74 |
| 色胺酸 | 204.22844 | 5.89 | 2.46 | 9.41 |
| 酪胺酸 | 181.19124 | 5.64 | 2.20 | 9.21 |
支鏈性質
[編輯]以下列表中的p𝘒ₐ值,可能與這些胺基酸在蛋白質內部時有所不同。
| 胺基酸 | 支鏈 | 疏水性 | p𝘒ₐ | 極性 | 電荷 | 芳香族 或脂肪族 |
范德瓦爾斯半徑 |
|---|---|---|---|---|---|---|---|
| 丙胺酸 | -CH3 | XXX | - | - | - | - | 67 |
| 半胱胺酸 | -CH2SH | XXX | 8.18 | - | 酸性 | - | 86 |
| 硒半胱胺酸 | -CH2SeH | X | 5.73 | - | - | - | |
| 天冬胺酸 | -CH2COOH | - | 3.90 | X | 酸性 | - | 91 |
| 穀胺酸 | -CH2CH2COOH | - | 4.07 | X | 酸性 | - | 109 |
| 苯丙胺酸 | -CH2C6H5 | X | - | - | - | 芳香性 | 135 |
| 甘胺酸 | -H | X | - | - | - | - | 48 |
| 組胺酸 | -CH2-C3H3N2 | - | 6.04 | X | 弱鹼性 | 芳香性 | 118 |
| 異亮胺酸 | -CH(CH3)CH2CH3 | X | - | - | - | 脂肪性 | 124 |
| 離胺酸 | -(CH2)4NH2 | - | 10.54 | X | 鹼性 | - | 135 |
| 吡咯離胺酸 | -C12H21N3O3 | ||||||
| 亮胺酸 | -CH2CH(CH3)2 | X | - | - | - | 脂肪性 | 124 |
| 甲硫胺酸 | -CH2CH2SCH3 | X | - | - | - | - | 124 |
| 天冬醯胺 | -CH2CONH2 | - | - | X | - | - | 96 |
| 脯胺酸 | -CH2CH2CH2- | X | - | - | - | - | 90 |
| 穀胺醯胺 | -CH2CH2CONH2 | - | - | X | - | - | 114 |
| 精胺酸 | -(CH2)3NH-C(NH)NH2 | - | 12.48 | X | 鹼性 | - | 148 |
| 絲胺酸 | -CH2OH | - | - | X | - | - | 73 |
| 蘇胺酸 | -CH(OH)CH3 | - | - | X | 弱酸性 | - | 93 |
| 纈胺酸 | -CH(CH3)2 | X | - | - | - | 脂肪性 | 105 |
| 色胺酸 | -CH2-C8H6N | X | - | - | - | 芳香性 | 163 |
| 酪胺酸 | -CH2-C6H4OH | X | 10.46 | X | - | 芳香性 | 141 |
基因表現與生物化學
[編輯]| 胺基酸 | 短寫 | 縮寫 | 密碼子 | 在蛋白質中 出現頻率(%) |
對人類的必需性 |
|---|---|---|---|---|---|
| 丙胺酸 | A | Ala | GCU, GCC, GCA, GCG | 7.8 | - |
| 半胱胺酸 | C | Cys | UGU, UGC | 1.9 | - |
| 硒半胱胺酸 | U | Sec | UGA | - | |
| 天冬胺酸 | D | Asp | GAU, GAC | 5.3 | - |
| 穀胺酸 | E | Glu | GAA, GAG | 6.3 | - |
| 苯丙胺酸 | F | Phe | UUU, UUC | 3.9 | X |
| 甘胺酸 | G | Gly | GGU, GGC, GGA, GGG | 7.2 | - |
| 組胺酸 | H | His | CAU, CAC | 2.3 | - |
| 異亮胺酸 | I | Ile | AUU, AUC, AUA | 5.3 | X |
| 離胺酸 | K | Lys | AAA, AAG | 5.9 | X |
| 吡咯離胺酸 | O | Pyl | UAG | ||
| 亮胺酸 | L | Leu | UUA, UUG, CUU, CUC, CUA, CUG | 9.1 | X |
| 甲硫胺酸 | M | Met | AUG | 2.3 | X |
| 天冬醯胺 | N | Asn | AAU, AAC | 4.3 | - |
| 脯胺酸 | P | Pro | CCU, CCC, CCA, CCG | 5.2 | - |
| 谷胺醯胺 | Q | Gln | CAA, CAG | 4.2 | - |
| 精胺酸 | R | Arg | CGU, CGC, CGA, CGG, AGA, AGG | 5.1 | - |
| 絲胺酸 | S | Ser | UCU, UCC, UCA, UCG, AGU, AGC | 6.8 | - |
| 蘇胺酸 | T | Thr | ACU, ACC, ACA, ACG | 5.9 | X |
| 纈胺酸 | V | Val | GUU, GUC, GUA, GUG | 6.6 | X |
| 色胺酸 | W | Trp | UGG | 1.4 | X |
| 酪胺酸 | Y | Tyr | UAU, UAC | 3.2 | - |
| 終止編碼 | - | Term | UAA, UAG, UGA | - | - |
必需胺基酸
[編輯]人體能消化吸收以及利用的胺基酸只有20種。其中有8種胺基酸(嬰兒為9種)是成人體內不能合成或合成速度不能滿足機體的需要,必須從膳食補充的胺基酸稱為必需胺基酸(EAA),即亮胺酸、異亮胺酸、纈胺酸、甲硫胺酸、苯丙胺酸、色胺酸、蘇胺酸、賴胺酸,組胺酸為小兒生長發育期間的必需胺基酸,胱胺酸、酪胺酸、牛磺酸為早產兒所必需。其他14種非必需胺基酸可以用葡萄糖或是別的礦物質來源製造。
肉類中的蛋白質是完全蛋白質,可以提供人體所需的全部胺基酸種類,瘦豬肉的蛋白質含量約為10%至17%,肥豬肉則只有2.2%;瘦牛肉為20%左右,肥牛肉為15.1%;瘦羊肉17.3%,肥羊肉9.3%;兔肉21.2%;雞肉23.3%;鴨肉16.5%;鵝肉10.8%。肉類的蛋白質經過烹調,有一部分會散在肉湯中,也有一部分水解成胺基酸,溶於肉湯裡,故烹調好的肉湯味道鮮美而富於營養。
胺基酸的分解代謝
[編輯]在人體中胺基酸中的氮元素以尿素循環的方式變成尿素隨尿液或汗液排出體外,而在其他動物中可以銨根、尿素或尿酸形式排除體外,或以醯胺的形式儲存。某些胺基酸可以通過特殊代謝途徑轉變成其他含氮物質如嘌呤、嘧啶、紫質、某些激素、色素、生物鹼等。胺基酸的分解代謝主要在肝臟中進行。主要方式有氧化去胺基、聯合去胺基等,以聯合去胺基為主。聯合去胺基的作用機理是在相應轉胺酶作用下生成麩胺酸,再由麩胺酸去氫酶催化氧化。α-胺基酸去胺生成的α-酮酸可以再合成胺基酸或轉變為醣類和脂質,亦可經轉化後進入三羧酸循環氧化供能。能轉變為糖的稱生糖胺基酸;能轉變為酮體的稱生酮胺基酸;兩者兼可的稱生糖生酮胺基酸。標準胺基酸中,白胺酸和離胺酸為生酮胺基酸,色胺酸、異白胺酸、蘇胺酸、苯丙胺酸、酪胺酸為生糖生酮胺基酸,其餘為生糖胺基酸。
次要編碼胺基酸
[編輯]通常的中止密碼子UGA(硒半胱胺酸)和UAG(吡咯離胺酸)編碼的胺基酸,出現在少數蛋白質中。
| 縮寫 | 縮寫 | 全名 | 中文譯名 | 結構 | 支鏈 | 分子量 | 等電點 | 解離常數 (羧基) |
解離常數 (胺基) |
pKr(R) | 其他 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| U | Sec | Selenocysteine | 硒半胱胺酸 | 
|
親水性 | ||||||
| O | Pyl | Pyrrolysine | 吡咯離胺酸 | 鹼性 |
其它胺基酸
[編輯]參考文獻
[編輯]引用
[編輯]- ^ Vickery HB, Schmidt CL. The history of the discovery of the amino acids. Chem. Rev. 1931, 9 (2): 169–318. doi:10.1021/cr60033a001.
- ^ Hansen S. Die Entdeckung der proteinogenen Aminosäuren von 1805 in Paris bis 1935 in Illinois (PDF). Berlin. May 2015. (原始內容 (PDF)存檔於1 December 2017) (德語).
- ^ Simoni RD, Hill RL, Vaughan M. The discovery of the amino acid threonine: the work of William C. Rose [classical article]. The Journal of Biological Chemistry. September 2002, 277 (37): E25 [4 July 2015]. PMID 12218068. doi:10.1016/S0021-9258(20)74369-3
 . (原始內容存檔於10 June 2019).
. (原始內容存檔於10 June 2019).
- ^ McCoy RH, Meyer CE, Rose WC. Feeding Experiments with Mixtures of Highly Purified Amino Acids. VIII. Isolation and Identification of a New Essential Amino Acid. Journal of Biological Chemistry. 1935, 112: 283–302. doi:10.1016/S0021-9258(18)74986-7
 .
.
來源
[編輯]- 人民教育出版社 普通高中課程標準實驗教科書
延伸閱讀
[編輯]- Tymoczko, John L. Protein Composition and Structure. Biochemistry. New York: W. H. Freeman and company. 2012: 28–31. ISBN 9781429229364.
- Doolittle RF. Redundancies in protein sequences. Fasman GD (編). Predictions of Protein Structure and the Principles of Protein Conformation. New York: Plenum Press. 1989: 599–623. ISBN 978-0-306-43131-9. LCCN 89008555.
- Nelson, David L.; Cox, Michael M. Lehninger Principles of Biochemistry 3rd. Worth Publishers. 2000. ISBN 978-1-57259-153-0. LCCN 99049137.
- Meierhenrich, Uwe. Amino acids and the asymmetry of life (PDF). Berlin: Springer Verlag. 2008. ISBN 978-3-540-76885-2. LCCN 2008930865. (原始內容 (PDF)存檔於12 January 2012).
參閱
[編輯]外部連結
[編輯]
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||

