金属蛋白

金属蛋白(英語:Metalloprotein)是一类含有配位结合的金属离子作为辅因子的蛋白质[1][2]。所有蛋白质中有大量是属于这一类。例如,尽管可能有多达3000种人类的锌金属蛋白质[3] ,但至少有1000种人类蛋白质(总数约20,000种)含有锌结合的蛋白质结构域[4] 。
丰度
[编辑]据估计,所有蛋白质中有大约一半含有金属[5]。据另一个估计,大约四分之一到三分之一的所有蛋白质被提议要求有金属执行其功能[6]。因此,金属蛋白在细胞中具有许多种不同的功能,例如蛋白质的储存和运输,酶和信号转导蛋白。金属离子在感染性疾病中的作用已经被审查[7]。金属结合蛋白的丰度可能是蛋白质使用的氨基酸所固有的,因为即使没有进化史的人工蛋白质也很容易结合金属[8]。
人体中的大多数金属都与蛋白质结合。 例如,人体中铁的相对较高浓度主要归因于血红蛋白中的铁。
| 肝脏 | 肾脏 | 肺脏 | 心脏 | 大脑 | 肌肉 | |
|---|---|---|---|---|---|---|
| Mn (锰) | 138 | 79 | 29 | 27 | 22 | <4-40 |
| Fe (铁) | 16,769 | 7,168 | 24,967 | 5530 | 4100 | 3,500 |
| Co (钴) | <2-13 | <2 | <2-8 | --- | <2 | 150 (?) |
| Ni (镍) | <5 | <5-12 | <5 | <5 | <5 | <15 |
| Cu (铜) | 882 | 379 | 220 | 350 | 401 | 85-305 |
| Zn (锌) | 5,543 | 5,018 | 1,470 | 2,772 | 915 | 4,688 |
配位化学原理
[编辑]金属蛋白中的金属离子一般是与多肽链上氨基酸残基中的氮、氧或硫原子或与蛋白质相结合的大环配体相配位。由于金属离子的特殊氧化还原性质,金属酶常用作催化生氧化还原反应的催化剂。
除了由氨基酸残基提供的供体基团外,许多有机辅因子还起配体的作用。 也许最著名的是并入血基質蛋白中的四齿N4大环配体。 无机配体如硫化物和氧化物也是常见的。
存储与运输相关的金属蛋白
[编辑]氧载体
[编辑]作为人类主要氧载体的血红蛋白具有四个亚基,其中铁(II)离子由平面大环配体原卟啉IX(PIX)和组氨酸残基的咪唑氮原子配位。第六配位位点含有一个水分子或二氧分子。 相比之下,在肌肉细胞中发现的蛋白质肌红蛋白只有一个这样的单位。活性位点位于疏水口袋中。这是重要的,因为没有它,铁(II)将不可逆地氧化成铁(III)。用于形成HbO2的平衡常数使得取决于肺中或肌肉中的氧气体分压而吸收或释放氧。在血红蛋白中,四个亚基显示协同效应,其允许容易的氧从血红蛋白转移到肌红蛋白[10]。
在血红蛋白和肌红蛋白中,有时都会错误地指出含氧物质含有铁(III)。 现在已知这些物质的抗磁性是因为铁(II)原子处于低自旋状态。 在氧合血红蛋白中,铁原子位于卟啉环的平面内,而在顺磁性脱氧血红蛋白中,铁原子位于环的平面上方[10]。 自旋态的这种变化是协同效应,这是由于氧合血红蛋白部分中较高的晶体场分裂和较小的Fe2+离子的原子半径。
蚯蚓血红蛋白(Hemerythrin)是另一种含铁的氧载体。氧结合位点是双核铁中心。
细胞色素
[编辑]氧化和还原反应在有机化学中不常见,因为很少有机分子可以充当氧化剂或还原剂。另一方面,铁(II)可以容易地被氧化成铁(III)。这种功能用于细胞色素,其作为電子轉移载体。 金属离子的存在允许金属酶进行诸如氧化还原反应的功能,其不容易通过在氨基酸中发现的有限组的官能团来进行[11]。大多数细胞色素中的铁原子包含在血红素基团中。 这些细胞色素之间的差异在于不同的侧链。 例如,细胞色素a具有血红素A辅基,细胞色素b具有血红素B辅基。这些差异导致不同的Fe 2+ / Fe 3+还原电位,使得各种细胞色素参与线粒体电子传递链[12]。
细胞色素P450酶执行将氧原子插入C-H键的功能,一个氧化反应[13][14]。
红氧还蛋白
[编辑]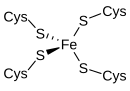
红氧还蛋白是在硫代谢细菌和古菌中发现的电子载体。活性位点包含一个铁离子,该铁离子由四个半胱氨酸残基的硫原子配位,形成几乎规则的四面体。 红氧还蛋白执行单电子转移过程。 铁原子的氧化状态在+2和+3状态之间变化。 在两种氧化态下,金属都是高自旋的,这有助于最小化结构变化。
質體藍素
[编辑]
質體藍素是参与电子转移反应的蓝铜蛋白家族之一。 铜结合位点被描述为扭曲的三角锥体。[15]
金属离子储存与转运
[编辑]铁离子
[编辑]铁以铁(III)的形式存储在铁蛋白中。 结合位点的确切性质尚未确定。 铁似乎以水解产物的形式存在,例如FeO(OH)。 铁由转铁蛋白运输,转铁蛋白的结合位点由两种酪氨酸,一种天冬氨酸和一种组氨酸组成[16] 。
铜离子
[编辑]钙离子
[编辑]骨桥蛋白参与骨骼和牙齿的细胞外基质的矿化。
金属酶
[编辑]金属酶均具有一个共同的特征,即金属离子通过一个不稳定的配合位点与蛋白质结合。 与所有酶一样,活性位点的形状是至关重要的。 金属离子通常被定位于形状适合基底的口袋中。 金属离子催化在有机化学中难以实现的反应。
碳酸酐酶
[编辑]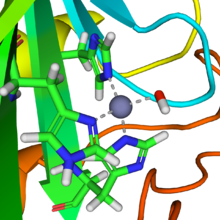
- CO2 + H2O ⇌ H2CO3
在没有催化剂的情况下该反应非常慢,但是在氢氧根离子的存在下该反应非常快
- CO2 + OH− ⇌ HCO−
3
碳酸酐酶几乎可以立即进行类似的反应。碳酸酐酶中活性位点的结构从许多晶体结构中是众所周知的。它由由三个组氨酸单元的三个咪唑氮原子配位的锌离子组成。 第四配位位点被水分子占据。 锌离子的配位球近似为四面体。带正电的锌离子使配位的水分子极化,并且带负电的氢氧化物部分对二氧化碳(碳酸酐)的亲核攻击迅速进行。催化循环产生碳酸氢根离子和氢离子[2]作为化学平衡
- H2CO3 ⇌ HCO−
3 + H+
维生素B12依赖酶
[编辑]含钴的维生素B12(也称为钴胺素)催化两个分子之间的甲基(−CH3) 基团转移,这涉及到C-C键的断裂,该过程在有机反应中在能量上昂贵。 金属离子通过形成瞬态Co−CH3键降低了该过程的活化能[18]。辅酶的结构被多萝西·霍奇金(Dorothy Hodgkin)和同事确定了,为此她获得了诺贝尔化学奖[19]。它由与咕啉环的四个氮原子和咪唑基团的第五个氮原子配位的钴(II)离子组成。 在静止状态下,有一个带有腺苷 5'碳原子的Co-C σ键[20]。这是一种天然存在的有机金属化合物,解释了其在反甲基化反应(例如蛋氨酸合酶进行的反应)中的功能。
固氮酶
[编辑]固定大气中的氮是一个非常耗能的过程,因为它涉及破坏氮原子之间非常稳定的三键。 固氮酶是可催化该过程的少数酶之一。该酶存在于根瘤菌细菌中。 其作用包括三个组成部分:活性位点上的钼原子,参与运输还原氮所需的电子的铁硫簇,以及以镁ATP形式存在的丰富能源。这最后组成部分是由细菌与宿主植物(通常是豆科植物)之间的共生关系提供的。 这种关系是共生的,因为植物通过光合作用提供能量,并通过获得固定氮而受益。该反应可以象征性地写为
其中的Pi代表无机磷酸盐。活性位点的确切结构很难确定。
超氧化物歧化酶
[编辑]
叶绿素结合蛋白
[编辑]叶绿素在光合作用中起着至关重要的作用。 它包含封闭在二氢卟吩环中的镁。 但是,镁离子并不直接参与光合作用,而是可以被其他二价离子所取代,而活性几乎没有损失。 相反,光子被二氢卟吩环吸收,其电子结构非常适合于此目的。
氢化酶
[编辑]
核酶、脱氧核酶
[编辑]自从1980年代初期托马斯·切赫(Thomas Cech)和西德尼·奥尔特曼(Sidney Altman)发现核酶以来,核酶已被证明是一类独特的金属酶[21]。 许多核酶在其活性位点需要金属离子进行化学催化。 因此,它们被称为金属酶。另外,金属离子对于核酶的结构稳定是必不可少的。第一组内含子是研究最多的核酶,它含有三种金属参与催化[22]。 其他已知的核酶包括第二组内含子,RNase P和一些小的病毒核酶(例如锤头,发夹,HDV和VS)和核糖体的大亚基。 最近,已经发现了四类新的核酶(命名分别是 twister, twister sister, pistol and hatchet),它们都是自裂解核酶[23]。
脱氧核酶,也称为DNA酶或催化性DNA,是人工催化的DNA分子,最早于1994年产生[24],此后迅速受到关注。 几乎所有的DNA酶都需要金属离子才能发挥作用。 因此,它们被分类为金属酶。
信号转导相关金属蛋白
[编辑]钙调素
[编辑]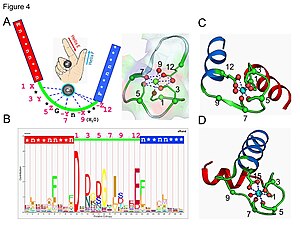
钙调蛋白是信号转导蛋白的一个例子。 它是一种小蛋白质,包含四个EF手模体,每个模体都可以结合Ca2+离子。
在EF手环中,钙离子以五角双锥体构型配位。 参与结合的六个谷氨酸和天冬氨酸残基在多肽链的1、3、5、7和9位置。在位置12,有一个谷氨酸或天冬氨酸配体,表现为(双齿配体),提供两个氧原子。 由于骨架的构象要求,环中的第九个残基必须是甘氨酸。 钙离子的配位球仅包含羧酸氧原子而不包含氮原子。 这与钙离子的硬性质是一致的。
该蛋白质具有两个大致对称的结构域,由柔性的“铰链”区域隔开。 钙的结合导致蛋白质中发生构象变化。 钙调蛋白通过充当初始刺激的扩散性第二信使参与细胞内信号传送系统[25][26]。
肌钙蛋白
[编辑]在心肌和骨骼肌中,肌肉力量的产生主要受细胞内钙浓度变化的控制。 通常,当钙增加时,肌肉收缩,而当钙下降时,肌肉放松。 肌钙蛋白与肌动蛋白和原肌球蛋白一起,是钙与之结合以触发肌肉力量产生的蛋白质复合物。
转录因子
[编辑]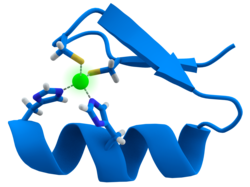
许多转录因子都包含一个称为锌指的结构,这是一个结构模体,其中蛋白质区域围绕锌离子折叠。 锌不直接接触这些蛋白质结合的DNA。 相反,辅因子对于紧密折叠的蛋白质链的稳定性至关重要[27]。 在这些蛋白质中,锌离子通常由半胱氨酸和组氨酸侧链对配位。
其它金属酶
[编辑]一氧化碳脱氢酶有两种类型:一种包含铜和钼,另一种包含镍和铁。 催化策略的平行和差异已被审查。[28] 根据所涉及的金属,下表列出了一些其他金属酶。
例子
[编辑]参阅
[编辑]参考文献
[编辑]- ^ Banci, Lucia. Sigel, Astrid; Sigel, Helmut; Sigel, Roland K. O. , 编. Metallomics and the Cell. Springer. 2013. ISBN 978-94-007-5561-1. ISSN 1868-0402.
- ^ 2.0 2.1 Shriver, D. F.; Atkins, P. W. Chapter 19, Bioinorganic chemistry. Inorganic chemistry 3rd. Oxford University Press. 1999. ISBN 0-19-850330-X.
- ^ Andreini C, Banci L, Bertini I, Rosato A. Zinc through the three domains of life. Journal of Proteome Research. November 2006, 5 (11): 3173–8. PMID 17081069. doi:10.1021/pr0603699.
- ^ Human reference proteome (页面存档备份,存于互联网档案馆) in Uniprot, accessed 12 Jan 2018
- ^ Thomson, A. J.; Gray, H. B. Bioinorganic chemistry. Current Opinion in Chemical Biology. 1998, 2: 155–158. doi:10.1016/S1367-5931(98)80056-2.
- ^ Waldron, K. J.; Robinson, N. J. How do bacterial cells ensure that metalloproteins get the correct metal?. Nat. Rev. Microbiol. January 2009, 7 (1): 25–35. PMID 19079350. doi:10.1038/nrmicro2057.
- ^ Carver, Peggy L. Chapter 1. Metal Ions and Infectious Diseases. An Overview from the Clinic. Sigel, Astrid; Sigel, Helmut; Sigel, Roland K. O. (编). Interrelations between Essential Metal Ions and Human Diseases. Metal Ions in Life Sciences 13. Springer. 2013: 1–28. doi:10.1007/978-94-007-7500-8_1.
- ^ Wang, MS; Hoegler, KH; Hecht, M. Unevolved De Novo Proteins Have Innate Tendencies to Bind Transition Metals. Life. 2019, 9 (8): 8. PMC 6463171
 . PMID 30634485. doi:10.3390/life9010008.
. PMID 30634485. doi:10.3390/life9010008.
- ^ Maret W. Metalloproteomics, metalloproteomes, and the annotation of metalloproteins. Metallomics. February 2010, 2 (2): 117–25. PMID 21069142. doi:10.1039/b915804a.
- ^ 10.0 10.1 Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4. Fig.25.7, p 1100 illustrates the structure of deoxyhemoglobin
- ^ Messerschmidt, A; Huber, R.; Wieghardt, K.; Poulos, T. Handbook of Metalloproteins. Wiley. 2001. ISBN 0-471-62743-7.
- ^ Moore, G. R.; Pettigrew,, G. W. Cytochrome c: Structural and Physicochemical Aspects. Berlin: Springer. 1990.
- ^ Sigel, Astrid; Sigel, Helmut; Sigel, Roland K. O. (编). The Ubiquitous Roles of Cytochrome 450 Proteins. Metal Ions in Life Sciences 3. Wiley. 2007. ISBN 978-0-470-01672-5.
- ^ Ortiz de Montellano, P. R. Cytochrome P450 Structure, Mechanism, and Biochemistry 3rd. Springer. 2005. ISBN 978-0-306-48324-0.
- ^ Colman PM, Freeman HC, Guss JM, Murata M, Norris VA, Ramshaw JA, Venkatappa MP. X-Ray Crystal-Structure Analysis of Plastocyanin at 2.7 Å Resolution. Nature. 1978, 272 (5651): 319–324. Bibcode:1978Natur.272..319C. doi:10.1038/272319a0.
- ^ Anderson BF, Baker HM, Dodson EJ, Norris GE, Rumball SV, Waters JM, Baker EN. Structure of human lactoferrin at 3.2-A resolution. Proceedings of the National Academy of Sciences of the United States of America. April 1987, 84 (7): 1769–73. PMC 304522
 . PMID 3470756. doi:10.1073/pnas.84.7.1769.
. PMID 3470756. doi:10.1073/pnas.84.7.1769.
- ^ Lindskog S. Structure and mechanism of carbonic anhydrase. Pharmacology & Therapeutics. 1997, 74 (1): 1–20. PMID 9336012. doi:10.1016/S0163-7258(96)00198-2.
- ^ Sigel A, Sigel H, Sigel RK (编). Metal–carbon bonds in enzymes and cofactors. Metal Ions in Life Sciences 6. Wiley. 2008. ISBN 978-1-84755-915-9.
- ^ The Nobel Prize in Chemistry 1964. Nobelprize.org. [2008-10-06]. (原始内容存档于2008-10-15).
- ^ Hodgkin, D. C. The Structure of the Corrin Nucleus from X-ray Analysis. Proc. Roy. Soc. A. 1965, 288 (1414): 294–305. Bibcode:1965RSPSA.288..294H. doi:10.1098/rspa.1965.0219.
- ^ Pyle AM. Ribozymes: a distinct class of metalloenzymes. Science. August 1993, 261 (5122): 709–14. Bibcode:1993Sci...261..709P. PMID 7688142. doi:10.1126/science.7688142.
- ^ Shan S, Yoshida A, Sun S, Piccirilli JA, Herschlag D. Three metal ions at the active site of the Tetrahymena group I ribozyme. Proceedings of the National Academy of Sciences of the United States of America. October 1999, 96 (22): 12299–304. Bibcode:1999PNAS...9612299S. PMC 22911
 . PMID 10535916. doi:10.1073/pnas.96.22.12299.
. PMID 10535916. doi:10.1073/pnas.96.22.12299.
- ^ Weinberg Z, Kim PB, Chen TH, Li S, Harris KA, Lünse CE, Breaker RR. New classes of self-cleaving ribozymes revealed by comparative genomics analysis. Nature Chemical Biology. August 2015, 11 (8): 606–10. PMC 4509812
 . PMID 26167874. doi:10.1038/nchembio.1846.
. PMID 26167874. doi:10.1038/nchembio.1846.
- ^ Breaker RR, Joyce GF. A DNA enzyme that cleaves RNA. Chemistry & Biology. December 1994, 1 (4): 223–9. PMID 9383394. doi:10.1016/1074-5521(94)90014-0.
- ^ Stevens FC. Calmodulin: an introduction. Canadian Journal of Biochemistry and Cell Biology. August 1983, 61 (8): 906–10. PMID 6313166. doi:10.1139/o83-115.
- ^ Chin D, Means AR. Calmodulin: a prototypical calcium sensor. Trends in Cell Biology. August 2000, 10 (8): 322–8. PMID 10884684. doi:10.1016/S0962-8924(00)01800-6.
- ^ Berg JM. Zinc finger domains: hypotheses and current knowledge. Annual Review of Biophysics and Biophysical Chemistry. 1990, 19 (1): 405–21. PMID 2114117. doi:10.1146/annurev.bb.19.060190.002201.
- ^ Jeoung, Jae-Hun; Fesseler, Jochen; Goetzl, Sebastian; Dobbek, Holger. Chapter 3. Carbon Monoxide. Toxic Gas and Fuel for Anaerobes and Aerobes: Carbon Monoxide Dehydrogenases. Peter M.H. Kroneck and Martha E. Sosa Torres (编). The Metal-Driven Biogeochemistry of Gaseous Compounds in the Environment. Metal Ions in Life Sciences 14. Springer. 2014: 37–69. doi:10.1007/978-94-017-9269-1_3.
- ^ Romani, Andrea M.P. Chapter 4 Magnesium Homeostasis in Mammalian Cells. Banci, Lucia (Ed.) (编). Metallomics and the Cell. Metal Ions in Life Sciences 12. Springer. 2013. ISBN 978-94-007-5560-4. doi:10.1007/978-94-007-5561-1_4. electronic-book ISBN 978-94-007-5561-1 ISSN 1559-0836 electronic-ISSN 1868-0402
- ^ Roth, Jerome; Ponzoni, Silvia; Aschner, Michael. Chapter 6 Manganese Homeostasis and Transport. Banci, Lucia (Ed.) (编). Metallomics and the Cell. Metal Ions in Life Sciences 12. Springer. 2013. ISBN 978-94-007-5560-4. doi:10.1007/978-94-007-5561-1_6. electronic-book ISBN 978-94-007-5561-1 ISSN 1559-0836 electronic-ISSN 1868-0402
- ^ Dlouhy, Adrienne C.; Outten, Caryn E. Chapter 8 The Iron Metallome in Eukaryotic Organisms. Banci, Lucia (Ed.) (编). Metallomics and the Cell. Metal Ions in Life Sciences 12. Springer. 2013. ISBN 978-94-007-5560-4. doi:10.1007/978-94-007-5561-1_8. electronic-book ISBN 978-94-007-5561-1 ISSN 1559-0836 electronic-ISSN 1868-0402
- ^ Cracan, Valentin; Banerjee, Ruma. Chapter 10 Cobalt and Corrinoid Transport and Biochemistry. Banci, Lucia (Ed.) (编). Metallomics and the Cell. Metal Ions in Life Sciences 12. Springer. 2013. ISBN 978-94-007-5560-4. doi:10.1007/978-94-007-5561-10_10. electronic-book ISBN 978-94-007-5561-1 ISSN 1559-0836 electronic-ISSN 1868-0402
- ^ Astrid Sigel, Helmut Sigel and Roland K.O. Sigel (编). Nickel and Its Surprising Impact in Nature. Metal Ions in Life Sciences 2. Wiley. 2008. ISBN 978-0-470-01671-8.
- ^ Sydor, Andrew M.; Zambie, Deborah B. Chapter 11 Nickel Metallomics: General Themes Guiding Nickel Homeostasis. Banci, Lucia (Ed.) (编). Metallomics and the Cell. Metal Ions in Life Sciences 12. Springer. 2013. ISBN 978-94-007-5560-4. doi:10.1007/978-94-007-5561-10_11. electronic-book ISBN 978-94-007-5561-1 ISSN 1559-0836 electronic-ISSN 1868-0402
- ^ Vest, Katherine E.; Hashemi, Hayaa F.; Cobine, Paul A. Chapter 13 The Copper Metallome in Eukaryotic Cells. Banci, Lucia (Ed.) (编). Metallomics and the Cell. Metal Ions in Life Sciences 12. Springer. 2013. ISBN 978-94-007-5560-4. doi:10.1007/978-94-007-5561-10_12. electronic-book ISBN 978-94-007-5561-1 ISSN 1559-0836 electronic-ISSN 1868-0402
- ^ Maret, Wolfgang. Chapter 14 Zinc and the Zinc Proteome. Banci, Lucia (Ed.) (编). Metallomics and the Cell. Metal Ions in Life Sciences 12. Springer. 2013. ISBN 978-94-007-5560-4. doi:10.1007/978-94-007-5561-10_14. electronic-book ISBN 978-94-007-5561-1 ISSN 1559-0836 electronic-ISSN 1868-0402
- ^ Peackock, Anna F.A.; Pecoraro, Vincent. Chapter 10. Natural and artificial proteins containing cadmium. Astrid Sigel, Helmut Sigel and Roland K. O. Sigel (编). Cadmium: From Toxicology to Essentiality. Metal Ions in Life Sciences 11. Springer. 2013: 303–337. doi:10.1007/978-94-007-5179-8_10.
- ^ Freisinger, Elsa F.A.; Vasac, Milan. Chapter 11. Cadmium in Metallothioneins. Astrid Sigel, Helmut Sigel and Roland K. O. Sigel (编). Cadmium: From Toxicology to Essentiality. Metal Ions in Life Sciences 11. Springer. 2013: 339–372. doi:10.1007/978-94-007-5179-8_11.
- ^ Mendel, Ralf R. Chapter 15 Metabolism of Molybdenum. Banci, Lucia (Ed.) (编). Metallomics and the Cell. Metal Ions in Life Sciences 12. Springer. 2013. ISBN 978-94-007-5560-4. doi:10.1007/978-94-007-5561-10_15. electronic-book ISBN 978-94-007-5561-1 ISSN 1559-0836 electronic-ISSN 1868-0402
- ^ ten Brink, Felix. Chapter 2. Living on acetylene. A Primordial Energy Source. Peter M.H. Kroneck and Martha E. Sosa Torres (编). The Metal-Driven Biogeochemistry of Gaseous Compounds in the Environment. Metal Ions in Life Sciences 14. Springer. 2014: 15–35. doi:10.1007/978-94-017-9269-1_2.
| |||||||||||||||||||||||||||||||
|
