三氯化銠
| 三氯化銠 | |
|---|---|
| |
| IUPAC名 Rhodium(III) chloride | |
| 別名 | 氯化銠 氯化銠(III) |
| 識別 | |
| CAS號 | 10049-07-7 13569-65-8(三水) |
| PubChem | 24872 |
| ChemSpider | 8096382 |
| SMILES |
|
| InChI |
|
| EINECS | 233-165-4 |
| RTECS | VI9290000 |
| 性質 | |
| 化學式 | RhCl3 |
| 摩爾質量 | 209.26 g·mol⁻¹ |
| 外觀 | 暗紅色固體 |
| 密度 | 5.38 g/cm3(固) |
| 熔點 | 450°C(分解[1]) |
| 溶解性(水) | 可溶 |
| pKa | 溶於水顯酸性 |
| 結構 | |
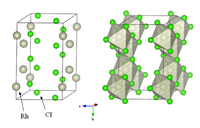
| 晶體結構 | YCl3型結構 |
| 配位幾何 | 八面體 |
| 熱力學 | |
| ΔfHm⦵298K | -234 kJ/mol |
| 危險性 | |
| 歐盟分類 | 未列明 |
| 閃點 | 不可燃 |
| 相關物質 | |
| 其他陰離子 | 三氟化銠、三溴化銠 三碘化銠 |
| 其他陽離子 | 氯化鈷(II)、三氯化銥 |
| 相關化學品 | 三氯化釕、氯化鈀 |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
三氯化銠(化學式:RhCl3),IUPAC名稱氯化銠(III),是最常見和最穩定的銠的氯化物,室溫下為暗紅色的固體。它是從其他鉑系元素中分離銠時的產物。
無水三氯化銠為聚合分子,與氯化鋁類質同晶,在水中的溶解度隨製備方法的不同而有差異。三水合三氯化銠(RhCl3·3H2O)是三氯化銠的水合物,也是三氯化銠最常用的形式,可溶於水,通常用於製備其他銠化合物。無水和三水合三氯化銠有很多不同的性質。
性質[編輯]
RhCl3(H2O)x是暗紅色的反磁性晶體,有中等的潮解性,可溶於水得到紅色溶液。該水溶液中存在RhCl3(H2O)3、[RhCl2(H2O)4]+和[RhCl(H2O)5]2+等微粒,比例隨放置時間長短而有變化。
製備[編輯]
把摩爾比為1:2的海綿銠和氯化鉀一起研細,然後在氯氣流中於550°C加熱60分鐘,用水浸泡紅色產物,過濾,濾液中含有K2[Rh(H2O)Cl5],加入足夠量的氫氧化鉀溶液,沉澱出氫氧化銠(III)(水合三氧化二銠)。洗滌沉澱後,將沉澱溶於儘量少的鹽酸中,蒸發溶液近干,就可得到酒紅色的RhCl3·3H2O晶體。[2]將該晶體在濃鹽酸中重結晶,去除含氮雜質,可以得到較純淨的三氯化銠三水合物。
在200-300°C時,氯氣與銠反應,生成紅色的RhCl3晶體,該晶體不溶於水。將RhCl3·3H2O在乾燥氯化氫氣流中加熱到180°C,得到能溶於水的RhCl3。在前者反應中,若以熔融的氯化鈉作介質,則反應產物為Na3RhCl6。
配合物[編輯]
三氯化銠三水合物是路易斯酸,可與配體生成種類繁多的配合物。與Rh(I)的平面正方特性不同,Rh(III)的配合物大多為八面體構型,在動力學上比較穩定。
氨配合物[編輯]
氨與RhCl3·3H2O的乙醇溶液反應生成氯化五氨配離子[RhCl(NH3)5]2+。該離子被鋅還原並用硫酸根成鹽後,得到無色的氫配合物[RhH(NH3)5]SO4。
硫醚配合物[編輯]
- RhCl3·3H2O + 3 SR2 → RhCl3(SR2)3 + 3 H2O
反應產物為三氯·三硫醚合銠(III),已經分離出相應的面式(fac-)與經式(mer-)異構體。
叔膦配合物[編輯]
溫和條件下,RhCl3·3H2O與叔膦反應,生成RhCl3(PR3)3類型的配合物。反應若在煮沸乙醇溶液中進行,則銠被還原,生成Rh(I)的配合物,如威爾金森催化劑(Wilkinson's catalyst)—RhCl(PPh3)3。反應中的還原劑為乙醇或三苯基膦,相應氧化產物為乙醛和三苯基氧膦。
- RhCl3·3H2O + 3 PPh3 + CH3CH2OH → RhCl(PPh3)3 + CH3CHO + 2 HCl + 3 H2O
- RhCl3·xH2O + 4 PPh3 → RhCl(PPh3)3 + Ph3P=O + 2 HCl + (x-1) H2O
吡啶配合物[編輯]
與乙醇和吡啶一起煮沸時,RhCl3·3H2O轉化為反式-[RhCl2(py)4)]Cl。若溶劑為水,則得到與硫醚配合物結構類似的面式-RhCl3(py)3。反式-[RhCl2(py)4)]Cl氧化得到藍色順磁性的[Cl(py)4Rh-O2Rh(py)4Cl]5+。
烯烴配合物[編輯]
三氯化銠三水合物也可與烯烴配位,尤其是與降冰片二烯和1,5-環辛二烯一類的二烯烴,生成形式為Rh2Cl2(烯烴)4的配合物。它與1,5-環辛二烯的配合物尤其穩定,甚至在乙醇中與1,3-環辛二烯反應,也會得到1,5-環辛二烯的配合物。雙烯配體可由氰離子移除。
羰基配合物[編輯]
RhCl3·3H2O的甲醇溶液與壓強為1bar的一氧化碳反應,生成二氯·二羰基銠(I)酸根陰離子([RhCl2(CO)2]−)。或用RhCl3·3H2O與通入的一氧化碳反應先生成[RhCl(CO)2]2紅色固體,然後再將該固體溶於醇並加入氯離子,也可得到[RhCl2(CO)2]−。
Rh(CO)(PR3)類型的化合物(R為有機基團)有很多是氫甲酰化反應的催化劑,其製備與性質也已被廣泛研究過。RhCl(PPh3)3與一氧化碳或甲醛反應會生成反式-RhCl(CO)(PPh3)2,與Vaska配合物是同類物質,但不及後者活潑。它會與硼氫化鈉和三苯基膦的混合物反應,得到RhH(CO)(PPh3)3。
催化化學[編輯]
對三水合三氯化銠催化性質的研究大致開始於20世紀60年代。當時發現它對很多涉及一氧化碳、氫氣和烯烴的反應都具有催化性能,例如用RhCl3(H2O)3作催化劑,乙烯發生二聚生成順式和反式2-丁烯的混合物:
- 2 C2H4 → CH3-CH=CH-CH3
然而高級烯烴不能發生該反應。幾十年後,人們發現含銠催化的反應在有機溶劑中進行時,有機配體會取代原化合物中的水分子配體,經由(Rh2Cl2(C2H4)4)一類的中間體。該發現推動了均相催化這一領域的發展。這之前大多數金屬催化的反應都屬於異相催化,反應物與催化劑處於兩相,含金屬的催化劑為固態,反應底物為液態或氣態。
均相催化中,三苯基膦配合物是一類重要的催化劑,顯示出較高的催化活性,並且對有機溶劑的溶解性也很好。這類配合物的例子包括RhCl(PPh3)3[3]和RhH(CO)(PPh3)3,可分別催化烯烴的氫化和異構化反應及烯烴的氫甲酰化反應。目前高效的銠催化劑已經在很大程度上替代以前廣泛使用且廉價的鈷催化劑。
參考資料[編輯]
- ^ Record of Rhodium(III)-chlorid in the GESTIS Substance Database from the IFA
- ^ Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4.
- ^ Bennet, M. A.; & Longstaff, P. A. (1965). Complexes of Rhodium(I) with Triphenylphosphine. Chem. Ind. (London) 846. Collman, J. P.; Hegedus, L.S.; Norton, J. R.; & Finke, R. G. Principles and Applications of Organotransition Metal Chemistry. Mill Valley (CA):University Science Books. 1987. ISBN 0-935702-51-2.
- Greenwood, N. N.; & Earnshaw, A. Chemistry of the Elements 2nd Ed. Oxford: Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4.
- Canterford, J. H.; & Colton, R. Halides of the Second and Third Row Transition Metals. London: Wiley-Interscience. 1968.
- Cotton, S. A. Chemistry of the Precious Metals. Chapman&Hall. 1997. ISBN 0-7514-0413-6.
