氮
氮(英語:Nitrogen,法語:azote,德語:Stickstoff)是一種化學元素,化學符號为N,原子序數为7。1772年,在丹尼尔·卢瑟福分離空氣後第一次被發現。雖然卡尔·威廉·舍勒及亨利·卡文迪什也在同一時間独立完成了相关研究,但因為盧瑟福更早公開發表而广受赞誉。1790年,法國化學家讓-安托萬·沙普塔提出了氮的命名nitrogène,因為氮存在于硝酸和硝酸鹽中。由于氮是窒息气体,安托万-洛朗·德·拉瓦锡提出了另一个命名azote,取自希腊语ἄζωτος,意思是“没有生命的”。这个名称被多数其它语言使用,例如法語、俄語等。
氮是元素周期表中最輕的氮族元素。它是宇宙中常見的元素,在銀河系和太陽系中含量大約排第七。在标准温度和压强下,兩個氮原子可以结合形成氮氣(N2)。氮氣是一種無色無味的双原子气体,是大氣中含量最多的气体,占比约为78%。氮也存在于生物的氨基酸、蛋白质和核酸中。人体中氮元素的质量约占3%,仅次於氧、碳和氫。氮循环是指氮元素從空氣進入生物圈和有機化合物中然後再返回大氣的转移過程。
很多工业上重要的化合物都含有氮原子,例如氨、硝酸、可用作推進劑或炸藥的硝酸酯、氰化物等。氮原子之間会形成非常牢固的氮氮三鍵(N≡N),其强度仅次于一氧化碳(C≡O),[5]而这影响了氮的化学性质:将氮转化为氮化合物很不容易,而相反的使氮化合物分解產生氮氣可以得到大量的能量。氮化合物氨和硝酸鹽是關鍵的工業化肥料。硝酸鹽肥料是引起水質優養化的關鍵污染物。
氮化合物除了作為肥料和能量儲存的功用之外還有多種用途,如作为克維拉纖維和氰基丙烯酸酯強力膠等多種材料的組成部分。许多药物也都含有氮元素。
名稱和历史
[编辑]
氮化合物历史悠久,早在中世纪就广为人知了。炼金术师知道硝酸,并把它称作aqua fortis(强水),也知道一些铵盐和硝酸盐。由于硝酸和盐酸的混合物可以溶解黄金(金属之王),因此被称做aqua regia(王水)。[6]
氮一般被认为是被苏格兰物理学家丹尼尔·卢瑟福在1772年发现的。他发现將生物放入这种气体中时都會窒息而死,因而将氮气叫作有害气体(noxious air)。[7][8]虽然他没有认出这是一种新物质,但是他知道这不是约瑟夫·布拉克的固定气体(二氧化碳)。[9]卢瑟福清楚空气中有一种成分不支持燃烧,但不知道那是新元素。当时,卡尔·威廉·舍勒、亨利·卡文迪什、约瑟夫·普利斯特里也都在研究氮气。氮气很不活跃,因此被拉瓦锡称为有毒气体(法語:air méphitique)或azote。azote源于希腊词 ἄζωτος (azotos),意思是 "无生命的"。[10]在氮气裡,动物死亡,火焰熄灭。拉瓦锡所给的氮气的名字被用于很多种语言(法语、意大利语、波兰语、俄语、阿尔巴尼亚语、等等),并且还处在于英语的一些化合物的常用名字里,比如肼和叠氮化合物。
英语单词nitrogen(1794)来自于法语单词nitrogène,是由法国化学家让-安托万·沙普塔將其命名為「Nitrogen」,以希臘文的「硝石」(nitre)與「產生」(genes)合成,意為「硝石生成的物質」。氮气常在硝酸气体中被发现,沙普塔認為氮气是硝酸的组成部分,是由硝石(nitre)(硝酸钾)产生的。[11]
德文中便直接以sticken(導致窒息)和Stoff(物質)組合,命名為Stickstoff(導致窒息的物質),日文及韓文便自此將之意譯為「窒素」。19世纪70年代化学家徐寿将、、、、译为轻氣、养氣、淡气、弗气、绿气,直至1933年,化学家郑贞文在其主持编写出版的《化学命名原则》一书中改成氢、氧、氮、氟、氯,一直沿用到现在。[12]中文名稱「氮」有沖淡氣體的意思。
最早的在军事,工业和农业上找到用途的氮化合物是硝石(硝酸钠或硝酸钾)的使用,尤其是在火药中和作为肥料。1910年,瑞利男爵发现在氮气中放电可以产生“活性氮”,一种氮的单原子同素异形体。由他的仪器中产生的“明黄色的旋转的云”与汞反应后生成爆炸性的氮化汞。[13]
氮化合物在相当长一段时间内来源有限。它们的自然来源要么是生物,要么是大气反应生成的硝酸盐。对肥料的需求日益增长促进了氮化合物的工业化生产。工业化的固氮过程(如奥斯特瓦尔德法和氰氨法)消除了氮化合物的短缺。1910年代哈柏法的发现和工业化应用彻底改变了氮化合物的供应,对食品生产产生了很大影响,使得养活全世界日益增长的人口成为可能。[14]
性质
[编辑]
一个氮原子有七粒电子。在基态下,这些电子的电子排布为1s2
2s2
2p1
x2p1
y2p1
z。它的2s和2p轨道有五个价电子,其中位于2p轨道的三个并未成对。氮的电负性是所有元素第四大的,鲍林标度为3.04,位列氯(3.16)、氧(3.44)和氟(3.98)之下。(更轻的惰性气体氦、氖、氩的电负性很可能比氮高,而在阿莱标度下正是如此。)[15]氮的单键共价半径为71 pm,比硼(84 pm)和碳(76 pm)小,而比氧(66 pm)和氟(57 pm)大,符合元素周期律。氮离子(N3−)则要大得多,离子半径为146 pm,与氧离子(O2−,140 pm)和氟离子(F−,133 pm)相似。[15]氮的前三级电离能分别是1.402 MJ·mol−1、2.856 MJ·mol−1、4.577 MJ·mol−1,这样高的电离能使氮无法在化学反应中生成简单阳离子。[16]2p轨道的性质使得氮、氧、氟和下面的元素相比有异常的性质。2p轨道很小,半径和2s轨道相似,因此容易与它杂化。此外,原子核和2s、2p轨道的价电子产生的吸引力极大,导致氮极高的电负性。出于同样的原因,氮几乎没有超价分子,因为氮极高的电负性将会强烈吸引电子,难以成为富含电子的三中心四电子键的中心原子。因此,虽然氮位于氮族元素,但化学性质和更重的氮族元素磷、砷、锑、铋有显著区别。[17]
氮不像碳那样容易成链,但和碳一样可以和金属形成化合物。氮也可以和碳形成化合物,它们的结构各不相同,有链形的、石墨形的、以及富勒烯形的。[18]
氮和氧一样电负性很高,可以形成氢键,也能通过分享孤电子对来形成配合物。氨(NH3)和水(H2O)的化学性质有些相似,例如都可以接受氢离子,分别生成NH4+和H3O+;或是释放氢离子,分别生成NH2−和OH−。这四种离子都能产生固体化合物。[19]
和隔壁的碳和氧一样,氮倾向于与其它碳、氮、氧原子形成多重键。[20]由于更重的氮族元素都较难形成多重键,所以氮可以形成的氮氧化物、亚硝酸盐、硝酸盐、硝基化合物、亚硝基化合物、偶氮化合物、重氮化合物、叠氮化合物、氰酸盐、硫氰酸盐、亚胺都难以找到对应的更重氮族元素化合物;反过来说磷能形成各种复杂的含氧酸,但氮不能。[20]
同位素
[编辑]已发现的氮的同位素共有十七种,包括至,其中只有和是最稳定的。最常见的是(99.634%),是在恒星的碳氮氧循環过程中产生的。[21]在其他人工合成的同位素中,的半衰期是10分钟,其他的同位素的半衰期都是以秒计或更短。[22]
生物介导反应(例如同化,硝化反应和反硝化反应)牢牢地控制着土壤的氮动力学。这些反应一般会导致基质的富集和产物的消耗。[23]
地球大气中的氮气的一小部分(0.73%)是同位素体,其余的大部分是。[24]
同素异形体
[编辑]单原子氮是非常活泼的三自由基,有三个不成对电子。它极易和其它元素反应,生成氮化物。两个单原子氮之间的碰撞会产生激发态的N2分子,后者的能量之高甚至可以把稳定的二氧化碳和水撞成自由基。单原子氮可通过对0.1–2 mmHg的氮气通电而成,并伴随着桃黄色的光。这种光直到结束通电后几分钟才会缓慢消失。[20]
氮通常以N2形式存在。它是无色、无臭、无味的抗磁性气体,熔点−210 °C,沸点−196 °C。[20]由于N2中含有又短(109.76 pm)、键能又高(945.41 kJ/mol),因此很强的氮氮三键,它并不活泼,但仍可和金属锂和某些过渡金属配合物反应。[20][25]
氮还有可能形成低聚物和聚合物。它们如果真的被合成了,将会是能量密度极高的材料,可用作推进剂或炸药。[26]在金刚石对顶砧产生的110万个大气压的高压和2000 K的高温下,氮会聚合成由单键链接而成的晶体。它的结构与钻石相似,且都有极强的共价键,因此别名“氮钻石”。[27]

在常压下,N2会在77 K(−196.2 °C)下液化,在63 K(−210.2 °C)下凝固成六方晶系的β相,[28]而继续降温到35.4 K(−237.8 °C)则会使N2变成立方晶系的α相。[29]液氮和水一样是无色液体,但其密度(0.808 g/mL)只有水的80.8%,是常用的制冷剂。[30]固态氮有多种晶体结构,是冥王星[31]和海卫一[32]表面的主要成分。即使在那边的低温下,这些固态氮仍具有挥发性,容易升华,形成氮气。这些氮气有的形成大气层,有的形成霜。在海卫一的极地冰盖,还会有氮气组成的间歇泉。[33]
化合物
[编辑]氮化物
[编辑]氮可以和大部分元素化合,生成各有不同性质和应用的二元化合物,即氮化物。[20]大部分元素都有多种氮化物,例如锰可以形成MnN、Mn6N5、Mn3N2、Mn2N、Mn4N、 MnxN(9.2 < x < 25.3)。氮化物可分为离子氮化物、共价氮化物、间隙氮化物及它们之间的混合类型。氮化物可通过金属和氮气或氨气直接反应,或是氨基化物的热分解产生:[34]
- 3 Ca + N2 → Ca3N2
- 3 Mg + 2 NH3 → Mg3N2 + 3 H2(900 °C)
- 3 Zn(NH2)2 → Zn3N2 + 4 NH3
离子氮化物形式上可看作是N3−离子形成的盐,但即使是电正性最强的元素都无法完全分离其电荷。最接近离子化合物的氮化物是锂(更重的碱金属由于空间位阻,氮化物并不稳定)和碱土金属的氮化物。重碱金属虽然氮化物不稳定,但它们有较为常见的叠氮化物(如NaN3和KN3,其中含有线形的N−
3离子)。从11到16族元素的氮化物的离子性较低,有更复杂的结构,受到冲击时会爆炸。[34]
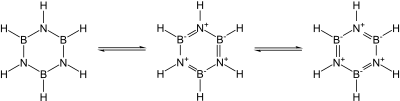
氮也可以形成共价氮化物,如氰((CN)2)、五氮化三磷(P3N5)、二氮化二硫(S2N2)、四氮化四硫(S4N4)。由于B–N单元和C–C单元是等电子体,且碳的大小约为硼和氮的平均值,一些有机化合物会有相关的硼氮化合物,如和苯相似的无机苯。不过,由于硼缺电子,这类化合物更容易被亲核试剂攻击,此现象在完全由碳组成的环中不会发生。[34]
氮化物最大的类别是间隙氮化物。在这类化合物中,较小的氮原子会出现在金属原子晶格之间的间隙里。它们不透明、非常硬、化学性质稳定、熔点极高(通常超过2500 °C),也具有金属般的光泽和电导性。它们的水解极慢。[34]
氢化物
[编辑]
氨(NH3)是最重要的氮化合物,其工业产量比任何化合物都高。它可以合成氮肥,养活了全球接近一半的人类。[36]它是无色、碱性的气体,有特征性的臭味。氨中有氢键,这也使得它有较高的熔点(−78 °C)和沸点(−33 °C)。液氨是很好的非水极性溶剂。氨是弱碱(pKb 4.74),可以接受一个氢离子,生成铵根离子 NH+
4;也是极弱的酸,可以失去一个氢离子,生成氨基负离子 NH−
2。和水类似,氨可以自耦电离,生成铵根离子和氨基负离子。氨在空气或氧气中燃烧会生成氮气,而在氟气中燃烧则会有黄绿色火焰,生成三氟化氮。氨和其它非金属的反应较复杂,会产生各种产物。氨和金属反应,生成氮化物。[37]
除了氨以外,氮也可以形成其它氢化物,其中比较重要的是肼(N2H4)和叠氮酸(HN3)。羟胺(NH2OH)虽然不是氮的氢化物,但其性质与氨、肼相似。肼是冒烟的无色液体,气味与氨相似,物理性质与水相似(熔点2.0 °C、沸点113.5 °C、密度1.00 g/cm3)。虽然肼在热力学上不稳定,但它在动力学上稳定。它在空气中快速燃烧并放出大量热,生成氮气和水蒸气。它可用作还原剂,[38]也是火箭推进剂。[39]
- NH3 + OCl− → NH2Cl + OH−
- NH2Cl + NH3 → N
2H+
5 + Cl−(慢) - N
2H+
5 + OH− → N2H4 + H2O(快)
反应添加明胶是为了移除Cu2+等金属离子,后者可以催化N2H4和NH2Cl的反应。[38]
叠氮酸(HN3)于1890年通过亚硝酸氧化水合肼首次合成。它极易爆炸,就连稀溶液都是危险的。它具有令人不愉快和刺激性的气味。它是叠氮根离子的共轭酸,性质与氢卤酸相似。[38]
卤化物及卤氧化物
[编辑]
氮能和四种卤素形成三卤化物,也可以形成混合卤化物和氢卤化物,如NClF2、NCl2F、NBrF2、NF2H、NFH2、NCl2H、NClH2。它们大多不稳定。[40]
三氟化氮(NF3)于1928年发现,是无色无味的气体,通过电解熔融的氟化铵氟化氢溶液产生。[41]和四氟化碳一样,三氟化氮是稳定的,不与水、稀酸或稀碱反应。只有在加热时,它才会变得活泼,能氟化铜、砷、锑、铋。四氟肼(N2F4)在室温下可以分解成二氟化氮(NF2•)自由基,并达成平衡。[42]叠氮化氟(FN3)不稳定,极易爆炸,其分解产物二氟化二氮(N2F2)有顺反异构体。[40]
三氯化氮(NCl3)是黄色、有挥发性、会爆炸的液体。它的物理性质和四氯化碳相似,但不同的是三氯化氮会水解,而四氯化碳不会。三氯化氮于1811年由皮埃尔·路易·杜隆发现,但他也因三氯化氮的爆炸失去了三根手指和一只眼睛。[43]三氯化氮曾用于漂白面粉,[44]但因为安全问题,现在已被禁用。三溴化氮(NBr3)于1975年发现,是深红色、对温度敏感的挥发性固体,即使在−100 °C下也会爆炸。三碘化氮(NI3)更不稳定,直到1990年才被发现。它的氨合物的发现时期更早,对冲击极为敏感,一根羽毛、空气气流、甚至是α粒子都能引爆它。[40][45]因此,高中课堂中常以少量的三碘化氮来演示“化学炸弹”。[46]叠氮化氯(ClN3)、叠氮化溴(BrN3)和叠氮化碘(IN3)都很敏感,容易爆炸。[47][48][49]
氮有两类卤氧化物,分别是亚硝酰卤(XNO)和硝酰卤(XNO2)。前者都是非常活泼的气体,可由卤素和一氧化氮直接反应而成。无色的亚硝酰氟(NOF)是强氟化剂,而黄色的亚硝酰氯(NOCl)也具有类似的性质。亚硝酰溴(NOBr)是红色的。属于硝酰卤的硝酰氟(FNO2)和硝酰氯(ClNO2)同样是强卤化剂。[40]
氮氧化物
[编辑]
2在低温下二聚成无色的四氧化二氮(N
2O
4),高温下又分解成NO
2。
氮有许多氧化物,如一氧化二氮(N2O)、一氧化氮(NO)、三氧化二氮(N2O3)、二氧化氮(NO2)、四氧化二氮(N2O4)、五氧化二氮(N2O5)、叠氮化亚硝酰(N4O)、[50]三硝基胺(N(NO2)3)。[51]它们在热力学上都不稳定,会分解成氮气和氧气。
一氧化二氮(N2O)俗称笑气,可由熔融的硝酸铵在250 °C下热分解而成。它常用作推进剂,还可以打发奶泡,也曾被用作麻醉剂。虽然化学式类似,但因为连二次硝酸(H2N2O2)无法通过一氧化二氮与水的反应产生,所以不能把一氧化二氮看作是其酸酐。[52]一氧化二氮不活泼,但在加热时会变得活泼。它会和卤素、碱金属或臭氧反应。一氧化二氮分子不对称,结构为N–N–O(N≡N+O−↔−N=N+=O),超过600 °C时会断裂N–O键并分解。[50]一氧化氮(NO)是最简单的稳定奇电子分子。它是哺乳动物,包括人类重要的信号分子。[53]一氧化氮是无色、顺磁性的气体,可由氨气催化氧化制得。它在热力学上不稳定,1100–1200 °C下分解成氮气和氧气。它和氧气反应生成红棕色的二氧化氮,而和卤素反应则生成亚硝酰卤。一氧化氮也能和过渡金属化合物反应,生成大多呈深色的亚硝基配合物。[50]
蓝色的三氧化二氮(N2O3)在熔点以上会快速分解成一氧化氮、二氧化氮和四氧化二氮。后两者由于一直处于平衡,较难单独研究。二氧化氮(NO2)是有刺激性气味的红棕色腐蚀性气体,而四氧化二氮(N2O4)则是无色气体,在相对电容率较高的介质中会理解成亚硝𬭩离子和硝酸根。它们都可通过无水金属硝酸盐分解而成,且都与水反应,生成硝酸。四氧化二氮可用于制备无水金属硝酸盐和硝酸根配合物,也可作为火箭推进剂。[50]
五氧化二氮(N2O5)是硝酸的酸酐,呈无色晶体,非常活泼、有强氧化性和吸湿性、且对光敏感,可由硝酸和五氧化二磷反应而成,能合成炸药。[54]固态的五氧化二氮是结构为[NO2]+[NO3]−的离子化合物,而气态或非极性溶液中的五氧化二氮则以O2N–O–NO2分子形式存在。五氧化二氮极易水解成硝酸,和过氧化氢也能产生类似反应,生成过氧硝酸(HOONO2)。气态的五氧化二氮通过以下反应分解:[50]
- N2O5 ⇌ NO2 + NO3 → NO2 + O2 + NO
- N2O5 + NO ⇌ 3 NO2
含氧酸、含氧酸根、含氧酸盐
[编辑]氮有多种含氧酸,但它们大多不稳定,只能以水溶液或盐的形式存在。连二次硝酸(H2N2O2)是弱二元酸(pKa1 6.9、pKa2 11.6),其结构为HON=NOH。它的酸性溶液稳定,pH超过4时会被碱催化分解成一氧化二氮和氢氧根离子。含有N
2O2−
2离子的连二次硝酸盐是还原剂,为氮循环中氨被氧化成亚硝酸盐中的反应中间体。连二次硝酸根是二齿配体。[55]
目前还未分离出纯的亚硝酸(HNO2)。它的水溶液是重要的试剂,可由亚硝酸盐溶液在低温下酸化产生。[56][57]它是弱酸(pKa 3.35)、不稳定,在室温下会歧化成硝酸盐和一氧化氮。它可被高锰酸盐氧化成硝酸盐,也能被二氧化硫还原成一氧化氮和一氧化二氮。亚硝酸和锡(II)反应生成连二次硝酸,和硫化氢反应则生成氨。它也能合成羟胺以及把芳香伯胺重氮化:[55]
- ArNH2 + HNO2 + H+ → [ArNN]+ + 2 H2O
亚硝酸钠有毒,半数致死量为180 mg/kg,但少量的亚硝酸钠可以腌肉。[58]亚硝酸根是两可配体,可用氮原子或氧原子与金属配合,其中用氮原子配合产生的配合物较稳定。[55]

硝酸(HNO3)于13世纪由炼金术师发现,是氮的含氧酸中最稳定、最重要的。硝酸主要通过奥斯特瓦尔德法生产。美国每年生产超过七百万吨的硝酸,它们大多用于合成硝酸盐,而硝酸盐又用于生产肥料和炸药。[59]无水硝酸可通过浓硝酸和五氧化二磷反应而成。它只能以固态存在,熔化后会自发分解。液态纯硝酸的自耦电离程度远比其它共价液体高。[55]
- 2 HNO3 ⇌ H
2NO+
3 + NO−
3 ⇌ H2O + [NO2]+ + [NO3]−
硝酸是强酸,浓硝酸有强氧化性,它有两种可以结晶的水合物,分别是HNO3·H2O和HNO3·3H2O。硝酸和浓硫酸混合会产生硝𬭩离子,它是硝化芳香化合物的亲电试剂:[55]
- HNO3 + 2 H2SO4 ⇌ NO+
2 + H3O+ + 2 HSO−
4
硝酸盐有不同的分解方法,有些分解成亚硝酸盐(如硝酸钠和硝酸钾[60])、有些分解成氧化物(如硝酸铅)、有些直接分解成金属单质(如硝酸银)。硝酸根也是常见的配体。[55]
虽然结构类似正磷酸的正硝酸(H3NO4)未被发现,但相关的NO3−
4离子已有钠盐和钾盐。[55]它们可通过硝酸盐和氧化物在高温[61]高压[62]下反应而成:
- NaNO3 + Na2O → Na3NO4
它们是白色晶体,对空气中的水蒸气和二氧化碳很敏感:[55]
- Na3NO4 + H2O + CO2 → NaNO3 + NaOH + NaHCO3
有机氮化合物
[编辑]氮是有机化学常见的元素,许多有机官能团都含有碳-氮键,如酰胺(RCONR2)、胺(R3N)、亚胺)RC(=NR)R)、酰亚胺((RCO)2NR)、叠氮化合物(RN3)、偶氮化合物(RN2R)、氰酸酯(ROCN)、异氰酸酯(RNCO)、硝酸酯(RONO2)、腈(RCN)、异腈(RNC)、亚硝酸酯(RONO)、硝基化合物(RNO2)、亚硝基化合物(RNO)、肟(RCR=NOH)。碳-氮键中的电子偏向氮。有机氮化合物中的氮通常呈三价(在季铵盐 R4N+中呈四价),有一对能接受氢离子、使化合物带有碱性的孤电子对。一些有机氮化合物因其它原因而碱性较弱,例如酰胺因为其孤对电子在羰基上离域,不接受氢离子,难以表现碱性(不过在强酸性环境下,酰胺可以被质子化);而吡咯的孤电子对是芳香环的一部分,难以接受氢离子,因此碱性也较弱。[63]物质中氮的含量可通过凯氏定氮法测定。[64]所有核酸、氨基酸、蛋白质以及储存能量的三磷酸腺苷都含氮,因此地球上所有生命都含氮。[63]
生产
[编辑]氮气是工业气体,通过分馏液态空气或是变压吸附法(PSA)生产。使用变压吸附法的氮气生成器的价格和能耗都比瓶装氮气低。[65]商品级氮气通常是提取空气中的氧气后的副产物。这些氮气被压缩后都用黑色钢瓶装,常被称为OFN(无氧氮气),[66]含有的氧气杂质至多为20 ppm。[67]
- NH4Cl + NaNO2 → N2 + NaCl + 2 H2O
反应中会产生少量的NO和HNO3杂质,可通过把气体通入含重铬酸钾的硫酸去除。[68]极纯的氮气则能通过叠氮化钡或叠氮化钠热分解而成。[69]
- 2 NaN3 → 2 Na + 3 N2
用途
[编辑]由于氮化合物很多,用途更多,所以此章节只讲氮单质本身的用途。
氮气
[编辑]氮气主要用作保护气体,避免氧气导致火灾、爆炸或氧化。氮气的用途包括:[67]
- 填充到包装食品中避免酸败和其它氧化过程,使其新鲜。氮气是食品添加剂,E编码 E941。[70]
- 成为白炽灯里氩气便宜的替代品。[71]
- 用于灭火。[67]
- 制造不锈钢。[72]
- 通过渗氮对钢表面硬化。[73]
- 由于空气中的水蒸气和氧气的氧化会导致不均匀的涨缩,[67]所以氮气成为了赛车和飞机轮胎的填充气体。[74]
液氮
[编辑]
液氮是外观像水的低温液体。它可用杜瓦瓶储存和运输。[75]和干冰一样,液氮主要用于创造低温。液氮可以保存血液、精子、卵子等生物样品。在冷疗手术中,液氮可以冻结和移除皮肤的囊肿和疣。[76]实验室的冷阱和低温泵也会使用液氮。它还可以冷却红外探测器和X射线探测器等热敏电子产品。液氮通常用于使东西的温度变得像它那样低,但由于液氮价格便宜,所以即使不需要它那么低的温度,它也被用于冷冻各种东西,如食物。[67]
危害
[编辑]氮气
[编辑]虽然氮气无毒,但它在封闭环境中可以取代氧气,使人窒息。由于人体颈动脉体对缺氧较不敏感,所以不容易感觉到氮气导致的窒息。[77]在STS-1发射不久前的1981年3月19日,两位技术人员因氮气窒息而死。[78]
吸入高气体分压(压强超过4巴,或是水肺潜水超过30米处)的氮气会导致氮醉,其症状类似吸入笑气之后的症状。[79][80]
氮气可溶于血液和脂肪。快速减压(例如潜水员上浮过快)会使氮气气泡在人体各处形成,引起可致命的减压症。[81][82]除了二氧化碳和氧气以外的其它气体都会导致减压症,所以把呼吸气体中的氮气替换成其它气体只能防止氮醉,不能防止减压症。[83]
液氮
[编辑]液氮温度极低,虽然莱顿弗罗斯特效应能提供极短(约一秒)的保护,但在这之后继续接触液氮会造成冻伤。[84]喝下液氮会造成严重的内脏损伤。2012年,英国有人喝了用液氮制成的鸡尾酒,结果她的胃被切除了。[85]
液氮容易蒸发成氮气,所以氮气的危害液氮也有。[86][87][88]有液氮的地方都会有氧气传感器,避免里面的人因为液氮产生的氮气窒息。[89]
装液氮的容器可以液化空气中的氧气。由于液氧的沸点是−183 °C,比液氮高,所以容器内的液氮蒸发,液氧开始富集,剧烈氧化有机物。[90]
参见
[编辑]参考文献
[编辑]- ^ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip J. H.; Gröning, Manfred; Holden, Norman E.; Meijer, Harro A. J. Standard atomic weights of the elements 2021 (IUPAC Technical Report). Pure and Applied Chemistry. 2022-05-04. ISSN 1365-3075. doi:10.1515/pac-2019-0603 (英语).
- ^ Gases - Density. The Engineering Toolbox. [27 January 2019]. (原始内容存档于2006-03-02).
- ^ 3.0 3.1 3.2 Lide, David R. CRC Handbook of Physics and Chemistry 71st. Boca Raton, Ann Arbor, Boston: CRC Press, inc. 1990–1991: 4-22(这是一页) (英语).
- ^ 四唑環中有一對以雙鍵鍵結、氧化態為0的氮原子。母體1-H-四唑(CH2N4)的合成過程參見Henry, Ronald A.; Finnegan, William G. An Improved Procedure for the Deamination of 5-Aminotetrazole. Journal of the American Chemical Society (American Chemical Society (ACS)). 1954, 76 (1): 290–291. ISSN 0002-7863. doi:10.1021/ja01630a086..
- ^ Common Bond Energies (D) and Bond Lengths (r). [2019-06-20]. 原始内容存档于2010-05-15.
- ^ Greenwood & Earnshaw 1997,第406–07頁.
- ^ Lavoisier, Antoine Laurent. Elements of chemistry, in a new systematic order: containing all the modern discoveries. Courier Dover Publications. 1965: 15. ISBN 0-486-64624-6.
- ^ Weeks, Mary Elvira. The discovery of the elements. IV. Three important gases. Journal of Chemical Education. 1932, 9 (2): 215. Bibcode:1932JChEd...9..215W. doi:10.1021/ed009p215.
- ^ Aaron J. Ihde, The Development of Modern Chemistry, New York 1964.
- ^ Elements of Chemistry, trans. Robert Kerr (Edinburgh, 1790; New York: Dover, 1965), 52.
- ^ nitrogen (页面存档备份,存于互联网档案馆). Etymonline.com. Retrieved on 2011-10-26.
- ^ 刘怀乐. 化学鉴源与略考. 化学教育. 1994, (04) [2013-02-25]. (原始内容存档于2013-10-04).
- ^ Lord Rayleigh's Active Nitrogen. Lateral Science. [2013-10-01]. (原始内容存档于2012-11-01).
- ^ Erisman, Jan Willem; Sutton, Mark A.; Galloway, James; Klimont, Zbigniew; Winiwarter, Wilfried. How a century of ammonia synthesis changed the world. Nature Geoscience. 2008, 1 (10): 636. Bibcode:2008NatGe...1..636E. doi:10.1038/ngeo325.
- ^ 15.0 15.1 Greenwood & Earnshaw 1997,第411–12頁.
- ^ Greenwood & Earnshaw 1997,第550頁.
- ^ Kaupp, Martin. The role of radial nodes of atomic orbitals for chemical bonding and the periodic table. Journal of Computational Chemistry. 1 December 2006, 28 (1): 320–25. PMID 17143872. S2CID 12677737. doi:10.1002/jcc.20522
 .
.
- ^ Miller, T. S.; Belen, A.; Suter, T. M.; Sella, A.; Corà, A.; McMillan, P. F. Carbon nitrides: synthesis and characterization of a new class of functional materials. Physical Chemistry Chemical Physics. 2017, 19 (24): 15613–15638. Bibcode:2017PCCP...1915613M. PMID 28594419. doi:10.1039/C7CP02711G
 .
.
- ^ House, J. E.; House, K. A. Descriptive Inorganic Chemistry. Amsterdam: Elsevier. 2016: 198. ISBN 978-0-12-804697-5.
- ^ 20.0 20.1 20.2 20.3 20.4 20.5 Greenwood & Earnshaw 1997,第412–16頁.
- ^ Bethe, H. A. Energy Production in Stars. Physical Review. 1939, 55 (5): 434–56. Bibcode:1939PhRv...55..434B. doi:10.1103/PhysRev.55.434.
- ^ Audi, G.; Wapstra, A. H.; Thibault, C.; Blachot, J. and Bersillon, O. The NUBASE evaluation of nuclear and decay properties (PDF). Nuclear Physics A. 2003, 729: 3–128. Bibcode:2003NuPhA.729....3A. doi:10.1016/j.nuclphysa.2003.11.001. (原始内容 (PDF)存档于2008-09-23).
- ^ Flanagan, Lawrence B.; Ehleringer, James R; Pataki, Diane E. Stable Isotopes and Biosphere - Atmosphere Interactions: Processes and Biological Controls. 2004-12-15: 74–75 [2013-10-02]. ISBN 9780080525280. (原始内容存档于2017-01-09).
- ^ Atomic Weights and Isotopic Compositions for Nitrogen. NIST. [2013-05-22]. (原始内容存档于2013-03-02).
- ^ Universal Industrial Gases, Inc...Nitrogen N2 Properties, Uses, Applications - Gas and Liquid. [2013-09-30]. (原始内容存档于2013-09-28).
- ^ Lewars, Errol G. Modeling Marvels: Computational Anticipation of Novel molecules. Springer Science+Business Media. 2008: 141–63. ISBN 978-1-4020-6972-7. doi:10.1007/978-1-4020-6973-4.
- ^ Polymeric nitrogen synthesized. physorg.com. 5 August 2004 [2009-06-22]. (原始内容存档于2012-01-24).
- ^ Gray, Theodore. The Elements: A Visual Exploration of Every Known Atom in the Universe
 . New York: Black Dog & Leventhal Publishers. 2009. ISBN 978-1-57912-814-2.
. New York: Black Dog & Leventhal Publishers. 2009. ISBN 978-1-57912-814-2.
- ^ Schuch, A. F.; Mills, R. L. Crystal Structures of the Three Modifications of Nitrogen 14 and Nitrogen 15 at High Pressure. The Journal of Chemical Physics. 1970, 52 (12): 6000–08. Bibcode:1970JChPh..52.6000S. doi:10.1063/1.1672899.
- ^ Iancu, C. V.; Wright, E. R.; Heymann, J. B.; Jensen, G. J. A comparison of liquid nitrogen and liquid helium as cryogens for electron cryotomography. Journal of Structural Biology. 2006, 153 (3): 231–40. PMID 16427786. doi:10.1016/j.jsb.2005.12.004.
- ^ Flowing nitrogen ice glaciers seen on surface of Pluto after New Horizons flyby. ABC News. 25 July 2015 [6 October 2015]. (原始内容存档于29 September 2015).
- ^ McKinnon, William B.; Kirk, Randolph L. Spohn, Tilman; Breuer, Doris; Johnson, Torrence , 编. Encyclopedia of the Solar System "Triton" 3rd. Amsterdam; Boston: Elsevier: 861–82. 2014 [2016-04-30]. ISBN 978-0-12-416034-7. (原始内容存档于2016-09-03).
- ^ Neptune: Moons: Triton. NASA. [September 21, 2007]. (原始内容存档于October 15, 2011).
- ^ 34.0 34.1 34.2 34.3 Greenwood & Earnshaw 1997,第417–20頁.
- ^ Greenwood & Earnshaw 1997,第434–38頁.
- ^ Ritchie, Hannah. How many people does synthetic fertilizer feed?. Our World in Data. Our World in Data. [4 September 2021]. (原始内容存档于2021-09-04).
- ^ Greenwood & Earnshaw 1997,第420–26頁.
- ^ 38.0 38.1 38.2 38.3 Greenwood & Earnshaw 1997,第426–33頁.
- ^ Vieira, R.; C. Pham-Huu; N. Keller; M. J. Ledoux. New carbon nanofiber/graphite felt composite for use as a catalyst for hydrazine catalytic decomposition. Chemical Communications. 2002, (9): 954–55. PMID 12123065. doi:10.1039/b202032g.
- ^ 40.0 40.1 40.2 40.3 Greenwood & Earnshaw 1997,第438–42頁.
- ^ Otto Ruff, Joseph Fischer, Fritz Luft. Das Stickstoff-3-fluorid. Zeitschrift für Anorganische und Allgemeine Chemie. 1928, 172 (1): 417–425. doi:10.1002/zaac.19281720132.
- ^ Jäger, Susanne; von Jouanne, Jörn; Keller-Rudek, Hannelore; Koschel, Dieter; Kuhn, Peter; Merlet, Peter; Rupecht, Sigrid; Vanecek, Hans; Wagner, Joachim. Koschel, Dieter; Kuhn, Peter; Merlet, Peter; Ruprecht, Sigrid; Wagner, Joachim , 编. F Fluorine: Compounds with Oxygen and Nitrogen. Gmelin Handbook of Inorganic Chemistry 4. Berlin: Springer. 1986: 162 [29 August 2015]. ISBN 978-3-662-06341-5. doi:10.1007/978-3-662-06339-2.
- ^ Thénard J. L.; Berthollet C. L. Report on the work of Pierre Louis Dulong. Annales de Chimie et de Physique. 1813, 86 (6): 37–43.
- ^ Hawthorn, J.; Todd, J. P. Some effects of oxygen on the mixing of bread doughs. Journal of the Science of Food and Agriculture. 1955, 6 (9): 501–511. Bibcode:1955JSFA....6..501H. doi:10.1002/jsfa.2740060906.
- ^ Bowden, F. P. Initiation of Explosion by Neutrons, α-Particles, and Fission Products. Proceedings of the Royal Society of London A. 1958, 246 (1245): 216–19. Bibcode:1958RSPSA.246..216B. S2CID 137728239. doi:10.1098/rspa.1958.0123.
- ^ Ford, L. A.; Grundmeier, E. W. Chemical Magic
 . Dover. 1993: 76. ISBN 978-0-486-67628-9.
. Dover. 1993: 76. ISBN 978-0-486-67628-9.
- ^ Frierson, W. J.; Kronrad, J.; Browne, A. W. Chlorine Azide, ClN3. I. Journal of the American Chemical Society. 1943, 65 (9): 1696–1698. doi:10.1021/ja01249a012.
- ^ Lyhs, Benjamin; Bläser, Dieter; Wölper, Christoph; Schulz, Stephan; Jansen, Georg. Solid-State Structure of Bromine Azide (PDF). Angewandte Chemie International Edition. 20 February 2012, 51 (8): 1970–1974 [25 August 2021]. PMID 22250068. doi:10.1002/anie.201108092. (原始内容存档 (PDF)于25 August 2021).
- ^ Urben, P. G. Bretherick's Handbook of Reactive Chemical Hazards 1 6th. Butterworth-Heinemann. 1999. ISBN 0-7506-3605-X.
- ^ 50.0 50.1 50.2 50.3 50.4 Greenwood & Earnshaw 1997,第443–58頁.
- ^ Rahm, Martin; Dvinskikh, Sergey V.; Furó, István; Brinck, Tore. Experimental Detection of Trinitramide, N(NO2)3. Angewandte Chemie International Edition. 23 December 2010, 50 (5): 1145–48. PMID 21268214. S2CID 32952729. doi:10.1002/anie.201007047.
- ^ Wiberg, Egon; Holleman, Arnold Frederick. Inorganic Chemistry. Elsevier. 2001. ISBN 0-12-352651-5.
- ^ Hou, Y. C.; Janczuk, A.; Wang, P. G. Current trends in the development of nitric oxide donors. Current Pharmaceutical Design. 1999, 5 (6): 417–41. PMID 10390607. doi:10.2174/138161280506230110111042.
- ^ Talawar, M. B.; et al. Establishment of Process Technology for the Manufacture of Dinitrogen Pentoxide and its Utility for the Synthesis of Most Powerful Explosive of Today – CL-20. Journal of Hazardous Materials. 2005, 124 (1–3): 153–64. PMID 15979786. doi:10.1016/j.jhazmat.2005.04.021.
- ^ 55.0 55.1 55.2 55.3 55.4 55.5 55.6 55.7 Greenwood & Earnshaw 1997,第459–72頁.
- ^ Y. Petit, M. Larchevêque. Ethyl Glycidate from (S)-Serine: Ethyl (R)-(+)-2,3-Epoxypropanoate. Org. Synth. 1998, 75: 37. doi:10.15227/orgsyn.075.0037.
- ^ Adam P. Smith, Scott A. Savage, J. Christopher Love, Cassandra L. Fraser. Synthesis of 4-, 5-, and 6-methyl-2,2'-bipyridine by a Negishi Cross-coupling Strategy: 5-methyl-2,2'-bipyridine. Org. Synth. 2002, 78: 51. doi:10.15227/orgsyn.078.0051.
- ^ Lerfall J, Østerlie M. Use of sodium nitrite in salt-curing of Atlantic salmon (Salmo salar L.) – Impact on product quality. Food Chemistry. February 2011, 124 (3): 759–766. doi:10.1016/j.foodchem.2010.06.092.
- ^ Laue, Wolfgang; Thiemann, Michael; Scheibler, Erich; Wiegand, Karl Wilhelm, Nitrates and Nitrites, Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, 2005, doi:10.1002/14356007.a17_265
- ^ Eli S. Freeman. The Kinetics of the Thermal Decomposition of Potassium Nitrate and of the Reaction between Potassium Nitrite and Oxygen. J. Am. Chem. Soc. 1957, 79 (4): 838–842. doi:10.1021/ja01561a015.
- ^ Jansen, Martin. Crystal Structure of Na3NO4. Angewandte Chemie International Edition in English. 1979-08-31, 18 (9): 698–699. doi:10.1002/anie.197906982.
- ^ Quesada Cabrera, R.; Sella, A.; Bailey, E.; Leynaud, O.; McMillan, P.F. High-pressure synthesis and structural behavior of sodium orthonitrate Na3NO4 (PDF). Journal of Solid State Chemistry. April 2011, 184 (4): 915–920. Bibcode:2011JSSCh.184..915Q. doi:10.1016/j.jssc.2011.02.013.
- ^ 63.0 63.1 March, Jerry (1985). Advanced Organic Chemistry, Reactions, Mechanisms and Structure, third Edition, John Wiley & Sons. ISBN 0-471-85472-7.
- ^ Rédei, George P. Kjeldahl Method. Encyclopedia of Genetics, Genomics, Proteomics and Informatics. 2008: 1063. ISBN 978-1-4020-6753-2. doi:10.1007/978-1-4020-6754-9_9066.
- ^ Froehlich, Peter. A Sustainable Approach to the Supply of Nitrogen. www.parker.com. Parker Hannifin Corporation. May 2013 [24 November 2016]. (原始内容存档于16 March 2016).
- ^ Reich, Murray; Kapenekas, Harry. Nitrogen Purfication. Pilot Plant Removal of Oxygen. Industrial & Engineering Chemistry. 1957, 49 (5): 869–73. doi:10.1021/ie50569a032.
- ^ 67.0 67.1 67.2 67.3 67.4 Greenwood & Earnshaw 1997,第409–11頁.
- ^ 68.0 68.1 Bartlett, J. K. Analysis for nitrite by evolution of nitrogen: A general chemistry laboratory experiment. Journal of Chemical Education. 1967, 44 (8): 475. Bibcode:1967JChEd..44..475B. doi:10.1021/ed044p475.
- ^ Eremets, M. I.; Popov, M. Y.; Trojan, I. A.; Denisov, V. N.; Boehler, R.; Hemley, R. J. Polymerization of nitrogen in sodium azide. The Journal of Chemical Physics. 2004, 120 (22): 10618–23. Bibcode:2004JChPh.12010618E. PMID 15268087. doi:10.1063/1.1718250.
- ^ Ministers, Nordic Council of. Food Additives in Europe 2000. 2002: 591 [2015-12-20]. ISBN 978-92-893-0829-8. (原始内容存档于2016-02-05).
- ^ Harding, Charlie (编). Elements of the p Block. Cambridge: Royal Society of Chemistry. 2002 [2020-08-24]. ISBN 978-0-85404-690-4. (原始内容存档于2021-10-01).
- ^ Gavriliuk, V. G.; Berns, Hans. High nitrogen steels: structure, properties, manufacture, applications. Springer. 1999 [2020-08-24]. ISBN 978-3-540-66411-6. (原始内容存档于2021-10-01).
- ^ Meka, S. R.; Chauhan, A.; Steiner, T.; Bischoff, E.; Ghosh, P. K.; Mittemeijer, E. J. Generating duplex microstructures by nitriding; nitriding of iron based Fe–Mn alloy. Materials Science and Technology. 2015, 32 (9): 1743284715Y.000. doi:10.1179/1743284715Y.0000000098
 .
.
- ^ Why don't they use normal air in race car tires?. Howstuffworks. 2001-03-16 [2006-07-22]. (原始内容存档于2011-07-12).
- ^ Kaganer, M. G.; Kozheurov, V. & Levina, Zh. L. Vessels for the storage and transport of liquid oxygen and nitrogen. Chemical and Petroleum Engineering. 1967, 3 (12): 918–22. S2CID 96762552. doi:10.1007/BF01136404.
- ^ Ahmed I; Agarwal S; Ilchyshyn A; Charles-Holmes S; Berth-Jones J. Liquid nitrogen cryotherapy of common warts: cryo-spray vs. cotton wool bud. Br. J. Dermatol. May 2001, 144 (5): 1006–09. PMID 11359389. S2CID 221325640. doi:10.1046/j.1365-2133.2001.04190.x.
- ^ Biology Safety – Cryogenic materials. The risks posed by them. University of Bath. [2007-01-03]. (原始内容存档于February 6, 2007).
- ^ Space Shuttle Columbia Fast Facts. CNN. September 30, 2013 [January 20, 2016]. (原始内容存档于February 2, 2016).
- ^ Fowler, B.; Ackles, K. N.; Porlier, G. Effects of inert gas narcosis on behavior – a critical review. Undersea Biomed. Res. 1985, 12 (4): 369–402 [2008-09-21]. PMID 4082343. 原始内容存档于2010-12-25.
- ^ Rogers, W. H.; Moeller, G. Effect of brief, repeated hyperbaric exposures on susceptibility to nitrogen narcosis. Undersea Biomed. Res. 1989, 16 (3): 227–32 [2008-09-21]. OCLC 2068005. PMID 2741255. 原始内容存档于2009-09-01.
- ^ Acott, C. A brief history of diving and decompression illness. South Pacific Underwater Medicine Society Journal. 1999, 29 (2) [2008-09-21]. OCLC 16986801. 原始内容存档于2011-09-05.
- ^ Kindwall, E. P.; Baz, A.; Lightfoot, E. N.; Lanphier, E. H.; Seireg, A. Nitrogen elimination in man during decompression. Undersea Biomed. Res. 1975, 2 (4): 285–97 [2008-09-21]. OCLC 2068005. PMID 1226586. 原始内容存档于2011-07-27.
- ^ US Navy Diving Manual, 6th revision. United States: US Naval Sea Systems Command. 2006 [2008-04-24]. (原始内容存档于2008-05-02).
- ^ Walker, Jearl. Boiling and the Leidenfrost Effect (PDF). Fundamentals of Physics: 1–4. [11 October 2014]. (原始内容存档 (PDF)于13 December 2019).
- ^ Liquid nitrogen cocktail leaves teen in hospital. BBC News. 2012-10-08. (原始内容存档于2017-04-12).
- ^ British Compressed Gases Association (2000) BCGA Code of Practice CP30. The Safe Use of Liquid nitrogen Dewars up to 50 litres.. ISSN 0260-4809. (原始内容存档于2007-07-18)..
- ^ Confined Space Entry – Worker and Would-be Rescuer Asphyxiated (PDF). Valero Refinery Asphyxiation Incident Case Study. (原始内容 (PDF)存档于2015-09-22).
- ^ Inquiry after man dies in chemical leak. BBC News. 1999-10-25. (原始内容存档于2017-01-07).
- ^ Liquid Nitrogen – Code of practice for handling. United Kingdom: Birkbeck, University of London. 2007 [2012-02-08]. (原始内容存档于2018-06-12).
- ^ Levey, Christopher G. Liquid Nitrogen Safety. Thayer School of Engineering at Dartmouth. [2016-11-23]. (原始内容存档于2016-03-05).
延伸阅读
[编辑]- Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4.
外部链接
[编辑]- 元素氮在洛斯阿拉莫斯国家实验室的介紹(英文)
- EnvironmentalChemistry.com —— 氮(英文)
- 元素氮在The Periodic Table of Videos(諾丁漢大學)的介紹(英文)
- 元素氮在Peter van der Krogt elements site的介紹(英文)
- WebElements.com – 氮(英文)
- Etymology of Nitrogen (页面存档备份,存于互联网档案馆)
- Why high nitrogen density in explosives? (页面存档备份,存于互联网档案馆)
- It's Elemental – Nitrogen (页面存档备份,存于互联网档案馆)
- Chemistry in its element podcast (MP3) from the Royal Society of Chemistry's Chemistry World: Nitrogen (页面存档备份,存于互联网档案馆)
- Schenectady County Community College – Nitrogen
- Nitrogen N2 Properties, Uses, Applications (页面存档备份,存于互联网档案馆)
- Handling procedures for liquid nitrogen
- Material Safety Data Sheet
- 氮元素的介紹影片 (页面存档备份,存于互联网档案馆)