谷氨酸
| 谷氨酸 | |
|---|---|
| |

| |
| |

| |
| IUPAC名 Glutamic acid 2-Aminopentanedioic acid 2-氨基戊二酸 | |
| 缩写 | Glu, E |
| 识别 | |
| CAS号 | 56-86-0((L isomer)) 617-65-2((D/L racemate)) |
| ChemSpider | 591 |
| SMILES |
|
| InChI |
|
| InChIKey | WHUUTDBJXJRKMK-UHFFFAOYAD |
| ChEBI | 18237 |
| KEGG | D0434 |
| 性质 | |
| 化学式 | C5H9NO4 |
| 摩尔质量 | 147.13 g·mol⁻¹ |
| 熔点 | 247~249 ℃ |
| 溶解性(水) | 8.57 g/L [1] |
| 溶解性 | 乙醇: 350 μg/100 g (25 °C)[2] |
| pKa | 2.10, 4.07, 9.47[3] |
| 磁化率 | −78.5·10−6 cm3/mol |
| 危险性 | |
GHS危险性符号
| |
| GHS提示词 | Warning |
| H-术语 | H315, H319, H335 |
| P-术语 | P261, P264, P271, P280, P302+352, P304+340, P305+351+338, P312, P321, P332+313, P337+313, P362, P403+233, P405 |
| NFPA 704 | |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
| “Glutamic acid”的各地常用名称 | |
|---|---|
| 中国大陆 | 谷氨酸 |
| 台湾 | 麸胺酸 |
| 港澳 | 谷氨酸 |
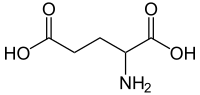
谷氨酸(英语:Glutamic acid)(符号 Glu或E[4],阴离子形式称为谷氨酸 glutamate),学名α-氨基戊二酸,是一种 α-氨基酸,几乎所有生物都在蛋白质的生物合成中使用它。谷氨酸是组成生物体内各种蛋白质的20种氨基酸之一。它是人类的非必需氨基酸,这意味著人体可以合成足够的营养素来供其使用。 它也是脊椎动物神经系统中最丰富的兴奋性神经传导物质。 它是 GABA 能神经元中合成抑制性γ-氨基丁酸 (GABA) 的前体。
其分子式为C
5H
9NO
4。谷氨酸以两种旋光异构体形式存在; 右旋L型通常是透过麸质水解或从甜菜糖生产废水或发酵中获得的[5]。其分子结构可理想化为HOOC−CH(NH
2)−(CH
2)2−COOH,具有两个羧基-COOH和一个氨基−NH
2。
历史
[编辑]尽管谷氨酸和其他氨基酸天然存在于许多食物中,但直到20世纪初才透过科学手段鉴定出其风味贡献。 这种物质是由德国化学家Karl Heinrich Ritthausen于1866年发现并鉴定的,他用硫酸处理了小麦麸质(因此得名麸质gluten)[6]。 1908年,日本东京帝国大学研究员池田菊苗鉴定出大量海带汤蒸发后留下的棕色结晶是谷氨酸。 这些晶体在品尝时,重现了他在许多食物中发现的不可言喻但不可否认的味道,尤其是在海藻中。 池田教授将这种味道称为鲜味(umami)。 随后,他获得了大规模生产谷氨酸结晶盐、味精(麸胺酸钠, Monosodium glutamate, MSG)的方法的专利[7][8]。
化学
[编辑]电离
[编辑]
当谷氨酸溶于水时,胺基(−NH
2)可能获得质子(H+
),和/或羧基可能会失去质子,这取决于介质的酸度。
在足够酸性的环境中,两个羧基都被质子化,分子变成带有单一正电荷的阳离子,HOOC−CH(NH+
3)−(CH
2)2−COOH.[9]
在pH值约2.5至4.1之间时,[9] 更接近胺的羧酸通常会失去一个质子,酸变成中性的两性离子,−OOC−CH(NH+
3)−(CH
2)2−COOH。这也是结晶固态化合物的形式。[10][11]质子化状态的改变是逐渐进行的;在pH值为2.10时,两种形式的浓度相等。[12]
在较高的pH值下,另一个羧酸基失去其质子,酸几乎完全以谷氨酸阴离子的形式存在−OOC−CH(NH+
3)−(CH
2)2−COO−,整体带有单一负电荷。质子化状态的改变发生在pH值为4.07时。[12]这种两种缺乏质子的羧酸盐的形式在生理pH值范围 (7.35–7.45) 中占主导地位。
在更高的pH值下,氨基会失去额外的质子,而普遍存在的物质是双负离子−OOC−CH(NH
2)−(CH
2)2−COO−。质子化状态的变化发生在pH值为9.47时。[12]
光学异构现象
[编辑]谷氨酸是手性的; 存在两种镜像对映异构体:d(−) 和 l(+)。 l型在自然界中更广泛存在,但d型出现在一些特殊的环境中,例如细菌的荚膜和细菌的细胞壁(通过谷氨酸消旋酶从l型产生它)和哺乳动物的肝脏.[13][14]
合成
[编辑]生物合成
[编辑]| 反应物 | 产物 | 酶 | |
|---|---|---|---|
| 谷氨酰胺 + H2O | → | Glu + NH3 | GLS, GLS2 |
| NAcGlu + H2O | → | Glu + 乙酸盐 | N-Acetyl-glutamate synthase |
| α-Ketoglutarate + 烟酰胺腺嘌呤二核苷酸磷酸H + NH4+ | → | Glu + 烟酰胺腺嘌呤二核苷酸磷酸+ + H2O | GLUD1, GLUD2[15] |
| α-Ketoglutarate + α-amino acid | → | Glu + α-keto acid | Transaminase |
| 1-Pyrroline-5-carboxylate + NAD+ + H2O | → | Glu + NADH | ALDH4A1 |
| N-Formimino-L-glutamate + FH4 | → | Glu + 5-formimino-FH4 | FTCD |
| NAAG | → | Glu + NAA | GCPII |
工业合成
[编辑]谷氨酸是胺基酸中生产规模最大的,2006年估计年产量约150万吨。[16]
谷氨酸的生物重要性
[编辑]- 谷氨酸是动物体内中枢神经系统的一种重要的兴奋性神经递质。它的特异性受体有三大类:AMPA(α-氨基-3-羟基-5-甲基-4-异唑丙酸),NMDA(N-甲基-D-天冬氨酸)和卡英酸(Kainate,红藻氨酸/海人藻酸)。
- 谷氨酸,在医学上主要用于治疗肝性昏迷,还用于改善儿童智力发育;食品工业上,味精是常用的增鲜剂,其主要成分是谷氨酸钠盐。
- 加工食品常含有人工抽取的谷氨酸,在食物包装上以不同名称列出。有研究[来源请求]指出会影响新陈代谢,增加肥胖的机会,甚至影响其他身体机能。
功能与用途
[编辑]代谢
[编辑]谷氨酸是细胞代谢中的关键化合物。 在人类中,膳食蛋白质经由消化分解成氨基酸,氨基酸作为体内其他功能作用的代谢燃料。 氨基酸降解的关键过程是转氨基作用,其中氨基酸的氨基转移为 α-酮酸,通常由转氨酶催化。这种反应可以概括为:
- R1-氨基酸 + R2-α-酮酸 ⇌ R1-α-酮酸 + R2-氨基酸
一种非常常见的α-酮酸是α-酮戊二酸,它是柠檬酸循环的中间体。α-酮戊二酸的转氨作用产生麸胺酸。所得的 α-酮酸产品通常也是有用的,它可以作为燃料或作为进一步代谢过程的底物。
丙酮酸和草酰乙酸都是细胞代谢的关键成分,在糖解作用、糖质新生作用和柠檬酸循环等基本过程中充当底物或中间体。
神经传导物质
[编辑]谷氨酸是脊椎动物神经系统中最丰富的兴奋性神经传导物质(英语:neurotransmitter)。[17] 在化学突触中,谷氨酸储存在囊泡中。神经冲动触发突触前细胞释放谷氨酸。谷氨酸作用于离子型和代谢型(G蛋白偶联)受体。[17] 在相对的突触后细胞中,谷氨酸受体(例如NMDA受体或AMPA受体)与谷氨酸结合并被活化。由于其在突触可塑性中的作用,谷氨酸参与大脑中的学习和记忆等认知功能。[18]被称为长期增强作用 (LTP) 的可塑性形式发生在海马体、新皮质和大脑其他部分的谷氨酸突触中。谷氨酸不仅充当点对点发射器 (point-to-point transmitter),还透过突触之间的溢出突触串扰起作用,其中从邻近突触释放的谷氨酸的总和创建突触外信号/大批量传输。[19]此外,正如马克·马特森 (Mark Mattson) 最初描述的那样,谷氨酸在大脑发育过程中生长锥和突触发生 (synaptogenesis) 的调节中发挥重要作用。
大脑非突触谷氨酸讯号传导回路
[编辑]发现果蝇大脑中的细胞外谷氨酸透过涉及受体脱敏的过程来调节突触后谷氨酸受体聚集。[20]神经胶质细胞中表现的基因主动将谷氨酸转运到细胞外空间,[20],而在刺激伏隔核II类代谢型谷氨酸受体中,该基因被发现可以降低细胞外谷氨酸水平。[21]这提出了这种细胞外谷氨酸作为更大的稳态系统的一部分发挥“类似内分泌”作用的可能性。
GABA前体
[编辑]此章节尚无任何内容,需要扩充。 |
增味剂
[编辑]谷氨酸是蛋白质的组成部分,存在于含有蛋白质的食物中,但只有以未结合的形式存在时才能品尝。多种食物中都含有大量的游离谷氨酸,包括干酪和酱油,谷氨酸负责鲜味,鲜味是人类味觉的五种基本味道之一。谷氨酸通常以其钠盐(称为味精(MSG))的形式用作食品添加剂和风味增强剂。
营养
[编辑]此章节尚无任何内容,需要扩充。 |
植物生长剂
[编辑]Auxigro是一种含有30%谷氨酸的植物生长制剂。
核磁共振波谱
[编辑]近年来,[何时?]人们对残馀偶极耦合 (Residual dipolar coupling, RDC) 在核磁共振波谱 (NMR) 中的应用进行了大量研究。谷氨酸衍生物聚-γ-芐基-L-谷氨酸 (PBLG) 通常用作对齐介质来控制观察到的偶极相互作用的规模。[22]
谷氨酸在衰老中的作用
[编辑]此章节尚无任何内容,需要扩充。 |
药理学
[编辑]此章节尚无任何内容,需要扩充。 |
参见
[编辑]参考文献
[编辑]- ^ L-Glutamic acid. National Library of Medicine. [24 June 2023]. (原始内容存档于2023-10-06).
- ^ Belitz, H.-D.; Grosch, Werner; Schieberle, Peter. Food Chemistry. Springer. 2009-02-27. ISBN 978-3540699330.
- ^ Amino Acid Structures. cem.msu.edu. (原始内容存档于1998-02-11).
- ^ Nomenclature and Symbolism for Amino Acids and Peptides. IUPAC-IUB Joint Commission on Biochemical Nomenclature. 1983 [2018-03-05]. (原始内容存档于2017-08-29).
- ^ Webster's Third New International Dictionary of the English Language Unabridged, Third Edition, 1971.
- ^ R. H. A. Plimmer. R. H. A. Plimmer; F. G. Hopkins , 编. The Chemical Constitution of the Protein. Monographs on biochemistry. Part I. Analysis 2nd. London: Longmans, Green and Co. 1912: 114 [1908] [June 3, 2012].
- ^ Renton, Alex. If MSG is so bad for you, why doesn't everyone in Asia have a headache?. The Guardian. 2005-07-10 [2008-11-21]. (原始内容存档于2008-10-12).
- ^ Kikunae Ikeda Sodium Glutamate. Japan Patent Office. 2002-10-07 [2008-11-21]. (原始内容存档于2007-10-28).
- ^ 9.0 9.1 Albert Neuberger (1936), "Dissociation constants and structures of glutamic acid and its esters". Biochemical Journal, volume 30, issue 11, article CCXCIII, pp. 2085–2094. PMC 1263308
 .
.
- ^ Rodante, F.; Marrosu, G. Thermodynamics of the second proton dissociation processes of nine α-amino-acids and the third ionization processes of glutamic acid, aspartic acid and tyrosine. Thermochimica Acta. 1989, 141: 297–303. Bibcode:1989TcAc..141..297R. doi:10.1016/0040-6031(89)87065-0.
- ^ Lehmann, Mogens S.; Koetzle, Thomas F.; Hamilton, Walter C. Precision neutron diffraction structure determination of protein and nucleic acid components. VIII: the crystal and molecular structure of the β-form of the amino acidl-glutamic acid. Journal of Crystal and Molecular Structure. 1972, 2 (5): 225–233. Bibcode:1972JCCry...2..225L. S2CID 93590487. doi:10.1007/BF01246639.
- ^ 12.0 12.1 12.2 William H. Brown and Lawrence S. Brown (2008), Organic Chemistry (5th edition). Cengage Learning. p. 1041. ISBN 0495388572、978-0495388579.
- ^ National Center for Biotechnology Information, "D-glutamate". PubChem Compound Database, CID=23327. Accessed 2017-02-17.
- ^ Liu, L.; Yoshimura, T.; Endo, K.; Kishimoto, K.; Fuchikami, Y.; Manning, J. M.; Esaki, N.; Soda, K. Compensation for {{{2}}}-glutamate auxotrophy of Escherichia coli WM335 by {{{2}}}-amino acid aminotransferase gene and regulation of murI expression. Bioscience, Biotechnology, and Biochemistry. 1998, 62 (1): 193–195. PMID 9501533. doi:10.1271/bbb.62.193
 .
.
- ^ Grabowska, A.; Nowicki, M.; Kwinta, J. Glutamate dehydrogenase of the germinating triticale seeds: Gene expression, activity distribution and kinetic characteristics. Acta Physiologiae Plantarum. 2011, 33 (5): 1981–1990. doi:10.1007/s11738-011-0801-1
 .
.
- ^ Alvise Perosa; Fulvio Zecchini. Methods and Reagents for Green Chemistry: An Introduction. John Wiley & Sons. 2007: 25. ISBN 978-0-470-12407-9.
- ^ 17.0 17.1 Meldrum, B. S. Glutamate as a neurotransmitter in the brain: Review of physiology and pathology. The Journal of Nutrition. 2000, 130 (4S Suppl): 1007S–1015S. PMID 10736372. doi:10.1093/jn/130.4.1007s
 .
.
- ^ McEntee, W. J.; Crook, T. H. Glutamate: Its role in learning, memory, and the aging brain. Psychopharmacology. 1993, 111 (4): 391–401. PMID 7870979. S2CID 37400348. doi:10.1007/BF02253527.
- ^ Okubo, Y.; Sekiya, H.; Namiki, S.; Sakamoto, H.; Iinuma, S.; Yamasaki, M.; Watanabe, M.; Hirose, K.; Iino, M. Imaging extrasynaptic glutamate dynamics in the brain. Proceedings of the National Academy of Sciences. 2010, 107 (14): 6526–6531. Bibcode:2010PNAS..107.6526O. PMC 2851965
 . PMID 20308566. doi:10.1073/pnas.0913154107
. PMID 20308566. doi:10.1073/pnas.0913154107  .
.
- ^ 20.0 20.1 Augustin H, Grosjean Y, Chen K, Sheng Q, Featherstone DE. Nonvesicular Release of Glutamate by Glial xCT Transporters Suppresses Glutamate Receptor Clustering In Vivo. Journal of Neuroscience. 2007, 27 (1): 111–123. PMC 2193629
 . PMID 17202478. doi:10.1523/JNEUROSCI.4770-06.2007.
. PMID 17202478. doi:10.1523/JNEUROSCI.4770-06.2007.
- ^ Zheng Xi; Baker DA; Shen H; Carson DS; Kalivas PW. Group II metabotropic glutamate receptors modulate extracellular glutamate in the nucleus accumbens. Journal of Pharmacology and Experimental Therapeutics. 2002, 300 (1): 162–171. PMID 11752112. doi:10.1124/jpet.300.1.162.
- ^ C. M. Thiele, Concepts Magn. Reson. A, 2007, 30A, 65–80


