鉛
鉛(拼音:qiān,注音:ㄑㄧㄢ,粵拼:jyun4;英語:Lead),是一種化學元素,其化學符號為Pb[3](源於拉丁語:Plumbum),原子序數為82,原子量為207.2 u。鉛是比大多數常見材料密度更高的重金屬。它是柔軟、可鍛鑄、熔點較低的金屬。剛切割出來的鉛呈略帶藍色的銀色,但暴露在空氣中後會失去光澤,變成暗灰色。鉛是原子序最高的穩定元素,其三個穩定同位素是較重元素的主要衰變鏈的終點。
鉛是一種較不易反應的後過渡金屬。它的弱金屬性由其兩性性質展現:鉛傾向形成共價鍵,而它和它的氧化物與酸、鹼都會反應。和其它碳族元素的+4氧化態不同,鉛在其化合物中通常以+2氧化態出現,但在有機鉛化合物中則和其它碳族元素一樣以+4氧化態出現。鉛傾向與自身結合成鏈狀和多面體結構,這點與其它碳族元素類似。
鉛很容易從其礦石中提取出來,這使得近東人很早就發現了它。方鉛礦是鉛的主要礦石,而這種礦石通常帶有銀。對銀的需求使得古羅馬開始廣泛提取和使用鉛。鉛的產量在羅馬帝國衰落後下降,直到工業革命才達到相比的水平。鉛合金因為可以鑄造印刷機的活字,所以在印刷機的發展中發揮了至關重要的作用。[4]在2014年,鉛的全球年產量約為1000萬噸,其中一半以上來自回收。鉛的高密度、低熔點、延展性和對氧化的相對惰性使其有用。這些特性加上其相對豐富含量和低成本,使其廣泛用於建築、管路系統、鉛酸蓄電池、彈頭和散彈彈丸、砝碼、銲料、白鑞、易熔合金、含鉛油漆、含鉛汽油和輻射屏蔽。
鉛的毒性在19世紀後期廣為人知,因此在許多應用中逐步淘汰。鉛是會在軟組織和骨骼中積累的神經毒素,會損害神經系統並干擾生物酶的功能,導致神經系統疾病。此外,鉛還會影響健康、心血管和腎臟系統。
物理性質
[編輯]純鉛是亮銀色,帶有一絲藍色的金屬,[5]在濕氣下失去光澤。鉛有高密度、延展性和因為鈍化造成的抗腐蝕性。[6]

鉛的最密堆積結構和高原子量造成了11.34 g/cm3的高密度,[7]比鐵(7.87 g/cm3)、銅(8.93 g/cm3)和鋅(7.14 g/cm3)等常見金屬的密度高。[8]一些如鎢和金(都是19.3 g/cm3)的金屬有更高的密度,而已知密度最大的金屬鋨的密度為22.59 g/cm3,幾乎是鉛的兩倍。[9]
鉛很軟,莫氏硬度僅為1.5,可以用指甲刮痕。[10]它有良好的展性和略微的延性。[11][a]鉛的體積模量為45.8 GPa。作為比較,鋁的體積模量為75.2 GPa,銅為137.8 GPa,低碳鋼則為160–169 GPa。[12]鉛的強度較低,為12–17 MPa(鋁的強度是它的六倍,銅為十倍,低碳鋼則為十五倍),但可以通過加入少量銅或銻強化。[13]
相較於其它金屬,鉛的熔點很低,只有327.5 °C(621.5 °F)[14]。[7][b]它的沸點是所有碳族元素中最低的,為1,749 °C(3,180 °F)。[14]鉛在20 °C下的電阻率為192 nΩ·m,比其它工業金屬(銅為15.43 nΩ·m,金為20.51 nΩ·m,鋁為24.15 nΩ·m)大了一個數量級。[16]鉛在7.19 K以下會轉變成超導體。[17]這個超導臨界溫度是第一類超導體中最高的,也是單質超導體中第三高的。[18]
原子性質
[編輯]鉛有82個電子,電子排布為 [Xe]4f145d106s26p2。照理來說,元素週期表越往下,元素的外層電子離原子核越遠,較低軌道的屏蔽效應越強,電離能就越低,但鉛的第一和第二電離能的總和(移除兩個6p電子所需的能量)比上面的錫略高。這個現象是由鑭系收縮導致的。和元素周期律預測的相反,鉛的前四個電離能的總和比錫高。[19]在重元素中變得顯著的相對論效應的影響也促成了這種現象。[c]相對論效應導致了惰性電子對效應,使得鉛的6s電子難以參與鍵合,因此鉛晶體中最近原子之間的距離異常的長。[21]
較輕的碳族元素由於其s軌道和p軌道的能量足夠近,可以雜化成四個 sp3軌道,因此都可以形成穩定或亞穩定的四配位鑽石結構同素異形體。不過,鉛因為惰性電子對效應而導致s軌道和p軌道的能量差距變大,而這個大差距使得鉛的晶格能無法彌補雜化軌道所需的能量。[22]因此,鉛不形成鑽石結構,而是使p電子離域,形成金屬鍵和面心立方結構。[23]其它有相似大小[24]的二價金屬鈣和鍶也會形成這種結構。[25][d]
同位素
[編輯]鉛有四種自然存在的穩定同位素:鉛-204、鉛-206、鉛-207和鉛-208[27]以及痕量的五種短壽命放射性同位素。[28]鉛的質子數82是幻數,因此核殼層模型認為鉛的原子核很穩定。[29]鉛-208的中子數126是另一個幻數,這使得它更加穩定。[29]
鉛是最重的穩定元素,而鉛-208是所有元素中最重的穩定同位素(以前認為原子序83的鉍是最重的穩定元素,但在2003年發現它唯一的原生核素鉍-209有極弱的放射性[e])。鉛的四種穩定同位素理論上都可以α衰變成汞的同位素並釋放能量,但至今仍未觀察到衰變,半衰期預測在1035至10189年之間。[32]
鉛-206、鉛-207和鉛-208分別是鈾-238、鈾-235和釷-232衰變的最終產物[33],它們的衰變鏈分別叫做鈾衰變鏈、錒衰變鏈和釷衰變鏈。[34]鉛同位素的豐度會因為鈾或釷的存在而可能有很大的變化。舉個例子,鉛-208正常的同位素豐度為52%,但在釷礦中的豐度可高達90%。[35]因此,鉛的標準原子質量只能精確到十分位。[36]隨着時間流逝,鉛-206和鉛-207的數量會因為鈾的衰變而增加,但鉛-204不會增加,因此它們的比例可用於測年。隨着鈾衰變成鉛,它們的比例也會改變,這也是鈾鉛測年法可以使用的基礎。[37]鉛-207會發生核磁共振,可用於研究其溶液和固態化合物,[38][39]甚至包括人體。[40]

除了穩定同位素以外,鉛還有一些痕量同位素。其中一種痕量同位素是鉛-210,雖然半衰期只有22.2年,[27]但在自然界中仍以鈾-238的衰變產物少量存在。鉛-211、鉛-212和鉛-214也都分別存在於鈾-235、釷-232和鈾-238的衰變鏈中,因此這三種鉛同位素都存在於自然界。極痕量的鉛-209可由鈾-235的衰變產物鐳-223罕見的簇衰變而成,或是在鎿-237(由鈾的中子捕獲而成)的衰變中產生。通過測量鉛-210和鉛-206(都存在於同一條衰變鏈中)的比例,可以得出樣本的年齡。[41]
人們已發現43種鉛的同位素,原子量在178–220之間。[27]其中,鉛-205是最穩定的放射性同位素,半衰期1.70×107年。[42][f]第二穩定的同位素是鉛-202,半衰期為52,500年,比所有鉛的天然放射性同位素長。[27]
化學性質
[編輯]
塊狀的鉛在濕氣下會形成含有各種成分的保護層。這層保護層主要是鹼式碳酸鉛,[44][45][46]而在城市或海洋則可能產生硫酸鉛或氯化鉛。[47]這層保護層使得塊狀鉛對空氣呈惰性。[47]和大部分金屬一樣,鉛粉會自燃,[48]並產生藍白色的火焰。[49]
氟氣在室溫下就能和鉛反應,形成氟化鉛。氯氣需要加熱才能發生反應,而且產生的氯化鉛會阻止反應。[47]熔融的鉛會和氧族元素反應,生成對應的化合物。[50]
金屬鉛可以抵禦硫酸和磷酸,但不能抵禦鹽酸和硝酸。[51]乙酸等有機酸在氧氣存在下可以溶解鉛。[47]濃鹼也可以溶解鉛,生成亞鉛酸鹽。[52]
無機化合物
[編輯]鉛有兩種常見的氧化態+4和+2。碳族元素通常以四價存在,而二價的碳族元素較罕見。二價錫佔了錫化學重要的一部分,但它仍比四價錫少見。不過,二價鉛化合物卻要比四價鉛化合物多。[47]這個現象是惰性電子對效應導致的,結果就是鉛的6s軌道收縮,使它在離子化合物中變得惰性。惰性電子對效應在共價化合物(例如有機鉛化合物)中沒那麼明顯。在這些化合物中,6s和6p軌道的大小接近,可以發生sp3雜化,因此鉛在這些化合物中和碳一樣主要以四價存在。[53]
鉛(II)和鉛(IV)的電負性差距很大(分別是1.87和2.23),表明碳族元素+4氧化態的穩定性隨着族往下而下降。作為比較,錫(II)和錫(IV)的電負性差距不大,分別是1.80和1.96。[54]
鉛(II)
[編輯]
無機鉛化合物中的鉛通常以+2氧化態存在。就算是像氟氣和氯氣這樣的強氧化劑也只能將鉛氧化到PbF2和PbCl2。[47]Pb2+離子通常無色,[55]會部分水解成Pb(OH)+和[Pb4(OH)4]4+(其中的氫氧根是橋接配體),[56][57]其還原性不如錫(II)。Pb2+的定性分析通常依賴它和稀鹽酸反應生成的氯化鉛沉澱。由於氯化鉛的溶解度不是特別小,所以在極稀溶液中會往溶液通入硫化氫,通過生成的硫化鉛來檢測Pb2+。[58]
一氧化鉛有兩種同質異形體,分別是紅色的密陀僧 α-PbO和黃色的黃丹 β-PbO,後者只在488 °C以上穩定。密陀僧是最常用的無機鉛化合物。[59]因為增加鉛(II)溶液的pH會使其水解,所以氫氧化鉛並不存在。[60]鉛會和較重的氧族元素反應。硫化鉛是半導體和光導體,還可以製造極敏感的紅外線探測器。另外兩種氧族元素化合物——硒化鉛和碲化鉛也都是光導體。它們的顏色隨着族往下而變淺。[61]

包括二砹化鉛[62]和像是PbFCl的混合鹵化物在內的二鹵化鉛都獲得了良好的表徵。除二氟化鉛以外的二鹵化鉛(特別是碘化鉛)在光照下都會分解。[63]許多鉛(II)的擬鹵化物都是已知的,例如其氰化物、氰酸鹽和硫氰酸鹽。[61][64]鉛(II)可以形成多種鹵素配離子,例如[PbCl4]2−、[PbCl6]4−和鏈狀離子[Pb2Cl9]n5n−。[63]
和其它二價重金屬的硫酸鹽一樣,硫酸鉛不溶於水。硝酸鉛和乙酸鉛極易溶於水,因此可用於合成其它鉛化合物。[65]
鉛(IV)
[編輯]無機鉛(IV)化合物不多,僅在強氧化性溶液中形成,通常不存在於標準條件下。[66]一氧化鉛可以繼續被氧化成Pb3O4,它的結構被描述為氧化鉛(II,IV)或2PbO·PbO2,是鉛最著名的混合價態化合物。二氧化鉛是強氧化劑,可以把鹽酸氧化成氯氣,[67]這是因為反應應該產生的PbCl4不穩定,會分解成PbCl2和Cl2。[68]類似一氧化鉛可以形成亞鉛酸鹽,二氧化鉛也可以形成鉛酸鹽。二硫化鉛[69]和二硒化鉛[70]都只在高壓下穩定。四氟化鉛(黃色晶體)是穩定的,但穩定性比二氟化鉛低。四氯化鉛(黃色油狀液體)在室溫下就會分解,四溴化鉛更不穩定,而四碘化鉛是否存在仍是問題。[71]
其它氧化態
[編輯]
一些鉛化合物中的鉛不以+4或+2氧化態存在。鉛(III)存在於較大的有機鉛化合物中,但因Pb3+和其配合物都是自由基而不穩定[73][74][75],存在於某些自由基中的鉛(I)也是如此。[76]
許多鉛(II)和鉛(IV)的混合氧化物是已知的。在空氣下加熱PbO2到293 °C會使其分解成Pb12O19,在351 °C下分解成Pb12O17,在374 °C下分解成Pb3O4,最終在605 °C下分解成PbO。Pb2O3和各種非整比氧化物可以在高壓下製備。這些氧化物大多呈有缺陷的螢石結構,其中一些應該是由氧佔據的地方被空位佔據。PbO的晶體結構也可以看作是有缺陷的螢石結構,其中每個交替的氧原子層都被空位取代。[77]
負價鉛存在於津特耳相中,例如Ba2Pb中的Pb(−IV)[78]和各種多面體形的簇合物(如三角雙錐形的Pb52−離子,其中有兩個鉛原子的氧化態為-1,另外三個為0[79]),可由在液氨里用鈉還原鉛而成。[80]
有機鉛化合物
[編輯]
碳
氫
鉛
和其它碳族元素一樣,鉛可以成鏈,但因為Pb–Pb鍵鍵能要比C–C鍵鍵能低很多而成鏈傾向較低。[50]鉛也可以形成雙鍵和三鍵。[81]它和碳成鍵成有機鉛化合物,但這些化合物因為Pb–C鍵較弱[56]而比普通的有機化合物不穩定。[82]這使得有機鉛化學的研究要比有機錫化學少。[83]有機鉛化合物的鉛通常以+4氧化態存在,但也有Pb[CH(SiMe3)2]2和Pb(η5-C5H5)2等例外。[83]
最簡單的有機化合物甲烷對應的鉛化合物是鉛烷,可由金屬鉛和氫原子反應而成。[84]它的衍生物四甲基鉛和四乙基鉛是最著名的有機鉛化合物。這些衍生物比較穩定,四乙基鉛在加熱[85]或光照下才會分解。[86][g]鈉鉛合金會和鹵代烴反應,生成如四乙基鉛的有機鉛化合物。[87]四乙酸鉛是實驗室中重要的氧化劑,可用於有機合成。[88]在四乙基鉛仍然可以添加到汽油的時代,它的產量比任何有機金屬化合物都要高。[83]其它有機鉛化合物都不穩定,[82]大部分有機化合物都沒有對應的鉛化合物。[84]
起源與存量
[編輯]| 原子序 | 元素 | 相對豐度 |
|---|---|---|
| 42 | 鉬 | 0.798 |
| 46 | 鈀 | 0.440 |
| 50 | 錫 | 1.146 |
| 78 | 鉑 | 0.417 |
| 80 | 汞 | 0.127 |
| 82 | 鉛 | 1 |
| 90 | 釷 | 0.011 |
| 92 | 鈾 | 0.003 |
太空
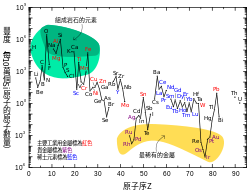
[編輯]鉛在太陽系的豐度是0.121 ppb,[89][h]是鉑的兩倍半,汞的八倍,金的十七倍。[89]由於更重的元素都會衰變成鉛[90],因此宇宙中鉛的豐度在不斷上升。[91]現在太陽系中鉛的豐度要比45億年前高出0.75%。[92]左邊的圖表顯示雖然鉛的原子序較高,但它的豐度要比大部分原子序大於40的元素高。[89]
鉛的穩定同位素鉛-204、鉛-206、鉛-207和鉛-208大多是由恆星中原子核不斷通過s-過程和r-過程捕獲中子而成的。[93]在s-過程中(s代表慢),每次中子捕獲都需要等待幾年或幾十年,使得較不穩定的原子核有足夠時間發生β衰變。[94]穩定的鉈-203捕獲一個中子成鉈-204,後者會β衰變成鉛-204。鉛-204捕獲另一個中子成半衰期1700萬年的鉛-205,之後繼續捕獲中子產生鉛-206、鉛-207和鉛-208,鉛-208再捕獲中子就會產生會迅速衰變成鉍-209的鉛-209。鉍-209會捕獲中子成鉍-210,之後β衰變成釙-210,最後α衰變成鉛-206,s-過程就在鉛-206、鉛-207、鉛-208和鉍-209的循環中結束。[95]
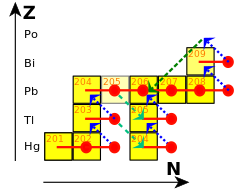
在r-過程中(r代表快),原子核捕獲中子的速度要比衰變的速度快。[96]r-過程會在如超新星或兩個中子星合併時等有大量中子的環境中發生,中子流通量可達每秒每平方厘米1022個中子。[97]r-過程產生的鉛的數量不如s-過程。[98]126個中子在原子核中會排列成完整的殼層,在能量上容納更多中子會變得更加困難,[99]因此r-過程會在原子核達到126個中子時停止。[100]當中子流減少時,這些原子核會β衰變成鋨、銥和鉑的穩定同位素。[101]
地球
[編輯]鉛是親硫元素,代表它經常以硫化物的形式存在。[102]天然金屬鉛很罕見。[103]大部分鉛礦都較輕,因此在形成時仍在地殼中而沒有沉下去。這使得鉛的地殼豐度較高,為14 ppm,是第38常見的元素。[104][i]
方鉛礦(PbS)是最常見的鉛礦,通常與鋅礦一起出現。[106]大部分鉛礦都與方鉛礦相關,例如硫銻鉛礦 Pb5Sb4S11是由方鉛礦衍生而成的混合物硫化物礦物,鉛礬 PbSO4是方鉛礦的氧化產物,而白鉛礦 PbCO3則是方鉛礦的分解產物。砷、錫、銻、銀、金、銅和鉍都是鉛礦中常見的雜質。[106]
世界鉛資源超過20億噸,其中有大量礦藏分佈在澳大利亞、中國、愛爾蘭、墨西哥、秘魯、葡萄牙、俄羅斯和美國。2016年,全球的鉛儲量(經濟上可行的開採資源)總計8800萬噸,其中澳大利亞有3500萬噸,中國有1700萬噸,俄羅斯則有640萬噸。[107]
鉛在大氣層中的環境背景值不超過0.1 μg/m3,在土壤中的環境背景值為100 mg/kg,在蔬菜中為4 mg/kg,在水中為5 μg/L。[108]
歷史
[編輯]史前
[編輯]
在小亞細亞已發現可追溯到公元前7000–6500年的鉛珠,這可能是冶煉金屬的第一個例子。[110]那時候鉛因為太軟且色澤暗淡用處不多。[110]廣泛生產鉛的主要原因是因為冶煉方鉛礦(一種常見的鉛礦)可以得到銀。[111]古埃及人第一個把鉛礦用作化妝品,而這些化妝品後來傳播到古希臘。[112]埃及人也把鉛用於漁網的沉子、玻璃、搪瓷和裝飾品中。[111]新月沃土的許多文明都把鉛用作寫字的材料、硬幣[113]和建築材料。[111]古中國宮廷會用鉛作興奮劑、[111]貨幣[114]和避孕藥,[115]印度河流域文明和中部美洲文明[111]用鉛做護身符,而東非和南非人則在金屬線的拉絲中使用鉛。[116]
古典時代
[編輯]公元前3000年,因為銀被廣泛用作裝飾材料和交易媒介,因此小亞細亞開始開採鉛礦。之後,愛琴海諸島和拉夫里奧也開發了鉛礦床。[117]這三個地區直到公元前1200年都在集體主導鉛礦的生產。[118]約公元前2000年,腓尼基人開始開採伊比利亞半島的礦床,而到了公元前1600年,塞浦路斯、希臘和撒丁島開始開採鉛礦。[119]

羅馬共和國在歐洲和地中海的擴張以及採礦業的發展使其成為古典時代鉛的最大生產者,預測的年輸出為八萬噸。和前人一樣,羅馬人的鉛大多都是冶煉銀的副產物。[109][121]在中歐、不列顛尼亞、巴爾幹半島、希臘、安納托利亞和西班牙都有鉛礦的開採,其中後者佔了全球40%的產量。[109]
鉛板用於寫信,[122]在猶太也有使用鉛棺材。[123]自公元前5世紀,鉛還被用於製造彈弓彈藥。羅馬大量使用鉛彈藥來攻擊100至150米內的目標,古迦太基和羅馬的傭兵巴利阿里擲石兵就聞名於他們的射程和精準度。[124]

在羅馬帝國,鉛被用於製造水管。鉛因為容易加工、熔點低、能夠輕鬆製造完全防水的焊接接頭及抗腐蝕性[125]使得它也廣泛用於其它用處,如藥品、屋頂、貨幣和戰爭。[126][127][128]當時老加圖、科魯邁拉和老普林尼等作家都推薦用鉛(或鍍鉛)容器製備加到紅酒和食物里的甜味劑和防腐劑。鉛會與之反應生成鉛糖(乙酸鉛)而使食物變得好吃,而使用銅或青銅容器會因為產生乙酸銅而使食物變苦。[129]
"Wine—An enological specimen bank", 1992[130]
羅馬作者維特魯威報告了鉛的健康危害,[131][132]而現代作家認為鉛中毒在羅馬帝國的衰落中扮演重要角色,[133][134][j]但一些研究者批評了這種說法,例如指出並非所有的腹痛都是由鉛中毒引起的。[136][137]考古研究表明羅馬的鉛水管會增加自來水的鉛含量,但這個含量「不太可能真正有害」。[138][139]
和錫、銻的混淆
[編輯]冶金學家和工程師自青銅器時代以來都知道錫和鉛的差別,但它們的名稱在某些語言中相似。羅馬人就把鉛叫做plumbum nigrum(黑鉛),錫則叫做plumbum candidum(亮鉛)。在其它語言中也可以看到鉛和錫的相關性,例如捷克語的olovo意為鉛,但俄文對應的同源字олово意為錫。[140]此外,鉛和銻的性質類似,都以硫化物礦物(方鉛礦和輝銻礦)存在,而且這些礦物還會一起出現,使得有人混淆了它們。老普林尼就錯把冶煉輝銻礦的產物寫做鉛,而實際產物是銻。[141]
中世紀和文藝復興
[編輯]
在西羅馬帝國滅亡後,西歐的鉛礦開採下降了,只剩下安達盧斯有相當量的鉛出口。[143][144]這時鉛的最大生產者在亞洲,尤其是開採量迅速增長的中國和印度。[144]
鉛於11和12世紀又開始被用於屋頂和水管,因此在歐洲的產量開始回升。自13世紀起,鉛就被用來製造花窗玻璃。[145]在歐洲和阿拉伯鍊金術中,鉛(鍊金術符號![]() )[146]被認為是不純的卑金屬,通過分離、純化和平衡它的構成本質就可以轉化成金。[147]鉛還用於摻假紅酒。雖然教宗詔書在1498年禁止摻假紅酒被用於基督教儀式,但直到18世紀末都有人因為喝這種紅酒而中毒。[143][148]鉛是印刷機部件的關鍵材料,這使得製造印刷機的工人經常會因為吸入含鉛粉塵而導致鉛中毒。[149]因為鉛便宜、對鐵槍管的傷害更小、密度高(可以更好地保持速度)和熔點低(使得生產更容易),鉛也是子彈的主要材料。[150]西歐貴族廣泛使用鉛粉來使臉變白,這被視為是謙虛的標誌。[151][152]這個時尚後來擴展到白色假髮和眼線,到了法國大革命才淡出。18世紀的日本隨着藝妓的出現也有類似的時尚,而它直到20世紀才消失。女性的白臉「代表她們身為日本女性的女性美德」,[153]而她們的面部增白劑就是鉛。[154]
)[146]被認為是不純的卑金屬,通過分離、純化和平衡它的構成本質就可以轉化成金。[147]鉛還用於摻假紅酒。雖然教宗詔書在1498年禁止摻假紅酒被用於基督教儀式,但直到18世紀末都有人因為喝這種紅酒而中毒。[143][148]鉛是印刷機部件的關鍵材料,這使得製造印刷機的工人經常會因為吸入含鉛粉塵而導致鉛中毒。[149]因為鉛便宜、對鐵槍管的傷害更小、密度高(可以更好地保持速度)和熔點低(使得生產更容易),鉛也是子彈的主要材料。[150]西歐貴族廣泛使用鉛粉來使臉變白,這被視為是謙虛的標誌。[151][152]這個時尚後來擴展到白色假髮和眼線,到了法國大革命才淡出。18世紀的日本隨着藝妓的出現也有類似的時尚,而它直到20世紀才消失。女性的白臉「代表她們身為日本女性的女性美德」,[153]而她們的面部增白劑就是鉛。[154]
歐洲和亞洲以外的鉛
[編輯]歐洲定居者來到新大陸便很快開始了鉛的生產,最早的紀錄可追溯到1621年的弗吉尼亞殖民地。[155]在澳大利亞,殖民者於1841年開闢的第一個礦山就是鉛礦。[156]在非洲的西非裂谷系[157]和剛果盆地就有鉛的開採和冶煉,而鉛被用於和歐洲人交易,直到17世紀以來也用於貨幣。[158]
工業革命
[編輯]
18世紀下半葉,歐美經歷了工業革命,這時鉛的產量首次超過羅馬。[159]原本英國是領先的生產國,但到19世紀中葉,隨着英國礦山的枯竭以及德國、西班牙和美國開採鉛礦的發展,英國失去了這一地位。[160]1900年,美國主導全球的鉛產量,而其它非歐洲國家(加拿大、墨西哥和澳大利亞)也有明顯的產量。[161]鉛需求的很大一部分來自管道和含鉛油漆。[162]當時有很多工人暴露於鉛下,鉛中毒案例也迅速增多,導致了對攝入鉛的影響的研究。鉛中毒和痛風有關,英國醫師阿弗列德·巴靈·加洛德注意到三分之一的痛風病人都是水管工和畫家。在19世紀也有鉛對健康的長期影響(包括精神錯亂)的研究。1870年代至1880年代,英國頒佈了第一條旨在減少工廠鉛中毒案例的法律。[162]
現代
[編輯]
人們在19世紀末和20世紀初發現鉛對人類構成威脅的更多證據。鉛中毒機製得到了更好的理解,並且在美國和歐洲已逐步停止使用。英國於1878年引入強制工廠檢查,並於1898年任命了第一位工廠醫療檢查員。這些事件的結果是從1900年到1944年,鉛中毒事件減少了25倍。[163]大部分歐洲國家在1930年就禁止了含鉛油漆。[164]
人類最近一次大量接觸鉛是四乙基鉛還用作汽油抗震劑的時候。美國和歐盟於2000年逐步淘汰了四乙基鉛。[162]
美國和西歐國家在1970年代立法來試圖減少空氣中的鉛污染。[165][166]立法的影響很顯著,美國疾病控制與預防中心的研究指出美國在1976–1980年時有77.8%的人有高血鉛水平,到了1991–1994年則下降到2.2%。[167]20世紀末最主要的含鉛產品是鉛酸蓄電池。[168]
西方集團在1960年至1990年的鉛出口量增加了31%,[169]而東方集團的全球鉛份額從1950年的10%增加到1990年的30%。在1970年代中期和1980年代,蘇聯是全球最大的鉛生產者,而中國的鉛產量在20世紀末開始增長。[170]到了2004年,中國的鉛產量超越了澳大利亞,成為全球最大的鉛生產者。[171]和之前歐洲工業化一樣,中國開採的鉛也影響了其人民的健康。[172]
生產
[編輯]
鉛的產量因為鉛酸蓄電池的增加而增加。[173]鉛的生產有兩大類——從鉛礦開採而來的初級鉛和從廢料回收的二級鉛。人們在2014年生產了458萬噸的初級鉛和564萬噸的二級鉛,而那年的前三大生產國分別是中國、澳大利亞和美國,[107]那年的前三大二級鉛生產國則為中國、美國和印度。[174]根據國際資源委員會2010年的社會金屬庫存報告,在全球範圍內使用、儲存、丟棄或消散到環境中的鉛總量是人均8公斤,其中已發展國家的人均值(20–150公斤)會比未發展國家(1–4公斤)高。[175]
初級鉛和二級鉛有類似的生產過程。一些初級生產廠會用廢鉛來補充他們的業務,而這種趨勢在未來可能會增加。如果有足夠的技術,通過二次工藝生產的鉛與通過初級工藝生產的鉛沒有區別。來自建築行業的廢鉛通常相當乾淨,無需冶煉即可重新熔化。因此就能源需求而言,二級鉛比初級鉛便宜50%或更多。[176]
初級生產
[編輯]大部分鉛礦的鉛含量較低(富礦也只含3–8%鉛),因此需要提取濃縮。[177]鉛礦會經過磨碎、分離、銑削、泡沫浮選和乾燥,得到的產物的鉛含量為30–80%(通常為50–60%),[177]然後轉化成(不純的)金屬鉛。
初級生產有兩個主要方法,分別是涉及在不同容器焙燒和提取的兩步法以及在同一個容器焙燒和提取的直接法。直接法較為常見,但兩步法仍然重要。[178]
| 國家 | 出口量 (千噸) |
|---|---|
| 2,400 | |
| 500 | |
| 335 | |
| 310 | |
| 250 | |
| 225 | |
| 135 | |
| 80 | |
| 76 | |
| 75 | |
| 41 | |
| 41 | |
| 40 | |
| 40 | |
| 35 | |
| 33 | |
| 33 | |
| 其它國家 | 170 |
兩步法
[編輯]首先,鉛的硫化物礦物會在空氣中焙燒,硫化鉛被氧化成氧化鉛:[179]
- 2 PbS(s) + 3 O2(g) → 2 PbO(s) + 2 SO2(g)↑
由於反應物本來就不是純硫化鉛,因此產物也不是純氧化鉛,而是鉛與其它金屬的各種氧化物、硫酸鹽和矽酸鹽。[180]這些不純的氧化鉛會在高爐中被焦炭還原成(一樣不純的)鉛:[181]
- 2 PbO(s) + C(s) → 2 Pb(s) + CO2(g)↑
這些雜質主要是砷、銻、鉍、鋅、銅、銀和金,它們會在各種高溫冶金過程中除去。融化的鉛會在反射爐中和空氣、水蒸氣和硫反應,氧化除銀、金和鉍以外的雜質。這些氧化產物會浮在液鉛上並被除去。[182][183]之後,銀和金可以通過在鉛中加鋅來分離。鉛不溶於鋅,但銀和金都可溶於鋅,因此把鋅溶液去除也能一起去除銀和金。[183][184]最後的鉍雜質則可以通過加入金屬鈣和鎂,使鉍與其反應並浮在鉛上,然後去除。[183]
除了冶金以外,極純的鉛還可以由Betts法生產。不純的鉛做成的陽極和純鉛做成的陰極在氟矽酸鉛(PbSiF6)電解質中電解,陽極的鉛就會溶於溶液並鍍到陰極上,而雜質則會留在溶液中。[183][185]這個過程的費用很高,因此只用於製造極純的鉛條。[186]
直接法
[編輯]首先,鉛的硫化物礦物會在熔爐中融化和氧化,產生氧化鉛。碳(以焦炭或煤氣的形式)和助焊劑之後會加入到熔融的鉛中。氧化鉛會被碳還原成金屬鉛。[178]
如果反應物富含鉛,那麼有80%的鉛可以以鉛條的形式取出,而剩下的20%以富含氧化鉛的爐渣存在。對於鉛含量較低的反應物,所有的鉛都會被氧化成爐渣。[178]這些鉛含量高(25–40%)的爐渣可以通過燃燒,用電爐還原或兩者兼施得到金屬鉛。[178]
替代方法
[編輯]人們仍在繼續研究更清潔、能耗更低的鉛提取方法,但缺點是浪費太多鉛或是產物的硫含量太高。電解提煉可能有潛力成為替代生產方法,但這個方法除非電很便宜,否則在經濟上不可行。[187]
二級生產
[編輯]除非回收的鉛有明顯的氧化,否則在初級生產中必要的冶煉過程在二級生產中會被跳過。[176]ISASMELT過程是可作為延伸初級生產的新冶煉方法。廢鉛酸蓄電池(含有硫酸鉛和鉛的各種氧化物)的硫酸鉛可以用鹼去除,然後在熔爐中和煤炭反應,生成不純的鉛。[188]二級鉛的提煉和初級鉛類似,但某些提煉過程可以根據回收材料和潛在污染跳過。[188]在鉛的回收來源中最重要的是鉛酸蓄電池,而鉛水管和電纜塗層也是重要的來源。[176]
用途
[編輯]
實際上,鉛筆並不是用鉛做的,但因為古時候把石墨誤認為是鉛,所以鉛筆一詞在各語言中流傳使用而未修正。[190]
單質
[編輯]金屬鉛的高密度、低熔點、展性和惰性使其可用於許多用途。雖然有很多金屬在某些方面比鉛好,但它們通常較罕見,也更難從礦石中提取。不過,鉛的毒性使它在某些用途中被逐步淘汰。[191]
自中世紀以來,鉛就被用於生產子彈。鉛很便宜,而且它的低熔點意味着可以用最少的技術設備鑄造小型武器彈藥和霰彈槍彈。此外,鉛的密度比大部分常見金屬高,可以更好地保持速度。今天,鉛(會加入其它金屬來變硬)仍然是子彈的主要材料,[150]但有人擔心用於狩獵的鉛彈會破壞環境。[k]
鉛也有許多用處應用了其高密度和抗腐蝕性。鉛的高密度使它可用作帆船龍骨的壓艙物,從而抵消風對帆的傾斜效應。[193]它也用於水肺潛水的配重系統中,以抵消潛水員的浮力。[194]1993年,比薩斜塔的底部就用了600噸的鉛來使其穩定。[195]鉛的抗腐蝕性使其可用於保護深海電纜。[196]

在建築工業中,鉛也有許多用途。鉛片可用於屋頂、覆層、落水管和女兒牆。[197][198]鉛至今仍用於製造雕像和雕塑,以及它們的骨架。[199]鉛在以前也用於平衡輪胎,但因為環境原因也被其它材料替代了。[107]
鉛可以添加到如青銅和黃銅等銅合金中來潤滑和增加可加工性。由於鉛不溶於銅,所以它會在合金的缺陷(例如晶粒邊界)中形成固體小球。在低濃度下,鉛除了起到潤滑劑的作用外,這些小球還會阻止切屑生成,因此增加了可加工性。鉛含量較高的銅合金可用於製造軸承。鉛用於潤滑,而銅則提供承重支撐。[200]
鉛的密度和原子序都很高,而且容易成型,這使得它可用於屏蔽聲音、震動和輻射。[201]鉛沒有自然頻率,[201]因此鉛片可用於錄音室的隔音。[202]管風琴聲管通常是由鉛合金製造的,這些合金會加入不等量的錫來控制音調。[203][204]由於其密度和衰減係數都很高,[205]鉛可用作核物理學和X光室的輻射屏蔽材料。[206]熔融的鉛可用作鉛冷快中子反應堆的冷卻劑。[207]
電池
[編輯]在21世紀初,鉛最大的用處就是製造鉛酸蓄電池。電池中的鉛並沒有與人體直接接觸,因此毒性問題較少,[l]但在生產鉛酸蓄電池的工廠工作的人可能會暴露於含鉛粉塵下。[209]在鉛酸蓄電池裏,鉛、二氧化鉛和硫酸的反應可以產生穩定的電壓。[m]包含鉛酸蓄電池的超級電容器可用於調節頻率、太陽能和風能等應用中。[211]這些電池雖然能量密度和充放電效率比鋰離子電池低,但比鋰離子電池便宜。[212]
電纜塗層
[編輯]鉛可以製造高壓電電纜的外殼,以防止水進到裏面,但因為毒性而被逐漸淘汰。[213]它也用於電器的焊料,但因為會影響環境而被某些國家淘汰。[214]鉛是博物館Oddy測試使用的三種金屬之一,可用於探測有機酸、醛和酸性氣體。[215][216]
化合物
[編輯]

鉛酸蓄電池除了是金屬鉛最大的用處以外,也是鉛化合物最大的用處。它的充放電反應涉及了硫酸鉛和二氧化鉛:
- Pb(s) + PbO
2(s) + 2H
2SO
4(aq) → 2PbSO
4(s) + 2H
2O(l)
含鉛顏料可以使釉和玻璃塗上紅色和黃色。[217]雖然含鉛顏料在歐洲和北美已被淘汰,但像是中國[218]、印度[219]和印尼[220]的發展中國家仍在使用含鉛顏料。四乙酸鉛和二氧化鉛是有機化學的氧化劑。鉛玻璃中含有12–28%的氧化鉛,其光學性質和可以屏蔽輻射的性質[221]可用於老式電視機和電腦熒幕的陰極射線管。碲化鉛和硒化鉛可用於太陽能光伏和紅外線探測器。[222]
生物作用
[編輯]| 鉛 | |
|---|---|

| |
| 危險性 | |
GHS危險性符號  
| |
| GHS提示詞 | Danger |
| H-術語 | H302, H332, H351, H360Df, H373, H410 |
| P-術語 | P201, P261, P273, P304, P340, P312, P308, P313, P391[223] |
| NFPA 704 | |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
鉛沒有已知的生物作用,也沒有確認安全的暴露量。[224]2009年的研究顯示就算是在被認為幾乎沒有風險的水平下,鉛仍會影響健康。[225]它在成年人中的含量平均為120 mg[n],在重金屬中僅次於鐵(4000 mg)和鋅(2500 mg)。[227]人體很容易吸收鉛鹽[228],有一小部分(1%)鉛會留在骨骼中,而剩下的部分會通過尿液和糞便在幾個星期後排出,但兒童只能排出三分之一的鉛。經常暴露於鉛可能會使它在體內累積。[229]
毒性
[編輯]鉛有劇毒,會影響人體幾乎所有的器官和系統。[230]空氣中鉛的濃度達到100 mg/m3就會立即危及生命或健康。[231]攝入的鉛大多會吸收到血流中。[232]鉛會和酶的巰基結合[233]或是模仿其它金屬並替代它們作為反應中的輔因子[234]來干擾酶正常工作,而這也是它有毒的原因。和鉛相互作用的必需金屬元素包括鈣、鐵和鋅。[235]高鈣和鐵水平對鉛中毒有一定的保護,而低水平則會增加鉛中毒的幾率。[228]
影響
[編輯]鉛會嚴重損害腦和腎,最終導致死亡。鉛可以通過模仿鈣穿過血腦屏障。它會分解神經元的髓鞘,干擾神經遞質,減少神經元生長。[233]鉛還會抑制膽色素原合成酶和亞鐵螯合酶,阻止膽色素原的合成和鐵與原卟啉IX的螯合(合成血紅素的最後一步)。這造成了血紅素不足和小細胞性貧血。[236]

鉛中毒的症狀包括腎病變、腹部疝痛和手指、手腕或腳踝變弱。它還會使中老年人的血壓小幅升高,並可能導致貧血。許多研究顯示暴露於鉛和心率變異性降低相關。[237]孕婦暴露於大量鉛下可能會流產,男性長期暴露於大量鉛下會降低生育能力。[238]
在兒童還在發育的腦中,鉛會干擾大腦皮質中突觸的形成、神經遞質和離子通道的管理。[239]兒童接觸鉛與他們的睡眠障礙和在白天嗜睡的風險增加有關。[240]鉛造成的高血壓和女生青春期延遲相關。[241]20世紀時因汽油中四乙基鉛導致的空氣中鉛含量的升高和下降也與當時的犯罪率相關。
暴露源
[編輯]鉛礦的開採和冶煉以及電池的生產、廢棄和回收都是鉛的暴露源。鉛可以通過吸入、食入或皮膚吸收。幾乎所有攝入的鉛都會被人體吸收,其中兒童的吸收率比成人高。[242]
鉛中毒通常由攝入受污染的食物或水引起,有時則是意外攝入受污染的土壤、灰塵或含鉛油漆。[243]受工業廢水污染的海產可能含鉛。[244]水果和蔬菜可能會受到土壤中高濃度鉛的污染,而土壤可能因含鉛油漆、含鉛汽油和水管中的鉛積聚而受污染。[245]
對於水質較軟或酸的地區,使用鉛水管是問題。[246]硬水會在水管表面形成不溶的保護層,而軟水和酸性水則會溶解鉛水管。[247]水中溶解的二氧化碳會溶解鉛,產生碳酸氫鉛,而含氧水則會使鉛變成氫氧化鉛。長期飲用這種水會因為溶解的鉛造成健康問題。水越硬,其中含有的碳酸氫鈣和硫酸鈣就越多,鉛水管的碳酸鉛或硫酸鉛保護層就越厚。[248]
攝入含鉛油漆(例如咬塗上含鉛油漆的窗台)是兒童接觸鉛的主要來源。此外,隨着所塗的含鉛油漆變質剝落,它們就會變成灰塵,然後通過手口接觸或污染食物和水進入人體。攝入某些傳統藥物也可能會攝入鉛。[249]
吸煙者和與鉛相關的工作者較易吸入鉛。[232]香煙煙霧除了其它有毒物質外,還有放射性的鉛-210。[250]使用有機鉛化合物的人可能會因暴露皮膚而使鉛進入體內。無機鉛化合物較難被皮膚吸收。[251]
塑料玩具
[編輯]根據美國疾病控制與預防中心,鉛仍未被禁止用於塑料中。鉛可以軟化塑料,使其可以回復到原來的形狀。它也用於使塑料中的分子不會因熱分解。這些塑料暴露在陽光、空氣和洗滌劑中就會破壞鉛和塑料之間的化學鍵,產生含鉛粉塵。[252]
治療
[編輯]鉛中毒可以用二巰基丙醇和二巰基丁二酸治療,[253]而急性鉛中毒則需要使用乙二胺四乙酸二鈉鈣或是乙二酸四乙酸二鈉治療。它們會和鉛形成螯合物,然後隨尿液排出這些鉛螯合物。[254]
對環境的影響
[編輯]
鉛與其產品的開採、生產、使用和廢棄已對土壤和水造成嚴重污染。大氣中的鉛含量在工業革命和20世紀下半葉(汽油含鉛的時代)達到頂峰。[255]
鉛會在自然來源(例如鉛礦本來的地方)、工業生產、焚化與回收中釋放出來。[255]由於鉛在許多用途中已被淘汰,因此鉛的回收也成為了重要的暴露源。[256]城市的土壤和沉積物中的鉛濃度持續升高,這是由於許多地方,尤其是發展中國家[257]的工業排放造成的。[258]
鉛會在土壤中富集,並留在那裏幾百或幾千年。環境中的鉛會和植物需要的其它金屬競爭,而到了足夠高的劑量則會影響植物的生長和生存。此外,被鉛污染的泥土和植物會讓它通過食物鏈影響微生物和動物。鉛會影響動物的許多器官,損害神經系統、腎、生殖系統、造血和心血管系統。[259]魚類會從水和沉積物中吸收鉛,[260]並在食物鏈中累積,對魚類、鳥類和海洋哺乳動物造成危害。[261]
人類產生的鉛來源包括散彈彈丸和沉子,它們與生產鉛的場所都是最大的鉛污染源。[262]美國在2017年就禁止使用鉛來製造彈丸和沉子,[263]但這個禁令只持續了一個月。[264]類似的禁令在歐盟也有出現。[265]
環境中的鉛可以用分光光度法、X射線熒光光譜儀、原子光譜學和電化學分析。[266]鉛中毒可以由血漿、血清和尿液中的δ-氨基乙酰丙酸水平確定。[267]
限制和整治
[編輯]
自1980年代中期以來,鉛的工業用途就劇烈下降。美國的環境法就一直減少或消除鉛的使用,包括汽油、油漆、焊料和水管。燃煤發電廠中有安裝捕獲鉛排放的設備。[258]1992年,美國國會要求美國環保局降低兒童的血鉛水平。[268]2003年,鉛的使用就被歐盟的危害性物質限制指令更進一步縮減。[269]荷蘭在1993年禁止在狩獵和射擊運動中使用鉛彈後,廢鉛量就從1990年的230噸大幅下降到1995年的47.5噸。[270]
鉛在工作場所的允許最大暴露限值為50 μg/m3,而血鉛水平上限則為5 μg/100 g。[271]在石器、[272]用於管道和電線絕緣的材料的乙烯基聚合物[273]和中國黃銅[o]中仍可以找到有害量的鉛。老屋子裏可能含有含鉛油漆。[273]含鉛油漆已在工業化國家中停售,但某些有特別用處的含鉛油漆(例如鉻酸鉛)仍然出售。[275]打磨這些舊油漆會產生含鉛灰塵。[276]
含鉛廢物取決於管轄範圍和性質可能會被看作是生活垃圾[277]或是需要特殊處理或儲存的有害垃圾。[278]鉛也會從射擊場所釋放到環境中,為此人們制定了管理實踐來應對鉛污染。[279]酸性土壤會使鉛遷移到其它地方,因此這些土壤需要用石灰中和,避免鉛滲到其它地方。[280]
人們已經研究如何通過生物方法從生物系統中去除鉛。魚骨頭可以生物修復受鉛污染的土壤,[281][282]而雜色麴黴可以有效吸收工業廢物中的鉛離子。[283]一些細菌可以有效去除環境中的鉛,例如硫酸鹽還原菌脫硫弧菌屬和脫硫腸狀菌屬。[284]
註釋
[編輯]- ^ 展性是物質在壓力下變形的難度,而延性是物質的拉伸能力。
- ^ 濕手指可以浸入液態鉛中而不會造成灼傷。[15]
- ^ 鑭系收縮有10%可以歸結為相對論效應的影響。[20]
- ^ 鑽石結構的錫叫α錫或灰錫,僅在13.2 °C(55.8 °F)以下穩定。室溫下穩定的錫同素異形體是β錫(白錫),它的晶體結構為扭曲的面心立方結構,是灰錫的鑽石結構和鉛標準的面心立方結構之間的結構,符合元素週期表越往下金屬性越強的趨勢。[26]
- ^ 鉍-209的半衰期為1.9×1019年。[30]一公斤天然鉍的放射性活度約為0.003 Bq(每秒衰變的次數)。作為比較,一公斤人體的放射性活度約為65 Bq。[31]
- ^ 鉛-205的衰變方式是電子捕獲,因此如果它的82個電子都被完全電離,周圍也沒有電子,它就無法衰變。鉛-205會衰變成鉈-205,但完全電離的鉈-205就不是穩定同位素了,會衰變成有一個電子的鉛-205。[43]
- ^ 四苯基鉛更加穩定,270 °C才分解。[83]
- ^ 來源中的豐度不是以分比計算,而是以和矽(豐度定義為106)的相對比例計算的。所有元素按這個相對比例計算的總和為2.6682×1010,其中鉛佔了3.258。
- ^ 元素豐度可能會因為來源的不同而有所改變。[105]
- ^ 儒略·凱撒只生一個孩子和奧古斯都據稱不育的事實都歸咎於鉛中毒。[135]
- ^ 加利福尼亞州因此在2015年7月開始禁止使用鉛彈打獵。[192]
- ^ 鉛酸蓄電池對普通使用者的潛在危害都和鉛的毒性無關。[208]
- ^ 參見這個參考資料[210]來得到鉛酸蓄電池工作原理的詳細資料。
- ^ 這個值會因國家而異。[226]
- ^ 這是黃銅(銅和鋅的合金)和鉛、鐵、錫(有時還有銻)組成的合金。[274]
參考文獻
[編輯]- ^ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip J. H.; Gröning, Manfred; Holden, Norman E.; Meijer, Harro A. J. Standard atomic weights of the elements 2021 (IUPAC Technical Report). Pure and Applied Chemistry. 2022-05-04. ISSN 1365-3075. doi:10.1515/pac-2019-0603 (英語).
- ^ Pb(0)存在於鉛和一氧化碳反應形成的羰基化合物中,參見Ling, Jiang; Qiang, Xu. Observation of the lead carbonyls PbnCO (n=1–4): Reactions of lead atoms and small clusters with carbon monoxide in solid argon. The Journal of Chemical Physics. 122 (3): 034505. 2005, 122 (3): 34505 [2022-09-27]. Bibcode:2005JChPh.122c4505J. ISSN 0021-9606. PMID 15740207. doi:10.1063/1.1834915. (原始內容存檔於2022-11-08).
- ^ 夏征農、陳至立 (編). 《辞海》第六版彩图本. 上海: 上海辭書出版社. 2009年: 第3227頁. ISBN 9787532628599.
- ^ Theodore Low De Vinne (1899). The Practice of Typography: A Treatise on the Processes of Type-making, the Point System, the Names, Sizes, Styles, and Prices of Plain Printing Types. Century Company. pp. 9–36.
- ^ Greenwood & Earnshaw 1998,第372頁.
- ^ Greenwood & Earnshaw 1998,第372–373頁.
- ^ 7.0 7.1 Thornton, Rautiu & Brush 2001,第6頁.
- ^ Lide 2005,第12-35, 12-40頁.
- ^ Lide 2005,第4-13, 4-21, 4-33頁.
- ^ Vogel & Achilles 2013,第8頁.
- ^ Anderson 1869,第341–343頁.
- ^ Gale & Totemeier 2003,第15–2–15–3頁.
- ^ Thornton, Rautiu & Brush 2001,第8頁.
- ^ 14.0 14.1 Lide 2005,第12-219頁.
- ^ Willey 1999.
- ^ Lide 2005,第12-45頁.
- ^ Blakemore 1985,第272頁.
- ^ Webb, Marsiglio & Hirsch 2015.
- ^ Lide 2005,第10-179頁.
- ^ Pyykkö 1988,第563–594頁.
- ^ Norman 1996,第36頁.
- ^ Greenwood & Earnshaw 1998,第226–227, 374頁.
- ^ Christensen 2002,第867頁.
- ^ Slater 1964.
- ^ Considine & Considine 2013,第501, 2970頁.
- ^ Parthé 1964,第13頁.
- ^ 27.0 27.1 27.2 27.3 IAEA - Nuclear Data Section 2017.
- ^ University of California Nuclear Forensic Search Project.
- ^ 29.0 29.1 Stone 1997.
- ^ de Marcillac et al. 2003,第876–78頁.
- ^ World Nuclear Association 2015.
- ^ Beeman et al. 2013.
- ^ Radioactive Decay Series 2012.
- ^ Committee on Evaluation of EPA Guidelines for Exposure to Naturally Occurring Radioactive Materials et al. 1999.
- ^ Smirnov, Borisevich & Sulaberidze 2012.
- ^ Greenwood & Earnshaw 1998,第368頁.
- ^ Levin 2009,第40–41頁.
- ^ Webb 2000,第115頁.
- ^ Wrackmeyer & Horchler 1990.
- ^ Cangelosi & Pecoraro 2015.
- ^ Fiorini 2010,第7–8頁.
- ^ Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S.; Audi, G. The NUBASE2020 evaluation of nuclear properties (PDF). Chinese Physics C. 2021, 45 (3): 030001. doi:10.1088/1674-1137/abddae.
- ^ Takahashi et al. 1987.
- ^ Thürmer, Williams & Reutt-Robey 2002,第2033–2035頁.
- ^ Tétreault, Sirois & Stamatopoulou 1998,第17–32頁.
- ^ Thornton, Rautiu & Brush 2001,第10–11頁.
- ^ 47.0 47.1 47.2 47.3 47.4 47.5 Greenwood & Earnshaw 1998,第373頁.
- ^ Bretherick 2016,第1442頁.
- ^ Harbison, Bourgeois & Johnson 2015,第132頁.
- ^ 50.0 50.1 Greenwood & Earnshaw 1998,第374頁.
- ^ Thornton, Rautiu & Brush 2001,第11–12頁.
- ^ Polyanskiy 1986,第20頁.
- ^ Kaupp 2014,第9–10頁.
- ^ Dieter & Watson 2009,第509頁.
- ^ Hunt 2014,第215頁.
- ^ 56.0 56.1 King 1995,第43–63頁.
- ^ Bunker & Casey 2016,第89頁.
- ^ Whitten, Gailey & David 1996,第904–905頁.
- ^ Greenwood & Earnshaw 1998,第384頁.
- ^ Greenwood & Earnshaw 1998,第387頁.
- ^ 61.0 61.1 Greenwood & Earnshaw 1998,第389頁.
- ^ Zuckerman & Hagen 1989,第426頁.
- ^ 63.0 63.1 Greenwood & Earnshaw 1998,第382頁.
- ^ Bharara & Atwood 2006,第4頁.
- ^ Greenwood & Earnshaw 1998,第388頁.
- ^ Toxicological Profile for Lead 2007,第277頁.
- ^ Downs & Adams 2017,第1128頁.
- ^ Brescia 2012,第234頁.
- ^ Macintyre 1992,第3775頁.
- ^ Silverman 1966,第2067–2069頁.
- ^ Greenwood & Earnshaw 1998,第381頁.
- ^ Yong, Hoffmann & Fässler 2006,第4774–4778頁.
- ^ Becker et al. 2008,第9965–9978頁.
- ^ Mosseri, Henglein & Janata 1990,第2722–2726頁.
- ^ Konu & Chivers 2011,第391–392頁.
- ^ Hadlington 2017,第59頁.
- ^ Greenwood & Earnshaw 1998,第384–386頁.
- ^ Röhr 2017.
- ^ Alsfasser 2007,第261–263頁.
- ^ Greenwood & Earnshaw 1998,第393頁.
- ^ Stabenow, Saak & Weidenbruch 2003.
- ^ 82.0 82.1 Polyanskiy 1986,第43頁.
- ^ 83.0 83.1 83.2 83.3 Greenwood & Earnshaw 1998,第404頁.
- ^ 84.0 84.1 Wiberg, Wiberg & Holleman 2001,第918頁.
- ^ Toxicological Profile for Lead 2007,第287頁.
- ^ Polyanskiy 1986,第44頁.
- ^ Windholz 1976.
- ^ Zýka 1966,第569頁.
- ^ 89.0 89.1 89.2 89.3 Lodders 2003,第1222–1223頁.
- ^ Lochner, Rohrbach & Cochrane 2005,第12頁.
- ^ Roederer et al. 2009,第1963–1980頁.
- ^ Lodders 2003,第1224頁.
- ^ Burbidge et al. 1957,第608–615頁.
- ^ Burbidge et al. 1957,第551頁.
- ^ Burbidge et al. 1957,第608–609頁.
- ^ Burbidge et al. 1957,第553頁.
- ^ Frebel 2015,第114–115頁.
- ^ Burbidge et al. 1957,第608–610頁.
- ^ Burbidge et al. 1957,第596頁.
- ^ Burbidge et al. 1957,第595頁.
- ^ Burbidge et al. 1957,第582, 609–615頁.
- ^ Langmuir & Broecker 2012,第183–184頁.
- ^ Davidson et al. 2014,第4–5頁.
- ^ Emsley 2011,第286, passim頁.
- ^ Cox 1997,第182頁.
- ^ 106.0 106.1 Davidson et al. 2014,第4頁.
- ^ 107.0 107.1 107.2 107.3 United States Geological Survey 2017,第97頁.
- ^ Rieuwerts 2015,第225頁.
- ^ 109.0 109.1 109.2 Hong et al. 1994,第1841–1843頁.
- ^ 110.0 110.1 Rich 1994,第4頁.
- ^ 111.0 111.1 111.2 111.3 111.4 Winder 1993b.
- ^ History of Cosmetics.
- ^ Chapurukha Kusimba, June 20, 2017. Making Cents of Currency's Ancient Rise. Smithsonian Magazine. [5 November 2021]. (原始內容存檔於2022-11-17).
- ^ Yu & Yu 2004,第26頁.
- ^ Toronto museum explores 2003.
- ^ Bisson & Vogel 2000,第105頁.
- ^ Wood, Hsu & Bell 2021.
- ^ Rich 1994,第5頁.
- ^ United States Geological Survey 1973.
- ^ Lead sling bullet.
- ^ de Callataÿ 2005,第361–372頁.
- ^ Ceccarelli 2013,第35頁.
- ^ Ossuaries and Sarcophagi.
- ^ Calvo Rebollar 2019,第45頁.
- ^ Rich 1994,第6頁.
- ^ Thornton, Rautiu & Brush 2001,第179–184頁.
- ^ Bisel & Bisel 2002,第459–460頁.
- ^ Retief & Cilliers 2006,第149–151頁.
- ^ Grout 2017.
- ^ Eschnauer & Stoeppler 1992,第58頁.
- ^ Hodge 1981,第486–491頁.
- ^ Marcus Vitruvius Pollio. De architectura. Book 8, 10-11 fulltext. 1914 [c. 15 BC].
- ^ Gilfillan 1965,第53–60頁.
- ^ Nriagu 1983,第660–663頁.
- ^ Frankenburg 2014,第16頁.
- ^ Scarborough 1984.
- ^ Waldron 1985,第107–108頁.
- ^ Reddy & Braun 2010,第1052頁.
- ^ Delile et al. 2014,第6594–6599頁.
- ^ Polyanskiy 1986,第8頁.
- ^ Thomson 1830,第74頁.
- ^ Kellett 2012,第106–107頁.
- ^ 143.0 143.1 Winder 1993a.
- ^ 144.0 144.1 Rich 1994,第7頁.
- ^ Rich 1994,第8頁.
- ^ Ede & Cormack 2016,第54頁.
- ^ Cotnoir 2006,第35頁.
- ^ Samson 1885,第388頁.
- ^ Sinha et al. 1993.
- ^ 150.0 150.1 Ramage 1980,第8頁.
- ^ Tungate 2011,第14頁.
- ^ Donnelly 2014,第171–172頁.
- ^ Ashikari 2003,第65頁.
- ^ Nakashima et al. 1998,第59頁.
- ^ Rabinowitz 1995,第66頁.
- ^ Gill & Libraries Board of South Australia 1974,第69頁.
- ^ Bisson & Vogel 2000,第85頁.
- ^ Bisson & Vogel 2000,第131–132頁.
- ^ Hong et al. 1994,第1841–43頁.
- ^ Lead mining.
- ^ Rich 1994,第11頁.
- ^ 162.0 162.1 162.2 Riva et al. 2012,第11–16頁.
- ^ Hernberg 2000,第246頁.
- ^ Markowitz & Rosner 2000,第37頁.
- ^ More et al. 2017.
- ^ American Geophysical Union 2017.
- ^ Centers for Disease Control and Prevention 1997.
- ^ Rich 1994,第117頁.
- ^ Rich 1994,第17頁.
- ^ Rich 1994,第91–92頁.
- ^ United States Geological Survey 2005.
- ^ Zhang et al. 2012,第2261–2273頁.
- ^ Tolliday 2014.
- ^ Guberman 2016,第42.14–15頁.
- ^ Graedel 2010.
- ^ 176.0 176.1 176.2 Thornton, Rautiu & Brush 2001,第56頁.
- ^ 177.0 177.1 Davidson et al. 2014,第6頁.
- ^ 178.0 178.1 178.2 178.3 Davidson et al. 2014,第17頁.
- ^ Thornton, Rautiu & Brush 2001,第51頁.
- ^ Davidson et al. 2014,第11–12頁.
- ^ Thornton, Rautiu & Brush 2001,第51–52頁.
- ^ Davidson et al. 2014,第25頁.
- ^ 183.0 183.1 183.2 183.3 Primary Lead Refining.
- ^ Pauling 1947.
- ^ Davidson et al. 2014,第34頁.
- ^ Davidson et al. 2014,第23頁.
- ^ Thornton, Rautiu & Brush 2001,第52–53頁.
- ^ 188.0 188.1 Thornton, Rautiu & Brush 2001,第57頁.
- ^ Street & Alexander 1998,第181頁.
- ^ Evans 1908,第133–179頁.
- ^ Baird & Cann 2012,第537–538, 543–547頁.
- ^ California Department of Fish and Wildlife.
- ^ Parker 2005,第194–195頁.
- ^ Krestovnikoff & Halls 2006,第70頁.
- ^ Street & Alexander 1998,第182頁.
- ^ Jensen 2013,第136頁.
- ^ Think Lead research.
- ^ Weatherings to Parapets.
- ^ Putnam 2003,第216頁.
- ^ Copper Development Association.
- ^ 201.0 201.1 Rich 1994,第101頁.
- ^ Guruswamy 2000,第31頁.
- ^ Audsley 1965,第250–251頁.
- ^ Palmieri 2006,第412–413頁.
- ^ Thornton, Rautiu & Brush 2001,第7頁.
- ^ National Council on Radiation Protection and Measurements 2004,第16頁.
- ^ Tuček, Carlsson & Wider 2006,第1590頁.
- ^ Concordia University 2016.
- ^ Toxicological Profile for Lead 2007,第5–6頁.
- ^ Progressive Dynamics, Inc.
- ^ Olinsky-Paul 2013.
- ^ Gulbinska 2014.
- ^ Rich 1994,第133–134頁.
- ^ Zhao 2008,第440頁.
- ^ Beiner et al. 2015.
- ^ Szczepanowska 2013,第84–85頁.
- ^ Burleson 2001,第23頁.
- ^ Insight Explorer & IPEN 2016.
- ^ Singh 2017.
- ^ Ismawati et al. 2013,第2頁.
- ^ Amstock 1997,第116–119頁.
- ^ Rogalski 2010,第485–541頁.
- ^ Lead 695912. [2022-10-15]. (原始內容存檔於2021-04-27).
- ^ World Health Organization 2018.
- ^ Bouchard et al. 2009.
- ^ World Health Organization 2000,第149–153頁.
- ^ Emsley 2011,第280, 621, 255頁.
- ^ 228.0 228.1 Luckey & Venugopal 1979,第177–178頁.
- ^ Toxic Substances Portal.
- ^ United States Food and Drug Administration 2015,第42頁.
- ^ National Institute for Occupational Safety and Health.
- ^ 232.0 232.1 Occupational Safety and Health Administration.
- ^ 233.0 233.1 Rudolph et al. 2003,第369頁.
- ^ Dart, Hurlbut & Boyer-Hassen 2004,第1426頁.
- ^ Kosnett 2006,第238頁.
- ^ Cohen, Trotzky & Pincus 1981,第904–906頁.
- ^ Sokol 2005,第133, passim頁.
- ^ Mycyk, Hryhorczuk & Amitai 2005,第462頁.
- ^ Liu et al. 2015,第1869–1874頁.
- ^ Schoeters et al. 2008,第168–175頁.
- ^ Tarragó 2012,第16頁.
- ^ Toxicological Profile for Lead 2007,第4頁.
- ^ Bremner 2002,第101頁.
- ^ Agency for Toxic Substances and Disease Registry.
- ^ Thornton, Rautiu & Brush 2001,第17頁.
- ^ Moore 1977,第109–115頁.
- ^ Wiberg, Wiberg & Holleman 2001,第914頁.
- ^ Tarragó 2012,第11頁.
- ^ Centers for Disease Control and Prevention 2015.
- ^ Wani, Ara & Usman 2015,第57, 58頁.
- ^ Lead in Consumer Products | Sources of Lead | CDC. www.cdc.gov. 2022-02-01 [2022-06-16]. (原始內容存檔於2022-10-16) (美國英語).
- ^ Prasad 2010,第651–652頁.
- ^ Masters, Trevor & Katzung 2008,第481–483頁.
- ^ 255.0 255.1 United Nations Environment Programme 2010,第4頁.
- ^ Renfrew, Daniel. Life without lead : contamination, crisis, and hope in Uruguay. Oakland, California. 2019: 8. ISBN 978-0-520-96824-0. OCLC 1102765674.
- ^ United Nations Environment Programme 2010,第6頁.
- ^ 258.0 258.1 Trace element emission 2012.
- ^ Assi et al. 2016.
- ^ World Health Organization 1995.
- ^ UK Marine SACs Project 1999.
- ^ United Nations Environment Programme 2010,第9頁.
- ^ McCoy 2017.
- ^ Cama 2017.
- ^ Layton 2017.
- ^ Hauser 2017,第49–60頁.
- ^ Lauwerys & Hoet 2001,第115, 116–117頁.
- ^ Auer et al. 2016,第4頁.
- ^ Petzel, Juuti & Sugimoto 2004,第122–124頁.
- ^ Deltares & Netherlands Organisation for Applied Scientific Research 2016.
- ^ Agency for Toxic Substances and Disease Registry 2017.
- ^ Grandjean 1978,第303–321頁.
- ^ 273.0 273.1 Levin et al. 2008,第1288頁.
- ^ Duda 1996,第242頁.
- ^ Crow 2007.
- ^ Marino et al. 1990,第1183–1185頁.
- ^ United States Environmental Protection Agency 2000.
- ^ Lead in Waste 2016.
- ^ United States Environmental Protection Agency 2005,第I-1頁.
- ^ United States Environmental Protection Agency 2005,第III-5–III-6頁.
- ^ Freeman 2012,第a20–a21頁.
- ^ Young 2012.
- ^ Acton 2013,第94–95頁.
- ^ Park et al. 2011,第162–174頁.
參考書目
[編輯]- Acton, Q. A. (編). Issues in Global Environment—Pollution and Waste Management: 2012 Edition. ScholarlyEditions. 2013 [2022-10-18]. ISBN 978-1-4816-4665-9. (原始內容存檔於2022-04-11).
- Agency for Toxic Substances and Disease Registry. Information for the Community: Lead Toxicity (MP4 webcast, 82 MB). [11 February 2017]. (原始內容存檔於2022-10-16).
- Alsfasser, R. Moderne anorganische Chemie [Modern inorganic chemistry]. Walter de Gruyter. 2007 [2022-10-01]. ISBN 978-3-11-019060-1. (原始內容存檔於2022-11-08) (德語).
- Amstock, J. S. Handbook of Glass in Construction. McGraw-Hill Professional. 1997 [2022-10-11]. ISBN 978-0-07-001619-4. (原始內容存檔於2022-11-08).
- American Geophysical Union. Human Activity Has Polluted European Air for 2000 Years. Eos Science News. 2017 [4 July 2017]. (原始內容存檔於27 June 2017).
- Anderson, J. Malleability and ductility of metals. Scientific American. 1869, 21 (22): 341–43 [2022-09-30]. doi:10.1038/scientificamerican11271869-341. (原始內容存檔於2022-10-05).
- Ashikari, M. The memory of the women's white faces: Japaneseness and the ideal image of women. Japan Forum. 2003, 15 (1): 55–79. S2CID 144510689. doi:10.1080/0955580032000077739.
- Assi, M. A.; Hezmee, M. N. M.; Haron, A. W.; et al. The detrimental effects of lead on human and animal health. Veterinary World. 2016, 9 (6): 660–671. ISSN 0972-8988. PMC 4937060
 . PMID 27397992. doi:10.14202/vetworld.2016.660-671.
. PMID 27397992. doi:10.14202/vetworld.2016.660-671. - Audsley, G. A. The Art of Organ Building 2. Courier. 1965 [2022-10-11]. ISBN 978-0-486-21315-6. (原始內容存檔於2022-10-11).
- Auer, Charles M.; Kover, Frank D.; Aidala, James V.; Greenwood, Mark. Toxic Substances: A Half Century of Progress (PDF) (報告). EPA Alumni Association. 1 March 2016 [1 January 2019]. (原始內容存檔 (PDF)於2021-07-02).
- Baird, C.; Cann, N. Environmental Chemistry 5th. W. H. Freeman and Company. 2012. ISBN 978-1-4292-7704-4.
- Becker, M.; Förster, C.; Franzen, C.; et al. Persistent radicals of trivalent tin and lead. Inorganic Chemistry. 2008, 47 (21): 9965–78. PMID 18823115. doi:10.1021/ic801198p.
- Beeman, J. W.; Bellini, F.; Cardani, L.; et al. New experimental limits on the α decays of lead isotopes. European Physical Journal A. 2013, 49 (50): 50. Bibcode:2013EPJA...49...50B. S2CID 119280082. arXiv:1212.2422
 . doi:10.1140/epja/i2013-13050-7.
. doi:10.1140/epja/i2013-13050-7. - Beiner, G. G.; Lavi, M.; Seri, H.; et al. Oddy Tests: Adding the Analytical Dimension. Collection Forum. 2015, 29 (1–2): 22–36. ISSN 0831-4985. doi:10.14351/0831-4985-29.1.22
 .
. - Bharara, M. S.; Atwood, D. A. Lead: Inorganic ChemistryBased in part on the article Lead: Inorganic Chemistry by Philip G. Harrison which appeared in theEncyclopedia of Inorganic Chemistry, First Edition. Lead: Inorganic Chemistry. 2006. ISBN 978-0470860786. doi:10.1002/0470862106.ia118.
- Bisel, S. C.; Bisel, J. F. Health and nutrition at Herculaneum. Jashemski, W. F.; Meyer, F. G. (編). The Natural History of Pompeii. Cambridge University Press. 2002: 451–75. ISBN 978-0-521-80054-9.
- Bisson, M. S.; Vogel, J. O. Ancient African Metallurgy: The Sociocultural Context. Rowman & Littlefield. 2000 [2022-10-04]. ISBN 978-0-7425-0261-1. (原始內容存檔於2022-11-08).
- Blakemore, J. S. Solid State Physics. Cambridge University Press. 1985 [2022-09-30]. ISBN 978-0-521-31391-9. (原始內容存檔於2022-11-08).
- Bouchard, M. F.; Bellinger, D. C.; Weuve, J.; et al. Blood Lead Levels and Major Depressive Disorder, Panic Disorder, and Generalized Anxiety Disorder in US Young Adults. Archives of General Psychiatry. 2009, 66 (12): 1313–9. ISSN 0003-990X. PMC 2917196
 . PMID 19996036. doi:10.1001/archgenpsychiatry.2009.164.
. PMID 19996036. doi:10.1001/archgenpsychiatry.2009.164. - Brescia, F. Fundamentals of Chemistry: A Modern Introduction. Elsevier. 2012 [2022-10-01]. ISBN 978-0-323-14231-1. (原始內容存檔於2022-10-05).
- Bremner, H. A. Safety and Quality Issues in Fish Processing. Elsevier. 2002 [2022-10-16]. ISBN 978-1-85573-678-8. (原始內容存檔於2022-10-18).
- Bretherick, L. Bretherick's Handbook of Reactive Chemical Hazards. Elsevier. 2016 [2022-10-01]. ISBN 978-1-4831-6250-8. (原始內容存檔於2022-10-01).
- Bunker, B. C.; Casey, W. H. The Aqueous Chemistry of Oxides. Oxford University Press. 2016 [2022-10-01]. ISBN 978-0-19-938425-9. (原始內容存檔於2022-11-08).
- Burbidge, E. M.; Burbidge, G. R.; Fowler, W. A.; et al. Synthesis of the Elements in Stars (PDF). Reviews of Modern Physics. 1957, 29 (4): 547–654 [2022-10-03]. Bibcode:1957RvMP...29..547B. doi:10.1103/RevModPhys.29.547
 . (原始內容 (PDF)存檔於2016-06-24).
. (原始內容 (PDF)存檔於2016-06-24). - Burleson, M. The Ceramic Glaze Handbook: Materials, Techniques, Formulas. Sterling. 2001 [2022-10-11]. ISBN 9781579904395. (原始內容存檔於2022-11-08).
- California Department of Fish and Wildlife. Nonlead Ammunition in California. www.wildlife.ca.gov. [17 May 2017]. (原始內容存檔於2017-08-27).
- Calvo Rebollar, Miguel. Construyendo la Tabla Periódica. Zaragoza, Spain: Prames. 2019. ISBN 978-84-8321-908-9.
- Cama, T. Interior secretary repeals ban on lead bullets. The Hill. 2017 [30 May 2018]. (原始內容存檔於2018-06-12).
- Cangelosi, V. M.; Pecoraro, V. L. Lead. Roduner, E. (編). Nanoscopic Materials: Size-Dependent Phenomena and Growth Principles. Royal Society of Chemistry. 2015: 843–875. ISBN 978-1-78262-494-3.
- Ceccarelli, P. Ancient Greek Letter Writing: A Cultural History (600 BC- 150 BC). OUP Oxford. 2013 [2022-10-05]. ISBN 978-0-19-967559-3. (原始內容存檔於2022-11-08).
- Centers for Disease Control and Prevention. Update: blood lead levels--United States, 1991-1994. Morbidity and Mortality Weekly Report. 1997, 46 (7): 141–146. ISSN 0149-2195. PMID 9072671.
- Christensen, N. E. Relativistic Solid State Theory. Schwerdtfeger, P. (編). Relativistic Electronic Structure Theory — Fundamentals. Theoretical and Computational Chemistry 11. Elsevier. 2002: 867–68. ISBN 978-0-08-054046-7. doi:10.1016/s1380-7323(02)80041-3.
- Considine, D. M.; Considine, G. D. Van Nostrand's Scientific Encyclopedia. Springer Science & Business Media. 2013 [2022-09-29]. ISBN 978-1-4757-6918-0. (原始內容存檔於2022-10-04).
- Committee on Evaluation of EPA Guidelines for Exposure to Naturally Occurring Radioactive Materials; Commission on Life Sciences; Division on Earth and Life Studies; National Research Council. Evaluation of Guidelines for Exposures to Technologically Enhanced Naturally Occurring Radioactive Materials. National Academies Press. 1999: 26, 30–32 [2022-10-01]. ISBN 978-0-309-58070-0. (原始內容存檔於2022-10-01).
- Concordia University. Lead acid batteries (PDF) (報告). 2016 [17 February 2019]. (原始內容存檔 (PDF)於2022-12-18).
- Copper Development Association. Leaded Coppers. copper.org. [10 July 2016]. (原始內容存檔於2022-12-03).
- Cotnoir, B. The Weiser Concise Guide to Alchemy. Weiser Books. 2006 [2022-10-06]. ISBN 978-1-57863-379-1. (原始內容存檔於2022-10-06).
- Cox, P. A. The Elements: Their Origin, Abundance and Distribution
 . Oxford University Press. 1997. ISBN 978-0-19-855298-7.
. Oxford University Press. 1997. ISBN 978-0-19-855298-7. - Lide, D. R. (編). CRC Handbook of Chemistry and Physics 85th. CRC Press. 2005. ISBN 978-0-8493-0484-2.
- Crow, J. M. Why use lead in paint?. Chemistry World (Royal Society of Chemistry). 2007 [22 February 2017]. (原始內容存檔於2017-02-22).
- Delile, H.; Blichert-Toft, J.; Goiran, J.-P.; et al. Lead in ancient Rome's city waters. Proceedings of the National Academy of Sciences. 2014, 111 (18): 6594–99. Bibcode:2014PNAS..111.6594D. ISSN 0027-8424. PMC 4020092
 . PMID 24753588. doi:10.1073/pnas.1400097111
. PMID 24753588. doi:10.1073/pnas.1400097111  .
. - Deltares; Netherlands Organisation for Applied Scientific Research. Lood en zinkemissies door jacht [Lead and zinc emissions from hunting] (PDF) (報告). 2016 [18 February 2017]. (原始內容 (PDF)存檔於2020-11-26) (荷蘭語).
- Davidson, A.; Ryman, J.; Sutherland, C. A.; et al. Lead. Ullmann's Encyclopedia of Industrial Chemistry. 2014. ISBN 978-3-527-30673-2. doi:10.1002/14356007.a15_193.pub3.
- Emsley, J. Nature's Building Blocks: An A-Z Guide to the Elements. Oxford University Press. 2011. ISBN 978-0-19-960563-7.
- Evans, J. W. V.— The meanings and synonyms of plumbago. Transactions of the Philological Society. 1908, 26 (2): 133–79 [2022-10-11]. doi:10.1111/j.1467-968X.1908.tb00513.x. (原始內容存檔於2022-10-16).
- Fiorini, E. 2.000 years-old Roman Lead for physics (PDF). ASPERA. 2010: 7–8 [29 October 2016]. (原始內容 (PDF)存檔於26 April 2018).
- Freeman, K. S. Remediating soil lead with fishbones. Environmental Health Perspectives. 2012, 120 (1): a20–a21. PMC 3261960
 . PMID 22214821. doi:10.1289/ehp.120-a20a.
. PMID 22214821. doi:10.1289/ehp.120-a20a. - de Callataÿ, F. The Graeco-Roman economy in the super long-run: Lead, copper, and shipwrecks. Journal of Roman Archaeology. 2005, 18: 361–72. S2CID 232346123. doi:10.1017/S104775940000742X.
- Guberman, D. E. Lead (PDF). 2014 Minerals Yearbook (報告). United States Geological Survey. 2016 [8 May 2017]. (原始內容存檔 (PDF)於2022-08-14).
- Guruswamy, S. Engineering properties and applications of lead alloys. Marcel Dekker. 2000. ISBN 978-0-8247-8247-4.
- Cohen, A. R.; Trotzky, M. S.; Pincus, D. Reassessment of the Microcytic Anemia of Lead Poisoning. Pediatrics. 1981, 67 (6): 904–906 [2022-10-15]. PMID 7232054. S2CID 42146120. doi:10.1542/peds.67.6.904. (原始內容存檔於2013-07-25).
- Dart, R. C.; Hurlbut, K. M.; Boyer-Hassen, L. V. Lead. Dart, R. C. (編). Medical Toxicology 3rd. Lippincott Williams & Wilkins. 2004: 1426. ISBN 978-0-7817-2845-4.
- de Marcillac, Pierre; Coron, Noël; Dambier, Gérard; et al. Experimental detection of α-particles from the radioactive decay of natural bismuth. Nature. 2003, 422 (6934): 876–78. Bibcode:2003Natur.422..876D. PMID 12712201. S2CID 4415582. doi:10.1038/nature01541.
- Donnelly, J. Deep Blue. Hachette Children's Group. 2014 [2022-10-06]. ISBN 978-1-4449-2119-9. (原始內容存檔於2022-10-09).
- Dieter, R. K.; Watson, R. T. Transmetalation reactions producing organocopper compounds. Rappoport, Z.; Marek, I. (編). The Chemistry of Organocopper Compounds 1. John Wiley & Sons. 2009: 443–526 [2022-10-01]. ISBN 978-0-470-77296-6. (原始內容存檔於2022-10-17).
- Downs, A. J.; Adams, C. J. The Chemistry of Chlorine, Bromine, Iodine and Astatine: Pergamon Texts in Inorganic Chemistry. Elsevier. 2017 [2022-10-01]. ISBN 978-1-4831-5832-7. (原始內容存檔於2022-10-06).
- Duda, M. B. Traditional Chinese Toggles: Counterweights and Charms. Editions Didier Millet. 1996. ISBN 978-981-4260-61-9.
- Ede, A.; Cormack, L. B. A History of Science in Society, Volume I: From the Ancient Greeks to the Scientific Revolution, Third Edition. University of Toronto Press. 2016 [2022-10-06]. ISBN 978-1-4426-3503-6. (原始內容存檔於2022-10-06).
- Eschnauer, H. R.; Stoeppler, M. Wine—An enological specimen bank. Stoeppler, M. (編). Hazardous Materials in the Environment. Elsevier Science. 1992: 49–72 (58). ISBN 978-0-444-89078-8. doi:10.1016/s0167-9244(08)70103-3.
- Frankenburg, F. R. Brain-Robbers: How Alcohol, Cocaine, Nicotine, and Opiates Have Changed Human History. ABC-CLIO. 2014 [2022-10-05]. ISBN 978-1-4408-2932-1. (原始內容存檔於2022-10-07).
- Frebel, A. Searching for the Oldest Stars: Ancient Relics from the Early Universe. Princeton University. 2015. ISBN 978-0-691-16506-6.
- Gale, W. F.; Totemeier, T. C. Smithells Metals Reference Book. Butterworth-Heinemann. 2003. ISBN 978-0-08-048096-1.
- Gilfillan, S. C. Lead poisoning and the fall of Rome. Journal of Occupational Medicine. 1965, 7 (2): 53–60. ISSN 0096-1736. PMID 14261844.
- Gill, T.; Libraries Board of South Australia. The history and topography of Glen Osmond, with map and illustrations. Libraries Board of South Australia. 1974. ISBN 9780724300358.
- Graedel, T. E.; et al. Metal stocks in Society – Scientific Synthesis (PDF) (報告). International Resource Panel: 17. 2010 [18 April 2017]. ISBN 978-92-807-3082-1. (原始內容 (PDF)存檔於26 April 2018).
- Grandjean, P. Widening perspectives of lead toxicity. Environmental Research. 1978, 17 (2): 303–21. Bibcode:1978ER.....17..303G. PMID 400972. doi:10.1016/0013-9351(78)90033-6.
- Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Butterworth-Heinemann. 1998. ISBN 978-0-7506-3365-9.
- Grout, J. Lead poisoning and Rome. Encyclopaedia Romana. 2017 [15 February 2017]. (原始內容存檔於2023-06-07).
- Gulbinska, M. K. Lithium-ion Battery Materials and Engineering: Current Topics and Problems from the Manufacturing Perspective. Springer. 2014: 96 [2022-10-11]. ISBN 978-1-4471-6548-4. (原始內容存檔於2022-10-16).
- Hadlington, T. J. On the Catalytic Efficacy of Low-Oxidation State Group 14 Complexes. Springer. 2017 [2022-10-01]. ISBN 978-3-319-51807-7. (原始內容存檔於2022-10-05).
- Harbison, R. D.; Bourgeois, M. M.; Johnson, G. T. Hamilton and Hardy's Industrial Toxicology. John Wiley & Sons. 2015. ISBN 978-0-470-92973-5.
- Hauser, P. C. Analytical Methods for the Determination of Lead in the Environment. Astrid, S.; Helmut, S.; Sigel, R. K. O. (編). Lead: Its Effects on Environment and Health. Metal Ions in Life Sciences 17. de Gruyter. 2017: 49–60. ISBN 9783110434330. PMID 28731296. doi:10.1515/9783110434330-003.
- Hernberg, S. Lead Poisoning in a Historical Perspective (PDF). American Journal of Industrial Medicine. 2000, 38 (3): 244–54 [1 March 2017]. PMID 10940962. doi:10.1002/1097-0274(200009)38:3<244::AID-AJIM3>3.0.CO;2-F. (原始內容 (PDF)存檔於21 September 2017).
- A History of Cosmetics from Ancient Times. Cosmetics Info. [18 July 2016]. (原始內容存檔於14 July 2016).
- Hodge, T. A. Vitruvius, lead pipes and lead poisoning. American Journal of Archaeology. 1981, 85 (4): 486–91. JSTOR 504874. S2CID 193094209. doi:10.2307/504874.
- Hong, S.; Candelone, J.-P.; Patterson, C. C.; et al. Greenland ice evidence of hemispheric lead pollution two millennia ago by Greek and Roman civilizations (PDF). Science. 1994, 265 (5180): 1841–43 [2022-10-04]. Bibcode:1994Sci...265.1841H. PMID 17797222. S2CID 45080402. doi:10.1126/science.265.5180.1841. (原始內容存檔 (PDF)於2019-04-29).
- Hunt, A. Dictionary of Chemistry. Routledge. 2014 [2022-10-01]. ISBN 978-1-135-94178-9. (原始內容存檔於2022-10-01).
- IAEA - Nuclear Data Section. Livechart - Table of Nuclides - Nuclear structure and decay data. www-nds.iaea.org. International Atomic Energy Agency. 2017 [31 March 2017]. (原始內容存檔於2021-09-29).
- Insight Explorer; IPEN. New Study Finds Lead Levels in a Majority of Paints Exceed Chinese Regulation and Should Not be on Store Shelves (PDF) (報告). 2016 [3 May 2018]. (原始內容存檔 (PDF)於2022-12-05).
- Ismawati, Yuyun; Primanti, Andita; Brosché, Sara; Clark, Scott; Weinberg, Jack; Denney, Valerie. Timbal dalam Cat Enamel Rumah Tangga di Indonesia (PDF) (報告). BaliFokus & IPEN. 2013 [26 December 2018]. (原始內容存檔 (PDF)於2021-03-28) (印度尼西亞語).
- Jensen, C. F. Online Location of Faults on AC Cables in Underground Transmission. Springer. 2013. ISBN 978-3-319-05397-4.
- Kaupp, M. Chemical bonding of main-group elements (PDF). Frenking, G.; Shaik, S. (編). The Chemical Bond: Chemical Bonding Across the Periodic Table. John Wiley & Sons. 2014: 1–24. ISBN 9783527664658. S2CID 17979350. doi:10.1002/9783527664658.ch1.
- Kellett, C. Poison and Poisoning: A Compendium of Cases, Catastrophes and Crimes. Accent Press. 2012 [2022-10-06]. ISBN 978-1-909335-05-9. (原始內容存檔於2019-07-08).
- King, R. B. Inorganic Chemistry of Main Group Elements. VCH Publishers. 1995. ISBN 978-1-56081-679-9.
- Konu, J.; Chivers, T. Stable Radicals of the Heavy p-Block Elements. Hicks, R. G. (編). Stable Radicals: Fundamentals and Applied Aspects of Odd-Electron Compounds. John Wiley & Sons. 2011 [2022-10-01]. ISBN 978-0-470-77083-2. doi:10.1002/9780470666975.ch10. (原始內容存檔於2022-10-05).
- Kosnett, M. J. Lead. Olson, K. R. (編). Poisoning and Drug Overdose 5th. McGraw-Hill Professional. 2006: 238. ISBN 978-0-07-144333-3.
- Krestovnikoff, M.; Halls, M. Scuba Diving
 . Dorling Kindersley. 2006. ISBN 978-0-7566-4063-7.
. Dorling Kindersley. 2006. ISBN 978-0-7566-4063-7. - Langmuir, C. H.; Broecker, W. S. How to Build a Habitable Planet: The Story of Earth from the Big Bang to Humankind. Princeton University Press. 2012 [2022-10-03]. ISBN 978-0-691-14006-3. (原始內容存檔於2022-10-03).
- Lauwerys, R. R.; Hoet, P. Industrial Chemical Exposure: Guidelines for Biological Monitoring, Third Edition. CRC Press. 2001 [2022-10-13]. ISBN 978-1-4822-9383-8. (原始內容存檔於2022-10-13).
- Layton, M. Lead faces threat of new Euro ban. shootinguk.co.uk. 2017 [30 May 2018]. (原始內容存檔於2019-06-09).
- Lead sling bullet; almond shape; a winged thunderbolt on one side and on the other, in high relief, the inscription DEXAI "Catch!". The British Museum. [30 April 2012]. (原始內容存檔於14 February 2012).
- Lead in Waste Disposal. United States Environmental Protection Agency. 2016 [28 February 2017]. (原始內容存檔於2022-12-19).
- Lead mining. The Northern Echo. [16 February 2016]. (原始內容存檔於2022-10-11).
- Levin, H. L. The Earth Through Time. John Wiley & Sons. 2009. ISBN 978-0-470-38774-0.
- Levin, R.; Brown, M. J.; Kashtock, M. E.; et al. Lead exposures in U.S. children, 2008: Implications for prevention. Environmental Health Perspectives. 2008, 116 (10): 1285–93. PMC 2569084
 . PMID 18941567. doi:10.1289/ehp.11241.
. PMID 18941567. doi:10.1289/ehp.11241. - Liu, J.; Liu, X.; Pak, V.; et al. Early blood lead levels and sleep disturbance in preadolescence. Sleep. 2015, 38 (12): 1869–74. PMC 4667382
 . PMID 26194570. doi:10.5665/sleep.5230.
. PMID 26194570. doi:10.5665/sleep.5230. - Lochner, J. C.; Rohrbach, G.; Cochrane, K. What is Your Cosmic Connection to the Elements? (PDF). Goddard Space Flight Center. 2005 [2 July 2017]. (原始內容 (PDF)存檔於29 December 2016).
- Lodders, K. Solar System abundances and condensation temperatures of the elements (PDF). The Astrophysical Journal. 2003, 591 (2): 1220–47 [2022-10-03]. Bibcode:2003ApJ...591.1220L. ISSN 0004-637X. S2CID 42498829. doi:10.1086/375492. (原始內容存檔 (PDF)於2021-09-16).
- Luckey, T. D.; Venugopal, B. Physiologic and Chemical Basis for Metal Toxicity. Plenum Press. 1979 [2022-10-15]. ISBN 978-1-4684-2952-7. (原始內容存檔於2022-10-17).
- Macintyre, J. E. Dictionary of Inorganic Compounds. CRC Press. 1992 [2022-10-01]. ISBN 978-0-412-30120-9. (原始內容存檔於2022-10-06).
- Marino, P. E.; Landrigan, P. J.; Graef, J.; et al. A case report of lead paint poisoning during renovation of a Victorian farmhouse. American Journal of Public Health. 1990, 80 (10): 1183–85. PMC 1404824
 . PMID 2119148. doi:10.2105/AJPH.80.10.1183.
. PMID 2119148. doi:10.2105/AJPH.80.10.1183. - Markowitz, G.; Rosner, D. "Cater to the children": the role of the lead industry in a public health tragedy, 1900–55. American Journal of Public Health. 2000, 90 (1): 36–46. PMC 1446124
 . PMID 10630135. doi:10.2105/ajph.90.1.36.
. PMID 10630135. doi:10.2105/ajph.90.1.36. - McCoy, S. The End of Lead? Federal Gov't Order Bans Sinkers, Ammo. GearJunkie. 2017 [30 May 2018]. (原始內容存檔於2020-03-08).
- Masters, S. B.; Trevor, A. J.; Katzung, B. G. Katzung & Trevor's Pharmacology: Examination & Board Review 8th. McGraw-Hill Medical. 2008. ISBN 978-0-07-148869-3.
- Moore, M. R. Lead in drinking water in soft water areas—health hazards. Science of the Total Environment. 1977, 7 (2): 109–15. Bibcode:1977ScTEn...7..109M. PMID 841299. doi:10.1016/0048-9697(77)90002-X.
- More, A. F.; Spaulding, N. E.; Bohleber, P.; et al. Next-generation ice core technology reveals true minimum natural levels of lead (Pb) in the atmosphere: Insights from the Black Death (PDF). GeoHealth. 2017, 1 (4): 211–219 [2022-10-08]. ISSN 2471-1403. PMC 7007106
 . PMID 32158988. doi:10.1002/2017GH000064. (原始內容存檔 (PDF)於2020-04-18).
. PMID 32158988. doi:10.1002/2017GH000064. (原始內容存檔 (PDF)於2020-04-18). - Mosseri, S.; Henglein, A.; Janata, E. Trivalent lead as an intermediate in the oxidation of lead(II) and the reduction of lead(IV) species. Journal of Physical Chemistry. 1990, 94 (6): 2722–26. doi:10.1021/j100369a089.
- Mycyk, M.; Hryhorczuk, D.; Amitai, Y.; et al. Lead. Erickson, T. B.; Ahrens, W. R.; Aks, S. (編). Pediatric Toxicology: Diagnosis and Management of the Poisoned Child. McGraw-Hill Professional. 2005. ISBN 978-0-07-141736-5.
- Nakashima, T.; Hayashi, H.; Tashiro, H.; et al. Gender and hierarchical differences in lead-contaminated Japanese bone from the Edo period. Journal of Occupational Health. 1998, 40 (1): 55–60. doi:10.1539/joh.40.55
 .
. - National Council on Radiation Protection and Measurements. Structural Shielding Design for Medical X-ray Imaging Facilities. 2004 [2022-10-11]. ISBN 978-0-929600-83-3. (原始內容存檔於2022-10-11).
- Navas-Acien, A. Lead Exposure and Cardiovascular Disease—A Systematic Review. Environmental Health Perspectives. 2007, 115 (3): 472–482. PMC 1849948
 . PMID 17431501. doi:10.1289/ehp.9785.
. PMID 17431501. doi:10.1289/ehp.9785. - Norman, N. C. Periodicity and the s- and p-Block Elements. Oxford University Press. 1996. ISBN 978-0-19-855961-0.
- National Institute for Occupational Safety and Health. NIOSH Pocket Guide to Chemical Hazards — Lead. www.cdc.gov. [18 November 2016]. (原始內容存檔於2010-11-08).
- Nriagu, J. O. Saturnine gout among Roman aristocrats — Did lead poisoning contribute to the fall of the Empire?. The New England Journal of Medicine. 1983, 308 (11): 660–63. PMID 6338384. doi:10.1056/NEJM198303173081123.
- Occupational Safety and Health Administration. Substance data sheet for occupational exposure to lead. www.osha.gov. [1 July 2017]. (原始內容存檔於16 March 2018).
- Encyclopedia Judaica: Ossuaries and Sarcophagi. www.jewishvirtuallibrary.org. [14 July 2018]. (原始內容存檔於2022-10-07).
- Olinsky-Paul, T. East Penn and Ecoult battery installation case study webinar (PDF). Clean Energy States Alliance. 2013 [28 February 2017]. (原始內容存檔 (PDF)於2020-04-20).
- Palmieri, R. (編). The Organ. Psychology Press. 2006 [2022-10-11]. ISBN 978-0-415-94174-7. (原始內容存檔於2024-03-17).
- Parthé, E. Crystal Chemistry of Tetrahedral Structures. CRC Press. 1964 [2022-09-29]. ISBN 978-0-677-00700-7. (原始內容存檔於2022-09-29).
- Park, J. H.; Bolan, N.; Meghara, M.; et al. Bacterial-assisted immobilization of lead in soils: Implications for remediation (PDF). Pedologist. 2011: 162–74. (原始內容 (PDF)存檔於26 November 2015).
- Parker, R. B. The New Cold-Molded Boatbuilding: From Lofting to Launching. WoodenBoat Books. 2005 [2022-10-11]. ISBN 978-0-937822-89-0. (原始內容存檔於2022-10-11).
- Pauling, L. General Chemistry. W. H. Freeman and Company. 1947. ISBN 978-0-486-65622-9.
- Petzel, S.; Juuti, M.; Sugimoto, Yu. Environmental Stewardship with Regional Perspectives and Drivers of the Lead-free Issue. Puttlitz, K. J.; Stalter, K. A. (編). Handbook of Lead-Free Solder Technology for Microelectronic Assemblies. CRC Press. 2004 [2022-10-18]. ISBN 978-0-8247-5249-1. (原始內容存檔於2022-04-11).
- Polyanskiy, N. G. Fillipova, N. A , 編. Аналитическая химия элементов: Свинец [Analytical Chemistry of the Elements: Lead]. Nauka. 1986 (俄語).
- Prasad, P. J. Conceptual Pharmacology. Universities Press. 2010 [21 June 2012]. ISBN 978-81-7371-679-9. (原始內容存檔於2022-10-15).
- Primary Lead Refining Technical Notes. LDA International. [7 April 2007]. (原始內容存檔於22 March 2007).
- Progressive Dynamics, Inc. How Lead Acid Batteries Work: Battery Basics. progressivedyn.com. [3 July 2016]. (原始內容存檔於19 November 2018).
- Putnam, B. The Sculptor's Way: A Guide to Modelling and Sculpture. Dover Publications. 2003 [2022-10-11]. ISBN 978-0-486-42313-5. (原始內容存檔於2022-10-16).
- Pyykkö, P. Relativistic effects in structural chemistry. Chemical Reviews. 1988, 88 (3): 563–94. doi:10.1021/cr00085a006.
- Rabinowitz, M. B. Imputing lead sources from blood lead isotope ratios. Beard, M. E.; Allen Iske, S. D. (編). Lead in Paint, Soil, and Dust: Health Risks, Exposure Studies, Control Measures, Measurement Methods, and Quality Assurance. ASTM. 1995: 63–75 [2022-10-06]. ISBN 978-0-8031-1884-3. doi:10.1520/stp12967s. (原始內容存檔於2022-10-06).
- Centers for Disease Control and Prevention. Radiation and Your Health. 2015 [28 February 2017]. (原始內容存檔於2022-10-22).
- Ramage, C. K. (編). Lyman Cast Bullet Handbook
 3rd. Lyman Products Corporation. 1980.
3rd. Lyman Products Corporation. 1980. - Reddy, A.; Braun, C. L. Lead and the Romans. Journal of Chemical Education. 2010, 87 (10): 1052–55. Bibcode:2010JChEd..87.1052R. doi:10.1021/ed100631y.
- Roederer, I. U.; Kratz, K.-L.; Frebel, A.; et al. The end of nucleosynthesis: Production of lead and thorium in the early galaxy. The Astrophysical Journal. 2009, 698 (2): 1963–80. Bibcode:2009ApJ...698.1963R. S2CID 14814446. arXiv:0904.3105
 . doi:10.1088/0004-637X/698/2/1963.
. doi:10.1088/0004-637X/698/2/1963. - Rieuwerts, J. The Elements of Environmental Pollution. Routledge. 2015. ISBN 978-0-415-85919-6.
- Riva, M. A.; Lafranconi, A.; d'Orso, M. I.; et al. Lead poisoning: Historical aspects of a paradigmatic "occupational and environmental disease". Safety and Health at Work. 2012, 3 (1): 11–16. PMC 3430923
 . PMID 22953225. doi:10.5491/SHAW.2012.3.1.11.
. PMID 22953225. doi:10.5491/SHAW.2012.3.1.11. - Retief, F.; Cilliers, L. P. Lead poisoning in ancient Rome. Acta Theologica. 2006, 26 (2): 147–64 (149–51). doi:10.4314/actat.v26i2.52570
 .
. - Rich, V. The International Lead Trade. Woodhead Publishing. 1994. ISBN 978-0-85709-994-5.
- Rogalski, A. Infrared Detectors 2nd. CRC Press. 2010 [19 November 2016]. ISBN 978-1-4200-7671-4. (原始內容存檔於2022-10-11).
- Röhr, C. Binare Zintl-Phasen [Binary Zintl Phases]. Intermetallische Phasen [Intermettallic Phases]. Universitat Freiburg. 2017 [18 February 2017]. (原始內容存檔於2020-11-06) (德語).
- Radioactive Decay Series (PDF). Nuclear Systematics. MIT OpenCourseWare. 2012 [28 April 2018]. (原始內容存檔 (PDF)於2016-05-28).
- Rudolph, A. M.; Rudolph, C. D.; Hostetter, M. K.; et al. Lead. Rudolph's Pediatrics 21st. McGraw-Hill Professional. 2003: 369. ISBN 978-0-8385-8285-5.
- Samson, G. W. The divine law as to wines. J. B. Lippincott & Co. 1885.
- Scarborough, J. The myth of lead poisoning among the Romans: An essay review. Journal of the History of Medicine and Allied Sciences. 1984, 39 (4): 469–475. PMID 6389691. doi:10.1093/jhmas/39.4.469.
- Schoeters, G.; Den Hond, E.; Dhooge, W.; et al. Endocrine disruptors and abnormalities of pubertal development (PDF). Basic & Clinical Pharmacology & Toxicology. 2008, 102 (2): 168–175 [2022-10-15]. PMID 18226071. doi:10.1111/j.1742-7843.2007.00180.x. hdl:1854/LU-391408
 . (原始內容存檔 (PDF)於2022-04-15).
. (原始內容存檔 (PDF)於2022-04-15). - Silverman, M. S. High-pressure (70-k) synthesis of new crystalline lead dichalcogenides. Inorganic Chemistry. 1966, 5 (11): 2067–69. doi:10.1021/ic50045a056.
- Singh, P. Over 73% of paints found to have excessive lead: Study. Times of India. 2017 [3 May 2018]. (原始內容存檔於2018-12-01).
- Sokol, R. C. Lead exposure and its effects on the reproductive system. Golub, M. S. (編). Metals, Fertility, and Reproductive Toxicity. CRC Press. 2005: 117–53 [2022-10-15]. ISBN 978-0-415-70040-5. doi:10.1201/9781420023282.ch6. (原始內容存檔於2022-10-15).
- Slater, J. C. Atomic Radii in Crystals. The Journal of Chemical Physics. 1964, 41 (10): 3199–3204. Bibcode:1964JChPh..41.3199S. ISSN 0021-9606. doi:10.1063/1.1725697.
- Sinha, S. P.; Shelly; Sharma, V.; et al. Neurotoxic effects of lead exposure among printing press workers. Bulletin of Environmental Contamination and Toxicology. 1993, 51 (4): 490–93. PMID 8400649. S2CID 26631583. doi:10.1007/BF00192162.
- Smirnov, A. Yu.; Borisevich, V. D.; Sulaberidze, A. Evaluation of specific cost of obtainment of lead-208 isotope by gas centrifuges using various raw materials. Theoretical Foundations of Chemical Engineering. 2012, 46 (4): 373–78. S2CID 98821122. doi:10.1134/s0040579512040161.
- Stabenow, F.; Saak, W.; Weidenbruch, M. Tris(triphenylplumbyl)plumbate: An anion with three stretched lead–lead bonds. Chemical Communications. 2003, (18): 2342–2343. PMID 14518905. doi:10.1039/B305217F.
- Street, A.; Alexander, W. Metals in the Service of Man 11th. Penguin Books. 1998. ISBN 978-0-14-025776-2.
- Stone, R. An Element of Stability. Science. 1997, 278 (5338): 571–572. Bibcode:1997Sci...278..571S. S2CID 117946028. doi:10.1126/science.278.5338.571.
- Tarragó, A. Case Studies in Environmental Medicine (CSEM) Lead Toxicity (PDF). Agency for Toxic Substances and Disease Registry. 2012 [2022-10-16]. (原始內容存檔 (PDF)於2022-10-13).
- Szczepanowska, H. M. Conservation of Cultural Heritage: Key Principles and Approaches. Routledge. 2013 [2022-10-11]. ISBN 978-0-415-67474-4. (原始內容存檔於2022-10-11).
- Tétreault, J.; Sirois, J.; Stamatopoulou, E. Studies of lead corrosion in acetic acid environments. Studies in Conservation. 1998, 43 (1): 17–32. JSTOR 1506633. doi:10.2307/1506633.
- Takahashi, K.; Boyd, R. N.; Mathews, G. J.; et al. Bound-state beta decay of highly ionized atoms (PDF). Physical Review C. 1987, 36 (4): 1522–1528 [27 August 2013]. Bibcode:1987PhRvC..36.1522T. OCLC 1639677. PMID 9954244. doi:10.1103/physrevc.36.1522. (原始內容 (PDF)存檔於21 October 2014).
- Thomson, T. The History of Chemistry. Henry Colburn and Richard Bentley (publishers). 1830. ISBN 9780405066238.
- Thornton, I.; Rautiu, R.; Brush, S. M. Lead: The Facts (PDF). International Lead Association. 2001 [5 February 2017]. ISBN 978-0-9542496-0-1. (原始內容存檔 (PDF)於2020-07-26).
- Toxicological Profile for Lead (PDF). Agency for Toxic Substances and Disease Registry/Division of Toxicology and Environmental Medicine. 2007. (原始內容 (PDF)存檔於1 July 2017).
- Tuček, K.; Carlsson, J.; Wider, H. Comparison of sodium and lead-cooled fast reactors regarding reactor physics aspects, severe safety and economical issues (PDF). Nuclear Engineering and Design. 2006, 236 (14–16): 1589–98 [2022-10-11]. doi:10.1016/j.nucengdes.2006.04.019. (原始內容存檔 (PDF)於2019-08-19).
- Think Lead research summary (PDF). The Lead Sheet Association. [20 February 2017]. (原始內容 (PDF)存檔於20 February 2017).
- Thürmer, K.; Williams, E.; Reutt-Robey, J. Autocatalytic oxidation of lead crystallite surfaces. Science. 2002, 297 (5589): 2033–35. Bibcode:2002Sci...297.2033T. PMID 12242437. S2CID 6166273. doi:10.1126/science.297.5589.2033.
- Tolliday, B. Significant growth in lead usage underlines its importance to the global economy. International Lead Association. 2014 [28 February 2017]. (原始內容存檔於28 February 2017).
Global demand for lead has more than doubled since the early 1990s and almost 90% of use is now in lead-acid batteries
- Toronto museum explores history of contraceptives. ABC News. 2003 [13 February 2016]. (原始內容存檔於2022-12-05).
- Trace element emission from coal. IEA Clean Coal Centre. 2012 [1 March 2017]. (原始內容存檔於2020-03-11).
- Toxic Substances Portal – Lead. Agency for Toxic Substances and Disease Registry. (原始內容存檔於6 June 2011).
- Tungate, M. Branded Beauty: How Marketing Changed the Way We Look. Kogan Page Publishers. 2011 [2022-10-06]. ISBN 978-0-7494-6182-9. (原始內容存檔於2022-10-07).
- UK Marine SACs Project. Lead. Water Quality (報告). 1999 [10 June 2018]. (原始內容存檔於2020-02-17).
- United States Geological Survey. Geological Survey Professional Paper. United States Government Publishing Office. 1973: 314.
- University of California Nuclear Forensic Search Project. Decay Chains. Nuclear Forensics: A Scientific Search Problem. [23 November 2015]. (原始內容存檔於2018-10-16).
- United States Environmental Protection Agency. Regulatory Status of Waste Generated by Contractors and Residents from Lead-Based Paint Activities Conducted in Households (August 2000). 2000 [28 February 2017]. (原始內容存檔於2022-05-31).
- Lead mining. The Northern Echo. [16 February 2016]. (原始內容存檔於2022-10-11).
- United Nations Environment Programme. Final review of scientific information on lead (PDF). Chemicals Branch, Division of Technology, Industry and Economics. 2010 [31 January 2017]. (原始內容存檔 (PDF)於2022-12-16).
- United States Food and Drug Administration. Q3D Elemental Impurities Guidance for Industry (PDF) (報告). United States Department of Health and Human Services: 41. 2015 [15 February 2017]. (原始內容存檔 (PDF)於2019-04-12).
- United States Geological Survey. Lead (PDF) (報告). 2005 [20 February 2016]. (原始內容存檔 (PDF)於2019-04-12).
- United States Geological Survey. Lead (PDF). Mineral Commodities Summaries. 2017 [8 May 2017]. (原始內容存檔 (PDF)於2019-04-12).
- Vogel, N. A.; Achilles, R. The Preservation and Repair of Historic Stained and Leaded Glass (PDF) (報告). United States Department of the Interior. 2013 [30 October 2016]. (原始內容存檔 (PDF)於2022-10-04).
- Waldron, H. A. Lead and lead poisoning in antiquity. Medical History. 1985, 29 (1): 107–08. PMC 1139494
 . doi:10.1017/S0025727300043878.
. doi:10.1017/S0025727300043878. - Wani, A. L.; Ara, A.; Usman, J. A. Lead toxicity: A review. Interdisciplinary Toxicology. 2015, 8 (2): 55–64. PMC 4961898
 . PMID 27486361. doi:10.1515/intox-2015-0009.
. PMID 27486361. doi:10.1515/intox-2015-0009. - Wiberg, E.; Wiberg, N.; Holleman, A. F. Inorganic Chemistry. Academic Press. 2001. ISBN 978-0-12-352651-9.
- Willey, D. G. The physics behind four amazing demonstrations — CSI. Skeptical Inquirer. 1999, 23 (6) [6 September 2016]. (原始內容存檔於2019-03-27).
- Webb, G. A. Nuclear Magnetic Resonance. Royal Society of Chemistry. 2000. ISBN 978-0-85404-327-9.
- Winder, C. The history of lead — Part 3. LEAD Action News. 1993b, 2 (3) [12 February 2016]. ISSN 1324-6011. (原始內容存檔於31 August 2007).
- Windholz, M. Merck Index of Chemicals and Drugs 9th. Merck & Co. 1976. ISBN 978-0-911910-26-1. Monograph 8393.
- Weatherings to Parapets and Cornices. The Lead Sheet Association. [20 February 2017]. (原始內容存檔於20 February 2017).
- Webb, G. W.; Marsiglio, F.; Hirsch, J. E. Superconductivity in the elements, alloys and simple compounds. Physica C: Superconductivity and Its Applications. 2015, 514: 17–27. Bibcode:2015PhyC..514...17W. S2CID 119290828. arXiv:1502.04724
 . doi:10.1016/j.physc.2015.02.037.
. doi:10.1016/j.physc.2015.02.037. - World Nuclear Association. Nuclear Radiation and Health Effects. 2015 [12 November 2015]. (原始內容存檔於2015-12-24).
- Wrackmeyer, B.; Horchler, K. 207Pb-NMR Parameters 22. Academic Press. 1990: 249–303. ISBN 978-0-08-058405-8. doi:10.1016/S0066-4103(08)60257-4.
- Whitten, K. W.; Gailey, K. D.; David, R. E. General chemistry with qualitative analysis 3rd. Saunders College. 1996. ISBN 978-0-03-012864-6.
- Winder, C. The history of lead — Part 1. LEAD Action News. 1993a, 2 (1) [5 February 2016]. ISSN 1324-6011. (原始內容存檔於31 August 2007).
- World Health Organization. Environmental Health Criteria 165: Inorganic Lead (報告). 1995 [10 June 2018]. (原始內容存檔於2022-07-05).
- World Health Organization. Lead (PDF). Air quality guidelines for Europe. Regional Office for Europe. 2000: 149–53. ISBN 978-92-890-1358-1. OCLC 475274390.
- World Health Organization. Lead poisoning and health. 2018 [17 February 2019]. (原始內容存檔於2019-01-07) (英語).
- Wood, J. R.; Hsu, Y-T.; Bell, C. Sending Laurion Back to the Future: Bronze Age Silver and the Source of Confusion (PDF). Internet Archaeology. 2021, 56 (9) [2022-10-05]. S2CID 236973111. doi:10.11141/ia.56.9. (原始內容存檔 (PDF)於2022-03-20).
- Yong, L.; Hoffmann, S. D.; Fässler, T. F. A low-dimensional arrangement of [Pb9]4· clusters in [K(18-crown-6)]2K2Pb9·(en)1.5. Inorganica Chimica Acta. 2006, 359 (15): 4774–78. doi:10.1016/j.ica.2006.04.017.
- Young, S. Battling lead contamination, one fish bone at a time. Compass. United States Coast Guard. 2012 [11 February 2017]. (原始內容存檔於14 June 2013).
- Yu, L.; Yu, H. Chinese Coins: Money in History and Society. Long River Press. 2004 [2022-10-04]. ISBN 978-1-59265-017-0. (原始內容存檔於2022-10-06).
- Zhang, X.; Yang, L.; Li, Y.; et al. Impacts of lead/zinc mining and smelting on the environment and human health in China. Environmental Monitoring and Assessment. 2012, 184 (4): 2261–73. PMID 21573711. S2CID 20372810. doi:10.1007/s10661-011-2115-6.
- Zhao, F. Information Technology Entrepreneurship and Innovation. IGI Global. 2008: 440 [2022-10-11]. ISBN 978-1-59904-902-1. (原始內容存檔於2022-10-14).
- Zuckerman, J. J.; Hagen, A. P. Inorganic Reactions and Methods, the Formation of Bonds to Halogens. John Wiley & Sons. 1989. ISBN 978-0-471-18656-4.
- Zýka, J. Analytical study of the basic properties of lead tetraacetate as oxidizing agent. Pure and Applied Chemistry. 1966, 13 (4): 569–81 [2 March 2017]. S2CID 96821219. doi:10.1351/pac196613040569. (原始內容存檔於2022-10-01).
延伸閱讀
[編輯][在維基數據編輯]
- Astrid, S.; Helmut, S.; Sigel, R. K. O. (編). Lead: Its Effects on Environment and Health. Metal Ions in Life Sciences 17. De Gruyter. 2017. ISBN 978-3-11-044107-9. ([//web.archive.org/web/20200311113727/https://www.degruyter.com/viewbooktoc/product/460569 頁面存檔備份,存於互聯網檔案館) Table of contents]
- Casas, J. S.; Sordo, J. (編). Lead Chemistry, Analytical Aspects. Environmental Impacts and Health Effects. Elsevier. 2006 [2022-09-30]. ISBN 978-0-444-52945-9. (原始內容存檔於2014-07-06).
外部連結
[編輯]- 元素鉛在洛斯阿拉莫斯國家實驗室的介紹(英文)
- EnvironmentalChemistry.com —— 鉛(英文)
- 元素鉛在The Periodic Table of Videos(諾丁漢大學)的介紹(英文)
- 元素鉛在Peter van der Krogt elements site的介紹(英文)
- WebElements.com – 鉛(英文)




