脯氨酸
| 脯氨酸 | |||
|---|---|---|---|
| |||
| IUPAC名 Proline | |||
| 系统名 Pyrrolidine-2-carboxylic acid[1] | |||
| 识别 | |||
| CAS号 | 609-36-9 344-25-2(R) 147-85-3(S) | ||
| PubChem | 614 8988(R) 145742(S) | ||
| ChemSpider | 594, 8640 (R), 128566 (S) | ||
| SMILES |
| ||
| InChI |
| ||
| Beilstein | 80812 | ||
| Gmelin | 26927 | ||
| EINECS | 210-189-3 | ||
| ChEBI | 26271 | ||
| RTECS | TW3584000 | ||
| DrugBank | DB02853 | ||
| KEGG | C16435 | ||
| MeSH | Proline | ||
| 性质 | |||
| 化学式 | C5H9NO2 | ||
| 摩尔质量 | 115.13 g·mol−1 | ||
| 外观 | 透明晶体 | ||
| 熔点 | 205-228 °C(478-501 K)(分解) | ||
| 溶解性 | 1.5g/100g(乙醇,19 °C)[2] | ||
| log P | -0.06 | ||
| pKa | 1.99(羧基)、10.96(氨基)[3] | ||
| 危险性 | |||
| 安全术语 | S:S22, S24/25 | ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
脯氨酸(Proline,缩写为Pro 或P )是一个α-氨基酸,又是一个环状氨基酸,20个DNA编码的其中之一。它极易溶于水,微溶于乙醇、丙酮、苯,不溶于乙醚、丙醇。 虽然属于蛋白氨基酸,并不是伯胺而是仲胺(旧称为亚氨酸),因此具有特殊构象刚性,影响肽的二级结构。其对应密码子为CCU、CCC、CCA和CCG。
脯氨酸不是一种必需氨基酸,人体可以自行合成。在20个蛋白质形成氨基酸中,其最特别之处在于胺氮被绑定到并非一个而是两个烷基基团,因此使它具有仲胺结构,天然的脯氨酸为L型,手性碳的构型为S。
生物化学[编辑]
脯氨酸由氨基酸的L-谷氨酸和其中间前驱物亚氨基乙酸((''S'')-1 -吡咯啉-5-羧酸甲酯(P5C)生物合成而成,典型生物合成所需要的酶包括:[4]
- 谷氨酸5-激酶,谷氨酸1-激酶(ATP依赖性)
- 氨酸脱氢酶(须具备NADH或NADPH)
- 吡咯啉-5-羧酸还原酶(须具备NADH或NADPH)

蛋白质结构的特性[编辑]
脯氨酸侧链的独特环状结构,使脯氨酸相对于其他氨基酸具有特殊构象刚性,它也影响了脯氨酸和其他氨基酸之间肽键形成的速率,当脯氨酸在一个肽键中被绑定作为酰胺时,其氮原子未绑定到任何的氢原子,则它不能作为氢键供体,但可以是氢键受体。
Pro-tRNAPro的肽键形成相较于其他tRNA相当的缓慢,此为N-烷基氨基羧酸一般的特征,[5] tRNA和脯氨酸键结端部之间肽键的形成也相当缓慢,在所有脯氨酸键结和脯氨酸键结之间的创造是速度最慢的。[6]
脯氨酸的特殊构象刚性影响蛋白质的二级结构,其蛋白质邻近于一个脯氨酸残基,而使脯氨酸在嗜热生物蛋白质中的高发病率,蛋白质的二级结构可以两面角φ,ψ和蛋白质主链ω表示,脯氨酸侧链的锁环结构的夹角φ约-60℃。
脯氨酸在正规二级结构元素中间为结构性干扰物,如α螺旋和β片层,脯氨酸是α螺旋常见的第一个残基,也同时是β片层的边缘链,脯氨酸也常发现于匝数(另一种二级结构)中,且有助于β匝数的形成,尽管具有一个完整的脂肪族侧链,脯氨酸通常暴露于溶剂之外。
一排中的多个脯氨酸和/或羟基脯氨酸可以创造一个聚脯氨酸螺旋,聚脯氨酸螺旋是胶原中的主要二级结构,脯氨酸经由脯氨酰羟化酶(或其它添加的吸电子取代基,如氟)的羟基化,显著增加胶原蛋白的构象稳定性。[7] 因此,脯氨酸的羟基化是一个关键生化过程,用以维持高等生物体的结缔组织,严重疾病如败血症,可导致羟基化的缺陷,例如在酶脯氨酰羟化酶中突变或缺乏必要的抗坏血酸(维生素C)辅助因子。
脯氨酸和2-氨基异丁酸(AIB)的序列也可以形成一个螺旋圈结构。[来源请求]
顺反异构物[编辑]
同大多数氨基酸肽键采用反式异构体(非应变条件下通常为99.9%)不同,脯氨酸和其它N-取代的氨基酸(如肌氨酸)的肽键既能形成顺式异构物也能形成反式异构物。这是因为在大多数氨基酸中,反式异构体比顺式异构体具有更小的空间位阻斥力,然而在X-Pro肽键的“顺”“反”异构物(X表示任何氨基酸)中,相邻取代基的空间位阻几乎相同。因此,X-Pro的肽键在非应变条件下,其“顺式”异构体的比例可以达到10-40%,这一比例轻微依赖于前面氨基酸的类型,特别是具有芳香族残基的氨基酸有利于使其成为“顺式”异构物。
从动力学的角度来看,脯氨酸的“顺”-“反”异构化是一个非常缓慢的过程,这一过程可以通过捕获一个或多个脯氨酸关键残基,从而阻碍非自然异构物的蛋白质折叠,特别是当自然蛋白质需要“顺式”异构物时。这是因为当脯氨酸残基在核糖体中只能被合成为反式构象。所有生物体都需要利用脯氨酰异构酶催化异构化,而一些细菌具有专门的与核糖体有关的脯氨酰异构酶。然而,脯氨酸并非对所有的折叠都是必须的,尽管具有许多X-脯肽键的非天然异构物的蛋白质是以正常的速率进行折叠的。
用途[编辑]
脯氨酸和其衍生物通常在有机反应中当作对称催化剂,CBS还原反应和脯氨酸被催化羟醛缩合反应是突出的例子。
L-脯氨酸是一种渗透保护剂,因此可用于多种药物,生物技术的应用。
在酿造时,蛋白质富含和多酚结合的脯氨酸,可产生雾度(浊度)。[8]
特色[编辑]
脯氨酸是不符合典型的拉氏图的两种氨基酸之一,另一个是甘氨酸。由于连接β碳原子的环形成时,肽键的ψ和φ角度有较少允许度的旋转,因此,它经常被发现于蛋白质的“匝数”当其自由熵(ΔS)比其他氨基酸大,因此在折叠的形式与未折叠的形式的比较中熵的变化较少,此外,脯氨酸的α和β结构很少被发现,因为其侧链上α-N只能形成一个氢键,它会降低结构的稳定性。
此外,脯氨酸是唯一的在色谱法中使用茚三酮后不形成蓝/紫色的氨基酸,相反,脯氨酸产生橙/黄色。
历史[编辑]
在1990年,里夏德·维尔施泰特(Richard Willstätter)透过丙二酸二乙酯的钠盐与1,3 -二溴丙烷的反应合成脯氨酸。在1901年, 赫尔曼·埃米尔·费歇尔(Hermann Emil Fischer)从酪蛋白和γ-邻苯二甲酰-propylmalonic酯的分解产物分离脯氨酸。[9]
合成[编辑]
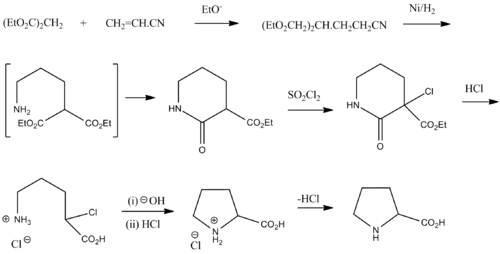
外消旋混合物脯氨酸可以从丙二酸二乙酯和丙烯腈被合成:[10]
参考文献[编辑]
- ^ 存档副本. [2014-06-23]. (原始内容存档于2014-01-16).
- ^ H.-D. Belitz; W. Grosch; P. Schieberle. Food Chemistry. : 15 [2014-06-23]. ISBN 978-3-540-69933-0. (原始内容存档于2016-05-15).
- ^ Nelson, D.L., Cox, M.M., Principles of Biochemistry. NY: W.H. Freeman and Company.
- ^ Template:Lehninger3rd.
- ^ Pavlov, Michael Y; Watts, Richard E; Tan, Zhongping; Cornish, Virginia W; Ehrenberg, Måns; Forster, Anthony C, Slow peptide bond formation by proline and other N-alkylamino acids in translation, PNAS, 2010, 106 (1): 50–54, PMC 2629218
 , PMID 19104062, doi:10.1073/pnas.0809211106.
, PMID 19104062, doi:10.1073/pnas.0809211106.
- ^ Buskirk, Allen R.; Green, Rachel. Getting Past Polyproline Pauses. Science. 2013, 339 (6115): 38–39 [2014-06-23]. doi:10.1126/science.1233338. (原始内容存档于2012-01-18).
- ^ Szpak, Paul. Fish bone chemistry and ultrastructure: implications for taphonomy and stable isotope analysis. Journal of Archaeological Science. 2011, 38 (12): 3358–3372 [2014-06-23]. doi:10.1016/j.jas.2011.07.022. (原始内容存档于2012-01-18).
- ^ K.J. Siebert, "Haze and Foam",存档副本. [2010-07-13]. (原始内容存档于2010-07-11). Accessed July 12, 2010.
- ^ R.H.A. Plimmer, R.H.A. Plimmer & F.G. Hopkins , 编, The chemical composition of the proteins, Monographs on biochemistry, Part I. Analysis 2nd, London: Longmans, Green and Co.: 130, 1912 [1908] [September 20, 2010]
- ^ Vogel, Practical Organic Chemistry 5th edition
延伸阅读[编辑]
- Balbach, J.; Schmid, F. X., Proline isomerization and its catalysis in protein folding, Pain, R. H. (编), Mechanisms of Protein Folding 2nd, Oxford University Press: 212–49, 2000, ISBN 0-19-963788-1.
- For a thorough scientific overview of disorders of proline and hydroxyproline metabolism, one can consult chapter 81 of OMMBID Charles Scriver, Beaudet, A.L., Valle, D., Sly, W.S., Vogelstein, B., Childs, B., Kinzler, K.W. (Accessed 2007). The Online Metabolic and Molecular Bases of Inherited Disease (页面存档备份,存于互联网档案馆). New York: McGraw-Hill. - Summaries of 255 chapters, full text through many universities. There is also the OMMBID blog.
参看[编辑]
外部链接[编辑]
- (英文)脯氨酸 MS Spectrum (页面存档备份,存于互联网档案馆)
- (英文)脯氨酸生物合成
- (英文)脯氨酸生物合成 Archive.is的存档,存档日期2013-01-02
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||