抗体:修订间差异
小无编辑摘要 |
翻译自en:Antybody 2011-06-20, oldid=435315063 |
||
| 第1行: | 第1行: | ||
{{Expert|time=2011-02-05}} |
{{Expert|time=2011-02-05}} |
||
<!--以下内容均因为歧义页面在中文版不存在而暂时没有作用--><!-- |
|||
[[File:Antibody.svg|thumb|255px|每個抗體結合特定[[抗原]](antigens);類似的鎖和鑰匙的互動性([[專一性]])。]] |
|||
{{Redirect|Immunoglobulin|the immunoglobulin family|Immunoglobulin superfamily}} |
|||
'''抗體'''(Antibody),又稱'''免疫球蛋白'''(Immunoglobin,簡稱 Ig),是一种[[免疫系统]]中鉴别与中和外来物质如[[细菌]]、[[病毒]]等的Y形的蛋白质,在[[脊椎動物]]的[[血液]]或其他體液中被發現。<ref name=Janeway5>{{cite book | author = [[Charles Janeway|Janeway CA, Jr.]] ''et al'' | title = Immunobiology. | edition = 5th | publisher = Garland Publishing | year = 2001 | id = [http://www.ncbi.nlm.nih.gov/books/bv.fcgi?call=bv.View..ShowTOC&rid=imm.TOC&depth=10 (electronic full text via NCBI Bookshelf)] ISBN 0-8153-3642-X }}</ref><ref name="pmid8450761">{{cite journal | author = Litman GW, Rast JP, Shamblott MJ, Haire RN, Hulst M, Roess W, Litman RT, Hinds-Frey KR, Zilch A, Amemiya CT | title = Phylogenetic diversification of immunoglobulin genes and the antibody repertoire | journal = Mol. Biol. Evol. | volume = 10 | issue = 1 | pages = 60–72 | year = 1993 | month = January | pmid = 8450761 | doi = | url = | issn = }}</ref>每个抗体的Y形的一个尖端包含一个[[互补位]](可类比为一个锁装结构),可以特异性结合抗原上的一种特定的[[表位]](等价为一把钥匙),将其精确的结合在一起。依靠这种结合机制,一个抗体可以“标记”一个微生物或一个被感染的细胞,以诱导其他免疫机制对其进行攻击,或直接中和其目标(例如通过阻断微生物的某一对入侵和生存至关重要的部分)。<ref name=Pier>{{cite book | author = Pier GB, Lyczak JB, Wetzler LM | title = Immunology, Infection, and Immunity | edition = | publisher = ASM Press| year = 2004 | isbn = 1-55581-246-5}}</ref>抗体也可以与[[血清]]中的[[补体]]一起直接杀死细菌。 |
|||
{{Redirect|Antibodies|the film|Antibodies (film)}} |
|||
--> |
|||
[[File:Antibody.svg|thumb|255px|每個抗體結合特定[[抗原]],如同鎖和鑰匙的互動性([[特异性]])。.]] |
|||
'''抗體'''(Antibody),又稱'''免疫球蛋白'''(Immunoglobin,簡稱 Ig),是一种[[免疫系统]]中鉴别与中和外来物质如[[细菌]]、[[病毒]]等的大型Y形[[蛋白质]],仅被发现存在于[[脊椎动物]]的[[血液]]等[[体液]]中<ref name=Janeway5>{{cite book | author = [[Charles Janeway|Janeway CA, Jr.]] ''et al'' | title = Immunobiology. | edition = 5th | publisher = Garland Publishing | year = 2001 | id = [http://www.ncbi.nlm.nih.gov/books/bv.fcgi?call=bv.View..ShowTOC&rid=imm.TOC&depth=10 (electronic full text via NCBI Bookshelf)] ISBN 0-8153-3642-X }}</ref><ref name="pmid8450761">{{cite journal | author = Litman GW, Rast JP, Shamblott MJ, Haire RN, Hulst M, Roess W, Litman RT, Hinds-Frey KR, Zilch A, Amemiya CT | title = Phylogenetic diversification of immunoglobulin genes and the antibody repertoire | journal = Mol. Biol. Evol. | volume = 10 | issue = 1 | pages = 60–72 | year = 1993 | month = January | pmid = 8450761 | doi = | url = | issn = }}</ref>。抗体能识别特定外来物的一个独特特征,该外来目标被称为[[抗原]]。蛋白上Y型的其中两个分叉顶端都有一被称为[[wikt:paratope|互补位]]的锁装结构,该结构仅针对一种特定的[[抗原表位]]。这就像一把钥匙只能开一把锁一般,使得一种抗体仅能和其中一种抗原相结合。正因这种特异性的结合机制,抗体可以“标记”外来[[微生物]]以及受感染的[[细胞]],以诱导其他免疫机制对其进行攻击,又或直接中和其目标,例如通过与入侵和生存至关重要的部分相结合而阻断微生物的感染能力等。[[体液免疫|体液免疫系统]]的主要功能便是制造抗体<ref name=Pier>{{cite book | author = Pier GB, Lyczak JB, Wetzler LM | title = Immunology, Infection, and Immunity | edition = | publisher = ASM Press| year = 2004 | isbn = 1-55581-246-5}}</ref>。抗体也可以与[[血清]]中的[[补体]]一起直接杀死外来目标。 |
|||
抗體是由一種叫做漿細胞的白血球所製造。抗体以两种物质形态出现,一种是从细胞分泌出的溶解形态,另一种是依附与B细胞表面的膜结合形态,结合后该复合物被称为[[B细胞受体]]。B细胞受体近存在于在B细胞表面,能辅助B细胞的激活及其后的分化:B细胞分化为抗体工厂——浆细胞,或保存相同抗体的持续生存的记忆性B细胞,以在未来再次暴露于抗原的时候更快的作出反应。 |
|||
抗 |
抗體是由一種叫做[[漿細胞]]的[[白细胞]]所製造。抗体有两种物理形态,一种是从细胞分泌出的可溶解物形态,另一种是依附于[[B细胞]]表面的[[细胞膜|膜]]结合形态。抗体与细胞膜结合后所形成的复合体又被称为[[B细胞感受器]](B Cell Receptor,BCR),这种复合体只存在于B细胞的细胞膜表面,是激活B细胞以及后续分化的重要结构。B细胞分化后成为生产抗体的工厂的[[浆细胞]],或者长期存活于体内以便未来能迅速抵抗相同入侵物的[[记忆B细胞]]<ref name="pmid17337763">{{cite journal | author = Borghesi L, Milcarek C | title = From B cell to plasma cell: regulation of V(D)J recombination and antibody secretion | journal = Immunol. Res. | volume = 36 | issue = 1-3 | pages = 27–32 | year = 2006 | pmid = 17337763 | doi = 10.1385/IR:36:1:27 | url = | issn = }}</ref>。在大多数情况下,与B细胞进行互动的[[辅助型T细胞]]对于B细胞的完全活化是至关重要的,因为辅助型T细胞负责识别抗原,并促使B细胞能分化出能与该抗原相结合的抗体的浆细胞和记忆型B细胞<ref>{{cite journal |doi=10.1146/annurev.iy.11.040193.001555 |author=Parker D |title=T cell-dependent B cell activation |journal=Annu Rev Immunol |volume=11 |issue= 1|pages=331–60 |year=1993 |pmid=8476565}}</ref>。而可溶性抗体则被释放到血液等体液当中(包括各种分泌物),持续抵抗正在入侵的外来微生物。 |
||
抗体 |
抗体是[[免疫球蛋白超家族]]中的一种[[糖蛋白]]<ref name=Rhoades>{{cite book | author = Rhoades RA, Pflanzer RG | title = Human Physiology | edition = 4th | publisher = Thomson Learning | year = 2002 | isbn = 0-534-42174-1}}</ref>。抗体通常由一些基础单元组成,每一个抗体包括:两个大的[[免疫球蛋白重链|重链]],以及两个小的[[免疫球蛋白轻链|轻链]]。重链的不同,将会导致抗体[[同种型_(免疫学)|种型]]的不同。在[[哺乳类动物]]身上已知的不同种型的抗体有五种,它们分别扮演不同的角色,并引导免疫系统对所遇到的不同类型外来入侵物产生正确的免疫响应<ref name="Market">{{cite journal | author = Market E, Papavasiliou FN | title = V(D)J recombination and the evolution of the adaptive immune system | journal = PLoS Biol. | volume = 1 | issue = 1 | pages = E16 | year = 2003 | month = October | pmid = 14551913 | pmc = 212695 | doi = 10.1371/journal.pbio.0000016 | url = | issn = }}</ref>。 |
||
尽管所有抗体 |
尽管所有的抗体大体上看都很相似,然而在蛋白质Y型分叉的两个顶端有一小部分是可以发生非常丰富的变化的。这一高变区上的细微变化可达百万种以上,该位置就是抗原结合点。每一种特定的变化,可以使该抗体和某一个特定的[[抗原]]特异结合<ref name=Janeway5>{{cite book | author = [[Charles Janeway|Janeway CA, Jr]] ''et al.'' | title = Immunobiology. | edition = 5th | publisher = Garland Publishing | year = 2001 | url = http://www.ncbi.nlm.nih.gov/books/bv.fcgi?call=bv.View..ShowTOC&rid=imm.TOC&depth=10 | isbn = 978-0-8153-3642-6 }}</ref>。这种极丰富的变化能力,使得免疫系统可以应对同样非常多变的各种抗体<ref name=Rhoades>{{cite book | author = Rhoades RA, Pflanzer RG | title = Human Physiology| edition = 4th | publisher = Thomson Learning | year = 2002 | isbn = 978-0-534-42174-8}}</ref>。之所以能产生如此丰富多样的抗体,是因为编码抗体[[基因]]中,编码抗原结合点(即互补位)的部分可以随机组合及[[突变]]<ref name=Market/><ref name=diaz>{{cite journal |author=Diaz M, Casali P |title=Somatic immunoglobulin hypermutation |journal=Curr Opin Immunol |volume=14 |issue=2 |pages=235–40 |year=2002 |pmid=11869898 |doi=10.1016/S0952-7915(02)00327-8}}</ref>。此外,在{{TransHint|免疫种型转换|Immunoglobulin class switching|en}}的过程中,可以修改重链的类型,从而制造出对相同抗原特异的不同种型的抗体,使得同种抗体可以用于不同的免疫系统过程中。 |
||
== |
==形态== |
||
表面免疫球蛋白通过跨膜部分附着在效应B细胞的细胞膜上,而分泌到血液等体液中的抗体则没有该跨膜部分。这两种抗体除了是否存在跨膜部分之外,结构是完全相同的。根据这一区别,抗体被分为两种形态:可溶形态(分泌形态)及膜结合形态。<!-- (Parham 21-22) --> |
|||
“设计的”[[单克隆抗体]]是可能的对抗[[癌症]]和其他疾病的有效武器。 |
|||
膜结合形态抗体可称为“表面免疫球蛋白”(sIg)或者“膜免疫球蛋白”(mIg),是“[[B细胞感受器]]”(BCR)的其中一部分。当体内存在某种抗原的时候,会与该蛋白结合,并激活B细胞<ref>{{cite journal |
|||
== 在[[生物化学]]中的应用 == |
|||
|author=Parker D |
|||
在生物化学中,抗体用来免疫鉴定蛋白质([[西方墨點法]]),接[[螢光]]標記之抗体可以用来确定蛋白质在活细胞中的位置。 |
|||
|title=T cell-dependent B cell activation |
|||
|journal=Annu. Rev. Immunol. |
|||
|volume=11 |
|||
|issue=1 |
|||
|pages=331–60 |
|||
|year=1993 |
|||
|pmid=8476565 |
|||
|doi=10.1146/annurev.iy.11.040193.001555}} |
|||
</ref>。B细胞感受器由表面免疫球蛋白(IgD或IgM),以及与之相连接的由Ig-α和Ig-β构成的[[异源二聚体]]所组成,其中后者负责传递抗原刺激信号<ref name="isbn978-0-7817-3650-3">{{cite book |
|||
|author=Wintrobe, Maxwell Myer |
|||
|authorlink= Maxwell Wintrobe |
|||
|editor= |
|||
|others= John G. Greer, John Foerster, John N Lukens, George M Rodgers, Frixos Paraskevas |
|||
|title=Wintrobe's clinical hematology |
|||
|edition=11 |
|||
|publisher=Lippincott Williams & Wilkins |
|||
|location=Hagerstown, MD |
|||
|year=2004 |
|||
|pages=453–456 |
|||
|quote= |
|||
|isbn=978-0-7817-3650-3 |
|||
}}</ref>。[[人类]]B细胞表面所拥有抗体的典型数量为5万至10万左右<ref name="isbn978-0-7817-3650-3" />。这些抗体通常会聚集在每个直径大约1[[微米]]的[[脂筏]]上,这些脂筏用于隔离细胞上的其它信号[[感受器]]<ref name="isbn978-0-7817-3650-3" />,这种聚集方式可能可以提升[[细胞媒介性免疫]]的效率<ref name="pmid18275475">{{cite journal |
|||
|author=Tolar P, Sohn HW, Pierce SK |
|||
|title=Viewing the antigen-induced initiation of B-cell activation in living cells |
|||
|journal=Immunol. Rev. |
|||
|volume=221 |
|||
|issue= |
|||
1|pages=64–76 |
|||
|year=2008 |
|||
|month=February |
|||
|pmid=18275475 |
|||
|doi=10.1111/j.1600-065X.2008.00583.x |
|||
|url=http://www.blackwell-synergy.com/openurl?genre=article&sid=nlm:pubmed&issn=0105-2896&date=2008&volume=221&spage=64 |
|||
}}</ref>。在人类B细胞的表面,这些B细胞感受器聚集的脂筏周围几百[[纳米]]的范围内没有其它感受器,以避免互相竞争的影响<ref name="isbn0-7817-3650-1">{{cite book |
|||
|author=Wintrobe, Maxwell Myer |
|||
|authorlink= Maxwell Wintrobe |
|||
|editor= |
|||
|others= John G. Greer, John Foerster, John N Lukens, George M Rodgers, Frixos Paraskevas |
|||
|title=Wintrobe's clinical hematology |
|||
|edition=11 |
|||
|publisher=Lippincott Williams & Wilkins |
|||
|location=Hagerstown, MD |
|||
|year=2004 |
|||
|pages=453–456 |
|||
|quote= |
|||
|isbn=0-7817-3650-1 |
|||
}}</ref>。 |
|||
== |
== 种型 == |
||
{| class = "wikitable" style = "width:55%; float:right; font-size:90%; margin-left:15px" |
|||
<references/> |
|||
|+ 哺乳类动物抗体的种型 |
|||
* 新药发现开发技术平台,2007年版,高等教育出版社, ISBN 978-7-04-022039-1 |
|||
| '''名称''' || '''类型数量''' || style="text-align:center;"| '''描述''' || style="text-align:center;"| '''抗体复合物''' |
|||
|- |
|||
== 参见 == |
|||
| style="text-align:center;"| [[IgA]] || style="text-align:center;"| 2 || 存在于[[粘膜]]组织,例如[[消化道]]、[[呼吸道]]以及[[泌尿生殖系统]],以避免遭到[[病原]]的入侵<ref>{{cite journal |author=Underdown B, Schiff J |title=Immunoglobulin A: strategic defense initiative at the mucosal surface |journal=Annu Rev Immunol |volume=4 |issue= 1|pages=389–417 |year=1986 |pmid=3518747 |doi=10.1146/annurev.iy.04.040186.002133}}</ref>,也存在于唾液、泪液以及乳汁当中。|| rowspan="5" |[[File:Mono-und-Polymere.svg|170px]]其中一些抗体[[蛋白质结构|复合体]]可以与多个抗原分子结合。 |
|||
|- |
|||
| style="text-align:center;"| [[IgD]] || style="text-align:center;"| 1 || 主要出现在尚未遇到过抗原的B细胞上的抗原感受器<ref name=Geisberger>{{cite journal |author=Geisberger R, Lamers M, Achatz G |title=The riddle of the dual expression of IgM and IgD |journal=Immunology |volume=118 |issue=4 |pages=429–37 |year=2006 |pmid=16895553 |doi=10.1111/j.1365-2567.2006.02386.x |pmc=1782314}}</ref>,用于刺激[[嗜碱性粒细胞]]及[[肥大细胞]]生产[[抗菌因子]]<ref name=Chen>{{cite journal |author=Chen K, Xu W, Wilson M, He B, Miller NW, Bengtén E, Edholm ES, Santini PA, Rath P, Chiu A, Cattalini M, Litzman J, B Bussel J, Huang B, Meini A, Riesbeck K, Cunningham-Rundles C, Plebani A, Cerutti A |title=Immunoglobulin D enhances immune surveillance by activating antimicrobial, proinflammatory and B cell-stimulating programs in basophils |journal=Nature Immunology |volume=10 |issue=8 |pages=889–98 |year=2009 |pmid=19561614 |doi=10.1038/ni.1748 |pmc=2785232}}。</ref> |
|||
|- |
|||
| style="text-align:center;"| [[IgE]] || style="text-align:center;"| 1 || 与[[致敏原]]相结合,刺激肥大细胞和嗜碱性粒细胞释放[[组织胺]]。该种型与[[过敏反应]]有关,同时也保护机体免受[[寄生虫]]的威胁<ref name=Pier/>。 |
|||
|- |
|||
| style="text-align:center;"| [[IgG]] || style="text-align:center;"| 4 || 抵抗病原入侵的抗体相关[[免疫力]],主要由该种型下的四种类型所提供<ref name=Pier/>,也是唯一一种可以穿过[[胎盘]]为[[胎儿]]提供[[被动免疫|被动免疫力]]的种型。 |
|||
|- |
|||
| style="text-align:center;"| [[IgM]] || style="text-align:center;"| 1 || 与B细胞表面结合的是[[单体]]形式,在分泌形态中则是[[五聚体]]形式,并具有极高的亲和力。在B细胞介导(体液)免疫的早期阶段IgG尚不充足,此时则主要由IgM来发挥清除病原的作用<ref name=Pier/><ref name=Geisberger/>。 |
|||
|} |
|||
抗体可以根据[[同种型_(免疫学)|种型]]来分为多种类别,不同的种型在免疫系统中有不同的确定作用。对于[[胎生]]哺乳类动物,存在5种种型,分别是IgA、IgD、IgE、IgG以及IgM,其中前面的"Ig"代表免疫球蛋白(Immunoglobulin,对抗体的另一种称法)。这几种种型在生物属性、发挥功能的位置以及所能处理的抗原类型均有所不同,具体请参见右方的表格<ref name = woof>{{cite journal |author=Woof J, Burton D |title=Human antibody-Fc receptor interactions illuminated by crystal structures |journal=Nat Rev Immunol |volume=4 |issue=2 |pages=89–99 |year=2004 |pmid=15040582 |doi=10.1038/nri1266}}</ref>。 |
|||
B细胞的抗体种型会随着B细胞的[[B细胞#发育|发育]]和活化而有所变化。从未接触过任何抗原的未成熟B细胞(也称为初始B细胞)尽在细胞表面表达IgM种型的膜结合形态。当其成熟后,将会同时表达IgM和IgG两种形式,这表明该B细胞仪能够对抗原产生响应,亦即“成熟”了<ref name=Goding>{{cite journal |author=Goding J |title=Allotypes of IgM and IgD receptors in the mouse: a probe for lymphocyte differentiation |journal=Contemp Top Immunobiol |volume=8 |issue= |pages=203–43 |year= 1978|pmid=357078}}</ref>。 |
|||
抗原与B细胞上抗体的结合,将会导致B细胞活化,并随之分裂并[[细胞分化|分化]]成生产抗体的[[浆细胞]]。这种活化形态的B细胞将会产生大量[[分泌]]形态的抗体,而不是膜结合形态的抗体。其中部分[[细胞分类|子代]]会发生[[免疫种型交换]],该机制将会导致生产的抗体从IgM或IgD种型,变成IgE、IgA或者IgG种型。 |
|||
== 结构 == |
|||
抗体是一种[[高分子]][[球状蛋白质|球状]][[血液蛋白质]],重量约为150[[原子质量单位|kDa]]。由于在部分[[氨基酸]]残基中含有糖链<ref>{{cite journal |author=Mattu T, Pleass R, Willis A, Kilian M, Wormald M, Lellouch A, Rudd P, Woof J, Dwek R |title=The glycosylation and structure of human serum IgA1, Fab, and Fc regions and the role of N-glycosylation on Fc alpha receptor interactions |journal=J Biol Chem |volume=273 |issue=4 |pages=2260–72 |year=1998 |pmid=9442070 |doi=10.1074/jbc.273.4.2260}}</ref>,抗体也是一种糖蛋白。能发挥功能的基本单位是一个免疫球蛋白单体。在分泌形态的抗体中包括:[[二聚体]]IgA、[[真骨附类|真骨附类鱼]]的[[四聚体]]IgM以及哺乳动物的[[五聚体]]IgM<ref name = roux>{{cite journal |author=Roux K |title=Immunoglobulin structure and function as revealed by electron microscopy |journal=Int Arch Allergy Immunol |volume=120 |issue=2 |pages=85–99 |year=1999 |pmid=10545762 |doi=10.1159/000024226}}</ref>。 |
|||
[[File:Antibody IgG2.png|thumb|right|多种免疫球蛋白结构域构成了抗体的两条重链(红色和蓝色部分),以及两条轻链(绿色和黄色)。这些结构域包含7次(恒定区)及9次(变化区)的[[Β折叠|β折叠]]。]] |
|||
可发生变化的部分称为V区(或变化区),而不变的部分称为C区(或恒定区)。 |
|||
===免疫球蛋白结构域=== |
|||
抗体的单体是一个Y型的分子,有4条[[多肽链]]组成。其中包括两条相同的重链,以及两条相同的轻链,之间由双硫键连接在一起<ref name = woof/>。每一条链均由称为[[免疫球蛋白结构域]]的多个[[结构域]]所组成。每一个结构域大约包含70至110个氨基酸,并根据大小和功能分门别类。例如可变域IgV以及恒定域IgC)<ref>{{cite journal |author=Barclay A |title=Membrane proteins with immunoglobulin-like domains--a master superfamily of interaction molecules |journal=Semin Immunol |volume=15 |issue=4 |pages=215–23 |year=2003 |pmid=14690046 |doi=10.1016/S1044-5323(03)00047-2}}</ref>。它们的[[免疫球蛋白折叠|折叠]]方式很特别:通过两次[[Β折叠|β折叠]]将另一条链卷入其中形成[[三明治]]状,互相之间通过[[半胱氨酸]]和其它带电荷氨基酸紧密结合。 |
|||
===重链=== |
|||
{{details|免疫球蛋白重链}} |
|||
哺乳动物的[[免疫球蛋白重链]]有5种,分别用[[希腊字母]]记为:α、δ、ε、γ以及μ<ref name=Janeway5/>。根据重链类型的不同,抗体被分为不同的种型,它们被发现依序本别存在于抗体IgA、IgD、IgE、IgG以及IgM中<ref name=Rhoades/>。不同的重链其大小和组成各不相同:α和γ大约有450个氨基酸组成,而μ和ε大约有550个氨基酸组成<ref name=Janeway5/>。 |
|||
[[File:Immunoglobulin basic unit.svg|thumb|1. [[抗原结合区]](Fab)<br />2. [[抗原结晶区]](Fc)<br />3. 蓝色的[[免疫球蛋白重链|重链]]有一个可变区(V<sub>H</sub>),紧随其后的一个恒定区(C<sub>H</sub>1),一个枢纽区,以及另两个恒定区(C<sub>H</sub>2 and C<sub>H</sub>3)组成<br />4. 绿色的[[免疫球蛋白轻链|轻链]]包含一个可变区(V<sub>L</sub>)以及一个恒定区(C<sub>L</sub>)<br />5. 抗原结合点<br />6. 枢纽区.]] |
|||
在[[鸟类]]的血液和[[蛋清]]中间,还发现了被称为{{TransHint|IgY|Immunoglobulin Y|en}}的[[血清]]抗体种型。这种抗体种型和哺乳动物的IgG有很大的区别。然而在一些旧资料,甚至是生命科学商业产品的网站上,仍然称之为IgG。这是错误的,并且容易引起混淆。 |
|||
每一条重链有两个区域:恒定区与可变区。同种型的抗体,其恒定区都是一样的,但不同种型之间该区域是不相同的。例如:γ、α以及δ型重链由三个免疫球蛋白结构域串联而成,并且还有一个用于增加弹性的铰链区;而μ及ε型重链则包括四个免疫球蛋白结构域<ref name=Janeway5/>。不同B细胞所生产抗体的重链可变区是不同的,但是同一个B细胞及其[[B细胞克隆|克隆体]]所生产的不同种型抗体的可变区则是完全相同的。重链的可变区由一个结构域组成,包含大110个氨基酸。 |
|||
===轻链=== |
|||
{{details|免疫球蛋白轻链}} |
|||
[[免疫球蛋白轻链]]由大约211至217个氨基酸组成<ref name=Janeway5/>,分为两个结构域,分别是恒定区和可变区。哺乳动物的[[免疫球蛋白轻链|轻链]]有两种,分别命名为λ(lambda)和κ(kappa)<ref name=Janeway5/>。每一个抗体的两个轻链永远是完全相同的,例如对于哺乳动物而言,同一个抗体要么是λ型,要么是κ,不会同时存在。在如[[软骨鱼纲]]及[[真骨下纲]]的低级脊椎动物中,还可发现其它类型的轻链,如ι(iota)型。 |
|||
===CDRs、Fv、Fab以及Fc结构域===<!-- several redirects lead here --> |
|||
抗体的某些部分具有独特的功能。比如说Y型的臂区,包含了两个可以结合抗原的点位,是识别外来物的关键所在。该区域被称为[[Fab区]],即抗体结合区段(fragment, antigen binding)。无论是重链还是轻链,片段均包括一个可变区与一个恒定区<ref name= putnam79>{{cite journal |author=Putnam FW, Liu YS, Low TL |title=Primary structure of a human IgA1 immunoglobulin. IV. Streptococcal IgA1 protease, digestion, Fab and Fc fragments, and the complete amino acid sequence of the alpha 1 heavy chain|journal= J Biol Chem|volume=254 |issue=8 |pages=2865–74|year=1979 |pmid=107164}}</ref>,其中可变区的[[互补位]]成型于抗体[[单体]]氨基酸链的末端。可变区又被称为F<sub>V</sub>区,是与抗体结合的最关键区域。更具体的说,其中轻链和重链上均存在三个可变的[[Β折叠|β折叠]]-[[转角_(生物化学)|转角]],该区域被称为[[互补决定区]](Complementarity Determining Region,CDR),也叫做高变区。乔西亚(Chothia)等人<ref name= Chothia1997> |
|||
{{cite journal |
|||
|doi=10.1006/jmbi.1997.1354 |
|||
|author=Al-Lazikani B, Lesk AM, Chothia C |
|||
|title=Standard conformations for the canonical structures of immunoglobulins |
|||
|journal= J Mol Biol |
|||
|volume=273 |
|||
|issue=4 |
|||
|pages=927–048 |
|||
|year=1997 |
|||
|pmid=9367782}}</ref>,以及后来的诺斯等人<ref name= North2010>{{cite journal |
|||
|author=North B, Lehmann A, Dunbrack RL |
|||
|title=A new clustering of antibody CDR loop conformations |
|||
|journal= J Mol Biol |
|||
|volume=406 |
|||
|issue=2 |
|||
|pages=228–256 |
|||
|year=2010 |
|||
|pmid=21035459 |
|||
|doi=10.1016/j.jmb.2010.10.030}}</ref>对互补决定区的结构进行了归类。在{{TransHint|免疫网络理论|immune network theory|en}}中,每个抗体的互补决定区又被称为独特型或者基因型。适应性免疫系统的适应过程,就是依靠有各个独特型之间的互动来进行调整的。 |
|||
Y型结构的基座的作用是调节免疫细胞的活动。该区域被成为[[Fc区]],即可结晶区域片段(Fragment, crystallizable),有两条重链组成。根据抗体类型不同,该区域的每一条重链由2个或者3个恒定结构域组成<ref name=Janeway5/>。因此,Fc区可通过与特定类型的[[Fc感受器]],或者其它免疫分子如[[补体系统|补体]]蛋白质相结合,来确保每个抗体可对一特定抗原产生一个正确的[[免疫应答]]。通过这一过程,可引发不同的[[生理学]]效果,包括识别[[噬菌素|调理颗粒]]、[[细胞溶解]],以及[[肥大细胞]]、[[嗜碱性粒细胞]]和[[嗜酸性粒细胞]]的[[脱颗粒]]过程<ref name = woof/><ref>{{cite journal |author=Heyman B |title=Complement and Fc-receptors in regulation of the antibody response |journal=Immunol Lett |volume=54 |issue=2-3 |pages=195–9 |year=1996 |pmid=9052877 |doi=10.1016/S0165-2478(96)02672-7}}</ref>。 |
|||
==功能== |
|||
{{further|免疫系统}} |
|||
活化的B细胞可[[分化]]成两种不同用途的细胞:生产可溶性抗体的[[浆细胞]],以及用于记忆已接触过的抗原的[[记忆B细胞]]。后者可在体内存活多年,并使得下次再接触到同样抗原时,能够更迅速的做出相应<ref>{{cite journal |
|||
|author=Borghesi L, Milcarek C |
|||
|title=From B cell to plasma cell: regulation of V(D)J recombination and antibody secretion |
|||
|journal=Immunol Res |
|||
|volume=36 |issue=1-3 |
|||
|pages=27–32 |
|||
|year=2006 |pmid=17337763 |
|||
|doi=10.1385/IR:36:1:27}} |
|||
</ref>。 |
|||
[[胎儿]]和[[新生儿]]体内的抗体是由母亲所提供的,是一种[[被动免疫]]。在出生后一年内,新生儿就可自行产生许多不同的抗体。由于抗体可以溶解在血液当中,因此它们是体液免疫系统的一部分。体液循环中的抗体,是由应答某一特定抗原如[[病毒]][[衣壳]]片段的B细胞克隆子代所产生的。抗体从下列三个方面为[[免疫力]]做出贡献:通过与病原体结合来避免入侵和破坏自身的细胞;通过刺激[[巨噬细胞]]等免疫细胞来包裹并清除冰原体;以及通过刺激其它[[免疫应答]]过程如[[补体系统|补体路径]],来消灭病原体<ref name=Ravetch>{{cite journal |author=Ravetch J, Bolland S |title=IgG Fc receptors |journal=Annu Rev Immunol |volume=19 |issue= 1|pages=275–90 |year=2001 |pmid=11244038 |doi=10.1146/annurev.immunol.19.1.275}}</ref>。 |
|||
[[File:IgM white background.png|thumb|left|哺乳动物分泌形态的[[IgM]]抗体有五个免疫球蛋白单元,每一个单元(标为1的部分)有两个抗原表位结合点[[Fab区]]。也就是说,一个IgM抗体可以与10个抗原表位相结合]] |
|||
===补体的活化=== |
|||
当[[补体]]与[[细菌]]结合形成[[补体系统|补体级联]]时,也是一种能和抗体结合的抗原。当抗体的[[Fv区]]与之结合时,会激活典型的补体系统<ref name=Ravetch/>。这将会动过两种途径消灭该细菌<ref name=Pier/>:第一种途径是通过抗体与补体的结合在微生物上作标记,使得[[噬菌細胞]]受到补体级联所产生的特定的补体的吸引,并通过一个叫做[[噬菌作用]]的过程吞噬细菌;第二种途径是通过形成一种叫做{{TransHint|补体膜攻击复合物|Complement membrane attack complex|en}}的补体抗体复合物来直接杀死细菌<ref>{{cite journal |author=Rus H, Cudrici C, Niculescu F |title=The role of the complement system in innate immunity |journal=Immunol Res |volume=33 |issue=2 |pages=103–12 |year=2005 |pmid=16234578 |doi=10.1385/IR:33:2:103}}</ref>。 |
|||
===效应细胞的活化=== |
|||
为了阻止病原体在细胞外进行复制,抗体通过与之结合而将其聚集在一起,即[[凝集]]。由于抗体至少拥有两个互不结合位,因此理论上它可以与不只一个相同类型的抗原相结合。通过对病原体的覆盖,抗体可以激活能识别该抗体Fc区的细胞的效应作用<ref name=Pier/>。拥有可以识别覆盖病原体的抗体Fc区的细胞,可以和IgA、IgG以及IgE型抗体的Fc区发生互动。某一特定细胞上的Fc区感受器遇到特定的抗体后,会引发该细胞的效应作用,例如:吞噬细胞会进行[[吞噬作用|吞噬]],肥大细胞和[[中性粒细胞]]会脱颗粒,而[[自然杀伤细胞]]会释放[[细胞因子]]和[[细胞毒素]]等化学物质。这些作用最终会导致入侵[[微生物]]的解体。Fc区感受器是种型敏感的,因此可使得免疫系统具备更高的灵活性,当不同的病原体入侵时可以仅仅触发正确的免疫机制<ref name=Janeway5/>。 |
|||
===中和抗体=== |
|||
[[人类]]及高级[[灵长类]]动物还可以在病毒入侵之前,在血液中释放中和抗体。中和抗体是指那些在任何[[感染]]、接种[[疫苗]]、接触任何外来抗原或者接受被动免疫之前,即已被制造和释放出来的抗体。这类抗体可以在适应性免疫响应被启动之前,激活经典的补体路径,来消解有包膜的病毒颗粒。许多中和抗体的目标抗体是双[[半乳糖]]α(1,3)-半乳糖(α-Gal),后者通常出现在[[糖基化]]的细胞膜蛋白的糖基终端上,也是人类消化道中细菌的代谢产物<ref>{{cite web |author= Racaniello, Vincent| url=http://www.virology.ws/2009/10/06/natural-antibody-protects-against-viral-infection/ |date=2009-10-06 |title=Natural antibody protects against viral infection |work=Virology Blog |accessdate=2010-01-22|archiveurl = http://www.webcitation.org/5uJzysytc |archivedate = 2010-11-17|deadurl=no}}</ref>。通常认为{{TransHint|异种器官移植|Organ xenotransplantation|en}}所引起的排斥,部分是由接受移植者血清中流动的中和抗体和移植器官上的α-Gal抗原结合造成的<ref>{{cite journal |author=Milland J, Sandrin MS |title=ABO blood group and related antigens, natural antibodies and transplantation |journal=Tissue Antigens |volume=68 |issue=6 |pages=459–66 |year=2006 |month=December |pmid=17176435 |doi=10.1111/j.1399-0039.2006.00721.x |url=}}</ref>。 |
|||
== 多样性 == |
|||
几乎所有的微生物都可以触发抗体的免疫应答。若想要成功识别并清除各种微生物,需要丰富多样的抗体,而这种多样性来自于抗体氨基酸的重组变化<ref>{{cite journal |author=Mian I, Bradwell A, Olson A |title=Structure, function and properties of antibody binding sites |journal=J Mol Biol |volume=217 |issue=1 |pages=133–51 |year=1991 |pmid=1988675 |doi=10.1016/0022-2836(91)90617-F}}</ref>。据估算,人类可以产生大约100亿种不同的抗体,每一种都可以与特定抗原的表位相结合<ref name="pmid8612345">{{cite journal |author=Fanning LJ, Connor AM, Wu GE |title=Development of the immunoglobulin repertoire |journal=Clin. Immunol. Immunopathol. |volume=79 |issue=1 |pages=1–14 |year=1996 |pmid=8612345 |doi=10.1006/clin.1996.0044}}</ref>。尽管每个人可以产生的抗体是如此之多,但是产生这些蛋白质的相关基因却十分有限。脊椎动物发展出了一些复杂的基因机制,使得其B细胞可以根据有限的基因产生非常多样的抗体<ref name = namazee>{{cite journal |author=Nemazee D |title=Receptor editing in lymphocyte development and central tolerance |journal=Nat Rev Immunol |volume=6 |issue=10 |pages=728–40 |year=2006 |pmid=16998507 |doi=10.1038/nri1939}}</ref>。 |
|||
===结构域的可变性=== |
|||
[[File:Complementarity determining regions.PNG|thumb|250px|right|图中红色部分是重链中的补体决定区({{PDB|1IGT}})]] |
|||
[[染色体]]当中用于编码抗体的[[基因座]]范围很广,其中包含了编码各个结构域的基因。其中编码人类重链的基因座([[IGH@]])位于[[14号染色体_(人类)|第14号染色体]],而编码λ和κ型轻链的基因座([[IGL@]]和[[IGK@]])则位于[[22号染色体_(人类)|第22号染色体]]和[[2号染色体_(人类)|第2号染色体]]。重链和轻链中均存在的可变区,在不同的B细胞所产生的抗体中是不一样的。控制这些差异的三个[[转角_(生物化学)|转角]]被称为超变区(HV-1、HV-2及HV-3),又称为[[补体决定区]](CDR1、CDR2及CDR3)。<!-- CDRs are supported within the variable domains by conserved framework regions. 无法确定以上部分的翻译-->编码重链部分的基因座包含了65种不同的可变区基因,通过将这些基因与其它结构域的基因想组合,就可以产生高度诧异的大量不同抗体,这一组合过程被称为V(D)J重组过程<ref>Peter Parham. "The Immune System. 2nd ed. Garland Science: New York, 2005. pg.47-62</ref>。 |
|||
===V(D)J重组=== |
|||
{{details|V(D)J重组}} |
|||
[[File:VDJ recombination.png|thumb|250px|right|免疫球蛋白重链的V(D)J重组的简要说明]] |
|||
体细胞的免疫球蛋白重组又被称为[[V(D)J重组]],该过程可导致可变区发生独特的变化。免疫球蛋白中每一条重链和轻链的可变区是由若干个基因片段所编码的,这些片断分别被称为可变段(V)、多样段(D)以及连接段(J)<ref name = namazee/>。这三种片段均存在于编码重链的基因片段中,而编码轻链的基因片段中只存在V和J段。在哺乳类动物的基因中,V、D和J段的重复基因序列串联在一起。骨髓中正在发育的B细胞,通过随机选择和组合V、D及J段各一段(轻链没有D段),来产生免疫蛋白的可变区。由于每段都有多个不同的拷贝,各段之间还存在不同的组合方式,因此抗体的可变区可以产生数量巨大的变化。正因有如此数量巨大的不同[[wikt:paratope|抗原结合位]],所以可以产生对大量不同抗原具有特异性的抗体<ref name=Market/>。 |
|||
在B细胞通过V(D)J重组过程产生了一个具备功能的免疫球蛋白之后,它就不可以在产生任何其它形状的可变区了,这一过程称为[[等位基因排斥]]。因此,每一个B细胞仅能产生某一种相同可变区的抗体<ref name=Janeway5/><ref>{{cite journal |author=Bergman Y, Cedar H |title=A stepwise epigenetic process controls immunoglobulin allelic exclusion |journal=Nat Rev Immunol |volume=4 |issue=10 |pages=753–61 |year=2004 |pmid=15459667 |doi=10.1038/nri1458}}</ref>。 |
|||
===体细胞超突变与亲和力成熟过程=== |
|||
:''详细请参见:[[体细胞超突变]]与[[亲和力成熟过程]]'' |
|||
B细胞被抗原激活之后,将会迅速的[[细胞分裂|增殖]]。在快速增殖的过程中,编码重链及轻链可变区的基因,会通过一种称为[[体细胞超突变]]过程,发生非常高概率的[[点突变]]。体细胞超突变会使得每一次细胞分裂,在基因的可变区中会产生大约一个[[核苷酸]]的变化<ref name=diaz/>。这一过程将导致每一个子代B细胞会与亲代的DNS,在抗体[[氨基酸|氨基酸链]]的可变区部分产生细微的差异。 |
|||
这种突变方式可以增加抗体池的多样性,并且对抗体与抗原的[[化学亲和力|亲和力]]产生影响<ref>{{cite journal |author=Honjo T, Habu S |title=Origin of immune diversity: genetic variation and selection |journal=Annu Rev Biochem |volume=54 |issue= 1|pages=803–30 |year=1985 |pmid=3927822 |doi=10.1146/annurev.bi.54.070185.004103}}</ref>。例如,突变的子代中,某些所产生的抗体与抗原结合的能力,比亲代所产生的抗体相比反而变弱了(亲和力下降),但另一些则可能变强了(亲和力增强)<ref name=orguil>{{cite journal |author=Or-Guil M, Wittenbrink N, Weiser AA, Schuchhardt J |title=Recirculation of germinal center B cells: a multilevel selection strategy for antibody maturation |journal=Immunol. Rev. |volume=216 |issue= |pages=130–41 |year=2007 |pmid=17367339 |doi=10.1111/j.1600-065X.2007.00507.x}}</ref>。那些表达亲和力更强的抗体的B细胞,会在与免疫系统其它部分的交互过程中,获得比较弱者更强的生存信号,后者会逐渐因为[[细胞凋亡|凋亡]]作用而消失。这种使得生产的抗体逐渐增加结合亲和力的过程,就是亲和力成熟过程。亲和力成熟过程发生在已发生过V(D)J重组后的成熟B细胞上,并需要[[辅助T细胞]]的帮助<ref>{{Cite journal | author = Neuberger M, Ehrenstein M, Rada C, Sale J, Batista F, Williams G, Milstein C |title=Memory in the B-cell compartment: antibody affinity maturation |journal=Philos Trans R Soc Lond B Biol Sci |volume=355 |issue=1395 |pages=357–60 |year=2000 |month=March |pmid=10794054 |pmc=1692737 |doi=10.1098/rstb.2000.0573}}</ref>。 |
|||
[[File:Class switch recombination.png|thumb|250px|right|种型转换的重组机制,使得活化的B细胞可以进行种型转换。]] |
|||
===种型转换=== |
|||
[[免疫种型转换]]是在活化后的B细胞中发生的一个[[生物学过程]],该过程使得细胞可以产生不同种型的抗体,如IgA、IgE及IgG等<ref name=Market/>。不同种型的抗体及其效应作用,是有免疫球蛋白重链中的恒定区决定的。最开始的时候,初始B细胞进表达抗原结合区域相同的膜结合形态IgM和IgD抗体。而在活化之后,由于不同种型的抗体仅应对特定的功能,B细胞会根据清除抗原所需要的功能,选择生产具备IgG、IgA或者IgE效应作用的抗体。通过种型转换,从同一个活化B细胞分裂出来的子代细胞就可以生产不同种型的抗体。在种型转换的过程中,只有重链的恒定区发生了改变,而可变区则没有发生任何改变,因此所针对抗原的特异性也不会发生改变。因此,同一个B细胞的子代都能生产针对同一抗原的抗体,但却可以对各种抗原状况提供恰当的效应作用。生产哪一种型的抗体,是由B细胞所处环境中存在的细胞因子类型所决定的<ref>{{cite journal |author=Stavnezer J, Amemiya CT |title=Evolution of isotype switching |journal=Semin. Immunol. |volume=16 |issue=4 |pages=257–75 |year=2004 |pmid=15522624 |doi=10.1016/j.smim.2004.08.005}}</ref>。 |
|||
生产抗体种型的转换,是通过一种称为种型转换重组(CSR)的机制对编码重链的基因座进行重组来完成的。该机制依赖被称为“交换区”的保守核苷酸模体,该模体存在于除δ链以外其它重链恒定区基因的上游[[DNA]]序列中。通过一系列[[酶]]的作用后DNA链的两个特定交换区被剪断<ref>{{cite journal |author=Durandy A |title=Activation-induced cytidine deaminase: a dual role in class-switch recombination and somatic hypermutation |journal=Eur. J. Immunol. |volume=33 |issue=8 |pages=2069–73 |year=2003 |pmid=12884279 |doi=10.1002/eji.200324133}}</ref><ref>{{cite journal |author=Casali P, Zan H |title=Class switching and Myc translocation: how does DNA break? |journal=Nat. Immunol. |volume=5 |issue=11 |pages=1101–3 |year=2004 |pmid=15496946 |doi=10.1038/ni1104-1101}}</ref>,然后通过[[非同源性末端接合]]的过程,将可变区[[外显子]]与需要的恒定区如γ、α、ε链重新接合在一起。通过该过程,一段编码抗体的基因即可产生不同种型的抗体<ref>{{cite journal |author=Lieber MR, Yu K, Raghavan SC |title=Roles of nonhomologous DNA end joining, V(D)J recombination, and class switch recombination in chromosomal translocations |journal=DNA Repair (Amst.) |volume=5 |issue=9-10 |pages=1234–45 |year=2006 |pmid=16793349 |doi=10.1016/j.dnarep.2006.05.013}}</ref>。 |
|||
==医学应用== |
|||
===疾病诊断及治疗=== |
|||
检测特定的抗体是一种常见的[[医学]][[诊断]]方式,而[[血清学]]方面的应用便依赖于此<ref>{{cite web |url=http://www.elispot-analyzers.de/english/elisa-animation.html |title=Animated depictions of how antibodies are used in [[ELISA]] assays |accessdate=2007-05-08 |work=Cellular Technology Ltd.—Europe|archiveurl = http://www.webcitation.org/5uK00Qems |archivedate = 2010-11-17|deadurl=no}}</ref>。以某种疾病的生化检查方法为例<ref>{{cite web |url= http://www.elispot-analyzers.de/english/elispot-animation.html |title=Animated depictions of how antibodies are used in [[ELISPOT]] assays |accessdate=2007-05-08 |work=Cellular Technology Ltd.—Europe|archiveurl = http://www.webcitation.org/5uK00pHh5 |archivedate = 2010-11-17|deadurl=no}}</ref>,可通过对血液中[[人類疱疹病毒第四型]]或者[[莱姆病]]抗体的[[滴定量]]来判断是否患病。如果被检测者的血液中没有发现这种抗体,则此人要么没有被感染,要么即使被感染也是很早以前的事情了——那些记忆B细胞都已消解殆尽了。在[[临床免疫学]]中,通过[[浊度测定法]](或者比浊法)对各种免疫球蛋白的水平进行测定,以了解患者的抗体情况<ref>{{cite journal |author=Stern P |title=Current possibilities of turbidimetry and nephelometry |journal=Klin Biochem Metab |volume=14 |issue=3 |pages=146–151 |year=2006| url= http://www.clsjep.cz/odkazy/kbm0603-146.pdf|archiveurl = http://www.webcitation.org/5uK01zkxp |archivedate = 2010-11-17|deadurl=no}}</ref>。对于[[肝脏]]发生损伤但尚未确诊的患者检查何种免疫球蛋白升高情况,有的时候有助于找出问题的原因<ref name=Rhoades/>。例如,IgA升高可能意味着酒精性[[肝硬化]],IgM升高可能意味着[[病毒性肝炎]]或者[[原发性胆汁性肝硬化]],IgG升高则可能是由肝硬化、病毒性肝炎或者[[自身免疫性肝炎]]的征兆。患有[[自身免疫性疾病]]的患者,通常会存在自身细胞[[抗原表位]]相结合的抗体,大部分患者可通过[[血液检查]]检测到。而通过抗体直接对[[红细胞]]的表面抗原进行{{TransHint|抗人球蛋白测试|Coombs test|en}},则可以确诊免疫所致的[[溶血性贫血]]<ref name=Dean>{{cite book |last=Dean |first=Laura |title= Blood Groups and Red Cell Antigens| year= 2005|publisher=National Library of Medicine (US), |location=NCBI Bethesda (MD) |isbn= |chapter= Chapter 4: Hemolytic disease of the newborn |chapterurl= http://www.ncbi.nlm.nih.gov/books/bv.fcgi?rid=rbcantigen.chapter.ch4}}</ref>。抗人球蛋白测试也用于[[输血]]之前的抗体筛查准备工作,以及[[产前]]孕妇的抗体筛查<ref name=Dean/>。在实践中,基于对抗原抗体复合物的免疫检测手段被用来诊断所感染的疾病,这些手段包括:[[酶联免疫吸附试验]]、[[免疫荧光染色法]]、[[西方墨点法]]、[[免疫扩散法]]、[[免疫电泳法]]以及[[磁性分离酶联免疫分析]]等。抗[[人绒毛膜促性腺激素]]抗体被用于非处方[[妊娠]]检测,如早孕试纸等。特定的[[单克隆抗体疗法]]被用于治疗诸如[[类风湿性关节炎]]<ref>{{cite journal |author=Feldmann M, Maini R |title=Anti-TNF alpha therapy of rheumatoid arthritis: what have we learned? |journal=Annu Rev Immunol |volume=19 |issue= 1|pages=163–96 |year=2001 |pmid=11244034 |doi=10.1146/annurev.immunol.19.1.163}}</ref>、[[多发性硬化症]]<ref>{{cite journal |author=Doggrell S |title=Is natalizumab a breakthrough in the treatment of multiple sclerosis? |journal=Expert Opin Pharmacother |volume=4 |issue=6 |pages=999–1001 |year=2003 |pmid=12783595 |doi=10.1517/14656566.4.6.999}}</ref>、[[银屑病]]<ref>{{Cite journal |author=Krueger G, Langley R, Leonardi C, Yeilding N, Guzzo C, Wang Y, Dooley L, Lebwohl M |title=A human interleukin-12/23 monoclonal antibody for the treatment of psoriasis| journal = [[N Engl J Med]]|volume=356 |issue=6 |pages=580–92 |year=2007 |pmid=17287478 |doi=10.1056/NEJMoa062382}}</ref>等疾病。此外,单克隆抗体还被用于治疗诸如[[非霍奇金氏淋巴瘤]]<ref>{{cite journal |author=Plosker G, Figgitt D |title=Rituximab: a review of its use in non-Hodgkin's lymphoma and chronic lymphocytic leukaemia |journal=Drugs |volume=63 |issue=8 |pages=803–43 |year=2003 |pmid=12662126 |doi=10.2165/00003495-200363080-00005}}</ref>、[[大肠癌]]、[[头颈部癌]]以及[[乳腺癌]]等多种[[癌症]]<ref>{{cite journal |author=Vogel C, Cobleigh M, Tripathy D, Gutheil J, Harris L, Fehrenbacher L, Slamon D, Murphy M, Novotny W, Burchmore M, Shak S, Stewart S |title=First-line Herceptin monotherapy in metastatic breast cancer |series=61 |journal=Oncology |volume=Suppl 2 |issue= Suppl. 2|pages=37–42 |year=2001 |pmid=11694786 |doi=10.1159/000055400}}</ref>。某些如{{TransHint|X-联无丙种球蛋白血症|X-linked agammaglobulinemia|en}}以及{{TransHint|低丙球蛋白血症|hypogammaglobulinemia|en}}的[[免疫缺陷]]会导致部分甚至全部抗体的缺失<ref>{{cite journal | author = LeBien TW | title = Fates of human B-cell precursors | journal = Blood | volume = 96 | issue = 1 | pages = 9–23 | date=1 July 2000| pmid = 10891425 | url = http://bloodjournal.hematologylibrary.org/cgi/content/full/96/1/9 |archiveurl = http://www.webcitation.org/5uK02zfmd |archivedate = 2010-11-17|deadurl=no}}</ref>。这种类型的疾病,通常是通过向病患注射包含抗体的人或动物[[血清]]、混合免疫球蛋白或者单克隆抗体等方式,建立短期的[[被动免疫|被动免疫力]]的手段进行治疗的<ref name=USC>{{cite web | author = Ghaffer A | title = Immunization | work = Immunology - Chapter 14 | publisher = University of South Carolina School of Medicine | url = http://pathmicro.med.sc.edu/ghaffar/immunization.htm | date = 2006-03-26 | accessdate = 2007-06-06|archiveurl = http://www.webcitation.org/5uK03Lul6 |archivedate = 2010-11-17|deadurl=no}}</ref>。 |
|||
===产前治疗=== |
|||
[[Rh血型系统|Rh因子]],又称为RhD抗原,是一种可存在于[[红细胞]]表面的抗原。Rh阳性(Rh+)的个体,其红细胞表面存在Rh抗原,而Rh阴性(Rh-)个体的红细胞表面则不存在这种抗原。正常的分娩过程,或者[[分娩]]创伤,或者[[怀孕]]过程中的[[并发症]],都可能导致[[胎儿]]的血液进入母亲的免疫系统中。这种血液混合的情况,可能会导致Rh阴性的母亲,产生针对Rh阳性婴儿的血细胞抗原的抗体。这将导致剩下的孕期,以及未来的怀孕过程产生[[新生儿溶血症]]的风险<ref>{{cite journal |author=Urbaniak S, Greiss M |title=RhD haemolytic disease of the fetus and the newborn |journal=Blood Rev |volume=14 |issue=1 |pages=44–61 |year=2000 |pmid=10805260 |doi=10.1054/blre.1999.0123}}</ref>。 |
|||
[[Rho(D)免疫球蛋白|Rh<sub>o</sub>(D)]]是对人类RhD抗原特异的抗体<ref name= Fung>{{cite journal |author=Fung Kee Fung K, Eason E, Crane J, Armson A, De La Ronde S, Farine D, Keenan-Lindsay L, Leduc L, Reid G, Aerde J, Wilson R, Davies G, Désilets V, Summers A, Wyatt P, Young D |title=Prevention of Rh alloimmunization |journal=J Obstet Gynaecol Can |volume=25 |issue=9 |pages=765–73 |year=2003 |pmid=12970812}}</ref>,是避免上述情形发生的[[孕期护理|产前治疗]]方案之一。对怀有RhD阳性胎儿的RhD阴性母亲来说,在接触到RhD抗原之前,或者至少在刚接触之时,通过给予RhD抗体的治疗方案是非常必要的。通过注射这种抗体,可以迅速有效地清除从胎儿血液中带来的包含RhD抗原表位的血细胞。这样可以避免刺激母亲的免疫系统产生能够生产RhD抗体的B细胞,尤其是记忆B细胞。因此,母亲的免疫系统就不会生产RhD抗体,也就不会攻击有RhD抗原的胎儿。尽管该治疗方案可以避免[[Rh血型新生儿溶血症]]的发生,但却不能治疗已经产生抗体所导致的情况<ref name= Fung/>。 |
|||
==科研应用== |
|||
[[File:FluorescentCells.jpg|thumb|right|200px|通过{{TransHint|免疫荧光染色法|Immunofluorescence|en}}所产生的[[真核生物|真核细胞]][[细胞骨架|骨架]]的图片。其中红色的是[[肌动蛋白]],绿色的是[[微管]],蓝色的则是[[细胞核]]。]] |
|||
通过向[[小鼠属|小鼠]]、[[大家鼠|大鼠]]或者[[兔]]身上注射特定的抗体,可以得到少量相应[[特异性]]的抗体。而如果需要得到大量的抗体,则需要向[[山羊]]、[[绵羊]]或者[[马]]身上注射相应的抗体。对这些实验动物的[[血液]]进行分离后,可以在[[血清]]中得到“[[多克隆抗体]]”。即,针对相同抗原的多种不同的抗体。这种方法制备的抗体又叫做[[抗血清]]。另一种制备抗体的方式是通过向受精蛋中注射抗原,然后从[[蛋清]]中获得抗体<ref>{{cite journal |author=Tini M, Jewell UR, Camenisch G, Chilov D, Gassmann M |title=Generation and application of chicken egg-yolk antibodies |journal=Comp. Biochem. Physiol., Part a Mol. Integr. Physiol. |volume=131 |issue=3 |pages=569–74 |year=2002 |pmid=11867282 |doi=10.1016/S1095-6433(01)00508-6}}</ref>。为了获得针对某一抗原单一抗原表位的特异性抗体,需要从动物身上分离出相应的抗体分泌[[淋巴细胞]],然后通过与[[癌细胞]]株相融合使之可[[生物学永生|无限增值]]。这种融合细胞叫做[[杂交瘤]],可以在培养环境中不停分泌抗体。通过[[稀释克隆法]]将单个杂交瘤细胞隔离出来,这种[[克隆|细胞克隆]]方法所制备出来的抗体是完全一样的,被称为[[单克隆抗体]]<ref>{{cite journal |author=Cole SP, Campling BG, Atlaw T, Kozbor D, Roder JC |title=Human monoclonal antibodies |journal=Mol. Cell. Biochem. |volume=62 |issue=2 |pages=109–20 |year=1984 |pmid=6087121 |doi=10.1007/BF00223301}}</ref>。多克隆抗体和单克隆抗体的制备,通常还需要使用{{TransHint|A/G蛋白质|Protein A/G|en}}或者[[亲和色谱法|抗体亲和色谱法]]来进行提纯<ref>{{cite journal |author=Kabir S |title=Immunoglobulin purification by affinity chromatography using protein A mimetic ligands prepared by combinatorial chemical synthesis |journal=Immunol Invest |volume=31 |issue=3-4 |pages=263–78 | year = 2002 |pmid=12472184 |doi=10.1081/IMM-120016245}}</ref>。 |
|||
在实验室中,纯化的单克隆抗体有许多应用场景。最常见的应用场景,是用来鉴定[[胞内|细胞内]]及[[胞外|细胞外]]的蛋白质类型。此外,不同类型的细胞会在细胞表面表达不同组合的{{TransHint|分化簇|cluster of differentiation|en}}分子,并生产出不同的胞内蛋白质,也会分泌出不同的蛋白质。因此单克隆抗体也被应用于[[流式细胞术]]中,通过识别不同细胞所表达的不同蛋白质来区分它们<ref name=Stecher>{{cite journal |author=Brehm-Stecher B, Johnson E |title=Single-cell microbiology: tools, technologies, and applications |url=http://mmbr.asm.org/cgi/content/full/68/3/538?view=long&pmid=15353569 | doi = 10.1128/MMBR.68.3.538-559.2004 |journal=Microbiol Mol Biol Rev |volume=68 |issue=3 |pages=538–59 |year=2004 |pmid=15353569 |pmc=515252|archiveurl = http://www.webcitation.org/5uK04DmZC |archivedate = 2010-11-17|deadurl=no}}</ref>。在[[免疫沉淀发]]中,也通过单克隆抗体来分离[[细胞溶解|细胞溶解物]]中的特定蛋白及其结合物<ref>{{cite journal |author=Williams N |title=Immunoprecipitation procedures |journal=Methods Cell Biol |volume=62 |issue= |pages=449–53 |year=2000 |pmid=10503210 |doi=10.1016/S0091-679X(08)61549-6}}</ref>。此外在[[西方墨点法]]中用来分析通过[[电泳|电泳法]]所分离出来的蛋白质<ref>{{cite journal |author=Kurien B, Scofield R |title=Western blotting |journal=Methods |volume=38 |issue=4 |pages=283–93 |year=2006 |pmid=16483794 |doi=10.1016/j.ymeth.2005.11.007}}</ref>,以及在[[免疫组织化学染色法]]或[[免疫荧光染色法]]中检验分析待检验[[组织_(生物学)|组织]]中所表达的蛋白质,甚至通过[[显微镜]]直接观察蛋白质在细胞中的分布情况<ref name=Stecher/><ref>{{cite journal |author=Scanziani E |title=Immunohistochemical staining of fixed tissues |journal=Methods Mol Biol |volume=104 |issue= |pages=133–40 |year= 1998|pmid=9711649 |doi=10.1385/0-89603-525-5:133}}</ref>。[[酶联免疫吸附试验]](ELISA)及[[酶联免疫斑点]](ELISPOT)等检测技术甚至可以通过单克隆抗体来对特定蛋白进行定量分析<ref>{{cite journal |author=Reen DJ.|title=Enzyme-linked immunosorbent assay (ELISA)|journal=Methods Mol Biol.|volume=32 |issue= |pages=461–6 |year= 1994|pmid=7951745 |doi=10.1385/0-89603-268-X:461}}</ref><ref>{{cite journal |author=Kalyuzhny AE |title=Chemistry and biology of the ELISPOT assay|journal=Methods Mol Biol.|volume=302 |issue= |pages=15–31 |year= 2005|pmid=15937343 |doi=10.1385/1-59259-903-6:015}}</ref>。 |
|||
==结构预测== |
|||
由于抗体对健康及[[生物技术]]工业的重要性,导致了对其高[[分辨率]]结构的知识的需求。这些信息对[[蛋白质工程]],修改抗体结合亲和性,以及识别特定抗体的抗原表位来说非常有用。[[X射线晶体学]]是其中一种研究抗体结构的常用手段,然而抗体的结晶过程非常耗时耗力。而通过[[计算机]]来研究晶体学问题,相对更快更便宜。但是计算机方法不能得出很确定的结论,因其不能产生经验所知的结构。诸如“网络抗体建模”(WAM)<ref>{{cite journal |author=Whitelegg N.R.J., Rees A.R. |title=WAM: an improved algorithm for modeling antibodies on the WEB |journal=Protein Engineering|volume=13|issue=12 |pages=819–824|year=2000 |doi=10.1093/protein/13.12.819 |pmid=11239080 |url=http://peds.oxfordjournals.org/cgi/content/abstract/13/12/819|archiveurl = http://www.webcitation.org/5uK04d3mA |archivedate = 2010-11-17|deadurl=no}}<br /> [http://antibody.bath.ac.uk/abmod.html WAM]</ref>,以及“免疫球蛋白结构预测”(PIGS)<ref>{{cite journal |author=Marcatili P, Rosi A,Tramontano A |title=PIGS: automatic prediction of antibody structures|journal=Bioinformatics |volume=24|issue=17 |pages=1953–1954 |year=2008 |doi=10.1093/bioinformatics/btn341 |pmid=18641403|url = http://arianna.bio.uniroma1.it/pigs/|archiveurl = http://www.webcitation.org/5uK06XmYO |archivedate = 2010-11-17|deadurl=no}}<br /> [http://arianna.bio.uniroma1.it/pigs/ Prediction of Immunoglobulin Structure (PIGS)]</ref>等在线[[服务器]],使得人们能通过计算机对抗体可变区进行建模。“罗塞塔抗体”(Rosetta Antibody)是一个新型的F<sub>V</sub>区结构预测服务器,通过使用非常复杂的技术,它可以最大程度简化CDR转角过程,并优化轻重链相对位置的定位过程,还可以根据已知[[同源]]结构模型来预测抗原抗体是否能成功对接<ref>{{cite journal |author=Sivasubramanian A, Sircar A, Chaudhury S, Gray J J |title=Toward high-resolution homology modeling of antibody Fv regions and application to antibody–antigen docking|journal=Proteins |volume=74 |pages=497–514 |year=2009 |doi=10.1002/prot.22309 |pmc=2909601 |pmid=19062174 |issue=2|url = http://arianna.bio.uniroma1.it/pigs/|archiveurl = http://www.webcitation.org/5uK07ARPr|archivedate = 2010-11-17|deadurl=no}} <br />[http://antibody.graylab.jhu.edu RosettaAntibody]</ref>。 |
|||
==历史== |
|||
{{see also|免疫学历史}} |
|||
抗体(antibody)这个词首次出现在[[保罗·埃尔利希]][[1891年]]10月公布的《免疫力的试验性研究》这篇文章中,德语的抗体“Antikörper”出现在该文章的结论部分。其中指出了“如果两种物质导致两种不同抗体的产生,那么这两种物质必然是不同的”<ref name=Lindenmann>{{cite journal |author=Lindenmann, Jean |url=http://www3.interscience.wiley.com/cgi-bin/fulltext/119531625/PDFSTART |title=Origin of the Terms 'Antibody' and 'Antigen' |journal=Scand. J. Immunol.|volume=19 |pages=281–5 |year=1984|accessdate=2008-11-01 |pmid=6374880 |issue=4|archiveurl = http://www.webcitation.org/5uK08DeWS |archivedate = 2010-11-17|deadurl=no}}</ref>。然而这一术语并没有立即被接受,还有被建议使用的其它几个术语,如:免疫体(Immunkörper)、介体受体(Amboceptor)、介体(Zwischenkörper)、物质敏感体(substance sensibilisatrice)、连接体(copula)、德氏体(Desmon)、白细胞素(philocytase)、介体固定体(fixateur)以及免疫素(Immunisin)等<ref name=Lindenmann/><ref name=Lindenmann/>。抗体和[[抗毒素]](Antitoxin)字面结构相似,概念则和免疫体(Immunkörper)类似<ref name=Lindenmann/>。 |
|||
[[File:AngeloftheWest.jpg|thumb|left|250px|根据E. Padlan公布的抗体结构图,{{TransHint|朱利·安沃斯-安德烈|Julian Voss-Andreae|en}}为[[斯克里普斯研究所]]佛罗里达分部创作了雕塑《西方天使》(2008年)<ref>{{cite journal | first = Eduardo | last = Padlan| year = 1994 | month = February | title = Anatomy of the antibody molecule | journal = Mol. Immunol. | pmid = 8114766 | volume = 31 | issue = 3 | pages = 169–217 | doi = 10.1016/0161-5890(94)90001-9}}</ref><ref>{{cite web | title = New Sculpture Portraying Human Antibody as Protective Angel Installed on Scripps Florida Campus | url = http://www.scripps.edu/newsandviews/e_20081110/sculpture.html | accessdate = 2008-12-12|archiveurl = http://www.webcitation.org/5uK08UfTv |archivedate = 2010-11-17|deadurl=no}}</ref>塑像仿照[[列奥纳多·达·芬奇]]的[[维特鲁威人]],将抗体放置到一个圆环的中间,寓意其对于人类的重要意义。<ref>{{cite web | title = Protein sculpture inspired by Vitruvian Man | url = http://www.boingboing.net/2008/10/22/protein-sculpture-in.html | accessdate = 2008-12-12|archiveurl = http://www.webcitation.org/5uK0Ai3D4 |archivedate = 2010-11-17|deadurl=no}}</ref>]] |
|||
针对抗体的研究始于[[1890年]],[[埃米尔·阿道夫·冯·贝林]]及[[北里柴三郎]]首次描述了抗体对[[白喉]]及[[破伤风痉挛毒素]]的抵抗作用。他们两人将[[体液免疫]]理论往前推进了一步,提出了血清中存在一种可以与外来抗原相反应的某种介质的假设<ref>{{cite web | url = http://nobelprize.org/nobel_prizes/medicine/laureates/1901/behring-bio.html | title = Emil von Behring - Biography | accessdate = 2007-06-05 | work = |archiveurl = http://www.webcitation.org/5uK0BRd1D |archivedate = 2010-11-17|deadurl=no}}</ref><ref>{{cite journal | author = AGN | title = The Late Baron Shibasaburo Kitasato | journal = Canadian Medical Association Journal | year = 1931 | volume = 25 | issue = 2 | page = 206 | pmc=382621}}</ref>。保罗·埃尔利希受到了他们的这一想法的启发,于[[1897年]]提出了抗体与抗原互动的[[侧链理论]]假说。他假设道,在细胞的表面存在能和特定[[毒素]]发生一把钥匙对应一把锁类似的特异结合作用的感受器(原文为“侧链”),而结合反应则会进一步导致相关抗体的生产<ref>{{cite journal |author=Winau F, Westphal O, Winau R |title=Paul Ehrlich--in search of the magic bullet |journal=Microbes Infect. |volume=6 |issue=8 |pages=786–9 |year=2004 |pmid=15207826 |doi=10.1016/j.micinf.2004.04.003}}</ref>。其他研究人员在之后的研究中认为,抗体可以在血液中稳定独立存在。在[[1904年]],[[奥姆罗斯·莱特]]进一步提出通过可溶性抗体在[[细菌]]的表面包裹标识,使其成为[[吞噬作用]]的目标,并最终被消灭。这一过程被他命名为[[调理作用]]<ref>{{cite journal |author=Silverstein AM |title=Cellular versus humoral immunology: a century-long dispute |journal=Nat. Immunol. |volume=4 |issue=5 |pages=425–8 |year=2003 |pmid=12719732 |doi=10.1038/ni0503-425}}</ref>。 |
|||
到了[[二十世纪]]二十年代,[[迈克尔·海德堡]]和[[奥斯瓦尔德·埃弗里]]观察到抗原可以被抗体所凝结,并进一步发现抗体是一种蛋白质<ref>{{cite journal |author=Van Epps HL |title=Michael Heidelberger and the demystification of antibodies |journal=J. Exp. Med. |volume=203 |issue=1 |page=5 |year=2006 |pmid=16523537 |url=http://www.jem.org/cgi/reprint/203/1/5.pdf |doi=10.1084/jem.2031fta |pmc=2118068|archiveurl = http://www.webcitation.org/5uK0EkKLx |archivedate = 2010-11-17|deadurl=no}}</ref>。在三十年代,[[约翰·马拉克]]对抗原-抗体结合活动的[[生物化学]]性质做了更详尽的实验<ref>{{cite book |last= Marrack | first = JR | title = Chemistry of antigens and antibodies | edition = 2nd | year = 1938 | publisher = His Majesty's Stationery Office | location = London | isbn= | oclc=3220539}}</ref>。接下来的一次重大突破发生在四十年代,[[莱纳斯·鲍林]]通过抗体抗原的互动能力取决于各自的形状而不是其化学成分,证明了埃尔利希所提出的一把钥匙配一把锁的免疫学理论<ref>{{cite web |url=http://profiles.nlm.nih.gov/MM/Views/Exhibit/narrative/specificity.html |title=The Linus Pauling Papers: How Antibodies and Enzymes Work |accessdate=2007-06-05|archiveurl = http://www.webcitation.org/5uK0FQBmR |archivedate = 2010-11-17|deadurl=no}}</ref>。1948年,[[阿斯特丽德·法戈瑞奥司]]发现B细胞的其中一种形式[[浆细胞]]就是负责生产抗体的工厂<ref>{{cite journal | author = Silverstein AM | title = Labeled antigens and antibodies: the evolution of magic markers and magic bullets | journal = Nat. Immunol. | volume = 5 | issue = 12 | pages = 1211–7 | year = 2004 | pmid = 15549122 | url = http://users.path.ox.ac.uk/~seminars/halelibrary/Paper%2018.pdf | doi = 10.1038/ni1140|archiveurl = http://www.webcitation.org/5m6w1MlHG |archivedate = 2009-12-18|deadurl=no}}</ref>。 |
|||
此后,研究工作的重点转向了识别抗体蛋白质结构中各部分的作用。二十世纪六十年代,[[杰拉尔德·埃德尔曼]]和[[约瑟夫·盖里]]发现了抗体的[[免疫球蛋白轻链|轻链]]<ref>{{cite journal |author=Edelman GM, Gally JA |title=The nature of Bence-Jones proteins. Chemical similarities to polypetide chains of myeloma globulins and normal gamma-globulins |journal=J. Exp. Med. |volume=116 |issue= 2|pages = 207–27 |year=1962 |pmid=13889153 |doi=10.1084/jem.116.2.207 |pmc=2137388}}</ref>,并且发现这和[[1845年]]由[[亨利·本册·琼斯]]所发现的[[本周氏蛋白质]]是同一种物质<ref>{{cite journal |author=Stevens FJ, Solomon A, Schiffer M |title=Bence Jones proteins: a powerful tool for the fundamental study of protein chemistry and pathophysiology |journal=Biochemistry |volume=30 |issue=28 |pages=6803–5 |year=1991 |pmid=2069946 |doi=10.1021/bi00242a001}}</ref>,这是一项重大的突破。紧接着,埃德尔曼在进一步发现抗体中的重链和轻链是由[[双硫键]]连接在一起的。与此同时,[[罗德尼·罗伯特·波特]]识别出了免疫球蛋白的抗体结合区(Fab)及抗体尾部的可结晶区<ref name=edel>{{cite journal |author=Raju TN |title=The Nobel chronicles. 1972: Gerald M Edelman (b 1929) and Rodney R Porter (1917-85) |journal=Lancet |volume=354 |issue=9183 |page=1040 |year=1999 |pmid=10501404 |doi=10.1016/S0140-6736(05)76658-7}}</ref>。根据这些发现,科学家们对免疫球蛋白的结构进行了推测,并描述了IgG蛋白质的完整[[氨基酸]]序列。以上这些发现,使得他们被共同授予[[1972年]]的[[诺贝尔生理学或医学奖]]<ref name=edel/>。Fv区则由戴维·吉沃尔(David Givol)所首先制备和识别<ref>{{cite journal |author=Hochman J, Inbar D, Givol D |title=An active antibody fragment (Fv) composed of the variable portions of heavy and light chains |journal=Biochemistry |volume=12 |issue= 6|pages=1130–5 |year=1973 |pmid=4569769 |doi= 10.1021/bi00730a018|pmc=}}</ref>。正当人们对抗体的大多数早期研究还集中在IgM和IgG上时,六十年代还发生了重要的事情:[[托马斯·托马西]]发现了属于新种型的分泌形态[[IgA]]抗体<ref>{{cite journal |author=Tomasi TB |title=The discovery of secretory IgA and the mucosal immune system |journal=Immunol. Today |volume=13 |issue=10 |pages=416–8 |year=1992 |pmid=1343085 |doi=10.1016/0167-5699(92)90093-M}}</ref>,[[戴维·S·罗维]]和[[约翰·L·费伊]]则识别出了IgD<ref>{{cite journal |author=Preud'homme JL, Petit I, Barra A, Morel F, Lecron JC, Lelièvre E |title=Structural and functional properties of membrane and secreted IgD |journal=Mol. Immunol. |volume=37 |issue=15 |pages=871–87 |year=2000 |pmid=11282392 |doi=10.1016/S0161-5890(01)00006-2}}</ref>,[[石坂公成]]和[[石坂照子]]夫妇则共同发现了与[[过敏反应]]有关的抗体种型[[IgE]]<ref>{{cite journal |author=Johansson SG |title=The discovery of immunoglobulin E |journal=Allergy and asthma proceedings : the official journal of regional and state allergy societies |volume=27 |issue=2 Suppl 1 |pages=S3–6 |year=2006 |pmid=16722325}}</ref>。[[1976年]],[[利根川进]]对免疫球蛋白相关基因进行研究,发现了抗体多样性的体细胞超突变基本原理<ref>{{cite journal |author=Hozumi N, Tonegawa S |title=Evidence for somatic rearrangement of immunoglobulin genes coding for variable and constant regions |journal=Proc. Natl. Acad. Sci. U.S.A. |volume=73 |issue=10 |pages=3628–32 |year=1976 |pmid=824647 |pmc=431171 |doi=10.1073/pnas.73.10.3628}}</ref>。 |
|||
==参见== |
|||
<div style="-moz-column-count:3; column-count:3;"> |
|||
* {{TransHint|拟抗体|Antibody mimetic|en}} |
|||
* {{TransHint|抗线粒体抗体|Anti-mitochondrial antibodies|en}} |
|||
* {{TransHint|抗核抗体|Anti-nuclear antibodies}} |
|||
* [[牛初乳]] |
|||
* [[酶联免疫吸附试验]] |
|||
* [[体液免疫]] |
|||
* [[免疫学]] |
* [[免疫学]] |
||
* [[免疫抑制药]] |
|||
* {{TransHint|静脉注射免疫球蛋白|Intravenous immunoglobulin|en}}(IVIg) |
|||
* {{TransHint|磁性免疫分析|Magnetic immunoassay|en}} |
|||
* {{TransHint|微抗体|Microantibody|en}} |
|||
* [[单克隆抗体]] |
* [[单克隆抗体]] |
||
* {{TransHint|中和抗体|Neutralizing antibody|en}} |
|||
* {{TransHint|初级和二级抗体|Secondary antibodies|en}} |
|||
* {{TransHint|单域抗体|Single-domain antibody|en}} |
|||
* {{TransHint|坡谱|Slope spectroscopy|en}} |
|||
</div> |
|||
==引用== |
|||
{{Reflist|2}} |
|||
==外部链接== |
|||
{{Commons category|Antibodies}} |
|||
<!--===========================({{No more links}})===============================--> |
|||
<!--| DO NOT ADD MORE LINKS TO THIS ARTICLE. WIKIPEDIA IS NOT A COLLECTION OF |--> |
|||
<!--| LINKS. If you think that your link might be useful, do not add it here, |--> |
|||
<!--| but put it on this article's discussion page first or submit your link |--> |
|||
<!--| to the appropriate category at the Open Directory Project (www.dmoz.org)|--> |
|||
<!--| |--> |
|||
<!--===========================({{No more links}})===============================--> |
|||
* [[剑桥大学]]的[http://www.path.cam.ac.uk/~mrc7/mikeimages.html 麦克的免疫球蛋白结构功能网页]; |
|||
* 在[[蛋白质资料库]]中的[http://www.rcsb.org/pdb/static.do?p=education_discussion/molecule_of_the_month/pdb21_1.html 口腔蛋白质分子资料库中的抗体]讨论到抗体的结构; |
|||
* [[南卡罗莱纳州立大学]]的[http://pathmicro.med.sc.edu/mayer/IgStruct2000.htm 微生物及免疫学在线教材]; |
|||
* [[牛津大学]]的[http://users.path.ox.ac.uk/~scobbold/tig/new1/mabth.html 近百年来的抗体治疗方案]论述了抗体在用于治疗疾病方面的历史和应用; |
|||
* “Cells Alive!”网站的[http://www.cellsalive.com/antibody.htm 淋巴细胞是如何产生抗体的]; |
|||
* [[伯明翰大学]]的[http://www.ii.bham.ac.uk/clinicalimmunology/CISimagelibrary/ 抗体应用]中的荧光抗体图片库 |
|||
{{免疫系統}} |
{{免疫系統}} |
||
{{球状蛋白质}} |
{{球状蛋白质}} |
||
<!-- 以下模板正在翻译中,请勿删除当前注释及下列若干行注释。 --> |
|||
<!-- |
|||
{{Immune_proteins}} |
|||
{{Autoantibodies}} |
|||
{{Use dmy dates|date=January 2011}} |
|||
--> |
|||
[[Category: |
[[Category:糖蛋白]] |
||
[[Category:免疫系统]] |
|||
{{Link FA|ar}} |
{{Link FA|ar}} |
||
{{Link FA|ca}} |
{{Link FA|ca}} |
||
{{Link FA|vi}} |
|||
{{Link GA|en}} |
{{Link GA|en}} |
||
{{Link GA|es}} |
{{Link GA|es}} |
||
| 第38行: | 第275行: | ||
[[am:ኣንቲቦዲ]] |
[[am:ኣንቲቦዲ]] |
||
[[ar:جسم مضاد]] |
[[ar:جسم مضاد]] |
||
[[bg:Антитяло]] |
|||
[[bn:অ্যান্টিবডি]] |
[[bn:অ্যান্টিবডি]] |
||
[[bs:Antitijelo]] |
[[bs:Antitijelo]] |
||
[[bg:Антитяло]] |
|||
[[ca:Anticòs]] |
[[ca:Anticòs]] |
||
[[cs:Protilátka]] |
[[cs:Protilátka]] |
||
| 第47行: | 第284行: | ||
[[dv:ހަށިދަމަނަ]] |
[[dv:ހަށިދަމަނަ]] |
||
[[en:Antibody]] |
[[en:Antibody]] |
||
[[ |
[[et:Antikehad]] |
||
[[es:Anticuerpo]] |
[[es:Anticuerpo]] |
||
[[ |
[[eo:Antikorpo]] |
||
[[eu:Antigorputz]] |
[[eu:Antigorputz]] |
||
[[fa:پادتن]] |
[[fa:پادتن]] |
||
[[fi:Vasta-aine]] |
|||
[[fr:Anticorps]] |
[[fr:Anticorps]] |
||
[[gl:Anticorpo]] |
[[gl:Anticorpo]] |
||
[[ |
[[ko:항체]] |
||
[[hi:प्रतिपिंड (एंटीबॉडी)]] |
[[hi:प्रतिपिंड (एंटीबॉडी)]] |
||
[[hr:Protutijela]] |
[[hr:Protutijela]] |
||
[[ |
[[id:Antibodi]] |
||
[[hu:Ellenanyag]] |
|||
[[ia:Anticorpore]] |
[[ia:Anticorpore]] |
||
[[id:Antibodi]] |
|||
[[it:Anticorpo]] |
[[it:Anticorpo]] |
||
[[ |
[[he:נוגדן]] |
||
[[kn:ಪ್ರತಿಕಾಯ(ಆಂಟಿಬಾಡಿ)]] |
[[kn:ಪ್ರತಿಕಾಯ(ಆಂಟಿಬಾಡಿ)]] |
||
[[ |
[[ht:Antikò]] |
||
[[la:Anticorpus]] |
[[la:Anticorpus]] |
||
[[lt:Antikūnas]] |
|||
[[lv:Antivielas]] |
[[lv:Antivielas]] |
||
[[lt:Antikūnas]] |
|||
[[hu:Ellenanyag]] |
|||
[[mk:Антитело]] |
[[mk:Антитело]] |
||
[[nds:Antikörper]] |
|||
[[nl:Immunoglobuline]] |
[[nl:Immunoglobuline]] |
||
[[ |
[[ja:抗体]] |
||
[[no:Antistoff]] |
[[no:Antistoff]] |
||
[[nn:Antistoff]] |
|||
[[nds:Antikörper]] |
|||
[[pl:Przeciwciało]] |
[[pl:Przeciwciało]] |
||
[[pt:Imunoglobulina]] |
[[pt:Imunoglobulina]] |
||
[[ro:Anticorp]] |
[[ro:Anticorp]] |
||
[[ru:Антитела]] |
[[ru:Антитела]] |
||
[[sh:Antitelo]] |
|||
[[simple:Antibody]] |
[[simple:Antibody]] |
||
[[sk:Protilátka]] |
[[sk:Protilátka]] |
||
[[sl:Protitelo]] |
[[sl:Protitelo]] |
||
[[sr:Антитело]] |
[[sr:Антитело]] |
||
[[sh:Antitelo]] |
|||
[[fi:Vasta-aine]] |
|||
[[sv:Antikropp]] |
[[sv:Antikropp]] |
||
[[tl:Panlaban ng katawan]] |
|||
[[ta:பிறபொருளெதிரி]] |
[[ta:பிறபொருளெதிரி]] |
||
[[th:แอนติบอดี]] |
[[th:แอนติบอดี]] |
||
[[tl:Panlaban ng katawan]] |
|||
[[tr:Antikor]] |
[[tr:Antikor]] |
||
[[uk:Антитіло]] |
[[uk:Антитіло]] |
||
2011年6月21日 (二) 09:55的版本
| 此條目需要精通或熟悉相关主题的编者参与及协助编辑。 (2011年2月5日) |
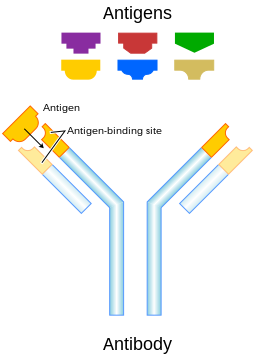
抗體(Antibody),又稱免疫球蛋白(Immunoglobin,簡稱 Ig),是一种免疫系统中鉴别与中和外来物质如细菌、病毒等的大型Y形蛋白质,仅被发现存在于脊椎动物的血液等体液中[1][2]。抗体能识别特定外来物的一个独特特征,该外来目标被称为抗原。蛋白上Y型的其中两个分叉顶端都有一被称为互补位的锁装结构,该结构仅针对一种特定的抗原表位。这就像一把钥匙只能开一把锁一般,使得一种抗体仅能和其中一种抗原相结合。正因这种特异性的结合机制,抗体可以“标记”外来微生物以及受感染的细胞,以诱导其他免疫机制对其进行攻击,又或直接中和其目标,例如通过与入侵和生存至关重要的部分相结合而阻断微生物的感染能力等。体液免疫系统的主要功能便是制造抗体[3]。抗体也可以与血清中的补体一起直接杀死外来目标。
抗體是由一種叫做漿細胞的白细胞所製造。抗体有两种物理形态,一种是从细胞分泌出的可溶解物形态,另一种是依附于B细胞表面的膜结合形态。抗体与细胞膜结合后所形成的复合体又被称为B细胞感受器(B Cell Receptor,BCR),这种复合体只存在于B细胞的细胞膜表面,是激活B细胞以及后续分化的重要结构。B细胞分化后成为生产抗体的工厂的浆细胞,或者长期存活于体内以便未来能迅速抵抗相同入侵物的记忆B细胞[4]。在大多数情况下,与B细胞进行互动的辅助型T细胞对于B细胞的完全活化是至关重要的,因为辅助型T细胞负责识别抗原,并促使B细胞能分化出能与该抗原相结合的抗体的浆细胞和记忆型B细胞[5]。而可溶性抗体则被释放到血液等体液当中(包括各种分泌物),持续抵抗正在入侵的外来微生物。
抗体是免疫球蛋白超家族中的一种糖蛋白[6]。抗体通常由一些基础单元组成,每一个抗体包括:两个大的重链,以及两个小的轻链。重链的不同,将会导致抗体种型的不同。在哺乳类动物身上已知的不同种型的抗体有五种,它们分别扮演不同的角色,并引导免疫系统对所遇到的不同类型外来入侵物产生正确的免疫响应[7]。
尽管所有的抗体大体上看都很相似,然而在蛋白质Y型分叉的两个顶端有一小部分是可以发生非常丰富的变化的。这一高变区上的细微变化可达百万种以上,该位置就是抗原结合点。每一种特定的变化,可以使该抗体和某一个特定的抗原特异结合[1]。这种极丰富的变化能力,使得免疫系统可以应对同样非常多变的各种抗体[6]。之所以能产生如此丰富多样的抗体,是因为编码抗体基因中,编码抗原结合点(即互补位)的部分可以随机组合及突变[7][8]。此外,在Template:TransHint的过程中,可以修改重链的类型,从而制造出对相同抗原特异的不同种型的抗体,使得同种抗体可以用于不同的免疫系统过程中。
形态
表面免疫球蛋白通过跨膜部分附着在效应B细胞的细胞膜上,而分泌到血液等体液中的抗体则没有该跨膜部分。这两种抗体除了是否存在跨膜部分之外,结构是完全相同的。根据这一区别,抗体被分为两种形态:可溶形态(分泌形态)及膜结合形态。
膜结合形态抗体可称为“表面免疫球蛋白”(sIg)或者“膜免疫球蛋白”(mIg),是“B细胞感受器”(BCR)的其中一部分。当体内存在某种抗原的时候,会与该蛋白结合,并激活B细胞[9]。B细胞感受器由表面免疫球蛋白(IgD或IgM),以及与之相连接的由Ig-α和Ig-β构成的异源二聚体所组成,其中后者负责传递抗原刺激信号[10]。人类B细胞表面所拥有抗体的典型数量为5万至10万左右[10]。这些抗体通常会聚集在每个直径大约1微米的脂筏上,这些脂筏用于隔离细胞上的其它信号感受器[10],这种聚集方式可能可以提升细胞媒介性免疫的效率[11]。在人类B细胞的表面,这些B细胞感受器聚集的脂筏周围几百纳米的范围内没有其它感受器,以避免互相竞争的影响[12]。
种型
| 名称 | 类型数量 | 描述 | 抗体复合物 |
| IgA | 2 | 存在于粘膜组织,例如消化道、呼吸道以及泌尿生殖系统,以避免遭到病原的入侵[13],也存在于唾液、泪液以及乳汁当中。 |  其中一些抗体复合体可以与多个抗原分子结合。 其中一些抗体复合体可以与多个抗原分子结合。
|
| IgD | 1 | 主要出现在尚未遇到过抗原的B细胞上的抗原感受器[14],用于刺激嗜碱性粒细胞及肥大细胞生产抗菌因子[15] | |
| IgE | 1 | 与致敏原相结合,刺激肥大细胞和嗜碱性粒细胞释放组织胺。该种型与过敏反应有关,同时也保护机体免受寄生虫的威胁[3]。 | |
| IgG | 4 | 抵抗病原入侵的抗体相关免疫力,主要由该种型下的四种类型所提供[3],也是唯一一种可以穿过胎盘为胎儿提供被动免疫力的种型。 | |
| IgM | 1 | 与B细胞表面结合的是单体形式,在分泌形态中则是五聚体形式,并具有极高的亲和力。在B细胞介导(体液)免疫的早期阶段IgG尚不充足,此时则主要由IgM来发挥清除病原的作用[3][14]。 |
抗体可以根据种型来分为多种类别,不同的种型在免疫系统中有不同的确定作用。对于胎生哺乳类动物,存在5种种型,分别是IgA、IgD、IgE、IgG以及IgM,其中前面的"Ig"代表免疫球蛋白(Immunoglobulin,对抗体的另一种称法)。这几种种型在生物属性、发挥功能的位置以及所能处理的抗原类型均有所不同,具体请参见右方的表格[16]。
B细胞的抗体种型会随着B细胞的发育和活化而有所变化。从未接触过任何抗原的未成熟B细胞(也称为初始B细胞)尽在细胞表面表达IgM种型的膜结合形态。当其成熟后,将会同时表达IgM和IgG两种形式,这表明该B细胞仪能够对抗原产生响应,亦即“成熟”了[17]。
抗原与B细胞上抗体的结合,将会导致B细胞活化,并随之分裂并分化成生产抗体的浆细胞。这种活化形态的B细胞将会产生大量分泌形态的抗体,而不是膜结合形态的抗体。其中部分子代会发生免疫种型交换,该机制将会导致生产的抗体从IgM或IgD种型,变成IgE、IgA或者IgG种型。
结构
抗体是一种高分子球状血液蛋白质,重量约为150kDa。由于在部分氨基酸残基中含有糖链[18],抗体也是一种糖蛋白。能发挥功能的基本单位是一个免疫球蛋白单体。在分泌形态的抗体中包括:二聚体IgA、真骨附类鱼的四聚体IgM以及哺乳动物的五聚体IgM[19]。

可发生变化的部分称为V区(或变化区),而不变的部分称为C区(或恒定区)。
免疫球蛋白结构域
抗体的单体是一个Y型的分子,有4条多肽链组成。其中包括两条相同的重链,以及两条相同的轻链,之间由双硫键连接在一起[16]。每一条链均由称为免疫球蛋白结构域的多个结构域所组成。每一个结构域大约包含70至110个氨基酸,并根据大小和功能分门别类。例如可变域IgV以及恒定域IgC)[20]。它们的折叠方式很特别:通过两次β折叠将另一条链卷入其中形成三明治状,互相之间通过半胱氨酸和其它带电荷氨基酸紧密结合。
重链
哺乳动物的免疫球蛋白重链有5种,分别用希腊字母记为:α、δ、ε、γ以及μ[1]。根据重链类型的不同,抗体被分为不同的种型,它们被发现依序本别存在于抗体IgA、IgD、IgE、IgG以及IgM中[6]。不同的重链其大小和组成各不相同:α和γ大约有450个氨基酸组成,而μ和ε大约有550个氨基酸组成[1]。

2. 抗原结晶区(Fc)
3. 蓝色的重链有一个可变区(VH),紧随其后的一个恒定区(CH1),一个枢纽区,以及另两个恒定区(CH2 and CH3)组成
4. 绿色的轻链包含一个可变区(VL)以及一个恒定区(CL)
5. 抗原结合点
6. 枢纽区.
在鸟类的血液和蛋清中间,还发现了被称为Template:TransHint的血清抗体种型。这种抗体种型和哺乳动物的IgG有很大的区别。然而在一些旧资料,甚至是生命科学商业产品的网站上,仍然称之为IgG。这是错误的,并且容易引起混淆。
每一条重链有两个区域:恒定区与可变区。同种型的抗体,其恒定区都是一样的,但不同种型之间该区域是不相同的。例如:γ、α以及δ型重链由三个免疫球蛋白结构域串联而成,并且还有一个用于增加弹性的铰链区;而μ及ε型重链则包括四个免疫球蛋白结构域[1]。不同B细胞所生产抗体的重链可变区是不同的,但是同一个B细胞及其克隆体所生产的不同种型抗体的可变区则是完全相同的。重链的可变区由一个结构域组成,包含大110个氨基酸。
轻链
免疫球蛋白轻链由大约211至217个氨基酸组成[1],分为两个结构域,分别是恒定区和可变区。哺乳动物的轻链有两种,分别命名为λ(lambda)和κ(kappa)[1]。每一个抗体的两个轻链永远是完全相同的,例如对于哺乳动物而言,同一个抗体要么是λ型,要么是κ,不会同时存在。在如软骨鱼纲及真骨下纲的低级脊椎动物中,还可发现其它类型的轻链,如ι(iota)型。
CDRs、Fv、Fab以及Fc结构域
抗体的某些部分具有独特的功能。比如说Y型的臂区,包含了两个可以结合抗原的点位,是识别外来物的关键所在。该区域被称为Fab区,即抗体结合区段(fragment, antigen binding)。无论是重链还是轻链,片段均包括一个可变区与一个恒定区[21],其中可变区的互补位成型于抗体单体氨基酸链的末端。可变区又被称为FV区,是与抗体结合的最关键区域。更具体的说,其中轻链和重链上均存在三个可变的β折叠-转角,该区域被称为互补决定区(Complementarity Determining Region,CDR),也叫做高变区。乔西亚(Chothia)等人[22],以及后来的诺斯等人[23]对互补决定区的结构进行了归类。在Template:TransHint中,每个抗体的互补决定区又被称为独特型或者基因型。适应性免疫系统的适应过程,就是依靠有各个独特型之间的互动来进行调整的。
Y型结构的基座的作用是调节免疫细胞的活动。该区域被成为Fc区,即可结晶区域片段(Fragment, crystallizable),有两条重链组成。根据抗体类型不同,该区域的每一条重链由2个或者3个恒定结构域组成[1]。因此,Fc区可通过与特定类型的Fc感受器,或者其它免疫分子如补体蛋白质相结合,来确保每个抗体可对一特定抗原产生一个正确的免疫应答。通过这一过程,可引发不同的生理学效果,包括识别调理颗粒、细胞溶解,以及肥大细胞、嗜碱性粒细胞和嗜酸性粒细胞的脱颗粒过程[16][24]。
功能
活化的B细胞可分化成两种不同用途的细胞:生产可溶性抗体的浆细胞,以及用于记忆已接触过的抗原的记忆B细胞。后者可在体内存活多年,并使得下次再接触到同样抗原时,能够更迅速的做出相应[25]。
胎儿和新生儿体内的抗体是由母亲所提供的,是一种被动免疫。在出生后一年内,新生儿就可自行产生许多不同的抗体。由于抗体可以溶解在血液当中,因此它们是体液免疫系统的一部分。体液循环中的抗体,是由应答某一特定抗原如病毒衣壳片段的B细胞克隆子代所产生的。抗体从下列三个方面为免疫力做出贡献:通过与病原体结合来避免入侵和破坏自身的细胞;通过刺激巨噬细胞等免疫细胞来包裹并清除冰原体;以及通过刺激其它免疫应答过程如补体路径,来消灭病原体[26]。

补体的活化
当补体与细菌结合形成补体级联时,也是一种能和抗体结合的抗原。当抗体的Fv区与之结合时,会激活典型的补体系统[26]。这将会动过两种途径消灭该细菌[3]:第一种途径是通过抗体与补体的结合在微生物上作标记,使得噬菌細胞受到补体级联所产生的特定的补体的吸引,并通过一个叫做噬菌作用的过程吞噬细菌;第二种途径是通过形成一种叫做Template:TransHint的补体抗体复合物来直接杀死细菌[27]。
效应细胞的活化
为了阻止病原体在细胞外进行复制,抗体通过与之结合而将其聚集在一起,即凝集。由于抗体至少拥有两个互不结合位,因此理论上它可以与不只一个相同类型的抗原相结合。通过对病原体的覆盖,抗体可以激活能识别该抗体Fc区的细胞的效应作用[3]。拥有可以识别覆盖病原体的抗体Fc区的细胞,可以和IgA、IgG以及IgE型抗体的Fc区发生互动。某一特定细胞上的Fc区感受器遇到特定的抗体后,会引发该细胞的效应作用,例如:吞噬细胞会进行吞噬,肥大细胞和中性粒细胞会脱颗粒,而自然杀伤细胞会释放细胞因子和细胞毒素等化学物质。这些作用最终会导致入侵微生物的解体。Fc区感受器是种型敏感的,因此可使得免疫系统具备更高的灵活性,当不同的病原体入侵时可以仅仅触发正确的免疫机制[1]。
中和抗体
人类及高级灵长类动物还可以在病毒入侵之前,在血液中释放中和抗体。中和抗体是指那些在任何感染、接种疫苗、接触任何外来抗原或者接受被动免疫之前,即已被制造和释放出来的抗体。这类抗体可以在适应性免疫响应被启动之前,激活经典的补体路径,来消解有包膜的病毒颗粒。许多中和抗体的目标抗体是双半乳糖α(1,3)-半乳糖(α-Gal),后者通常出现在糖基化的细胞膜蛋白的糖基终端上,也是人类消化道中细菌的代谢产物[28]。通常认为Template:TransHint所引起的排斥,部分是由接受移植者血清中流动的中和抗体和移植器官上的α-Gal抗原结合造成的[29]。
多样性
几乎所有的微生物都可以触发抗体的免疫应答。若想要成功识别并清除各种微生物,需要丰富多样的抗体,而这种多样性来自于抗体氨基酸的重组变化[30]。据估算,人类可以产生大约100亿种不同的抗体,每一种都可以与特定抗原的表位相结合[31]。尽管每个人可以产生的抗体是如此之多,但是产生这些蛋白质的相关基因却十分有限。脊椎动物发展出了一些复杂的基因机制,使得其B细胞可以根据有限的基因产生非常多样的抗体[32]。
结构域的可变性

染色体当中用于编码抗体的基因座范围很广,其中包含了编码各个结构域的基因。其中编码人类重链的基因座(IGH@)位于第14号染色体,而编码λ和κ型轻链的基因座(IGL@和IGK@)则位于第22号染色体和第2号染色体。重链和轻链中均存在的可变区,在不同的B细胞所产生的抗体中是不一样的。控制这些差异的三个转角被称为超变区(HV-1、HV-2及HV-3),又称为补体决定区(CDR1、CDR2及CDR3)。编码重链部分的基因座包含了65种不同的可变区基因,通过将这些基因与其它结构域的基因想组合,就可以产生高度诧异的大量不同抗体,这一组合过程被称为V(D)J重组过程[33]。
V(D)J重组
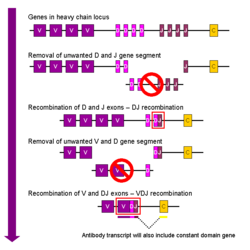
体细胞的免疫球蛋白重组又被称为V(D)J重组,该过程可导致可变区发生独特的变化。免疫球蛋白中每一条重链和轻链的可变区是由若干个基因片段所编码的,这些片断分别被称为可变段(V)、多样段(D)以及连接段(J)[32]。这三种片段均存在于编码重链的基因片段中,而编码轻链的基因片段中只存在V和J段。在哺乳类动物的基因中,V、D和J段的重复基因序列串联在一起。骨髓中正在发育的B细胞,通过随机选择和组合V、D及J段各一段(轻链没有D段),来产生免疫蛋白的可变区。由于每段都有多个不同的拷贝,各段之间还存在不同的组合方式,因此抗体的可变区可以产生数量巨大的变化。正因有如此数量巨大的不同抗原结合位,所以可以产生对大量不同抗原具有特异性的抗体[7]。
在B细胞通过V(D)J重组过程产生了一个具备功能的免疫球蛋白之后,它就不可以在产生任何其它形状的可变区了,这一过程称为等位基因排斥。因此,每一个B细胞仅能产生某一种相同可变区的抗体[1][34]。
体细胞超突变与亲和力成熟过程
B细胞被抗原激活之后,将会迅速的增殖。在快速增殖的过程中,编码重链及轻链可变区的基因,会通过一种称为体细胞超突变过程,发生非常高概率的点突变。体细胞超突变会使得每一次细胞分裂,在基因的可变区中会产生大约一个核苷酸的变化[8]。这一过程将导致每一个子代B细胞会与亲代的DNS,在抗体氨基酸链的可变区部分产生细微的差异。
这种突变方式可以增加抗体池的多样性,并且对抗体与抗原的亲和力产生影响[35]。例如,突变的子代中,某些所产生的抗体与抗原结合的能力,比亲代所产生的抗体相比反而变弱了(亲和力下降),但另一些则可能变强了(亲和力增强)[36]。那些表达亲和力更强的抗体的B细胞,会在与免疫系统其它部分的交互过程中,获得比较弱者更强的生存信号,后者会逐渐因为凋亡作用而消失。这种使得生产的抗体逐渐增加结合亲和力的过程,就是亲和力成熟过程。亲和力成熟过程发生在已发生过V(D)J重组后的成熟B细胞上,并需要辅助T细胞的帮助[37]。
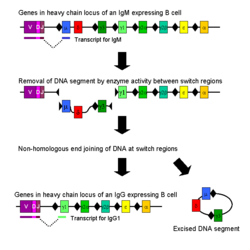
种型转换
免疫种型转换是在活化后的B细胞中发生的一个生物学过程,该过程使得细胞可以产生不同种型的抗体,如IgA、IgE及IgG等[7]。不同种型的抗体及其效应作用,是有免疫球蛋白重链中的恒定区决定的。最开始的时候,初始B细胞进表达抗原结合区域相同的膜结合形态IgM和IgD抗体。而在活化之后,由于不同种型的抗体仅应对特定的功能,B细胞会根据清除抗原所需要的功能,选择生产具备IgG、IgA或者IgE效应作用的抗体。通过种型转换,从同一个活化B细胞分裂出来的子代细胞就可以生产不同种型的抗体。在种型转换的过程中,只有重链的恒定区发生了改变,而可变区则没有发生任何改变,因此所针对抗原的特异性也不会发生改变。因此,同一个B细胞的子代都能生产针对同一抗原的抗体,但却可以对各种抗原状况提供恰当的效应作用。生产哪一种型的抗体,是由B细胞所处环境中存在的细胞因子类型所决定的[38]。
生产抗体种型的转换,是通过一种称为种型转换重组(CSR)的机制对编码重链的基因座进行重组来完成的。该机制依赖被称为“交换区”的保守核苷酸模体,该模体存在于除δ链以外其它重链恒定区基因的上游DNA序列中。通过一系列酶的作用后DNA链的两个特定交换区被剪断[39][40],然后通过非同源性末端接合的过程,将可变区外显子与需要的恒定区如γ、α、ε链重新接合在一起。通过该过程,一段编码抗体的基因即可产生不同种型的抗体[41]。
医学应用
疾病诊断及治疗
检测特定的抗体是一种常见的医学诊断方式,而血清学方面的应用便依赖于此[42]。以某种疾病的生化检查方法为例[43],可通过对血液中人類疱疹病毒第四型或者莱姆病抗体的滴定量来判断是否患病。如果被检测者的血液中没有发现这种抗体,则此人要么没有被感染,要么即使被感染也是很早以前的事情了——那些记忆B细胞都已消解殆尽了。在临床免疫学中,通过浊度测定法(或者比浊法)对各种免疫球蛋白的水平进行测定,以了解患者的抗体情况[44]。对于肝脏发生损伤但尚未确诊的患者检查何种免疫球蛋白升高情况,有的时候有助于找出问题的原因[6]。例如,IgA升高可能意味着酒精性肝硬化,IgM升高可能意味着病毒性肝炎或者原发性胆汁性肝硬化,IgG升高则可能是由肝硬化、病毒性肝炎或者自身免疫性肝炎的征兆。患有自身免疫性疾病的患者,通常会存在自身细胞抗原表位相结合的抗体,大部分患者可通过血液检查检测到。而通过抗体直接对红细胞的表面抗原进行Template:TransHint,则可以确诊免疫所致的溶血性贫血[45]。抗人球蛋白测试也用于输血之前的抗体筛查准备工作,以及产前孕妇的抗体筛查[45]。在实践中,基于对抗原抗体复合物的免疫检测手段被用来诊断所感染的疾病,这些手段包括:酶联免疫吸附试验、免疫荧光染色法、西方墨点法、免疫扩散法、免疫电泳法以及磁性分离酶联免疫分析等。抗人绒毛膜促性腺激素抗体被用于非处方妊娠检测,如早孕试纸等。特定的单克隆抗体疗法被用于治疗诸如类风湿性关节炎[46]、多发性硬化症[47]、银屑病[48]等疾病。此外,单克隆抗体还被用于治疗诸如非霍奇金氏淋巴瘤[49]、大肠癌、头颈部癌以及乳腺癌等多种癌症[50]。某些如Template:TransHint以及Template:TransHint的免疫缺陷会导致部分甚至全部抗体的缺失[51]。这种类型的疾病,通常是通过向病患注射包含抗体的人或动物血清、混合免疫球蛋白或者单克隆抗体等方式,建立短期的被动免疫力的手段进行治疗的[52]。
产前治疗
Rh因子,又称为RhD抗原,是一种可存在于红细胞表面的抗原。Rh阳性(Rh+)的个体,其红细胞表面存在Rh抗原,而Rh阴性(Rh-)个体的红细胞表面则不存在这种抗原。正常的分娩过程,或者分娩创伤,或者怀孕过程中的并发症,都可能导致胎儿的血液进入母亲的免疫系统中。这种血液混合的情况,可能会导致Rh阴性的母亲,产生针对Rh阳性婴儿的血细胞抗原的抗体。这将导致剩下的孕期,以及未来的怀孕过程产生新生儿溶血症的风险[53]。
Rho(D)是对人类RhD抗原特异的抗体[54],是避免上述情形发生的产前治疗方案之一。对怀有RhD阳性胎儿的RhD阴性母亲来说,在接触到RhD抗原之前,或者至少在刚接触之时,通过给予RhD抗体的治疗方案是非常必要的。通过注射这种抗体,可以迅速有效地清除从胎儿血液中带来的包含RhD抗原表位的血细胞。这样可以避免刺激母亲的免疫系统产生能够生产RhD抗体的B细胞,尤其是记忆B细胞。因此,母亲的免疫系统就不会生产RhD抗体,也就不会攻击有RhD抗原的胎儿。尽管该治疗方案可以避免Rh血型新生儿溶血症的发生,但却不能治疗已经产生抗体所导致的情况[54]。
科研应用

通过向小鼠、大鼠或者兔身上注射特定的抗体,可以得到少量相应特异性的抗体。而如果需要得到大量的抗体,则需要向山羊、绵羊或者马身上注射相应的抗体。对这些实验动物的血液进行分离后,可以在血清中得到“多克隆抗体”。即,针对相同抗原的多种不同的抗体。这种方法制备的抗体又叫做抗血清。另一种制备抗体的方式是通过向受精蛋中注射抗原,然后从蛋清中获得抗体[55]。为了获得针对某一抗原单一抗原表位的特异性抗体,需要从动物身上分离出相应的抗体分泌淋巴细胞,然后通过与癌细胞株相融合使之可无限增值。这种融合细胞叫做杂交瘤,可以在培养环境中不停分泌抗体。通过稀释克隆法将单个杂交瘤细胞隔离出来,这种细胞克隆方法所制备出来的抗体是完全一样的,被称为单克隆抗体[56]。多克隆抗体和单克隆抗体的制备,通常还需要使用Template:TransHint或者抗体亲和色谱法来进行提纯[57]。
在实验室中,纯化的单克隆抗体有许多应用场景。最常见的应用场景,是用来鉴定细胞内及细胞外的蛋白质类型。此外,不同类型的细胞会在细胞表面表达不同组合的Template:TransHint分子,并生产出不同的胞内蛋白质,也会分泌出不同的蛋白质。因此单克隆抗体也被应用于流式细胞术中,通过识别不同细胞所表达的不同蛋白质来区分它们[58]。在免疫沉淀发中,也通过单克隆抗体来分离细胞溶解物中的特定蛋白及其结合物[59]。此外在西方墨点法中用来分析通过电泳法所分离出来的蛋白质[60],以及在免疫组织化学染色法或免疫荧光染色法中检验分析待检验组织中所表达的蛋白质,甚至通过显微镜直接观察蛋白质在细胞中的分布情况[58][61]。酶联免疫吸附试验(ELISA)及酶联免疫斑点(ELISPOT)等检测技术甚至可以通过单克隆抗体来对特定蛋白进行定量分析[62][63]。
结构预测
由于抗体对健康及生物技术工业的重要性,导致了对其高分辨率结构的知识的需求。这些信息对蛋白质工程,修改抗体结合亲和性,以及识别特定抗体的抗原表位来说非常有用。X射线晶体学是其中一种研究抗体结构的常用手段,然而抗体的结晶过程非常耗时耗力。而通过计算机来研究晶体学问题,相对更快更便宜。但是计算机方法不能得出很确定的结论,因其不能产生经验所知的结构。诸如“网络抗体建模”(WAM)[64],以及“免疫球蛋白结构预测”(PIGS)[65]等在线服务器,使得人们能通过计算机对抗体可变区进行建模。“罗塞塔抗体”(Rosetta Antibody)是一个新型的FV区结构预测服务器,通过使用非常复杂的技术,它可以最大程度简化CDR转角过程,并优化轻重链相对位置的定位过程,还可以根据已知同源结构模型来预测抗原抗体是否能成功对接[66]。
历史
抗体(antibody)这个词首次出现在保罗·埃尔利希1891年10月公布的《免疫力的试验性研究》这篇文章中,德语的抗体“Antikörper”出现在该文章的结论部分。其中指出了“如果两种物质导致两种不同抗体的产生,那么这两种物质必然是不同的”[67]。然而这一术语并没有立即被接受,还有被建议使用的其它几个术语,如:免疫体(Immunkörper)、介体受体(Amboceptor)、介体(Zwischenkörper)、物质敏感体(substance sensibilisatrice)、连接体(copula)、德氏体(Desmon)、白细胞素(philocytase)、介体固定体(fixateur)以及免疫素(Immunisin)等[67][67]。抗体和抗毒素(Antitoxin)字面结构相似,概念则和免疫体(Immunkörper)类似[67]。

针对抗体的研究始于1890年,埃米尔·阿道夫·冯·贝林及北里柴三郎首次描述了抗体对白喉及破伤风痉挛毒素的抵抗作用。他们两人将体液免疫理论往前推进了一步,提出了血清中存在一种可以与外来抗原相反应的某种介质的假设[71][72]。保罗·埃尔利希受到了他们的这一想法的启发,于1897年提出了抗体与抗原互动的侧链理论假说。他假设道,在细胞的表面存在能和特定毒素发生一把钥匙对应一把锁类似的特异结合作用的感受器(原文为“侧链”),而结合反应则会进一步导致相关抗体的生产[73]。其他研究人员在之后的研究中认为,抗体可以在血液中稳定独立存在。在1904年,奥姆罗斯·莱特进一步提出通过可溶性抗体在细菌的表面包裹标识,使其成为吞噬作用的目标,并最终被消灭。这一过程被他命名为调理作用[74]。
到了二十世纪二十年代,迈克尔·海德堡和奥斯瓦尔德·埃弗里观察到抗原可以被抗体所凝结,并进一步发现抗体是一种蛋白质[75]。在三十年代,约翰·马拉克对抗原-抗体结合活动的生物化学性质做了更详尽的实验[76]。接下来的一次重大突破发生在四十年代,莱纳斯·鲍林通过抗体抗原的互动能力取决于各自的形状而不是其化学成分,证明了埃尔利希所提出的一把钥匙配一把锁的免疫学理论[77]。1948年,阿斯特丽德·法戈瑞奥司发现B细胞的其中一种形式浆细胞就是负责生产抗体的工厂[78]。
此后,研究工作的重点转向了识别抗体蛋白质结构中各部分的作用。二十世纪六十年代,杰拉尔德·埃德尔曼和约瑟夫·盖里发现了抗体的轻链[79],并且发现这和1845年由亨利·本册·琼斯所发现的本周氏蛋白质是同一种物质[80],这是一项重大的突破。紧接着,埃德尔曼在进一步发现抗体中的重链和轻链是由双硫键连接在一起的。与此同时,罗德尼·罗伯特·波特识别出了免疫球蛋白的抗体结合区(Fab)及抗体尾部的可结晶区[81]。根据这些发现,科学家们对免疫球蛋白的结构进行了推测,并描述了IgG蛋白质的完整氨基酸序列。以上这些发现,使得他们被共同授予1972年的诺贝尔生理学或医学奖[81]。Fv区则由戴维·吉沃尔(David Givol)所首先制备和识别[82]。正当人们对抗体的大多数早期研究还集中在IgM和IgG上时,六十年代还发生了重要的事情:托马斯·托马西发现了属于新种型的分泌形态IgA抗体[83],戴维·S·罗维和约翰·L·费伊则识别出了IgD[84],石坂公成和石坂照子夫妇则共同发现了与过敏反应有关的抗体种型IgE[85]。1976年,利根川进对免疫球蛋白相关基因进行研究,发现了抗体多样性的体细胞超突变基本原理[86]。
参见
引用
- ^ 1.00 1.01 1.02 1.03 1.04 1.05 1.06 1.07 1.08 1.09 Janeway CA, Jr.; et al. Immunobiology. 5th. Garland Publishing. 2001. (electronic full text via NCBI Bookshelf) ISBN 0-8153-3642-X. 引证错误:带有name属性“Janeway5”的
<ref>标签用不同内容定义了多次 - ^ Litman GW, Rast JP, Shamblott MJ, Haire RN, Hulst M, Roess W, Litman RT, Hinds-Frey KR, Zilch A, Amemiya CT. Phylogenetic diversification of immunoglobulin genes and the antibody repertoire. Mol. Biol. Evol. 1993, 10 (1): 60–72. PMID 8450761. 已忽略未知参数
|month=(建议使用|date=) (帮助) - ^ 3.0 3.1 3.2 3.3 3.4 3.5 Pier GB, Lyczak JB, Wetzler LM. Immunology, Infection, and Immunity. ASM Press. 2004. ISBN 1-55581-246-5.
- ^ Borghesi L, Milcarek C. From B cell to plasma cell: regulation of V(D)J recombination and antibody secretion. Immunol. Res. 2006, 36 (1-3): 27–32. PMID 17337763. doi:10.1385/IR:36:1:27.
- ^ Parker D. T cell-dependent B cell activation. Annu Rev Immunol. 1993, 11 (1): 331–60. PMID 8476565. doi:10.1146/annurev.iy.11.040193.001555.
- ^ 6.0 6.1 6.2 6.3 Rhoades RA, Pflanzer RG. Human Physiology 4th. Thomson Learning. 2002. ISBN 0-534-42174-1. 引证错误:带有name属性“Rhoades”的
<ref>标签用不同内容定义了多次 - ^ 7.0 7.1 7.2 7.3 Market E, Papavasiliou FN. V(D)J recombination and the evolution of the adaptive immune system. PLoS Biol. 2003, 1 (1): E16. PMC 212695
 . PMID 14551913. doi:10.1371/journal.pbio.0000016. 已忽略未知参数
. PMID 14551913. doi:10.1371/journal.pbio.0000016. 已忽略未知参数|month=(建议使用|date=) (帮助) - ^ 8.0 8.1 Diaz M, Casali P. Somatic immunoglobulin hypermutation. Curr Opin Immunol. 2002, 14 (2): 235–40. PMID 11869898. doi:10.1016/S0952-7915(02)00327-8.
- ^ Parker D. T cell-dependent B cell activation. Annu. Rev. Immunol. 1993, 11 (1): 331–60. PMID 8476565. doi:10.1146/annurev.iy.11.040193.001555.
- ^ 10.0 10.1 10.2 Wintrobe, Maxwell Myer. Wintrobe's clinical hematology. John G. Greer, John Foerster, John N Lukens, George M Rodgers, Frixos Paraskevas 11. Hagerstown, MD: Lippincott Williams & Wilkins. 2004: 453–456. ISBN 978-0-7817-3650-3.
- ^ Tolar P, Sohn HW, Pierce SK. Viewing the antigen-induced initiation of B-cell activation in living cells. Immunol. Rev. 2008, 221 (1): 64–76. PMID 18275475. doi:10.1111/j.1600-065X.2008.00583.x. 已忽略未知参数
|month=(建议使用|date=) (帮助) - ^ Wintrobe, Maxwell Myer. Wintrobe's clinical hematology. John G. Greer, John Foerster, John N Lukens, George M Rodgers, Frixos Paraskevas 11. Hagerstown, MD: Lippincott Williams & Wilkins. 2004: 453–456. ISBN 0-7817-3650-1.
- ^ Underdown B, Schiff J. Immunoglobulin A: strategic defense initiative at the mucosal surface. Annu Rev Immunol. 1986, 4 (1): 389–417. PMID 3518747. doi:10.1146/annurev.iy.04.040186.002133.
- ^ 14.0 14.1 Geisberger R, Lamers M, Achatz G. The riddle of the dual expression of IgM and IgD. Immunology. 2006, 118 (4): 429–37. PMC 1782314
 . PMID 16895553. doi:10.1111/j.1365-2567.2006.02386.x.
. PMID 16895553. doi:10.1111/j.1365-2567.2006.02386.x.
- ^ Chen K, Xu W, Wilson M, He B, Miller NW, Bengtén E, Edholm ES, Santini PA, Rath P, Chiu A, Cattalini M, Litzman J, B Bussel J, Huang B, Meini A, Riesbeck K, Cunningham-Rundles C, Plebani A, Cerutti A. Immunoglobulin D enhances immune surveillance by activating antimicrobial, proinflammatory and B cell-stimulating programs in basophils. Nature Immunology. 2009, 10 (8): 889–98. PMC 2785232
 . PMID 19561614. doi:10.1038/ni.1748.。
. PMID 19561614. doi:10.1038/ni.1748.。
- ^ 16.0 16.1 16.2 Woof J, Burton D. Human antibody-Fc receptor interactions illuminated by crystal structures. Nat Rev Immunol. 2004, 4 (2): 89–99. PMID 15040582. doi:10.1038/nri1266.
- ^ Goding J. Allotypes of IgM and IgD receptors in the mouse: a probe for lymphocyte differentiation. Contemp Top Immunobiol. 1978, 8: 203–43. PMID 357078.
- ^ Mattu T, Pleass R, Willis A, Kilian M, Wormald M, Lellouch A, Rudd P, Woof J, Dwek R. The glycosylation and structure of human serum IgA1, Fab, and Fc regions and the role of N-glycosylation on Fc alpha receptor interactions. J Biol Chem. 1998, 273 (4): 2260–72. PMID 9442070. doi:10.1074/jbc.273.4.2260.
- ^ Roux K. Immunoglobulin structure and function as revealed by electron microscopy. Int Arch Allergy Immunol. 1999, 120 (2): 85–99. PMID 10545762. doi:10.1159/000024226.
- ^ Barclay A. Membrane proteins with immunoglobulin-like domains--a master superfamily of interaction molecules. Semin Immunol. 2003, 15 (4): 215–23. PMID 14690046. doi:10.1016/S1044-5323(03)00047-2.
- ^ Putnam FW, Liu YS, Low TL. Primary structure of a human IgA1 immunoglobulin. IV. Streptococcal IgA1 protease, digestion, Fab and Fc fragments, and the complete amino acid sequence of the alpha 1 heavy chain. J Biol Chem. 1979, 254 (8): 2865–74. PMID 107164.
- ^ Al-Lazikani B, Lesk AM, Chothia C. Standard conformations for the canonical structures of immunoglobulins. J Mol Biol. 1997, 273 (4): 927–048. PMID 9367782. doi:10.1006/jmbi.1997.1354.
- ^ North B, Lehmann A, Dunbrack RL. A new clustering of antibody CDR loop conformations. J Mol Biol. 2010, 406 (2): 228–256. PMID 21035459. doi:10.1016/j.jmb.2010.10.030.
- ^ Heyman B. Complement and Fc-receptors in regulation of the antibody response. Immunol Lett. 1996, 54 (2-3): 195–9. PMID 9052877. doi:10.1016/S0165-2478(96)02672-7.
- ^ Borghesi L, Milcarek C. From B cell to plasma cell: regulation of V(D)J recombination and antibody secretion. Immunol Res. 2006, 36 (1-3): 27–32. PMID 17337763. doi:10.1385/IR:36:1:27.
- ^ 26.0 26.1 Ravetch J, Bolland S. IgG Fc receptors. Annu Rev Immunol. 2001, 19 (1): 275–90. PMID 11244038. doi:10.1146/annurev.immunol.19.1.275.
- ^ Rus H, Cudrici C, Niculescu F. The role of the complement system in innate immunity. Immunol Res. 2005, 33 (2): 103–12. PMID 16234578. doi:10.1385/IR:33:2:103.
- ^ Racaniello, Vincent. Natural antibody protects against viral infection. Virology Blog. 2009-10-06 [2010-01-22]. (原始内容存档于2010-11-17).
- ^ Milland J, Sandrin MS. ABO blood group and related antigens, natural antibodies and transplantation. Tissue Antigens. 2006, 68 (6): 459–66. PMID 17176435. doi:10.1111/j.1399-0039.2006.00721.x. 已忽略未知参数
|month=(建议使用|date=) (帮助) - ^ Mian I, Bradwell A, Olson A. Structure, function and properties of antibody binding sites. J Mol Biol. 1991, 217 (1): 133–51. PMID 1988675. doi:10.1016/0022-2836(91)90617-F.
- ^ Fanning LJ, Connor AM, Wu GE. Development of the immunoglobulin repertoire. Clin. Immunol. Immunopathol. 1996, 79 (1): 1–14. PMID 8612345. doi:10.1006/clin.1996.0044.
- ^ 32.0 32.1 Nemazee D. Receptor editing in lymphocyte development and central tolerance. Nat Rev Immunol. 2006, 6 (10): 728–40. PMID 16998507. doi:10.1038/nri1939.
- ^ Peter Parham. "The Immune System. 2nd ed. Garland Science: New York, 2005. pg.47-62
- ^ Bergman Y, Cedar H. A stepwise epigenetic process controls immunoglobulin allelic exclusion. Nat Rev Immunol. 2004, 4 (10): 753–61. PMID 15459667. doi:10.1038/nri1458.
- ^ Honjo T, Habu S. Origin of immune diversity: genetic variation and selection. Annu Rev Biochem. 1985, 54 (1): 803–30. PMID 3927822. doi:10.1146/annurev.bi.54.070185.004103.
- ^ Or-Guil M, Wittenbrink N, Weiser AA, Schuchhardt J. Recirculation of germinal center B cells: a multilevel selection strategy for antibody maturation. Immunol. Rev. 2007, 216: 130–41. PMID 17367339. doi:10.1111/j.1600-065X.2007.00507.x.
- ^ Neuberger M, Ehrenstein M, Rada C, Sale J, Batista F, Williams G, Milstein C. Memory in the B-cell compartment: antibody affinity maturation. Philos Trans R Soc Lond B Biol Sci. 2000, 355 (1395): 357–60. PMC 1692737
 . PMID 10794054. doi:10.1098/rstb.2000.0573. 已忽略未知参数
. PMID 10794054. doi:10.1098/rstb.2000.0573. 已忽略未知参数|month=(建议使用|date=) (帮助) - ^ Stavnezer J, Amemiya CT. Evolution of isotype switching. Semin. Immunol. 2004, 16 (4): 257–75. PMID 15522624. doi:10.1016/j.smim.2004.08.005.
- ^ Durandy A. Activation-induced cytidine deaminase: a dual role in class-switch recombination and somatic hypermutation. Eur. J. Immunol. 2003, 33 (8): 2069–73. PMID 12884279. doi:10.1002/eji.200324133.
- ^ Casali P, Zan H. Class switching and Myc translocation: how does DNA break?. Nat. Immunol. 2004, 5 (11): 1101–3. PMID 15496946. doi:10.1038/ni1104-1101.
- ^ Lieber MR, Yu K, Raghavan SC. Roles of nonhomologous DNA end joining, V(D)J recombination, and class switch recombination in chromosomal translocations. DNA Repair (Amst.). 2006, 5 (9-10): 1234–45. PMID 16793349. doi:10.1016/j.dnarep.2006.05.013.
- ^ Animated depictions of how antibodies are used in [[ELISA]] assays. Cellular Technology Ltd.—Europe. [2007-05-08]. (原始内容存档于2010-11-17). 网址-维基内链冲突 (帮助)
- ^ Animated depictions of how antibodies are used in [[ELISPOT]] assays. Cellular Technology Ltd.—Europe. [2007-05-08]. (原始内容存档于2010-11-17). 网址-维基内链冲突 (帮助)
- ^ Stern P. Current possibilities of turbidimetry and nephelometry (PDF). Klin Biochem Metab. 2006, 14 (3): 146–151. (原始内容存档于2010-11-17).
- ^ 45.0 45.1 Dean, Laura. Chapter 4: Hemolytic disease of the newborn. Blood Groups and Red Cell Antigens. NCBI Bethesda (MD): National Library of Medicine (US),. 2005.
- ^ Feldmann M, Maini R. Anti-TNF alpha therapy of rheumatoid arthritis: what have we learned?. Annu Rev Immunol. 2001, 19 (1): 163–96. PMID 11244034. doi:10.1146/annurev.immunol.19.1.163.
- ^ Doggrell S. Is natalizumab a breakthrough in the treatment of multiple sclerosis?. Expert Opin Pharmacother. 2003, 4 (6): 999–1001. PMID 12783595. doi:10.1517/14656566.4.6.999.
- ^ Krueger G, Langley R, Leonardi C, Yeilding N, Guzzo C, Wang Y, Dooley L, Lebwohl M. A human interleukin-12/23 monoclonal antibody for the treatment of psoriasis. N Engl J Med. 2007, 356 (6): 580–92. PMID 17287478. doi:10.1056/NEJMoa062382.
- ^ Plosker G, Figgitt D. Rituximab: a review of its use in non-Hodgkin's lymphoma and chronic lymphocytic leukaemia. Drugs. 2003, 63 (8): 803–43. PMID 12662126. doi:10.2165/00003495-200363080-00005.
- ^ Vogel C, Cobleigh M, Tripathy D, Gutheil J, Harris L, Fehrenbacher L, Slamon D, Murphy M, Novotny W, Burchmore M, Shak S, Stewart S. First-line Herceptin monotherapy in metastatic breast cancer. Oncology. 61. 2001,. Suppl 2 (Suppl. 2): 37–42. PMID 11694786. doi:10.1159/000055400.
- ^ LeBien TW. Fates of human B-cell precursors. Blood. 1 July 2000, 96 (1): 9–23. PMID 10891425. (原始内容存档于2010-11-17).
- ^ Ghaffer A. Immunization. Immunology - Chapter 14. University of South Carolina School of Medicine. 2006-03-26 [2007-06-06]. (原始内容存档于2010-11-17).
- ^ Urbaniak S, Greiss M. RhD haemolytic disease of the fetus and the newborn. Blood Rev. 2000, 14 (1): 44–61. PMID 10805260. doi:10.1054/blre.1999.0123.
- ^ 54.0 54.1 Fung Kee Fung K, Eason E, Crane J, Armson A, De La Ronde S, Farine D, Keenan-Lindsay L, Leduc L, Reid G, Aerde J, Wilson R, Davies G, Désilets V, Summers A, Wyatt P, Young D. Prevention of Rh alloimmunization. J Obstet Gynaecol Can. 2003, 25 (9): 765–73. PMID 12970812.
- ^ Tini M, Jewell UR, Camenisch G, Chilov D, Gassmann M. Generation and application of chicken egg-yolk antibodies. Comp. Biochem. Physiol., Part a Mol. Integr. Physiol. 2002, 131 (3): 569–74. PMID 11867282. doi:10.1016/S1095-6433(01)00508-6.
- ^ Cole SP, Campling BG, Atlaw T, Kozbor D, Roder JC. Human monoclonal antibodies. Mol. Cell. Biochem. 1984, 62 (2): 109–20. PMID 6087121. doi:10.1007/BF00223301.
- ^ Kabir S. Immunoglobulin purification by affinity chromatography using protein A mimetic ligands prepared by combinatorial chemical synthesis. Immunol Invest. 2002, 31 (3-4): 263–78. PMID 12472184. doi:10.1081/IMM-120016245.
- ^ 58.0 58.1 Brehm-Stecher B, Johnson E. Single-cell microbiology: tools, technologies, and applications. Microbiol Mol Biol Rev. 2004, 68 (3): 538–59. PMC 515252
 . PMID 15353569. doi:10.1128/MMBR.68.3.538-559.2004. (原始内容存档于2010-11-17).
. PMID 15353569. doi:10.1128/MMBR.68.3.538-559.2004. (原始内容存档于2010-11-17).
- ^ Williams N. Immunoprecipitation procedures. Methods Cell Biol. 2000, 62: 449–53. PMID 10503210. doi:10.1016/S0091-679X(08)61549-6.
- ^ Kurien B, Scofield R. Western blotting. Methods. 2006, 38 (4): 283–93. PMID 16483794. doi:10.1016/j.ymeth.2005.11.007.
- ^ Scanziani E. Immunohistochemical staining of fixed tissues. Methods Mol Biol. 1998, 104: 133–40. PMID 9711649. doi:10.1385/0-89603-525-5:133.
- ^ Reen DJ. Enzyme-linked immunosorbent assay (ELISA). Methods Mol Biol. 1994, 32: 461–6. PMID 7951745. doi:10.1385/0-89603-268-X:461.
- ^ Kalyuzhny AE. Chemistry and biology of the ELISPOT assay. Methods Mol Biol. 2005, 302: 15–31. PMID 15937343. doi:10.1385/1-59259-903-6:015.
- ^ Whitelegg N.R.J., Rees A.R. WAM: an improved algorithm for modeling antibodies on the WEB. Protein Engineering. 2000, 13 (12): 819–824. PMID 11239080. doi:10.1093/protein/13.12.819. (原始内容存档于2010-11-17).
WAM - ^ Marcatili P, Rosi A,Tramontano A. PIGS: automatic prediction of antibody structures. Bioinformatics. 2008, 24 (17): 1953–1954. PMID 18641403. doi:10.1093/bioinformatics/btn341. (原始内容存档于2010-11-17).
Prediction of Immunoglobulin Structure (PIGS) - ^ Sivasubramanian A, Sircar A, Chaudhury S, Gray J J. Toward high-resolution homology modeling of antibody Fv regions and application to antibody–antigen docking. Proteins. 2009, 74 (2): 497–514. PMC 2909601
 . PMID 19062174. doi:10.1002/prot.22309. (原始内容存档于2010-11-17).
. PMID 19062174. doi:10.1002/prot.22309. (原始内容存档于2010-11-17).
RosettaAntibody - ^ 67.0 67.1 67.2 67.3 Lindenmann, Jean. Origin of the Terms 'Antibody' and 'Antigen'. Scand. J. Immunol. 1984, 19 (4): 281–5 [2008-11-01]. PMID 6374880. (原始内容存档于2010-11-17).
- ^ Padlan, Eduardo. Anatomy of the antibody molecule. Mol. Immunol. 1994, 31 (3): 169–217. PMID 8114766. doi:10.1016/0161-5890(94)90001-9. 已忽略未知参数
|month=(建议使用|date=) (帮助) - ^ New Sculpture Portraying Human Antibody as Protective Angel Installed on Scripps Florida Campus. [2008-12-12]. (原始内容存档于2010-11-17).
- ^ Protein sculpture inspired by Vitruvian Man. [2008-12-12]. (原始内容存档于2010-11-17).
- ^ Emil von Behring - Biography. [2007-06-05]. (原始内容存档于2010-11-17).
- ^ AGN. The Late Baron Shibasaburo Kitasato. Canadian Medical Association Journal. 1931, 25 (2): 206. PMC 382621
 .
.
- ^ Winau F, Westphal O, Winau R. Paul Ehrlich--in search of the magic bullet. Microbes Infect. 2004, 6 (8): 786–9. PMID 15207826. doi:10.1016/j.micinf.2004.04.003.
- ^ Silverstein AM. Cellular versus humoral immunology: a century-long dispute. Nat. Immunol. 2003, 4 (5): 425–8. PMID 12719732. doi:10.1038/ni0503-425.
- ^ Van Epps HL. Michael Heidelberger and the demystification of antibodies (PDF). J. Exp. Med. 2006, 203 (1): 5. PMC 2118068
 . PMID 16523537. doi:10.1084/jem.2031fta. (原始内容存档于2010-11-17).
. PMID 16523537. doi:10.1084/jem.2031fta. (原始内容存档于2010-11-17).
- ^ Marrack, JR. Chemistry of antigens and antibodies 2nd. London: His Majesty's Stationery Office. 1938. OCLC 3220539.
- ^ The Linus Pauling Papers: How Antibodies and Enzymes Work. [2007-06-05]. (原始内容存档于2010-11-17).
- ^ Silverstein AM. Labeled antigens and antibodies: the evolution of magic markers and magic bullets (PDF). Nat. Immunol. 2004, 5 (12): 1211–7. PMID 15549122. doi:10.1038/ni1140. (原始内容存档于2009-12-18).
- ^ Edelman GM, Gally JA. The nature of Bence-Jones proteins. Chemical similarities to polypetide chains of myeloma globulins and normal gamma-globulins. J. Exp. Med. 1962, 116 (2): 207–27. PMC 2137388
 . PMID 13889153. doi:10.1084/jem.116.2.207.
. PMID 13889153. doi:10.1084/jem.116.2.207.
- ^ Stevens FJ, Solomon A, Schiffer M. Bence Jones proteins: a powerful tool for the fundamental study of protein chemistry and pathophysiology. Biochemistry. 1991, 30 (28): 6803–5. PMID 2069946. doi:10.1021/bi00242a001.
- ^ 81.0 81.1 Raju TN. The Nobel chronicles. 1972: Gerald M Edelman (b 1929) and Rodney R Porter (1917-85). Lancet. 1999, 354 (9183): 1040. PMID 10501404. doi:10.1016/S0140-6736(05)76658-7.
- ^ Hochman J, Inbar D, Givol D. An active antibody fragment (Fv) composed of the variable portions of heavy and light chains. Biochemistry. 1973, 12 (6): 1130–5. PMID 4569769. doi:10.1021/bi00730a018.
- ^ Tomasi TB. The discovery of secretory IgA and the mucosal immune system. Immunol. Today. 1992, 13 (10): 416–8. PMID 1343085. doi:10.1016/0167-5699(92)90093-M.
- ^ Preud'homme JL, Petit I, Barra A, Morel F, Lecron JC, Lelièvre E. Structural and functional properties of membrane and secreted IgD. Mol. Immunol. 2000, 37 (15): 871–87. PMID 11282392. doi:10.1016/S0161-5890(01)00006-2.
- ^ Johansson SG. The discovery of immunoglobulin E. Allergy and asthma proceedings : the official journal of regional and state allergy societies. 2006, 27 (2 Suppl 1): S3–6. PMID 16722325.
- ^ Hozumi N, Tonegawa S. Evidence for somatic rearrangement of immunoglobulin genes coding for variable and constant regions. Proc. Natl. Acad. Sci. U.S.A. 1976, 73 (10): 3628–32. PMC 431171
 . PMID 824647. doi:10.1073/pnas.73.10.3628.
. PMID 824647. doi:10.1073/pnas.73.10.3628.
外部链接
- 剑桥大学的麦克的免疫球蛋白结构功能网页;
- 在蛋白质资料库中的口腔蛋白质分子资料库中的抗体讨论到抗体的结构;
- 南卡罗莱纳州立大学的微生物及免疫学在线教材;
- 牛津大学的近百年来的抗体治疗方案论述了抗体在用于治疗疾病方面的历史和应用;
- “Cells Alive!”网站的淋巴细胞是如何产生抗体的;
- 伯明翰大学的抗体应用中的荧光抗体图片库
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Template:Link FA Template:Link FA Template:Link GA Template:Link GA
