錫
| 外觀 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
銀白色金屬 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 概況 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 名稱·符號·序數 | 錫(tin)·Sn·50 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 元素類別 | 貧金屬 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 族·週期·區 | 14·5·p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 標準原子質量 | 118.710(7)[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
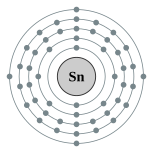
| 電子組態 | [Kr] 4d10 5s2 5p2 2, 8, 18, 18, 4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 歷史 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 發現 | 約西元前3500年 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物理性質 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物態 | 固態 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 | (接近室溫) (白錫) 7.365 g·cm−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 | (接近室溫) (灰錫) 5.769 g·cm−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔點時液體密度 | 6.99 g·cm−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔點 | 505.08 K,231.93 °C,449.47 °F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 沸點 | 2875 K,2602 °C,4716 °F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔化熱 | (白錫) 7.03 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 汽化熱 | (白錫) 296.1 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 比熱容 | (白錫) 27.112 J·mol−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
蒸氣壓
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子性質 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 氧化態 | 4, 3[2], 2, 1[3], -4 (兩性) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電負性 | 1.96(鮑林標度) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電離能 | 第一:708.6 kJ·mol−1 第二:1411.8 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子半徑 | 140 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 共價半徑 | 139±4 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 范德華半徑 | 217 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 雜項 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 晶體結構 | 四方
(白錫) (灰錫) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 磁序 | (灰錫) 抗磁性[4], (白錫) 順磁性 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電阻率 | (0 °C)115 n Ω·m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熱導率 | 66.8 W·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 膨脹係數 | (25 °C)22.0 µm·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 聲速(細棒) | (室溫)(rolled) 2730 m·s−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 楊氏模量 | 50 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 剪切模量 | 18 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 體積模量 | 58 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 泊松比 | 0.36 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 莫氏硬度 | 1.5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 布氏硬度 | ~350 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS號 | 7440-31-5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 同位素 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
主條目:錫的同位素
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
主要特徵[編輯]
物理特性[編輯]

錫是可延展、柔軟、高度結晶狀、銀白色的金屬。當錫棒彎曲時,由於錫晶體是孿晶,可以聽到稱為錫鳴的爆裂聲。[5]
錫在溫度達到3.72K以下時成為超導體。[6]事實上,錫是最早被研究的超導體之一;超導體的特性之一——邁斯納效應,就是首先在錫晶體上發現的。[7]
同素異形體[編輯]

在常壓下錫有2種同素異形體。以灰錫(α錫)、白錫(β錫)的狀態存在。
在室溫,是常見的銀白色金屬白錫,富有延展性。白錫的晶體為正方晶結構,呈金屬性,比重較灰錫重。當溫度回降到低於13.2℃的話,它會慢慢變為粉末狀的灰錫。灰錫的晶體結構是與鑽石、矽和鍺類似的鑽石型晶體結構。灰錫因為其原子間形成了共價結構,電子不能自由轉移,故而沒有任何金屬性。灰錫是暗灰色的粉狀物,除了一些非常特殊的半導體應用,日常用途不大。[5]在低溫下,白錫轉化為灰錫的現象常被稱為錫疫。[註 2]這個現象最早由亞里斯多德發現。未染上「錫疫」的錫板,一旦和有「錫疫」的錫板接觸,也會產生灰色的斑點而逐漸「腐爛」掉。這個過程的轉化溫度會因存在雜質如鋁和鋅而降低。在錫中加入銻或鉍可以防止錫的退化,促進錫的延展性。[9]這是由於鉍原子中有多餘的電子可供錫的結晶點陣,使錫的晶體結構穩定化,完全消除「錫疫」的可能性。
錫的另外兩種同素異形體γ錫和σ錫,只存在於溫度高於161℃ (322℉)和壓力大於幾個GPa的環境中。[10]
化學性質[編輯]
錫受水的鏽蝕的影響很小,但易被酸和鹼腐蝕。錫可以被高度的拋光,可被用作其他金屬的保護層。[5]錫表面會形成保護性的氧化層以防止進一步的氧化。白錫和其他的錫合金表面都會形成這樣的保護層。[11]當氧氣存在於溶液中時,錫會變成一種催化劑,加速化學腐蝕。[5]
在空氣中加熱後錫可以形成SnO2。SnO2是弱酸性的。與熔融鹼反應可以形成錫酸鹽。它可以直接與氯和氧反應。在稀酸中它可以取代氫離子。
- 作為金屬,可氧化至二價錫和較穩定的四價錫。
同位素[編輯]
錫有10種穩定的同位素,是所有化學元素中穩定同位素最多的。此外錫還有61種不穩定同位素。
用途[編輯]
錫很容易與鐵結合,它被用來做鉛、鋅和鋼的防腐層。塗錫的鋼罐多用於貯藏食物,這是金屬錫的一個重要用途。
其它用途:
- 錫是一些重要合金如青銅、巴氏合金等的組成部分。
- 氯化錫在印刷術中被用作一種還原劑和媒染劑。錫鹽噴在玻璃上可以形成導電的塗層。這些塗層被用在防凍玻璃上。
- 一般玻璃板是將熔化的玻璃澆在錫板上形成的,來保證玻璃面的平坦和光滑。
- 焊錫含錫用來連接管道和電子線路,此外錫還被用在多種化學反應中。
- 可鍍於銅和鐵上,鍍錫的鐵片稱為馬口鐵;可防鏽、製作罐頭容器。
- 有機錫可作為有機化合物的合成的試劑,作用包括還原官能團、造成自由基及令有機份子重新排列。
在3.75K的低溫下,錫晶體可成為超導體,也是最早被發現的超導體之一,超導體的一個特別特徵邁斯納效應便是首先在錫晶體中被發現。由於鈮-錫-混合物(Nb3Sn)擁有較高的臨界溫度(18K)和較高的臨界磁場(25特斯拉),它常被用來製作商用超導電磁鐵的導線,一個數千克重的超導電磁鐵可以產生一個數噸重的普通電磁鐵所產生之磁場。
全球年錫用量約為30萬噸,其中約35%用作焊錫,30%用為錫片和30%用為化學原料或顏色。由于越來越多的錫-鉛-焊錫被無鉛焊錫(含95%以上的錫)代替,全球的錫用量每年約提高10%。2003年在倫敦金屬交易所,錫的價格為每噸五千美元左右,2004年的價格達每噸八千到一萬美元。
自1992年起,美國立法禁止包裝產品中使用鉛、汞、鎘及六價鉻這四種有毒金屬。全球著名的紅酒封套生產商拉蒙丁(RAMONDIN)公司便開始使用錫作為以上有毒金屬的替代品,此種錫封套是當今紅酒封套製造業中的領先技術且無法被輕易複製,因此成為保護紅酒品牌及產品的一種有效途徑。
歷史[編輯]
錫是人類知道最早的金屬之一,從古代開始它就是青銅的組成部分之一。早在西元前3000年左右,人們就用錫來硬化銅。約從前7世紀開始人類認識到純的錫。於戰國時期就開始用來作武器的主要材料。
今天有時錫這個詞也被用在沒有錫或只有很少錫的物體上。比如許多「錫紙」實際上是鋁紙。大多數錫罐實際上是鋼罐,上面塗有一層非常薄的錫。
來源[編輯]
全世界約有35個國家產錫。幾乎每個洲都有重要的產錫國。
在地殼中錫比較稀少,只占地殼的百萬分之二,今天的錫礦的產量可能還可以維持約35年[來源請求]。80%錫礦是沉積岩,至少半數的錫來自東南亞(從中國中部經泰國到印度尼西亞)。
最重要的錫礦石是錫石(SnO2),錫礦中的原礦石含約5%的錫,首先礦石要被粉碎和用不同的方式提純,提純後的錫礦含75%的錫。在精煉爐中錫從其礦物中用碳還原出來。精煉爐中的溫度稍高於錫的熔點,而雜質的熔點比這個溫度要高,因此還原的錫可以從爐中流出。少量錫來自它的硫化物如圓柱錫石、硫銀錫礦和硫錫鉛礦等。越來越多的錫是回收來的。
中國的錫產量占全世界的30%,其它東南亞國家一起占30%,南美洲占20%。
生理作用[編輯]
金屬錫即使大量也是無毒的,簡單的錫化合物和錫鹽的毒性相當低,但一些有機錫化物的毒性非常高。尤其錫的三烴基化合物被用作船的漆來殺死附在船身上的微生物和貝殼。這些化合物可以摧毀含硫的蛋白質。
註釋[編輯]
- ^ 全國科學技術名詞審定委員會曾長期建議讀xí
- ^ 這種轉化被稱為錫病或錫疫。錫疫在18世紀的北歐是一個特別的問題,因為管風琴的琴管是由錫合金製成,在漫長的冷冬有時會發生錫疫。有些來源說,在拿破崙的1812年的俄國戰役時,由於溫度太低以至於士兵們的軍服上的錫紐扣都被凍壞,是他們戰敗原因之一。[8]
參考資料[編輯]
- ^ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip J. H.; Gröning, Manfred; Holden, Norman E.; Meijer, Harro A. J. Standard atomic weights of the elements 2021 (IUPAC Technical Report). Pure and Applied Chemistry. 2022-05-04. ISSN 1365-3075. doi:10.1515/pac-2019-0603 (英語).
- ^ SnH3. NIST Chemistry WebBook. National Institure of Standards and Technology. [23 January 2013]. (原始內容存檔於2017-06-30).
- ^ HSn. NIST Chemistry WebBook. National Institute of Standards and Technology. [23 January 2013]. (原始內容存檔於2017-06-30).
- ^ Magnetic susceptibility of the elements and inorganic compounds 網際網路檔案館的存檔,存檔日期2012-01-12., in Lide, D. R. (編), CRC Handbook of Chemistry and Physics 86th, Boca Raton (FL): CRC Press, 2005, ISBN 0-8493-0486-5
- ^ 5.0 5.1 5.2 5.3 Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils;. Tin. Lehrbuch der Anorganischen Chemie 91–100. Walter de Gruyter. 1985: 793–800. ISBN 3-11-007511-3 (德語).
- ^ Dehaas, W; Deboer, J; Vandenberg, G. The electrical resistance of cadmium, thallium and tin at low temperatures. Physica. 1935, 2: 453. Bibcode:1935Phy.....2..453D. doi:10.1016/S0031-8914(35)90114-8.
- ^ Meissner, W.; R. Ochsenfeld. Ein neuer effekt bei eintritt der supraleitfähigkeit. Naturwissenschaften. 1933, 21 (44): 787–788. Bibcode:1933NW.....21..787M. doi:10.1007/BF01504252.
- ^ Le Coureur, Penny; Burreson, Jay. Napoleon's Buttons: 17 Molecules that Changed History. New York: Penguin Group USA. 2004.
- ^ Schwartz, Mel. Tin and Alloys, Properties. Encyclopedia of Materials, Parts and Finishes 2nd. CRC Press. 2002. ISBN 1-56676-661-3.
- ^ Molodets, A. M.; Nabatov, S. S. Thermodynamic Potentials, Diagram of State, and Phase Transitions of Tin on Shock Compression. High Temperature. 2000, 38 (5): 715–721. doi:10.1007/BF02755923.
- ^ Craig, Bruce D; Anderson, David S; International, A.S.M. Handbook of corrosion data. 1995-01: 126 [2013-09-04]. ISBN 978-0-87170-518-1. (原始內容存檔於2021-05-02).
延伸閱讀[編輯]
[在維基數據編輯]
外部連結[編輯]
- 元素錫在洛斯阿拉莫斯國家實驗室的介紹(英文)
- EnvironmentalChemistry.com —— 錫(英文)
- 元素錫在The Periodic Table of Videos(諾丁漢大學)的介紹(英文)
- 元素錫在Peter van der Krogt elements site的介紹(英文)
- WebElements.com – 錫(英文)
| 元素週期表(主族金屬) | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| IA 1 |
IIA 2 |
IIIB 3 |
IVB 4 |
VB 5 |
VIB 6 |
VIIB 7 |
VIIIB 8 |
VIIIB 9 |
VIIIB 10 |
IB 11 |
IIB 12 |
IIIA 13 |
IVA 14 |
VA 15 |
VIA 16 |
VIIA 17 |
VIIIA 18 | ||||||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||||
| |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||