铍
鈹(英語:Beryllium;舊譯鋍、鑉、鋊),是一種化學元素,化學符號为Be,原子序數为4,原子量為9.0121831 u,屬於鹼土金屬。鈹通常在宇宙射线散裂過程中產生,是宇宙中較為稀有的元素之一。所有自然界中的鈹都與其他元素結合,形成礦物,如綠柱石(海藍寶石、祖母綠)和金綠寶石等。單質鈹呈鋼灰色,輕、硬而易碎。
在鋁、銅、鐵和鎳中加入鈹作為合金材料,可以加強其物理性質。[5]用鈹銅合金製成的工具十分堅硬,在敲擊鋼鐵表面時也不會產生火花。由於鈹的抗彎剛度、熱穩定性、熱導率都很高,密度卻很低(只有水的1.85倍),所以適合做航空航天材料,用於導彈、航天器和人造衛星之中。[5]X射線等電離輻射能夠穿透低密度和低原子量的鈹,所以在X光儀器和粒子物理學實驗中都常用鈹作為窗口材料。[5]鈹和氧化鈹可以很好地傳導熱量,因此被用於控制器械的溫度。
在處理鈹的時候,必須使用適當的措施控制粉塵,因為吸入含鈹粉塵會引致可致命的慢性过敏性铍中毒。[6]
物理性質
[编辑]鈹是一種呈鋼灰色的堅硬金屬,在室溫下易碎,晶體呈六方密排結構。[5]其剛性極高(楊氏模量為287GPa),熔點也很高。鈹的彈性模量大約比鋼鐵高50%,又因密度較低,所以它的音速特別高,在標準溫度和壓力下約為12.9 km/s。由於熱容量(1925 J·kg−1·K−1)和熱導率(216 W·m−1·K−1)都很高,因此鈹是每單位重量散熱性最佳的金屬材料。其線性熱膨脹率(11.4×10−6 K−1)較低,在熱負荷條件下有著特殊的穩定性。[7]
核物理性質
[编辑]除微量由宇宙射線所致的放射性同位素以外,天然鈹幾乎完全由核自旋為的鈹-9同位素組成。鈹的高能中子截面較大,對能量高於10keV的中子截面約為6靶恩。因此,它是一種中子反射體和中子減速劑,能使中子熱能降至0.03eV以下。鈹對這些低能中子的截面比高能中子低至少一個數量級,其確切截面值取決於材料雛晶的純度和大小[8]。
9Be同位素還會進行中子能量高於1.9MeV的(n,2n)中子反應,產生,後者立刻又分裂成兩個α粒子。所以對於高能中子來說,鈹是一種中子倍增劑,即它釋放的中子多於吸收的中子。核反應式如下:[9]
- ,其中為粒子,為碳-12原子核。
鈹在氘核和質子的撞擊下也會釋放中子,所以在實驗室中可用鐳、釙和鈈對鈹進行輻射作為中子源。[9]
原子核在吸收低能中子後,會釋放少量的氚。反應共有三步驟:
其中的半衰期只有0.8秒,是電子,的高能中子截面較高。氚是核反應廢料中受關注的放射性同位素之一。[10]
大部份波長的X射線和γ射線都可以穿透鈹金屬,所以鈹可以做X射線管等器材的窗口材料[7]。
同位素與核合成
[编辑]恒星內部會產生鈹的穩定和不穩定同位素,其中不穩定同位素會迅速衰變。宇宙射線會引致星際物質中更重的元素裂變,產生鈹。科學家相信,宇宙中大部份的穩定鈹同位素都是這樣產生的。[11]原始鈹只由這一種穩定同位素組成,所以鈹屬於單一同位素元素[12]。

地球大氣層中的氧受宇宙射線散裂,會產生放射性。[13]在土壤表面積累,並存留一段較長的時間(半衰期為136萬年),再衰變成硼-10。因此及其衰變產物可用於檢測自然水土流失、成土作用和紅土的形成,以及間接測量太陽週期和冰芯的年齡。[14]的生成率與太陽活動成反比,因為太陽活動越高,太陽風就越強,能夠抵達地球的宇宙射線通量也就越低。[13]核爆時,快中子和空氣中二氧化碳的反應,也會形成。利用這一現象,可以推測一個地點是否進行過核試驗。[15]半衰期為53天的同位素也是由宇宙射線產生的,其在大氣中的含量同一樣和太陽黑子數目有關聯[16]。
的半衰期只有約s。這在宇宙學上有重要的意義,因為任何比鈹更重的元素都不可能在大爆炸核聚變中形成:[16]核合成階段沒有足夠的時間把4He原子核融合在一起,的濃度又太低,所以無法形成碳。英國天文學家弗雷德·霍伊爾首次表明,在以氦為燃料的恒星內部,時間充裕,和也有足夠的能量觸發3氦過程來產生碳。恒星所製造的碳和眾多元素一樣,經漸近巨星分支恒星和超新星噴射出來,最終成為地球以及碳生命的組成元素。[17]
鈹原子的內層電子可以參與化學成鍵。當經電子捕獲衰變時,其原子核會拿去內層電子。因此鈹的電子排布能夠影響其衰變率,程度可觀,這在各種核素的核衰變中屬於較為罕見的現象。[18]
會經中子發射衰變,其半衰期為s,是所有已知鈹同位素中最短的。半衰期亦很短,只有s。[19]特殊同位素和原子核帶有核暈,[20]即分別有1個和4個中子在古典費米水滴核模型的外圍較遠處運轉。
化學性質
[编辑]鈹較低的原子半徑和離子半徑決定了它的化學性質。其電離能非常高,與其他原子鍵合時有很強的極化性,所以所有鈹化合物都屬於共價化合物。[5]根据对角线规则,與元素週期表中鄰近的元素相比,鈹的化學性質更接近鋁,因為兩者的電荷半徑之比都很高。[5]鈹的表面會形成氧化層,有效避免進一步被空氣氧化;要加熱至1000 °C以上,鈹才會繼續和空氣發生反應。[5][21]燃燒中的鈹會產生明亮的光芒,並形成氧化鈹和氮化鈹。[21]鈹易溶於如氫氯酸和稀釋硫酸等非氧化酸,但不溶於的硝酸和水。[5]和鋁一樣,鈹在水中會形成氫氧化物保護層,避免進一步反應。[22]鈹也可以溶於鹼溶液中。[5]
鈹原子的電子排布為[He] 2s2。由於有兩個價電子,所以鈹幾乎永遠以+2氧化態形成兩個共價鍵。+1態較罕見,如須在高溫下製備、在低溫下會歧化的一氯化鈹。[22]根據八隅體規則,原子會儘量達到8價狀態,使電子排布接近稀有氣體元素。鈹在形成兩個共價鍵後會有4個價電子,即八隅體的一半,所以鈹的配位數為4。[5]這一配位數使氟化鈹和氯化鈹等鈹化合物能夠形成聚合物。
硫酸鈹和硝酸鈹等鈹鹽溶液呈酸性,因為[Be(H2O)4]2+離子會進行水解反應:
水解的產物還包括三聚體離子。氫氧化鈹()屬於兩性化合物,可溶於強鹼溶液中,但不可溶於中性和酸性溶液中。
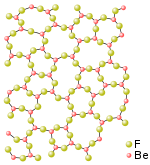
鈹可以和許多非金屬形成二元化合物,包括與氟、氯、溴和碘所形成的無水鹵化物。氟化鈹(BeF2)的結構類似於二氧化矽,形成角與角相接的四面體形。氯化鈹()和溴化鈹()具有鏈條狀結構,形成邊與邊相接的四面體形。氣態下的鹵化鈹形成線形單體分子結構。[21]
氟化鈹()是比較特殊的二氟化物:其共價性質比其他鹼土金屬的氟化物強得多,但仍比其他鹵化鈹更接近離子化合物。它和二氧化矽()有許多相似之處。兩者都形成四面體配位結構,並會玻璃化。氟化鈹的室溫晶體結構和某些高溫結構都和石英相同。與其他鹼土金屬氟化物不同的是,氟化鈹易溶於水。[23]由於氟化鈹具有部份共價鍵性質,所以它在水溶和熔融狀態下的電導率比假設它為完全離子化合物所得數值低得多。[24][25][26][27]
氧化鈹()是一種白色耐火材料,晶體結構和硫化鋅相同,熱導率和某些金屬一樣高,屬於兩性化合物。Be(OH)2經酸處理後,可製備各種鈹鹽。[21]已知鈹鹽包括硫化鈹、硒化物和碲化物,它們都具有立方晶系結構。[22]
氮化鈹()是一種可以輕易水解的高熔點化合物。鈹也可以形成疊氮化鈹()。的結構與相似。鹼式硝酸鈹和鹼式醋酸鈹都具有四面體型結構,每個中心氧離子與四個鈹原子配位。[22]鈹有幾種已知的硼化物,如、、、、和。碳化鈹()是一種磚紅色耐火材料,和水反應後會產生甲烷。[22]鈹沒有已知的矽化物。[21]
分佈
[编辑]

鈹在太陽中的濃度約為十億分之0.1,[28]在地球地殼中的濃度約為百萬分之2至6,[29]其中土壤的鈹濃度最高,約為百萬分之6。鈹在海水中的濃度為萬億分之0.2至0.6,在湖泊中為萬億分之1.1,在泉水等流動水源中則可高達十億分之0.1。地球大氣中也有痕量的鈹。[30]
含有鈹的礦物有上百種,[31]但都並不常見。這些礦物有:羥矽鈹石()、綠柱石()、金綠寶石()、矽鈹石()等等。較珍貴的綠柱石種類包括海藍寶石、紅綠柱石和祖母綠。[7][32][33]綠柱石寶石呈綠色,是因為其中含有少量的鉻。不同品種綠柱石的鉻含量各異,在祖母綠中大約為2%。綠柱石和羥矽鈹石是鈹的主要礦石,分佈於阿根廷、巴西、印度、馬達加斯加及美國。全球鈹礦藏在40萬噸以上。[34]
歷史
[编辑]綠柱石是一種含鈹的礦物,至少從埃及托勒密王朝就開始被人使用。公元1世紀,羅馬博物學家老普林尼在其所著的百科全書《博物志》中提到綠柱石和祖母綠有相似之處。3至4世紀寫成的《斯德哥爾摩紙莎草書》記載了這兩種礦物的人工製造配方。[35]

馬丁·克拉普羅特、托爾貝恩·貝里曼、弗朗茲·卡爾·阿哈爾德和約翰·雅各布·賓特海姆賓德海姆(Johann Jakob Bindheim)最早研究綠柱石和祖母綠時,總是取得相似的元素,所以誤認為礦石都是矽酸鋁組成的。[36]礦物學家勒內·茹斯特·阿羽依發現這兩種晶石有相同的幾何形狀,並請化學家路易-尼古拉·沃克蘭做一次化學分析。[35]
1798年,沃克蘭在一份向法蘭西學會發表的論文中稱,他把綠柱石和祖母綠中的氫氧化鋁溶解於鹼中後,發現了一種新的「土」。[37]由於這種新物質所形成的鹽有甜味,因此《化學與物理年刊》的編輯為它起名為「Glucine」,源於希臘文γλυχυς(甜)、γλυχύ(甜酒)和γλυχαιτω(加入甜味)。[38]之後大約160年,鈹元素都被稱為「Glucinium」或「Glucinum」,符號為Gl[39]或G[40],中文譯作鋊[41]或鑉。然而,當時已經有一種名為Glycine的植物,而且氧化釔也同樣會形成有甜味的鹽,所以克拉普羅特認為更應該以綠柱石(Beryl)為這種物質命名為「Beryllina」。[42][43]弗里德里希·維勒在1828年首次使用元素名稱「Beryllium」。[44]

1828年,弗里德里希·維勒[45]和安托萬·比西[46]使鉀金屬和氯化鈹發生反應,各自獨立分離出鈹元素。
維勒把氯化鈹和鉀交替疊起,並在鉑製坩堝中利用酒精燈進行加熱。以上反應立刻開始進行,坩堝達到白熱溫度。他觀察到,在冷卻和清洗之後所剩餘的灰黑色粉末是由具有金屬光澤的細小粒子組成的。[47]這種利用鉀的製備方法產量較低,無法製成鈹金屬鑄塊。
1898年,保羅·勒博對氟化鈹和氟化鈉的混合熔融物直接進行電解,首次分離出高純度鈹樣本(99.5至99.8%純度)。鈹熔點很高,所以同樣的過程在分離鈹的時候比分離鹼金屬所需能耗更高。20世紀初,一些科學家受鋯分離過程的啟發,試圖對碘化鈹進行熱分解來分離出鈹金屬,但最後發現該方法在大規模生產上的經濟效益太低。[48]阿爾弗雷德·施托克和漢斯·戈爾德施密特於1932年研發出鈹金屬的首個商業化生產過程。[47]他們在氟化鈹中加入鋇,使熔融鈹可以積累在水冷鐵製陰極上。
詹姆斯·查德威克在1932年用α粒子對鈹樣本進行撞擊,從而發現了中子。[34]以此方法為原理的一種放射性同位素中子源,可以每十萬個粒子產生3個中子。[29]
第二次世界大戰期間,鈹的生產隨著鈹銅合金和螢光燈磷光體的需求而大增。大部份早期螢光燈用含不同比例鈹的原矽酸鋅來發出綠光,但在人們發現鈹具有毒性之後,含鈹磷光體就被鹵磷酸鹽磷光體淘汰了。[49]
1957年,純鈹金屬開始有商業規模的生產,但市場需求卻遠比人們想像的低。[34]真空鑄造的鈹金屬塊在2001年於美國的售價為每磅338美元(即每公斤745美元)。[50]1998到2008年間,鈹的全球年產量從343噸降至約200噸,其中176噸(88%)產於美國。[51][52]
製備
[编辑]鈹在高溫下對氧有很強的親和力,在去除表面氧化層後則會對水進行還原反應,因此從化合物中萃取出鈹並不容易。只有美國、中國和哈薩克斯坦有大規模的鈹萃取工業。[53]
鈹一般從綠柱石提取,有用萃取劑燒結或熔化成可溶混合物兩種方法。用燒結法,首先綠柱石在770°C與氟矽酸鈉和鹼混合,形成氟鈹酸鈉和二氧化矽。[5]把氟鈹酸鈉加入氫氧化鈉溶液,使氫氧化鈹沉澱出來。用熔融法,綠柱石須磨碎成粉,並加熱至1650°C。[5]熔融物用水迅速降溫,再在硫酸中重新加熱至250到300°C,主要產生硫酸鈹和硫酸鋁。[5]最後用氨水去除鋁和硫,留下氫氧化鈹。
從氫氧化鈹到鈹金屬也有兩種途徑。用第一種方法,對氫氧化鈹加入水溶氟化氫銨,使四氟鈹酸銨沉澱出來,沉澱物加熱至1000°C後即會形成氟化鈹。[5]氟化鈹在900°C與鎂發生反應,形成鈹細粉,繼續加熱至1300°C之後可得出鈹金屬塊。[5]用另一種方法,對氫氧化鈹加熱產生氧化鈹,再與碳和氯發生反應形成氯化鈹。氯化鈹經電解後即可得出鈹金屬。[5]
應用
[编辑]輻射窗口材料
[编辑]

鈹的原子序和X射線吸收率都很低,所以最早被應用於X射線管的輻射窗口,至今這仍是鈹的一大用途。[34]為避免在X射線影像上產生額外的痕跡,鈹金屬必須純度高且徹底乾淨。鈹對X射線的吸收率極低,不會在同步加速器能量等級的X射線下過分加熱。真空室窗口和同步加速器射束管都完全以鈹作為材料。X射線光譜實驗的樣本固定器一般都以鈹製成,因為鈹所發出的X射線能量(約為100eV)比大部份樣本材料低得多。[7]
高能粒子也能夠輕易穿透鈹金屬,所以鈹適合做粒子物理學實驗中撞擊區周圍的材料,這些實驗包括:大型強子對撞機四個主要實驗(分別為大型離子對撞機實驗、超環面儀器、緊湊緲子線圈、LHCb)、[54]兆電子伏特加速器以及SLAC。鈹的優點有四:密度低,能夠減少撞擊產物在抵達四周的探測器之前的交互作用;剛性高,射束管內可以維持高真空,從而降低各種氣體對實驗的干擾;熱穩定性高,能夠承受絕對零度以上幾度的低溫;具抗磁性,不會干擾用於聚焦和引導粒子束的多極磁系統。[55]
機械
[编辑]鈹金屬剛性高、密度低,在很大的溫度範圍內都可穩定保持形狀,所以在國防及航空航天工業中可做輕質結構部件材料,用於高速飛機、導彈、航天器和衛星等。一些液體火箭發動機噴嘴以純鈹製成。[56][57]科學家曾經考慮用鈹金屬粉末作為火箭燃料,但這一計劃從未付諸實行。[34]一些自行車用鈹造車架,價格極其昂貴。[58]1998年至2000年,邁凱輪一級方程式車隊所用的梅賽德斯-賓士引擎活塞由鈹鋁合金製造,[59]但在法拉利車隊抗議之後,國際汽車聯合會決定禁止使用鈹引擎部件。[60]
在銅裡面加入約2.0%的鈹,可形成比銅金屬強六倍的鈹銅合金。[61]鈹合金彈性高、電導率高、熱導率高、強度高、硬度高、無磁性、抗腐蝕性強、抗疲勞性強,因此用途很廣,[34][5]例如在可燃氣體附近使用的無火花工具(鈹鎳)、彈簧及外科器材和高溫儀器中的薄膜(鈹鎳和鈹鐵)等。[34][5]在液態鎂當中只須加入十萬分之5的鈹,就會顯著加強抗氧化性及降低易燃性。[5]

鈹的彈性剛度高,在精密儀器方面有廣泛的應用,例如慣性導航系統和光學系統中的支撐部分。[7]鈹銅合金被用於剝除船體油漆的工具中。[62]
由於硬度高、熔點高、散熱性強,所以鈹曾被用在軍用飛機的制動器中。因環保原因,鈹已被其他材料替代。[7]
鏡面
[编辑]鈹密度低,並可長期不變形,可以用作氣象衛星的大面積蜂巢狀鏡子材料。小型鈹鏡子則可用於光學導向系統和火控系統,例如德國的豹1型坦克和 豹2型坦克。這些系統須要快速運動,所以鏡面必須輕,但剛度必須高。鈹鏡面通常塗上無電解鎳鍍層,在拋光後的光學精度能比直接用鈹更高。不過,在須低溫作業的應用上,鈹鏡面會直接拋光,因為鍍鎳後所造成的冷熱收縮率不均會使鏡面彎曲。[7]
詹姆斯·韋伯太空望遠鏡[63]將由18塊六邊形鈹鏡子組成。由於望遠鏡的作業溫度為33 K,鏡子須由比玻璃更能承受極低溫度的鍍金鈹金屬製成。[64]同理,史匹哲太空望遠鏡也帶有鈹金屬鏡子。[65]
磁應用
[编辑]
鈹基材料不受磁鐵吸引,所以適合用來處理一般使用磁力引線的水雷。[66]Beryllium tools [可疑]核磁共振成像儀會產生巨大的磁場,其結構材料也常會使用鈹。[67]在無線電和雷達方面,鈹製工具可用於調節磁力極強的速調管、磁控管、行波管等產生強微波的發送器組件。[68]
核應用
[编辑]
一些核武器設計方案用鈹製薄板或薄片來做氫彈第一級鈈核的最外層材料,用於包裹裂變物質,有助鈈-239內爆和中子反射。[69]
當在實驗室中需要少量中子時,可把鈹用作中子源,無須用到核反應爐或粒子加速器。要產生中子,須對鈹目標體進行高能α粒子的撞擊,α粒子源可以是釙-210、鐳-226、鈈-239、鋂-241等放射性同位素。α粒子與鈹原子核反應之後,鈹會嬗變成碳-12,並發射一顆中子。中子的方向接近於原先α粒子的前進方向。這種以α衰變驅動的鈹中子源稱為海膽型中子引發劑,曾用於早期核武器中。[69]鈹在γ衰變同位素的γ射線照射下也可以作為實驗室中子源。[70]
在加拿大重水鈾反應堆(CANDU)中,鈹被用於製造燃料。每根燃料棒束都有經感應釬焊法釬焊到燃料包層上的小附體,所用的釬料就是鈹。軸瓦可避免燃料棒束和壓力管之間接觸,而內部元件間隔墊則避免元件之間接觸。
歐洲聯合環形加速器和國際熱核聚變實驗反應堆都有使用鈹。[71]有科學家提出利用鈹的力學、化學和核性質製造核燃料棒的包殼。[7]氟化鈹是共晶鹽混合物氟鋰鈹()的成分之一。不少假想的熔鹽堆設計都利用氟鋰鈹作為溶劑、中子減速劑和冷卻劑。[72]
聲學
[编辑]鈹質量低、剛度高,因此適合做高頻揚聲器驅動器材料。但由於鈹價格昂貴(比鈦高幾倍),塑性時易碎,且具有毒性,所以一般只有高端家居、專業音響和公共廣播才會使用含鈹的高音揚聲器。[73][74][75][76][77]一些廠商甚至會將不含鈹的揚聲器稱為「鈹揚聲器」。[78]
電子應用
[编辑]鈹屬於3-5族化合物半導體的P型摻雜物,常用於以分子束磊晶法長成的材料之中,如砷化鎵、砷化鋁鎵和砷化銦鉀等。[79]在表面安裝技術上,橫軋鈹金屬片可以為印刷電路板提供極佳的結構支撐。除此之外,鈹還可以用來製造散熱片。其熱膨脹率須要與礬土和聚酰亞胺玻璃基底相匹配。鈹-氧化鈹金屬基複合材料(E-材料)可用於這些電子應用上,且可以針對各種基底材料來調節其熱膨脹率。[7]
氧化鈹是一種熱導率、強度、硬度和熔點都很高的電絕緣體,常被用於無線電發送器的大功率晶體管之中。科學家正在嘗試用氧化鈹來提高氧化鈾核燃料球的熱導率。[80]熒光燈管曾含有鈹化合物,但這一應用在燈廠工人開始患上铍中毒之後陸續被終止。[81]
安全
[编辑]人體內有大約35毫克的鈹,不足以造成傷害。鈹的化學性質和鎂相似,所以會在酶中取代鎂,破壞酶的功能。若在短時間內吸入大量或長期吸入少量的鈹粉塵,都會引致肺部和循環系統肉芽腫病,是為鈹中毒。鈹中毒的症狀可能在五年以後才開始出現,對三分之一病人致死,對其餘則致殘。[82]國際癌症研究機構(IARC)將鈹和鈹化合物列為1類致癌物。[83]美國職業安全與健康管理局(OSHA)為鈹設下了暴露限值為:時間加權平均值每30分鐘0.002mg/m3,峰值0.025mg/m3。美國國家職業安全衛生研究所(NIOSH)所建議的暴露限值為0.0005mg/m3。鈹的立即威脅生命健康值(IDLH)為4mg/m3。[84]
歐洲和美國分別在1933年和1943年開始有鈹中毒所造成的化學性肺炎記錄。調查指出,在1949年美國有5%的熒光燈廠工人患有鈹相關的肺病。[85]慢性鈹中毒在很多方面都和結節病相似,鑒別診斷較為困難。一些參與核武器研發的早期工人也因此病逝,如曼哈頓計劃成員赫伯特·安德森。[86]
煤渣可以做研磨劑,用於磨去堅硬表面上的油漆和鐵銹。但煤渣含有鈹,所以鈹會在研磨過程中瀰漫在空氣之中,有吸入攝取的危險。[87]
科學家在早期須辨嘗各種化合物,用味覺判斷鈹的存在,但這種危險性極高的做法已被現代儀器完全淘汰。[5]吸入過多的含鈹飛塵會提高罹患肺癌的可能性,所以鈹和鈹化合物都須要小心處理,特別須避免產生飛塵。雖然鈹化合物自1949年已不再用於熒光燈管中,但在今天仍有一些可能攝取鈹的行業,包括:核工業、航空航天工業、鈹金屬的提煉與鈹合金產業、電子產品產業等等。[88]
國際上已對在空氣中和各種表面上的鈹含量測量法標準達成共識(標準ASTM D7202)。方法先用稀釋氟化氫銨進行溶解,再與硫化羥基苯奎寧結合,最後用熒光檢測法檢測鈹的含量(含量越高則熒光亮度越高)。此方法的靈敏度為工作場所鈹含量建議值的100倍,可在各種表面上探測微量的耐火氧化鈹和矽質鈹(標準ASTM D7458)。[89][90]
注釋
[编辑]- ^ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip J. H.; Gröning, Manfred; Holden, Norman E.; Meijer, Harro A. J. Standard atomic weights of the elements 2021 (IUPAC Technical Report). Pure and Applied Chemistry. 2022-05-04. ISSN 1365-3075. doi:10.1515/pac-2019-0603 (英语).
- ^ Beryllium: Beryllium(I) Hydride compound data (PDF). bernath.uwaterloo.ca. [2007-12-10]. (原始内容 (PDF)存档于2007-12-02).
- ^ 存档副本. [2016-02-26]. (原始内容存档于2016-02-19).
- ^ Haynes, William M. CRC handbook of chemistry and physics: a ready-reference book of chemical and physical data 92nd. Boca Raton, FL.: CRC Press. 2011: 14.48. ISBN 978-1-4398-5511-9. OCLC 730008390 (英语).
- ^ 5.00 5.01 5.02 5.03 5.04 5.05 5.06 5.07 5.08 5.09 5.10 5.11 5.12 5.13 5.14 5.15 5.16 5.17 5.18 5.19 Jakubke, Hans-Dieter; Jeschkeit, Hans (编). Concise Encyclopedia Chemistry. trans. rev. Eagleson, Mary. Berlin: Walter de Gruyter. 1994.
- ^ Puchta, Ralph. A brighter beryllium. Nature Chemistry. 2011, 3 (5): 416. Bibcode:2011NatCh...3..416P. PMID 21505503. doi:10.1038/nchem.1033.
- ^ 7.00 7.01 7.02 7.03 7.04 7.05 7.06 7.07 7.08 7.09 Behrens, V. 11 Beryllium. Beiss, P. (编). Landolt-Börnstein – Group VIII Advanced Materials and Technologies: Powder Metallurgy Data. Refractory, Hard and Intermetallic Materials 2A1. Berlin: Springer. 2003: 1–11. ISBN 978-3-540-42942-5. doi:10.1007/10689123_36.
- ^ 井上和彦、坂本幸夫. ベリリウムフィルターの散乱冷中性子による透過スペクトル歪 (PDF). 北海道大學工學部研究報告 (北海道大学): 57–61頁。. [2017-10-14]. (原始内容存档 (PDF)于2016-03-05).
- ^ 9.0 9.1 Hausner, Henry H. Nuclear Properties. Beryllium its Metallurgy and Properties. University of California Press. 1965: 239.
- ^ Tomberlin, T. A. Beryllium – A Unique Material In Nuclear Applications (PDF). Idaho National Laboratory. Idaho National Engineering and Environmental Laboratory. [2004-11-15]. (原始内容 (PDF)存档于2015-12-22).
- ^ Ekspong, G. Physics: 1981–1990. World Scientific. 1992: 172 ff. ISBN 978-981-02-0729-8.
- ^ Brian, Monica (2010) p. 58
- ^ 13.0 13.1 Emsley 2001,第56頁.
- ^ Beryllium: Isotopes and Hydrology. University of Arizona, Tucson. [2011-04-10]. (原始内容存档于2013-05-26).
- ^ Whitehead, N; Endo, S; Tanaka, K; Takatsuji, T; Hoshi, M; Fukutani, S; Ditchburn, Rg; Zondervan, A. A preliminary study on the use of (10)Be in forensic radioecology of nuclear explosion sites. Journal of environmental radioactivity. Feb 2008, 99 (2): 260–70. PMID 17904707. doi:10.1016/j.jenvrad.2007.07.016.
- ^ 16.0 16.1 Boyd, R. N.; Kajino, T. Can Be-9 provide a test of cosmological theories?. The Astrophysical Journal. 1989, 336: L55. Bibcode:1989ApJ...336L..55B. doi:10.1086/185360.
- ^ Arnett, David. Supernovae and nucleosynthesis. Princeton University Press. 1996: 223. ISBN 0-691-01147-8.
- ^ Johnson, Bill. How to Change Nuclear Decay Rates. University of California, Riverside. 1993 [2008-03-30]. (原始内容存档于2013-06-23).
- ^ Hammond, C. R. "Elements" in Lide, D. R. (编), CRC Handbook of Chemistry and Physics 86th, Boca Raton (FL): CRC Press, 2005, ISBN 0-8493-0486-5
- ^ Hansen, P. G.; Jensen, A. S.; Jonson, B. Nuclear Halos. Annual Review of Nuclear and Particle Science. 1995, 45: 591. Bibcode:1995ARNPS..45..591H. doi:10.1146/annurev.ns.45.120195.003111.
- ^ 21.0 21.1 21.2 21.3 21.4 Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4.
- ^ 22.0 22.1 22.2 22.3 22.4 Wiberg, Egon; Holleman, Arnold Frederick. Inorganic Chemistry. Elsevier. 2001. ISBN 0-12-352651-5.
- ^ Storer, Frank Humphreys. First Outlines of a Dictionary of Solubilities of Chemical Substances. Cambridge. 1864: 278–80. ISBN 978-1-176-62256-2.
- ^ Bell, N. A. Beryllium halide and pseudohalides. Emeléus, Harry Julius; Sharpe, A. G. (编). Advances in inorganic chemistry and radiochemistry 14. New York: Academic Press. 1972: 256–277. ISBN 978-0-12-023614-5.
- ^ Walsh, Kenneth A. Beryllium chemistry and processing. ASM International. 2009-08-01: 99–102, 118–119. ISBN 978-0-87170-721-5.
- ^ Mackay, Mackay & Henderson 2002,第243–244頁.
- ^ Hertz, Raymond K. General analytical chemistry of beryllium. Coyle, Francis T. (编). Chemical analysis of metals: a symposium. ASTM. 1987: 74–75. ISBN 978-0-8031-0942-1.
- ^ Abundance in the sun. Mark Winter, The University of Sheffield and WebElements Ltd, UK. WebElements. [2011-08-06]. (原始内容存档于2011-08-27).
- ^ 29.0 29.1 Merck contributors. O'Neil, Marydale J.; Heckelman, Patricia E.; Roman, Cherie B. , 编. The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals 14th. Whitehouse Station, NJ, USA: Merck Research Laboratories, Merck & Co., Inc. 2006. ISBN 0-911910-00-X.
- ^ Toxicological Profile for Beryllium (PDF) (报告). U.S. Department of Health and Human Services. 2002 [2016-02-26]. (原始内容存档 (PDF)于2016-05-10).
- ^ Mindat search on Be. [2016-02-26]. (原始内容存档于2016-03-04).
- ^ Walsh, Kenneth A. Sources of Beryllium. Beryllium chemistry and processing. 2009: 20–26 [2016-02-26]. ISBN 978-0-87170-721-5. (原始内容存档于2016-05-13).
- ^ Mining, Society for Metallurgy, Exploration (U.S). Distribution of major deposits. Industrial minerals & rocks: commodities, markets, and uses. 2006-03-05: 265–269 [2016-02-26]. ISBN 978-0-87335-233-8. (原始内容存档于2016-05-04).
- ^ 34.0 34.1 34.2 34.3 34.4 34.5 34.6 Emsley 2001,第58頁.
- ^ 35.0 35.1 Weeks 1968,第535頁.
- ^ Weeks 1968,第537頁.
- ^ Vauquelin, Louis-Nicolas. De l'Aiguemarine, ou Béril; et découverie d'une terre nouvelle dans cette pierre [Aquamarine or beryl; and discovery of a new earth in this stone]. Annales de Chimie. 1798, 26: 155–169 [2016-02-26]. (原始内容存档于2016-04-27).
- ^ 請見第169頁 (页面存档备份,存于互联网档案馆)的法文腳註。
- ^ Black, The Macmillan Company, New York, 1937
- ^ John Newlands' table of octaves
- ^ 鋊. 台灣教育部. [2016-01-20]. (原始内容存档于2016-03-07).
- ^ Klaproth, Martin Heinrich, Beitrage zur Chemischen Kenntniss der Mineralkörper, vol. 3, (Berlin: Heinrich August Rottmann, 1802), pages 78-79 (页面存档备份,存于互联网档案馆)
- ^ Weeks 1968,第538頁.
- ^ Wöhler, F. Ueber das Beryllium und Yttrium [On beryllium and yttrium]. Annalen der Physik und Chemie. 1828, 13 (89): 577–582 [2016-02-26]. (原始内容存档于2016-04-26).
- ^ Wöhler, Friedrich. Ueber das Beryllium und Yttrium. Annalen der Physik und Chemie. 1828, 89 (8): 577–582 [2016-02-26]. Bibcode:1828AnP....89..577W. doi:10.1002/andp.18280890805. (原始内容存档于2016-05-27).
- ^ Bussy, Antoine. D'une travail qu'il a entrepris sur le glucinium. Journal de Chimie Medicale. 1828, (4): 456–457 [2016-02-26]. (原始内容存档于2016-05-22).
- ^ 47.0 47.1 Weeks 1968,第539頁.
- ^ Babu, R. S.; Gupta, C. K. Beryllium Extraction – A Review. Mineral Processing and Extractive Metallurgy Review. 1988, 4: 39. doi:10.1080/08827508808952633.
- ^ Kane, Raymond; Sell, Heinz. A Review of Early Inorganic Phosphors. Revolution in lamps: a chronicle of 50 years of progress. 2001: 98 [2016-02-26]. ISBN 978-0-88173-378-5. (原始内容存档于2016-05-07).
- ^ Beryllium Statistics and Information. United States Geological Survey. [2008-09-18]. (原始内容存档于2008-09-16).
- ^ Commodity Summary 2000: Beryllium (PDF). United States Geological Survey. [2010-05-16]. (原始内容存档 (PDF)于2010-06-01).
- ^ Commodity Summary 2000: Beryllium (PDF). United States Geological Survey. [2010-05-16]. (原始内容存档 (PDF)于2010-07-16).
- ^ Sources of Beryllium. Materion Brush Inc. [2011-08-06]. (原始内容存档于2014-10-25).
- ^ Veness, R.; Ramos, D.; Lepeule, P.; Rossi, A.; Schneider, G.; Blanchard, S. Installation and commissioning of vacuum systems for the LHC particle detectors (PDF). CERN. [2016-02-26]. (原始内容 (PDF)存档于2011-11-14).
- ^ Wieman, H; Bieser, F.; Kleinfelder, S.; Matis, H.S.; Nevski, P.; Rai, G.; Smirnov, N. A new inner vertex detector for STAR. Nuclear Instruments and Methods in Physics Research Section a Accelerators Spectrometers Detectors and Associated Equipment. 2001, 473: 205. Bibcode:2001NIMPA.473..205W. doi:10.1016/S0168-9002(01)01149-4.
- ^ Davis, Joseph R. Beryllium. Metals handbook. ASM International. 1998: 690–691. ISBN 978-0-87170-654-6.
- ^ Schwartz, Mel M. Encyclopedia of materials, parts, and finishes. CRC Press. 2002: 62. ISBN 1-56676-661-3.
- ^ Museum of Mountain Bike Art & Technology: American Bicycle Manufacturing. (原始内容存档于2011-07-20).
- ^ Ward, Wayne. Aluminium-Beryllium. Ret-Monitor. [2012-07-18]. (原始内容存档于2010-08-01).
- ^ Collantine, Keith. Banned! – Beryllium. [2012-07-18]. (原始内容存档于2012-07-21).
- ^ McGraw-Hill contributors. Geller, Elizabeth , 编. Concise Encyclopedia of Chemistry. New York City: McGraw-Hill. 2004. ISBN 0-07-143953-6.
- ^ Defence forces face rare toxic metal exposure risk. The Sydney Morning Herald. 2005-02-01 [2009-08-08]. (原始内容存档于2007-12-30).
- ^ Beryllium related details from NASA. NASA. [2008-09-18]. (原始内容存档于2008-05-29).
- ^ Gardner, Jonathan P. The James Webb Space Telescope (PDF). Proceedings of Science. 2007: 5 [2016-02-26]. Bibcode:2007mru..confE...5G. (原始内容 (PDF)存档于2016-03-03).
- ^ Werner, M. W.; Roellig, T. L.; Low, F. J.; Rieke, G. H.; Rieke, M.; Hoffmann, W. F.; Young, E.; Houck, J. R.; et al. The Spitzer Space Telescope Mission. Astrophysical Journal Supplement. 2004, 154: 1. Bibcode:2004ApJS..154....1W. arXiv:astro-ph/0406223
 . doi:10.1086/422992.
. doi:10.1086/422992.
- ^ Kojola, Kenneth; Lurie, William. The selection of low-magnetic alloys for EOD tools. Naval Weapons Plant Washington DC. 1961-08-09 [2016-02-26]. (原始内容存档于2011-08-23).
- ^ Dorsch, Jerry A. & Dorsch, Susan E. Understanding anesthesia equipment. Lippincott Williams & Wilkins. 2007: 891. ISBN 0-7817-7603-1.
- ^ Ropp, Richard C. Encyclopedia of the Alkaline Earth Compounds. 2012-12-31: 7 [2016-02-26]. ISBN 9780444595539. (原始内容存档于2016-05-11).
- ^ 69.0 69.1 Barnaby, Frank. How nuclear weapons spread. Routledge. 1993: 35. ISBN 0-415-07674-9.
- ^ Byrne, J. Neutrons, Nuclei, and Matter, Dover Publications, Mineola, NY, 2011, ISBN 0486482383, pp. 32–33.
- ^ Clark, R. E. H.; Reiter, D. Nuclear fusion research. Springer. 2005: 15. ISBN 3-540-23038-6.
- ^ Petti, D; Smolik, G; Simpson, M; Sharpe, J; Anderl, R; Fukada, S; Hatano, Y; Hara, M; et al. JUPITER-II molten salt Flibe research: An update on tritium, mobilization and redox chemistry experiments. Fusion Engineering and Design. 2006, 81 (8–14): 1439. doi:10.1016/j.fusengdes.2005.08.101.
- ^ Scan Speak offers Be tweeters to OEMs and Do-It-Yourselfers (PDF). Scan Speak. [2010-05-01]. (原始内容 (PDF)存档于2014-05-25).
- ^ Johnson, Jr., John E. Usher Be-718 Bookshelf Speakers with Beryllium Tweeters. 2007-11-12 [2008-09-18]. (原始内容存档于2011-06-13).
- ^ Exposé E8B studio monitor. KRK Systems. [2009-02-12]. (原始内容存档于2011-04-10).
- ^ Beryllium use in pro audio Focal speakers. [2010-07-10]. (原始内容存档于2012-12-31).
- ^ VUE Audio announces use of Be in Pro Audio loudspeakers. [2012-05-21]. (原始内容存档于2012-05-10).
- ^ Svilar, Mark. Analysis of "Beryllium" Speaker Dome and Cone Obtained from China. 2004-01-08 [2009-02-13]. (原始内容存档于2013-05-17).
- ^ Diehl, Roland. High-power diode lasers. Springer. 2000: 104. ISBN 3-540-66693-1.
- ^ Purdue engineers create safer, more efficient nuclear fuel, model its performance. Purdue University. 2005-09-27 [2008-09-18]. (原始内容存档于2012-05-27).
- ^ Breslin AJ. Chap. 3. Exposures and Patterns of Disease in the Beryllium Industry. Stokinger, HE (编). in Beryllium: Its Industrial Hygiene Aspects. Academic Press, New York. 1966: 30–33.
- ^ Emsley 2001,第57頁.
- ^ IARC Monograph. International Agency for Research on Cancer. 1993 [2008-09-18]. (原始内容存档于2012-07-31).
|volume=被忽略 (帮助) - ^ NIOSH Pocket Guide to Chemical Hazards. #0054. NIOSH.
- ^ Emsley 2001,第5頁.
- ^ Photograph of Chicago Pile One Scientists 1946. Office of Public Affairs, Argonne National Laboratory. 2006-06-19 [2008-09-18]. (原始内容存档于2008-12-11).
- ^ Newport News Shipbuilding Workers Face a Hidden Toxin (页面存档备份,存于互联网档案馆), Daily Press (Virginia), Michael Welles Shapiro, 31 August 2013
- ^ International Programme On Chemical Safety. Beryllium: ENVIRONMENTAL HEALTH CRITERIA 106. World Health Organization. 1990 [2011-04-10]. (原始内容存档于2011-06-09).
- ^ ASTM D7458 –08. American Society for Testing and Materials. [2009-08-08]. (原始内容存档于2010-07-12).
- ^ Minogue, EM; Ehler, DS; Burrell, AK; McCleskey, TM; Taylor, TP. Development of a New Fluorescence Method for the Detection of Beryllium on Surfaces. Journal of ASTM International. 2005, 2 (9): 13168. doi:10.1520/JAI13168.
參考資料
[编辑]- Emsley, John. Nature's Building Blocks: An A–Z Guide to the Elements. Oxford, England, UK: Oxford University Press. 2001. ISBN 0-19-850340-7.
- Mackay, Kenneth Malcolm; Mackay, Rosemary Ann; Henderson, W. Introduction to modern inorganic chemistry 6th. CRC Press. 2002. ISBN 0-7487-6420-8.
- Weeks, Mary Elvira; Leichester, Henry M. Discovery of the Elements. Easton, PA: Journal of Chemical Education. 1968. LCCCN 68-15217.
延伸閱讀
[编辑]- Newman LS. Beryllium. Chemical & Engineering News. 2003, 36 (36): 38. doi:10.1021/cen-v081n036.p038.
- Mroz MM, Balkissoon R, Newman LS. "Beryllium". In: Bingham E, Cohrssen B, Powell C (eds.) Patty's Toxicology, Fifth Edition. New York: John Wiley & Sons 2001, 177–220.
- Walsh, KA, Beryllium Chemistry and Processing (页面存档备份,存于互联网档案馆). Vidal, EE. et al. Eds. 2009, Materials Park, OH:ASM International.
- Beryllium Lymphocyte Proliferation Testing (BeLPT). DOE Specification 1142–2001. Washington, DC: U.S. Department of Energy, 2001.
外部連結
[编辑]- 元素铍在洛斯阿拉莫斯国家实验室的介紹(英文)
- EnvironmentalChemistry.com —— 铍(英文)
- 元素铍在The Periodic Table of Videos(諾丁漢大學)的介紹(英文)
- 元素铍在Peter van der Krogt elements site的介紹(英文)
- WebElements.com – 铍(英文)
- (英文)ATSDR環境醫學案例分析:鈹的毒性 (页面存档备份,存于互联网档案馆)(美國衛生及公共服務部)
- (英文)Beryllium (页面存档备份,存于互联网档案馆) at The Periodic Table of Videos(諾丁漢大學)
- (英文)美國國家職業安全衛生研究所:鈹 (页面存档备份,存于互联网档案馆)
- (英文)美國鈹價格趨勢圖 (页面存档备份,存于互联网档案馆)
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||
|































![{\displaystyle {\ce {[Be(H2O)4]^2+ + H2O <=> [Be(H2O)3(OH)]+ + H3O+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/91239668ef12f5e4a1e674adb4feeec12af01a5e)
![{\displaystyle {\ce {[Be3(OH)3(H2O)6]^3+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0019d6427cddd5d6e4da6bfe403163ced86dc2ec)






















