烯烴


最簡單的烯烴是乙烯(C2H4),國際純化學和應用化學聯合會命名為ethene。乙烯是工業上生產規模最大的有機化合物[5]。
「烯」字是新造字,左邊的火取自「碳」字,代表可以燃燒;右邊的希取自「稀」字,表示氫原子和化合價稀少之意,意味著烯是烷(完整)烴的一類不飽和衍生物。
乙烯的結構
[編輯]乙烯的形狀
[編輯]根據價層電子對互斥理論,乙烯中每一個雙鍵碳原子的鍵角都約是120°。這個角度會受連接在雙鍵碳原子上的官能基的交互作用產生的范德瓦耳斯力(凡得瓦力)影響。比如,C-C-C 鍵角在丙烯中為123.9°。烯烴的碳-碳雙鍵鍵能比單鍵高,133pm的鍵長也比單個共價鍵短。
分子的幾何型態
[編輯]如同單個共價鍵,雙鍵也能被描述為原子軌道的重疊。與單鍵不同的是,單鍵只包含一個σ鍵,而碳-碳雙鍵包含了一個σ鍵和一個π鍵。
每一個雙鍵碳原子利用它本身的三個sp2混成軌域與三個原子形成σ鍵,那一個未混成的"2p"軌域,垂直於由三個sp2混成軌域形成的平面,重疊形成π鍵。


因為需要很多的能量才能破壞π鍵(對於乙烯是264 千焦/莫爾),所以碳-碳雙鍵間的轉動很困難並嚴重受限。結果是取代烯烴存在一個或兩個異構物(順式異構和反式異構)。例如順-2-丁烯中的兩個甲基取代在雙鍵的同一側,而反-2-丁烯的在不同的側面。
雙鍵不可能被扭曲。事實上,一個90°的扭曲需要的能量約等於鍵鍵能的一半。p軌道之間的偏差與預期的要小,因為形成了三角形平面。反-環辛烯是不穩定的,軌道誤差僅僅是19°,二面角137°(正常應該是120°),並且還有18°錐形化。這解釋了為什麼這個化合物有0.8 D的偶極矩(順式為0.4 D,預期均應該為零)。反式環庚烷只能在低溫下穩定存在。
物理性質
[編輯]烯烴的物理性質可以與烷烴對比。物理狀態決定於分子質量。簡單的烯烴中,乙烯、丙烯和丁烯是氣體(C2~C4烯烴為氣體),含有五至十八個碳原子的直鏈烯烴是液體(C5~C18為易揮發液體),更高級的烯烴則是蠟狀固體(C19以上固體)。在正構烯烴中,隨著相對分子質量的增加,沸點升高。同碳數正構烯烴的沸點比帶支鏈的烯烴沸點高。相同碳架的烯烴,雙鍵由鏈端移向鏈中間,熔點、沸點都有所增加。烯烴為非極性化合物,其唯一的分子間作用力為分散力,因此烯烴不溶於水,但可溶於四氯化碳等有機溶劑。液體烯類之密度小於水,會浮在水面上。反式烯烴比順式烯烴的沸點低,而熔點高,這是因反式異構物極性小,對稱性好。與相應的烷烴相比,烯的沸點、折射率,水中溶解度,相對密度等都比烷的略小些。其密度比水小。
化學性質
[編輯]烯烴的化學性質比較穩定,但比烷烴活潑。與乙烯相似,可使KMnO₄酸性溶液褪色,考慮到烯烴中的碳-碳雙鍵比烷烴中的碳-碳單鍵強,所以大部分烯烴的反應都有雙鍵的斷開並形成兩個新的單鍵。
合成
[編輯]- CH3CH2OH + H2SO4 → CH3CH2OSO3H + H2O → H2C=CH2 + H2SO4
- 其他醇的消去反應都是Chugaev消去反應和Grieco消去反應,產生烯烴。
- 高級α-烯烴的催化合成可以由乙烯和有機金屬化合物三乙烯基鋁在鎳,鈷和鉑催化的情況下實現。
- 烯烴可以由羰基化合物通過一系列反應合成,比如乙醛和酮。
- 和一個烷基鹵化物發生Wittig反應
- 和一個苯基碸發生Julia成烯反應
- 和兩個不同的酮發生Barton-Kellogg反應
- 結合一個酮,Bamford-Stevens反應或者Shapiro反應
- 烯烴可以由乙烯基鹵化物結合生成。
- 烯烴可以由炔烴的選擇性還原合成。
- 烯烴可以由Diels-Alder反應或Ene反應重排製得。
- 烯烴可以由α-氯代碸通過Ramberg-Bäcklund反應合成。
反應
[編輯]烯烴因為可以廣泛參與石化工業的反應,被譽為石化工業的原材料。
加成反應
[編輯]烯烴能進行很多種加成反應:
親電加成
[編輯]大部分的烯烴加成反應是依照親電加成機理完成的。一個例子就是Prins反應,其中羰基是親電試劑。
- RCH=CH2 + HX → RCHX-CH3
- RCH=CH2 + H2O → RCHOH-CH3
- 與鹵素X2反式加成:
- RCH=CH2 + X2 → RCHX-CH2X
- 與次鹵酸HOX加成:
- RCH=CH2 + X-OH → RCHOH-CH2X
與氫加成
[編輯]烯烴經催化氫化可得到相應的烷烴。這種反應需要在高壓環境下由金屬催化劑參與進行。一般工業催化劑包含了鎳、鈀和鉑。實驗室合成中,Raney鎳是常用催化劑。一個例子就是乙烯催化加氫得到乙烷:
- CH2=CH2 + H2 → CH3-CH3
與水加成
[編輯]烯烴在酸(常用硫酸或磷酸)的催化作用下,與水直接加成生成醇。酸催化下,烯烴的直接水合是親電加成反應。反應的第一步是酸中的質子加到雙鍵碳原子上,生成碳正離子中間體,這一步是控制反應速率的慢步驟。然後水分子與碳正離子反應,生成質子化的醇。最後質子化的醇失去質子生成醇。不對稱烯烴與水的加成也遵循馬可尼可夫法則。例如:
- CH2=CH2 + HOH → CH3-CH2-OH (H3PO4,280-300℃,7-8MPa)
- CH3-CH=CH2 + HOH → CH3CHOHCH3 (H3PO4,195℃,2MPa)
上述反應工業上生產乙醇和異丙醇等低級醇的一種方法,稱為「直接水合法」。除乙烯外,其他烯烴均不生成一級醇。
與鹵素加成
[編輯]烯烴與溴或者氯的加成得到鄰二溴或二氯烷烴。氟,因為反應太劇烈,過程中放出大量的熱,容易使烯烴分解,所以反應需在特定條件下進行。氯,溴,容易發生加成反應,但是一般具有很強的立體選擇性,生成反式產物。碘,活潑性太低,通常不能直接反應。溴水的褪色可以作為檢驗乙烯的測試:
- CH2=CH2 + Br2 → BrCH2-CH2Br
- 以下是此反應機理:
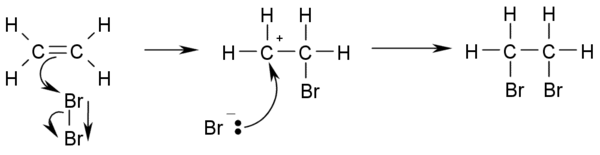
- 此反應之所以能夠發生,是因為雙鍵的高電子雲密度導致了溴-溴間電子的臨時移動產生一個臨時的偶極,最終導致靠近雙鍵的溴略顯正電性變為親電試劑。
- CH3-CH=CH2 + HBr → CH3-CHBr-CH3
- 如果兩個雙鍵碳原子連接的氫原子數量不等,鹵素將優先加成在擁有氫較少的碳上(Markovnikov's規則)
- 以下是反應機理:
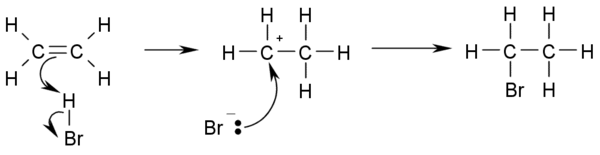
與次鹵酸加成
[編輯]烯烴與次鹵酸(常用次氯酸或次溴酸)加成生成β-鹵代醇。例如:
- CH2=CH2 + HOCl → CH2ClCH2OH
在實際生產中,由於次氯酸不穩定,常用氯和水直接反應。例如,將乙烯和氯氣直接通入水中以生產β-氯乙醇。這時反應的第一步是烯烴與氯氣進行加成,生成環狀氯鎓離子中間體。在第二步反應中,由於大量水的存在,水進攻氯鎓離子生成β-氯乙醇。但溶液中還有氯離子存在,它進攻氯鎓離子,故有副產物1,2-二氯乙烷生成。
不對稱烯烴與次鹵酸的加成,也遵循馬可尼可夫法則。親電試劑的氯加到含氫較多的雙鍵碳原子上,水加到含氫較少的雙鍵碳原子上。例如:
- CH3CH=CH2 + HOCl → CH3CHOHCH2Cl
上述兩個反應的產物——氯乙醇和1-氯-2-丙醇是製備環氧乙烷和甘油等化合物的重要化工原料。
與硫酸加成
[編輯]和烯烴與鹵化氫的加成相似,烯烴與硫酸的加成也是離子型的親核加成。例如,將乙烯通入冷的濃硫酸中,首先質子加到一個雙鍵碳原子上,生成碳正離子中間體,然後硫酸氫負離子與之結合,生成硫酸氫乙酯:
- CH2=CH2 + HOSO2OH → CH3-CH2-OSO2OH
因為硫酸擁有兩個活潑氫原子,所以在一定條件下可與兩分子乙烯進行加成,生成硫酸二乙酯(中性硫酸酯):
- CH2=CH2 + HOSO2OH + CH2=CH2 → CH3CH2OSO2OCH2CH3
不對稱烯烴與硫酸的加成反應,也符合馬可尼可夫法則。例如(括號內為反應溫度及硫酸濃度):
- CH3CH=CH2 + HOSO2OH → CH3CH(OSO2OH)CH3 (50℃,75-85%)
- (CH3)2C=CH2 + HOSO2OH → (CH3)3COSO2OH (10-30℃,50-65%)
上述反應說明,烯烴對反應條件和硫酸濃度的要求,隨著烯烴雙鍵碳原子上連接的甲基增多而降低,即烯烴的活性和烯烴與鹵素、鹵化氫的加成活性相同。
若將C12至C18的直鏈α-烯烴與硫酸反應,再將生成的酸性硫酸酯用鹼中和,則會得到一種硫酸酯鹽型陰離子表面活性劑,可作為液體洗滌劑的原料,也可用作紡織助劑:
- R-CH=CH2 + HOSO2OH → R-CH(OSO2OH)CH3
- R-CH(OSO2OH)CH3 + NaOH → R-CH(OSO2ONa)CH3 + H2O
氧化反應
[編輯]烯烴可以被許多氧化劑所氧化。
- R1-CH=CH-R2 + O3 → R1-CHO + R2-CHO + H2O
- 這個反應可以用來測定未知烯烴的雙鍵位置。
3CH2=CH2+2KMnO4+4H2O→2MnO2+2KOH+3HO-CH2-CH2-OH
聚合反應
[編輯]烯烴的聚合反應是一個經濟意義極高的反應,得到的高聚物有很高的工業價值,例如塑膠中的聚乙烯和聚丙烯,合成潤滑油中的聚a-烯烴。聚合反應既可以通過自由基機理來實現,又可以通過離子機理來實現。
烯烴的命名
[編輯]IUPAC名稱
[編輯]根據IUPAC命名規則,為了給烯烴主鏈命名。英文命名將中綴-an-換為-en-。例如CH3-CH3 是ethane。因此 CH2=CH2的名字是ethene。中文命名是直接將「烷」變為「烯」,例如CH3-CH3是乙烷,因此CH2=CH2的名字是乙烯。
在高級烯烴中,因為雙鍵位置不同而導致異構物的出現,我們運用下面的數字系統:
- 命名含有雙鍵的最長碳鏈為主鏈,使得雙鍵碳原子的數字儘可能最小。
- 用第一個雙鍵碳原子指出雙鍵的位置。
- 對照烷烴那樣命名取代烯烴或支鏈。
- 首先是給碳原子標號,按順序註明取代基團,雙鍵和主鏈的名字。
|
CH3CH2CH2CH2CH==CH2 |
CH3 |
CH2CH3 |

順反標記
[編輯]
E/Z標記
[編輯]
一般名稱
[編輯]儘管IUPAC命名系統有很高的通用性和精確性,但是一些烯烴的一般名稱已經被廣泛接受。 例如:
| (CH3)2C=CH2 | |
| IUPAC 名稱: | 2-甲基丙烯 |
| 一般名稱: | 異丁烯 |
參考資料
[編輯]- ^ 《化學命名原則》,第四版,國立編譯館,2004. [2018-05-04]. (原始內容存檔於2021-02-10).
- ^ 中華民國教育部重編國語辭典修訂本 - 烴. [2017-08-27]. (原始內容存檔於2021-02-06).
- ^ Wade, L.G. Organic Chemistry 6th. Pearson Prentice Hall. 2006: 279. ISBN 1-4058-5345-X.
- ^ Moss, G. P.; Smith, P. A. S.; Tavernier, D. Glossary of Class Names of Organic Compounds and Reactive Intermediates Based on Structure (IUPAC Recommendations 1995). Pure and Applied Chemistry. 1995, 67 (8–9): 1307–1375. doi:10.1351/pac199567081307.
- ^ Production: Growth is the Norm. Chemical and Engineering News. July 10, 2006, 84 (28): 59. doi:10.1021/cen-v084n034.p059.
參見
[編輯]命名法外部連結
[編輯]- Rule A-3. Unsaturated Compounds and Univalent Radicals [1] (頁面存檔備份,存於網際網路檔案館) IUPAC Blue Book.
- Rule A-4. Bivalent and Multivalent Radicals [2] (頁面存檔備份,存於網際網路檔案館) IUPAC Blue Book.
- Rules A-11.3, A-11.4, A-11.5 Unsaturated monocyclic hydrocarbons and substituents [3] (頁面存檔備份,存於網際網路檔案館) IUPAC Blue Book.
- Rule A-23. Hydrogenated Compounds of Fused Polycyclic Hydrocarbons [4] (頁面存檔備份,存於網際網路檔案館) IUPAC Blue Book.



