肺癌
| 肺癌 | |
|---|---|
| 同义词 | Lung carcinoma |
 | |
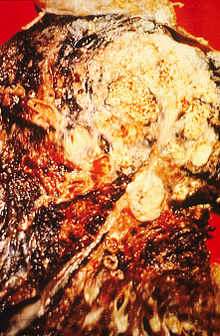
| 胸部X光(胸片)显示出肺部肿瘤(箭头所指处)。 | |
| 症状 | 咳嗽(包含咳嗽咳出血)、體重減輕、呼吸短促、各種胸痛[1] |
| 常見始發於 | ~70 歲[2] |
| 类型 | 小细胞癌(SCLC)、非小細胞癌(NSCLC)[3] |
| 风险因子 | 吸菸、遺傳因子、氡氣、石棉、空氣污染[4][5] |
| 診斷方法 | 醫學影像、活體組織切片[6][7] |
| 治療 | 外科手術、化学疗法、放射線療法[7] |
| 预后 | 五年存活率 17.4%(美國)[2] |
| 盛行率 | 330萬(2015年)[8] |
| 死亡數 | 170萬(2015年)[9] |
| 分类和外部资源 | |
| 醫學專科 | 肿瘤学 |
| ICD-11 | 2C25 |
| ICD-10 | C3333.-C3434. |
| ICD-9-CM | 162.3、162.5、162.8、162.4 |
| OMIM | 211980、608935、612593、614210、612571 |
| DiseasesDB | 7616 |
| MedlinePlus | 007194、007270 |
| eMedicine | 279960、280104、362919、358274、358433 |
肺癌(英語:Lung cancer[7])也称支气管肺癌[10][11][12],是惡性的肺部肿瘤,肇因於肺部組織细胞不受控制地生長[13]。如不治疗,肿瘤细胞會转移至鄰近組織或身體的其他地方[14]。肺部最常見的原發性惡性腫瘤屬於上皮癌[15],可粗分為小细胞癌(SCLC)和非小细胞癌(NSCLC)[3]。肺癌最常見的症狀有咳嗽(包括咳血)、体重减轻、气短和胸痛[1]。
大多数(85%)肺癌患者患病的原因为长期吸菸[4],然而亦有大约10-15%的患者从不吸菸[16]。这部分人患上肺癌常是由于遗传因素和吸入氡氣、石棉、二手煙,或其他空气污染物共同导致[4][17][5][18]。肺癌在胸部X光或斷層掃描(CT)中可见[7],并可通过支气管镜检查或CT引导下进行活检确诊[6][19]。
避開汙染物等風險因子為最主要的預防方式[20]。肺癌的治疗和长期疗效取决于类型、阶段(转移的程度)和患者的整体健康状况[7]。大多數的肺癌無法治癒[3],常見治療方式有外科手術、化疗和放疗[7]。非小细胞肺癌有时采用手术治疗,而小细胞肺癌(SCLC)通常对化疗和放疗的效果佳[21]。
在2012年,全球約有180萬人新罹患肺癌,並導致160萬人死亡[15]。肺癌是男性常見的癌症致死病因,在女性則僅次於乳癌,列名第二[22]。肺癌最常於70歲上下診斷[2]。在美国,总体而言患者在确诊为肺癌之後,有17.4%的人存活时间超过5年[2],而这个比例在发展中国家则较低[23]。
在2020年,全球新发肺癌病例约220.7 万,新增肺癌死亡病例约179.6万,分别占全部恶性肿瘤新发和死亡病例的11.4%和18.0%。[24]2022年中国新发肺癌病例约87.1万,新增肺癌死亡病例约76.7万,分别占所有恶性肿瘤发病和死亡病例的18.1%和23.9%。[25]
臨床表現[编辑]
肺癌的臨床表現包含:[1]
如果肿瘤生长在呼吸道,那么其可能会阻断气流,造成呼吸困难,还可能阻碍呼吸道分泌物的排出,使得分泌物聚积在呼吸道,增加罹患阻塞性肺炎的可能性[1]。
不同类型肿瘤,会导致不同的腫瘤伴隨症候群。這些與原病灶發生處無關的症狀,常作為初始症狀表現,往往才是肺癌被發現的主因[26]。肺癌的腫瘤伴隨症狀可能包括高血鈣、抗利尿激素分泌异常综合征(SIADH,尿液异常浓缩和血液稀释)、異位性促腎上腺皮質激素(ACTH)分泌、Lambert-Eaton 肌無力症候群(自身抗体引起的肌无力)。肺尖部的肿瘤称为潘科斯特瘤可能会侵犯局部交感神经系统,导致霍纳氏综合征(眼睑低垂和同侧瞳孔缩小),也可能会损伤臂神经丛[1]。
肺癌的许多症状都不具特异性,如食慾減退、消瘦、發熱和疲乏無力等等[6]。因此许多患者在出现症状后就医时,癌组织早已从原发部位扩散转移[27]。提示出现癌转移的症状有消瘦、骨痛和神经系统症状(头痛、昏厥、惊厥或四肢无力)[1]。肺癌常見的轉移部位有脑、骨、肾上腺、对侧肺、肝、心包膜和肾脏[27]。大约10%肺癌患者被确诊时没有临床症状,而是在常规胸片检查时意外发现[19]。
病因[编辑]


細胞的癌變與DNA及表觀遺傳等遺傳信息的突變有關,这些变化会影响细胞的正常功能,包括细胞增殖、程序性细胞死亡(细胞凋亡)和DNA修复。损伤累积的越多,癌症发生的风险就越高[28]。
吸菸[编辑]
吸菸是目前为止导致肺癌的主要原因[4]。香菸菸雾中含有至少73种已知的致癌物质[29],包括苯并芘[30]、NNK、1,3-丁二烯,以及钋-210等放射性物質[29]。以发展中国家在2000年的資料來看,患肺癌死亡的男性中90%是吸菸所致(女性为70%)[31]。吸菸导致的肺癌患者占了肺癌病人的85%[7]。
被动吸烟(吸二手菸,意为吸入其他吸菸者产生的菸草煙雾)也是导致不吸菸的人患上肺癌的原因。美国[32][33][34] 、欧洲[35],和英国[36]的研究都表明被动吸菸者患肺癌风险在显著增加[37]。和吸菸者共同生活的人患病风险增加20-30%,而工作环境中有二手菸的人其患病风险增加16-19%[38]。而研究亦顯示側流菸比直接吸菸更危险[39]。美国每年有大约3,400人死于被动吸菸造成的肺癌[34]。
大麻和菸草菸雾中含有许多相同致癌物[40],但抽大麻对患肺癌风险的影响还不清楚[41][42]。2013年的一篇回顾性文章并未发现轻度到中度吸食大麻会使患肺癌风险增加[43]。而2014年的回顧性文章则发现吸食大麻会使肺癌风险增加一倍[44]。
氡氣[编辑]
氡是一种无色无味的气体,由地壳中存在的铀的衰变产物镭裂變後生成。这些放射衰变产物会使遗传物质电离,進而導致基因產生某些致癌突变。氡气是美国肺癌的第二常见的暴露因子[45]。每年导致约21,000人死亡[46]。氡气浓度每立方米升高100贝可(100 Bq/m³),其致癌风险就会增加8-16%[47]。 氡气含量随区域和下层土壤、岩石的成分变化而不同。美国每15个家庭中就有大约一个的氡气水平超过了建议量每升4皮居里(4 pCi/l)[48]。「密閉」、「通風不足」、「一樓的地板有裂縫,使得土壤中的氡逸散到室內」的建築,將有較高濃度的氡。
石棉[编辑]
石棉可导致多种肺病,包括肺癌。石棉者和吸菸會產生協同作用,大幅增加罹患肺癌的機會[5]。吸菸者工作环境中有石棉时,其患肺癌风险較一般人高了45倍[49]。石棉也可导致胸膜癌變,稱為間皮瘤(和肺癌不同)[50]。
空氣汙染物[编辑]
戶外空氣汙染物會增加罹患肺癌的風險,特別是燃燒化石燃料產生的廢氣[4]。懸浮细颗粒(PM2.5)和硫酸盐气溶胶也會稍微提升风险,此類汙染物常來自於汽車排放的廢氣[4][51]。二氧化氮浓度每增加10 ppb,人患肺癌风险就上升14%[52]。据估計,1-2%的肺癌由户外空气污染所致[4]。
初步证据支持室内空气污染会使患肺癌风险增加,包括做饭和取暖时燃烧木材、木炭、粪便或作物残茬[53]。暴露于室内煤烟的女性,罹患肺癌风险會提升大概一倍,许多生物质燃烧后的副产品是已知或可疑的致癌物[54]。这一风险影響全球大约24亿人[53],據信約有1.5%的肺癌死亡病例是由此导致[54]。
遺傳因素[编辑]
约8%肺癌由遗传因素所致[55]。若亲属中有肺癌患者时患病风险會增加一倍, 本疾病可能由多基因共同調控[56]。目前已知5、6和15号染色体上的基因多态性会影响患肺癌的风险[57]。
其他原因[编辑]
许多其它物质、职业及所处环境都与肺癌有关联。国际癌症研究机构(IARC)声称有“充足证据证明”以下物质是肺部的致癌物[58]:
- 某些金属(铝制品、镉及其化合物、铬(VI)化合物、铍及其化合物、钢铁、镍化合物、砷及无机砷化合物、地下赤铁矿)
- 一些燃烧产物(不完全燃烧产物、煤(家庭烧煤所致室内排放物)、煤的气化物、煤-焦油沥青、焦炭生产所排放物质、煤烟、柴油机排放气体)
- 电离辐射(X射线、伽马射线、钚)
- 一些有害气体(甲醚(工业级)、双氯甲醚(氯甲基)、硫芥、MOPP、油画释放的气体)
- 橡胶制品和结晶矽尘
- 硬皮症患者罹患肺癌風險稍高。
致病機轉[编辑]
和许多其它癌症类似,肺癌也始于原癌基因的激活或抑癌基因的灭活[59]。而致癌物正是誘發這些變的因素[60]。K-ras原癌基因的突变导致10-30%的肺腺癌[61][62]。大概4%的非小细胞肺癌与一个EML4-ALK酪氨酸激酶融合基因有关[63]。表观遗传学的变化——如DNA甲基化,组织蛋白尾部修饰或小核糖核酸(微RNA)调控的改变可能会导致抑癌基因的灭活[64]。
表皮细胞生长因子受体(EGFR)调控细胞增殖、凋亡、血管生成和肿瘤侵袭[61]。EGFR基因的突變和增幅是非小細胞癌常見的致病機轉,因此EGFR抑制劑可以用於某些肺癌的治療[61]。其它经常发生突变或扩增的基因有c-MET、NKX2-1、LKB1、PIK3CA和BRAF[61]。
其细胞株系起源機制尚不完全清楚[1]。机理可能涉及干细胞的异常活化。在气道近端,表达角蛋白5的干细胞最易發生癌變,导致肺鳞状细胞癌。在气道中段,支氣管無纖毛分泌細胞(club cell)和神经上皮細胞等會表達子宮球蛋白的細胞具幹細胞性質。小细胞肺癌可能来源于这些细胞系[65],或神经分泌细胞[1],也可能会表达CD44[65]。
肺癌細胞在原發時大多為上皮细胞型,但該型細胞並不利遠端轉移,必須要轉變為间质细胞型才可以進行遠端轉移,該現象稱為上皮間質轉化。涉及轉化的蛋白包含Akt/GSK3Beta、MEK-ERK、Fas和Par6等[66]。
COPD和肺纤维化(α1-抗胰蛋白酶缺乏)可能增加肺癌易感性;此外,吸烟者补充β-胡萝卜素也会增加患肺癌的危险性。空气污染和雪茄烟雾中含有致癌物质,这些致癌物质可能存在一定的致癌风险,但尚未显示可引起肺癌。患者若有其他的肺部疾病(如肺结核)所致瘢痕,那么他们的患癌风险也将增加。[7]
呼吸道上皮细胞需长时间暴露于促癌物质下并逐渐积累多种基因突变才能成为腫瘤。刺激细胞生长(K-ras, MYC)的基因突变逐渐导致生长因子受体(EGFR,HER2/neu)信号异常,抑制凋亡(BCL-2),引起异常细胞增殖。此外,肿瘤抑制基因的突变(p53、APC)亦可导致癌症。[7]
诊断[编辑]

當病人的症狀疑為肺癌時,胸部影像學檢查可提供初步的檢查和評估。肺癌在影像學的表現包括如单个肿块、多发肿块、孤立的肺结节等等。另外還有肺门增大、纵隔增宽(可能代表縱膈腔淋巴結轉移)、肺不张、气管支气管狭窄、肺實變,未緩解的实质浸润、空洞。或其他原因無法解釋的肋膜積水[7]。電腦斷層(CT)可以提供更多相關資訊,例如說腫瘤的擴散程度及類別,也相較胸部X光片更能發現縱膈腔後的腫瘤。但上述影像學檢查僅能夠提供診斷上的參考,確診必須透過细胞病理学證實。因此可以透過支气管镜检查或CT引导下的组织活检,進行组织病理学检查的取样[19]。
胸片上肺癌通常表现为一个單一肺結節。但由於有許多症狀類似的疾病,因此仍須配合其他檢查以進行鉴别诊断。與肺癌在影像學類似的疾病包含其他腫瘤的轉移、错构瘤、感染肉芽腫(如肺结核、組織孢漿菌症、球黴菌症等等)[67],其他导致单个肺结节但不太常见的原因包括支气管源性囊肿、腺瘤、动静脉畸形、肺隔离症、类风湿结节、肉芽肿病伴多血管炎或淋巴瘤[68]。肺癌亦可能在進行其他无关原因做胸部X片或CT扫描时意外發現[69]。肺癌需要通过对可疑组织的临床和影像学特征进行组织学检查方能确诊[1][6]。临床实践指南推荐了肺結節的监测频率[70]。CT扫描不应使用过长时间或过于频繁,因为会增加人们接触到的射线量[70]。
毛玻璃樣斑塊(Ground-glass opacity,GGO)是描述胸部照影中的肺部毛玻璃樣病灶,過去大多被視為良性變化。但在更進一步的解剖研究後,發現有些GGO具有惡性潛勢。良性的GGO包含局部間質纖維化(focal interstitial fibrosis)、發炎,或是出血。惡性的狀況則包含異形腺瘤性增生(AAH)、原位肺腺癌(AIS),或微侵犯型肺腺癌(MIA),以及鱗屑樣為主型肺腺癌(lepidic-predominant invasive adenocarcinomas,LPA)等[71]。由於GGO的惡性機率高達63%,因此在癌早期發現的角色也越顯重要[72]。
分类[编辑]

| 组织类型 | 每年每100,00人的发病率 |
|---|---|
| 所有类型 | 66.9 |
| 腺癌 | 22.1 |
| 鳞狀上皮癌 | 14.4 |
| 小细胞癌 | 9.8 |
肺癌的分類須透過組織病理分型[6],分類對於治療策略的選擇跟預測療效相當重要。肺癌屬於上皮癌,意即腫瘤發源自上皮細胞,可根據顯微鏡下觀察到的癌細胞的大小和形態對肺癌進行分類。為方便治療,肺癌可大致分為非小細胞癌和小細胞肺癌[74]。
非小細胞癌[编辑]

非小細胞癌(NSCLC)可粗分為三大類:肺腺癌、鱗狀上皮癌,和大細胞癌[1]。
接近40%的肺癌屬於肺腺癌,腺癌一般起源於周圍肺組織[6]。雖然多數腺癌與吸菸有關,但在從未吸菸者、一生抽菸少於100根,以及曾中度吸菸並已戒治者的肺癌患者中,肺腺癌亦為最常見類型[1][75]。而肺癌的其中一種亞型細支氣管肺泡癌,則多見於女性未吸菸者,其長期存活率較佳[76]。
鱗癌大概占肺癌的30%,一般位於大氣道附近。癌組織中央常可發現因細胞壞死而形成的空腔[6]。大約9%的肺癌為大細胞癌。之所以稱其為大細胞癌是因為癌細胞體積大,細胞質過量,細胞核大,核仁明顯[6]。
小细胞肺癌[编辑]

小细胞肺癌(SCLC)的癌细胞内含有緻密的神经内分泌颗粒(即含有神经内分泌激素的囊泡),因此這類肿瘤可能會有内分泌相關的副癌综合征[77]。多数小细胞肺癌发生在大的气道(主支气管和次级支气管)[19]。病程中癌组织生长迅速,发生扩散早,60-70%的患者就诊时已有廣泛侵犯的情形(意即一次放射線治療無法打完)。小细胞癌和吸烟有着极大的关系[1]。
其他[编辑]
公认的主要组织学亚型有四种,有些癌组织可能同時擁有不同亚型[74],如腺鱗癌[6]。罕见的亚型包括:腺瘤、類癌和肉瘤樣癌(sarcomatoid carcinomas)[6]。
转移[编辑]
| 免疫分型 | Napsin-A | TTF-1 | P40 |
|---|---|---|---|
| 鳞狀上皮癌 | 阴性 | 阴性 | 阳性 |
| 腺癌 | 阳性 | 阳性 | 阴性 |
| 小細胞癌 | 阴性 | 阳性 | 阴性 |
肺部為身體其他腫瘤常見的轉移位置。继发性肿瘤可根据其原发部位分类,如扩散到肺部的乳腺癌被称为转移性乳腺癌。转移性肿瘤在胸片中常显示为典型的圆形[78]。
而原发性肺癌本身最常见的转移部位是脑、骨、肝脏和肾上腺[6]。对活检组织进行免疫染色通常有助于确定癌症原发部位[79]。若腫瘤細胞出現Napsin-A、TTF-1、CK7和CK20等標記,可以協助確認腫瘤的亞型。如SCLC是源自於神經內分泌細胞,因此可能會表現CD56、神經元黏附分子、突觸素,或嗜鉻粒蛋白等等[1]。
分期[编辑]
癌症分期是对其从原发部位扩散的程度进行评价[80],是影响肺癌预后和潜在治疗措施的因素之一[1][80]。最初对非小细胞肺癌的分期评估使用的是TNM分期法。是基于原发肿瘤(Tumor)的大小,是否累及淋巴结(lymph Node)及有否远处转移(Metastasis)[1]。
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
使用TNM分期系统可将非小細胞肺癌分为隐匿癌、0、IA、IB、IIA、IIB、IIIA、IIIB、IIIC、IVA,和IVB期。这一分期系统可辅助选择治疗措施和评估预后[82]。
小细胞肺癌被归入局限期(limited stage,只限于單側胸腔的一半,且能被纳入单一放射治疗區域)和广泛期(播散范围更广)[1]。但使用TNM系统进行分类有助于评估其预后[82]。
对非小细胞肺癌和小细胞肺癌来说有两种分期评估方法:临床分期和外科手术分期。临床分期在根除性手術之前进行,主要以影像学检查结果(如CT扫描和PET扫描)和组织活检结果为基础。外科手术分期在术中或术后进行,综合考虑手术和临床的结果,包括对胸腔淋巴结的手术取样[6]。
| TNM | 期組 |
|---|---|
| T1 N0 M0 | IA |
| T2a N0 M0 | IB |
| T2b N0 M0 | IIA |
| T1-T2 N1 M0 | IIB |
| T3 N0 M0 | |
| T1–T2 N2 M0 | IIIA |
| T3 N1 M0 | |
| T4 N0–N1 M0 | |
| T1-T2 N3 M0 | IIIB |
| T3-T4 N2 M0 | |
| T3-T4 N3 M0 | IIIC |
| M1a-M1b | IVA |
| M1c | IVB |
预防[编辑]
禁菸[编辑]
在大多数国家,大部分工业和家用的可致癌物质都已經鑑別出來,並明令規範,但吸菸仍相當普遍。限制吸烟是预防肺癌的首要目标,而戒菸是这个过程中最重要的一环[84]。
有更多西方国家通过政策干预来减少在餐馆和工作场所等公共区域的被动吸烟[85]。不丹於2005年起已实行完全禁烟令[86],印度也从2008年10月开始也实行了公共场所禁烟令[87]。世界卫生组织(WHO)号召各国政府全面禁止菸草广告以防止年轻人沾染,WHO估计在实行这种禁令的国家烟草消费量已减少了至少16%[88]。
筛檢[编辑]
肺癌篩檢乃在没有症状的人群中進行大規模医学检查[89]。对有患肺癌高风险的人群可以通过電腦斷層来筛查发现癌组织,也使病人有机会早期診斷並治療从而延长寿命[70][90]。这种形式的筛查使死于肺癌机率的絕對風險减少了0.3%(相對風險减少了20%)[91][92] 。高危人群是指那些年龄为55-74岁,抽烟量相当于连续30年每天1盒,而且戒烟不超过15年的人[70]。
電腦斷層偽陽性率高,可能导致采取不必要的治疗措施[93]。被篩檢為陽性者,僅有1/20為偽陰性[94]。偽陽性率高所衍生的公衛議題包含會造成額外的輻射暴露[93],且後續檢查也可能造成不必要的花費[70]。目前痰液細胞篩檢和胸部X光等另外兩種篩檢沒有任何已知效益[90][95]。
美国预防服务工作组(USPSTF)建议年龄介于55-80歲之间,每年抽菸超過20包,且戒菸未超過15年的族群,每年進行低剂量CT肺癌筛檢[96]。但若合併其他健康問題,使提前診斷無法延長預期壽命,或就算診斷也無法進行治療的族群,並不建議常規進行低剂量CT(LDCT)肺癌筛檢[97]。2014年,英国国家卫生署重新审查了支持进行CT筛查的证据[98]。
臺灣國民健康署建議下列肺癌高風險族群可考慮LDCT篩檢:[99]
- 年齡介於50-80歲,抽菸史超過30包年之民眾(含戒菸時間未超過15年的民眾)。
- 具有肺癌家族史的民眾(父母、子女或兄弟姊妹罹患肺癌)。
- 有肺部病史者(如肺結核、慢性肺阻塞症)。
- 暴露於氡氣環境,或特定職場環境工作者(如:金屬業、冶礦業、石油化學工業、石綿接觸者或長期暴露在有粉塵、油煙、棉絮、化學物質、放射環境下等)。
其他预防措施[编辑]
长期补充维生素A[100][101]、C[100]、D[102]或E[100]并不会降低患肺癌的风险。一些研究表明:饮食中蔬菜和水果比例较高的人患肺癌风险似乎更低[34][103],但这也可能混杂了其他混擾因子,因為會吃蔬果的人可能會抽菸的比例也較低。目前还未有严谨的调查研究证明饮食和肺癌风险之间有明确关联[1][103],但有芸萃分析支持抽菸者如果配合健康飲食可以降低肺癌風險[104]。
治療[编辑]
肺癌的治疗取决于癌细胞的类型,扩散程度和病人的身体状况。通常的治疗措施包括:和缓医疗[105]、手术,化疗和放疗[1]。对晚期肺癌来说,標靶治療会变得越来越重要。
手术[编辑]

如果确诊为非小细胞肺癌,对其进行分期可确定肺癌病灶是否为局限性、能否手术切除,或是否癌组织已扩散到无法用手术治疗的程度,这可用CT和正电子成像术(PET)扫描来决定[1]。如果怀疑纵膈淋巴结受累可以取样淋巴结从而协助分期。取樣技術包含經胸壁穿刺針吸活檢術(transthoracic needle aspiration)、经支气管针吸活检(transbronchial needle aspiration,可選擇是否要用氣管內視鏡超音波輔助)、內視鏡超音波細針抽吸、纵膈镜检、胸腔鏡[106]。血液检查和肺功能检查可用于评估病人能否承受手术[19]。如果肺功能检查发现病人呼气储备量很低可能不会进行手术[1]。
对大多数早期的非小细胞肺癌患者手术会选择只切除一个肺叶(肺叶切除术)。对于不适合行完整肺叶切除术的病人,可能可沿邊緣將含有腫瘤的三角形區域切除(楔形切除术)。但是与肺叶切除术相比楔形切除术术后更易复发[107]。在楔形切除部位的边缘进行近距离放射碘治療(Radioactive iodine brachytherapy)可能会降低复发的风险[108]。僅有在相當罕見的情況下才會進行全肺切除术[109]。电视辅助胸腔镜手术(VATS)和VATS肺叶切除术使用微创技术对肺癌进行手术治疗[110]。与传统的开放肺叶切除术相比VATS肺叶切除术同样有效且术后并发症更少[111]。
小细胞肺癌通常使用化疗和/或放疗[112],但是人们正重新考量手术对小细胞肺癌的作用。對於沒有遠端轉移且無進犯縱膈者,可以先以外科手術切除,再進行輔助性化療[113]。而對於已經進犯縱膈腔者,則建議先以化放療作為初始治療[113]。
放疗[编辑]

化疗通常和放疗同时进行,对于不符合手术条件的非小细胞肺癌患者,放疗也可用于根治性治疗。这种高强度的放疗被称为根治性放疗[114]。连续超分割加速放疗(CHART)是对根治性放疗的改进,它在短时间内给予患者大剂量的放疗[115]。非小细胞肺癌行治疗目的的手术后一般不應進行胸部放疗[116],但对有纵膈N2淋巴结累及的一些患者来说术后放疗可能有好处[117]。对可能治癒的小细胞肺癌患者化疗之外通常建议进行胸部放疗[6]。
如果癌组织堵塞了一小段支气管,可以在气道内用近距离治疗(局部放疗)直接打通。和体外放射治疗相比,近距离治疗可减少治疗时间,也可减少对医护人员的射线照射量[118]。然而目前近距離治療的相關治療證據,仍比傳統的体外放射治疗要少[119]。
预防性颅脑照射(PCI)是脑部的一种放疗手段,用于降低肿瘤转移风险,对小细胞肺癌最有用。PCI使局限期肺癌的三年生存率從15%提升至20%,使广泛期肺癌的一年生存率從13%增加至27%[120]。
近年来靶向治疗和影像技术的改进使立体定向放疗治疗早期肺癌这一疗法得到发展。这种放疗方法使用立体定向定位技术分几次对病人进行大剂量放疗。这最初用于那些由于某些合并症无法进行手术的患者[121]。
对非小细胞肺癌和小细胞肺癌患者来说稍小剂量的胸部放疗可用于控制症状(和緩性放療)[122]。射频消融术是一种利用高频电流来杀死肿瘤细胞的新技术,可以用于肿瘤病灶较小的早期患者或放疗后的复发患者。这是一种创伤较小的治疗手段,较开胸手术而言,可以尽可能多地保护肺功能,适用于无法手术的患者[7]。
化疗[编辑]
化疗方案取决于肿瘤类型[6]。小细胞肺癌(SCLC)即使在相对早期也主要采用化疗和放疗进行治疗[123],常用的化疗方案为依托泊苷联合一种铂类药物(顺铂或卡铂)[124],二者也常和卡铂、吉西他滨、紫杉醇、长春瑞滨、拓扑替康、伊立替康等药物联用[125][126]。对于晚期非小细胞肺癌(NSCLC),如果病人身体可承受,化疗可提高存活率,為第一线治疗手段[127],并且通常使用两种药物来治疗,其中一种常为铂类(顺铂或卡铂)。其它常用的化疗药物为:吉西他滨、紫杉醇、多西他赛[128][129]、培美曲塞[130]、依托泊苷或长春瑞滨[129]。70歲以上的患者如果使用铂类药物進行化療,其產生嚴重副作用的風險會較高[131]。
辅助化疗是指在進行根除型手术後再实施化疗,目的是提高疗效。对于非小细胞肺癌,手术过程中会在病灶旁淋巴结取样以辅助分期。如果确定其为肺癌II或III期,辅助性化疗可以使五年生存率提高4%[132][133][134] 。与旧的化疗方案相比,长春瑞滨和顺铂联用更有效[133]。对IB期肺癌是否应采用辅助性化疗还有争议,因为临床试验还未证明其可以提高生存率[135]。非小细胞肺癌的癌组织若能手术切除,术前化疗也能提高疗效[136][137]。
在对非小细胞肺癌的治疗中,化疗可能会与和缓医疗联合应用。对晚期病人而言,适当的化疗比单纯的支持性护理更能提高平均存活率,也可以改善生存质量[138][139]。在和缓医疗的过程中如果病人身体状况允许的话,持續化疗可以使存活时间延长1.5到3个月,也可减轻症状,改善生存质量,且现代化疗药物的效果更好[140][141]。非小细胞肺癌芸萃分析协作小组建议:在晚期非小细胞肺癌的治疗中,如果患者願意而且可忍受就应该考虑进行化疗[127][142]。
標靶治療[编辑]
肺癌、特别是在晚期肺癌的治疗中,有几种以分子路径为靶标的药物可用。厄洛替尼 、吉非替尼,和阿法替尼抑制表皮生长因子受体中的酪氨酸激酶。Denosumab是針對RANKL的单克隆抗体,本品會與RANKL結合,使其無法激活蝕骨細胞,对治疗骨转移癌有效[143]。2015年单克隆抗体药物安维汀(贝伐珠单抗)肺癌适应症在中国上市,其通过抑制肿瘤血管生成来治疗癌症[144]。
T细胞上的受体CTLA-4会抑制免疫系统,有些癌細胞便會依此機制來逃脫免疫系統的偵查。伊匹单抗(Ipilimumab)會抑制CTLA-4,藉此來阻断其信号传导,減少癌細胞逃脫的機會,FDA已批准其用于治疗黑色素瘤。目前有第三期試驗顯示伊匹单抗與保疾伏(nivolumab)併用可以延長非小细胞肺癌的存活期[145]。
程序性细胞死亡1蛋白(PD-1)传导的信号可使T细胞失活,一些癌细胞會表达PD-L1,使T细胞無法作用。因此有些藥物藉由抑制PD-1与其配体PD-1配体1(PD-L1)来发挥疗效,此類藥物已被批准作為某些肺癌的前幾線藥物[146]。PD-1因此可使用PD-1和PD-L1的单克隆抗体來對況這些癌細胞。此類藥物包含派姆单抗(pembrolizumab)、保疾伏[66]、癌自禦(atezolizumab)[147],以及度伐魯單抗(durvalumab)等等[146],相關的临床试验目前正在进行[146]。
有些肺癌患者已对表皮生长因子受体(EGFR)和间变性淋巴瘤激酶(ALK)的酪氨酸激酶抑制剂產生耐受性,故有些新药正在開發中。新的EGFR抑制剂包括阿法替尼和達科米替尼。新的ALK抑制剂包括克里唑替尼(crizotinib)和色瑞替尼(ceritinib)[148]。
支氣管鏡[编辑]
對於氣道阻塞或流血的病人,有數種治療可透過支氣管鏡進行。如果氣管遭到腫瘤堵塞者,可以選擇的治療包含硬式支氣管鏡(rigid bronchoscopy)、支氣管內氣囊擴張和成形術(balloon bronchoplasty)、支架置放術,以及微型輕創術(microdebridement)等等[149]。雷射燒灼術(Laser photosection)則需藉由支氣管鏡讓雷射進入氣道,並將堵塞的腫瘤移除[150]。
和缓医疗[编辑]
和缓医疗能提升患者在治療期間的生活品質。即使正在進行常規化疗的患者,合併給予和緩醫療也有助益[151]。和緩醫療也能夠給予患者和醫師雙方一段過渡期,以避免情急之下做出無法反悔的決定[152][153] 。和緩醫療並不只用於生命垂危之際,在整个病程中,和缓医疗都可以避免无用但昂贵的治疗措施。对那些癌症晚期的病人,則建議轉由安宁病房進行安寧療護[19][153]。
预后[编辑]
| 临床分期 | 五年以上存活率(%) | |
|---|---|---|
| 非小细胞肺癌 | 小细胞肺癌 | |
| IA | 50 | 38 |
| IB | 47 | 21 |
| IIA | 36 | 38 |
| IIB | 26 | 18 |
| IIIA | 19 | 13 |
| IIIB | 7 | 9 |
| IV | 2 | 1 |
美国所有肺癌患者中16.8%确诊后存活了至少5年[2][154]。在英格蘭和威爾斯2010年到2011年之间肺癌总的五年生存率僅約有9.5%[155]。发展中国家这一情况更糟糕[23],确诊时往往已是晚期。就诊时30-40%的非小细胞肺癌已是Ⅳ期,60%的小细胞肺癌也已发展到Ⅳ期[6]。确诊时分期越晚,肺癌患者存活时间越短,英国的数据表明:确诊时处于最早期的病人中70%可以存活至少1年;但对那些确诊时处于最晚期的病人,这一数字下降到只有14%[156]。
非小细胞肺癌的预后影响因素包括有无肺部症状、肿瘤大小(>3公分)、细胞类型(组织学)、扩散程度(分期)和是否转移到多处淋巴结,有无血管侵犯。不能进行手术的病人中,身体状况差且体重下降超过10%者预后更差[157]。小细胞肺癌的预后影响因素包括:身体状况、性别、癌症分期,还有确诊时癌细胞是否累及中枢神经系统或者肝脏[158]。
对于非小细胞肺癌,若IA期时手术完整切除癌灶预后最好,多达70%患者可存活5年[159]。小细胞肺癌的五年存活率总共约为5%[1]。晚期小细胞肺癌患者平均五年生存率不到1%。局限期患者的平均生存时间是20个月,五年生存率为20%[7]。
根据美国国家癌症研究所提供的数据,美国肺癌患者确诊时的年龄中位数为70岁[160],死亡年龄中位数为72岁[161];有医疗保险的人可能预后更好[162]。
流行病学[编辑]


肺癌是全球男性最常見的癌症,也是發生率和死亡率最高的癌症。在女性則為發生率第三高的癌症,而死亡率則仅次于乳癌,居第二位。2012年,全球肺癌新病例數約為182万,同時也有156万例死于肺癌,占了所有因癌症死亡人数的19.4%[22]。肺癌发病率最高的是北美、欧洲和东亚。2012年,超过三分之一的新增患者出现在中国大陸,而非洲和南亚肺癌发病率则要低得多[163]。在英国肺癌是第二大最常见癌症(2011年有大约43,500人被诊断为肺癌),也是癌症致死的最常见病因(2012年大约35,400人死于肺癌)[164]。
年龄超过50岁且有吸烟史的人群最可能罹患肺癌。和20多年前就开始下降的男性肺癌死亡率相比,女性的肺癌死亡率在过去数十年來不斷上升,最近才趋于稳定[165]。在美国,男性一生中患肺癌的风险是8%,女性是6%[1]。
據統計,約每抽掉300到400万根香烟,就有一个人死于肺癌[166]。五大菸業的影响力在吸烟文化中发挥重要作用[167]。看到烟草广告的年轻的非吸烟者更有可能开始吸烟[168]。近年來,人们越来越重視二手菸在誘發肺癌中的角色[37],以致政府进行政策干预以减少非吸烟者不想要的暴露于其他人的烟草烟雾中的几率[169]。汽车、工厂、发电厂排放的废气也造成了潜在的风险[4]。
东欧男性的肺癌死亡率最高,而北欧和美国女性的肺癌死亡率最高。美国黑人男性和女性的发病率都更高[170]。目前在開發中國家,肺癌的發生率相對較低[171],但隨著這些國家的吸菸人口逐漸上升,肺癌的發生率在接下來的幾年可能會逐漸上升,特別是中國[172]和印度[173]。
在美國,老兵的肺癌發生率較其他族群要高出了25–50%,可能肇因於其抽菸比率較高[174]。也可能是在二戰和韓戰期間暴露於石棉當中,或在越戰中有遭受橘劑暴露[175]。
肺癌為英國第三常見的癌症(2014年約有46,400人新診斷肺癌)[176],且也是最常見的致死癌症(2014年約有35,900人死於肺癌)[177]。
在中国大陆,肺癌确诊后存活过5年的病人不足五分之一,中国大陆采用疗法的普遍有效程度虽然高于发展中国家的平均水平,但是显著低于日本、韩国等发达国家,而且也低于例如乳癌、结直肠癌等其它癌症在中国大陆的疗效水平。[178]。在台湾,确诊后存活过5年的病人约占总确诊人数的15.9%,其中一半的人能活过13.2个月。[179]
从1960年代开始,相对于其他类型肺癌,肺腺癌的发病率开始上升,部分原因是过滤嘴香烟的面世。过滤嘴过滤掉了烟草中的大颗粒物,因此减少了大气道中的沉积物。但是抽烟者必须吸得更深以获得等量的尼古丁,因此沉积在小气道的颗粒物就增加了,而小氣道正是肺腺癌易发部位[180]。肺腺癌的发病率还在持续上升[181]。
历史[编辑]
在吸菸普及之前,肺癌其實並不常見;在1761年之前,人们甚至不认为肺癌是一个明确的疾病[182]。肺癌的各个方面在1810年得以详细记述[183]。在1878年,尸检时发现的癌症中恶性肺肿瘤仅占1%,但到20世纪早期,这一比例已上升到10-15%[184]。在1912年,全世界医学文献中的肺癌病例报告只有374例[185],但是一篇尸检的综述表明肺癌的发病率已经从1852年的0.3%上升到了1952年的5.66%[186]。1929年,德国内科医生弗里茨·利金特意识到了吸烟和肺癌的直接关联[184],这导致了一场激进的反吸烟运动[187]。在1950年代发表的对英国医生吸烟和肺癌的研究结果,第一次为吸烟和肺癌之间的关联提供了确凿的流行病学证据[188]。因此在1964年美国军医署建议吸烟者戒烟[189]。
至於肺癌與氡氣之間的關聯性,則要從一群在萨克森州施內貝格附近的厄尔士山脉工作的礦工開始說起。該礦坑從1740年就开始开采银矿,这些矿富含铀,也附带有镭和氡气[190]。矿工中很多人患了肺部疾病,直到1870年代才意识到是肺癌[191]。尽管发现了这些问题,但由于苏联对铀的需求,开采还是持续到了1950年代[190]。1960年代,氡被确认为肺癌的一个致病因素[192]。
用于治疗肺癌的全肺切除术,在1933年首次成功[193]。姑息放疗从1940年代开始使用[194],从1950年代开始使用根治性放疗,即尝试对那些处于肺癌早期但不适合手术治疗的病人使用更大的放射剂量[195]。在1997年,连续超分割加速放疗法出现,这被认为是对传统的根治性放疗的改进[196]。对小细胞肺癌,1960年代开始尝试手术切除[197]和根治性放疗[198],但並不成功。至1970年代才开发出了成功的化疗方案[199]。
研究方向[编辑]
当前肺癌治疗的研究方向包括免疫治疗(激活机体免疫系统攻击肿瘤细胞)[146]、表观遗传学、化疗和放疗新组合(单独或合併使用)。这些新的治疗措施中很多是通过阻斷免疫關卡,干扰癌细胞逃避免疫系统攻击的能力[146]。
表观遗传学是研究遺傳性基因修飾以及基因表達的學門。生物體在不改變DNA序列狀況下,可以藉由一些分子標籤改變基因的表現,而這類修飾常常具有遺傳性。针对这些分子标签的药物可以杀死癌细胞,研究显示非小細胞癌早期給予藥物阻斷多重分子標籤,可以在副作用更少的情形下殺死癌細胞[200]。在对病人进行标准化治疗前给他们用这些药可以提高效果[200]。相關的臨床研究正在進行中,期望能探知此類藥物對於人類肺癌的效果[200]。开发中的藥物包含组蛋白脱乙酰酶抑制剂和DNA甲基转移酶,前者包括丙戊酸,伏立诺他(vorinostat)、貝利司他(belinostat)、帕比司他(panobinostat)、恩替诺特(entinostat)和罗醚酯肽(romidepsin)。後者則包括地西他滨(decitabine)、氮杂胞苷(azacitidine)和肼屈嗪[64]。
TRACERx計畫正在观察非小细胞肺癌如何形成和发展,以及这些肿瘤如何变得对治疗耐受[201]。这一项目会观察来自850例非小细胞肺癌病人的肿瘤样本,这些病人处于确诊后、初次治疗后、治疗后、和复发后等各个时期[202]。通过分析肿瘤发展不同阶段的样本,研究者们希望找出哪些变化能够加速肿瘤的生长,加强肿瘤对治疗的耐受性。该项目的结果能够帮助科学家和医生理解非小细胞肺癌,并且可能有助于发现治疗肺癌的新的手段[201]。
嵌合抗原受體T細胞免疫療法(Chimeric Antigen Receptor T-Cell Immunotherapy)乃是先取得患者自身的T細胞後,在體外以基因工程的技術,使T細胞具有辨識癌細胞的能力後,再回輸到患者身上。被改造後的T細胞即稱為嵌合抗原受體T細胞(CAR-T),該療法在急性淋巴性白血病(ALL)的治療方面取得了重大突破。目前也正在研究該療法在治療非小細胞肺癌以及間皮瘤的潛力[203]。
參考文獻[编辑]
- ^ 1.00 1.01 1.02 1.03 1.04 1.05 1.06 1.07 1.08 1.09 1.10 1.11 1.12 1.13 1.14 1.15 1.16 1.17 1.18 1.19 1.20 1.21 1.22 Horn L, Lovly CM, Johnson DH. Chapter 107: Neoplasms of the lung. Kasper DL, Hauser SL, Jameson JL, Fauci AS, Longo DL, Loscalzo J (编). Harrison's Principles of Internal Medicine 19th. McGraw-Hill. 2015. ISBN 978-0-07-180216-1.
- ^ 2.0 2.1 2.2 2.3 2.4 Surveillance, Epidemiology and End Results Program. National Cancer Institute. [2016-03-05]. (原始内容存档于2016-03-04).
- ^ 3.0 3.1 3.2 Lung Cancer—Patient Version. NCI. [2016-03-05]. (原始内容存档于2016-03-09).
- ^ 4.0 4.1 4.2 4.3 4.4 4.5 4.6 4.7 4.8 Alberg AJ, Brock MV, Samet JM. Chapter 52: Epidemiology of lung cancer. Murray & Nadel's Textbook of Respiratory Medicine 6th. Saunders Elsevier. 2016. ISBN 978-1-4557-3383-5.
- ^ 5.0 5.1 5.2 O'Reilly KM, Mclaughlin AM, Beckett WS, Sime PJ. Asbestos-related lung disease. American Family Physician. March 2007, 75 (5): 683–8. PMID 17375514. (原始内容存档于2007年9月29日).
- ^ 6.00 6.01 6.02 6.03 6.04 6.05 6.06 6.07 6.08 6.09 6.10 6.11 6.12 6.13 6.14 Lu C, Onn A, Vaporciyan AA, et al. Chapter 78: Cancer of the Lung. Holland-Frei Cancer Medicine 8th. People's Medical Publishing House. 2010. ISBN 978-1-60795-014-1.
- ^ 7.00 7.01 7.02 7.03 7.04 7.05 7.06 7.07 7.08 7.09 7.10 7.11 Lung Carcinoma: Tumors of the Lungs. Merck Manual Professional Edition, Online edition. [2007-08-15]. (原始内容存档于2007-08-16).
- ^ GBD 2015 Disease and Injury Incidence and Prevalence, Collaborators. Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990–2015: a systematic analysis for the Global Burden of Disease Study 2015.. Lancet. 2016-10-08, 388 (10053): 1545–1602. PMC 5055577
 . PMID 27733282. doi:10.1016/S0140-6736(16)31678-6.
. PMID 27733282. doi:10.1016/S0140-6736(16)31678-6.
- ^ GBD 2015 Mortality and Causes of Death, Collaborators. Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980–2015: a systematic analysis for the Global Burden of Disease Study 2015.. Lancet. 2016-10-08, 388 (10053): 1459–1544. PMC 5388903
 . PMID 27733281. doi:10.1016/S0140-6736(16)31012-1.
. PMID 27733281. doi:10.1016/S0140-6736(16)31012-1.
- ^ 葛均波; 徐永健; 王辰 (编). 第八章 肺癌. 内科学(第9版). 北京: 人民卫生出版社. 2018: 75. ISBN 978-7-117-26541-6.
- ^ 陈至立 (编). 肺癌. 辞海. 上海: 上海辞书出版社. 2019. ISBN 978-7-5326-5325-6. (原始内容存档于2024-03-12).
- ^ 宋元林. 肺癌. 中国大百科全书. 北京: 中国大百科全书出版社. 2022-12-23.
- ^ Non-Small Cell Lung Cancer Treatment –Patient Version (PDQ®). NCI. 2015-05-12 [2016-03-05]. (原始内容存档于2016-02-29).
- ^ Falk S, Williams C. Chapter 1. Lung Cancer—the facts 3rd. Oxford University Press. 2010: 3–4. ISBN 978-0-19-956933-5.
- ^ 15.0 15.1 World Cancer Report 2014. World Health Organization. 2014: Chapter 5.1. ISBN 92-832-0429-8.
- ^ Thun MJ, Hannan LM, Adams-Campbell LL, et al. Lung cancer occurrence in never-smokers: an analysis of 13 cohorts and 22 cancer registry studies. PLoS Medicine. September 2008, 5 (9): e185. PMC 2531137
 . PMID 18788891. doi:10.1371/journal.pmed.0050185.
. PMID 18788891. doi:10.1371/journal.pmed.0050185.
- ^ Carmona, RH. The Health Consequences of Involuntary Exposure to Tobacco Smoke: A Report of the Surgeon General. U.S. Department of Health and Human Services. 2006-06-27. (原始内容存档于2017-02-15).
Secondhand smoke exposure causes disease and premature death in children and adults who do not smoke.
- ^ Tobacco Smoke and Involuntary Smoking (PDF). IARC Monographs on the Evaluation of Carcinogenic Risks to Humans (WHO International Agency for Research on Cancer). 2004, 83. (原始内容存档 (PDF)于2015-08-13).
There is sufficient evidence that involuntary smoking (exposure to secondhand or 'environmental' tobacco smoke) causes lung cancer in humans. ... Involuntary smoking (exposure to secondhand or 'environmental' tobacco smoke) is carcinogenic to humans (Group 1).
- ^ 19.0 19.1 19.2 19.3 19.4 19.5 Collins LG, Haines C, Perkel R, Enck RE. Lung cancer: diagnosis and management. American Family Physician. January 2007, 75 (1): 56–63. PMID 17225705. (原始内容存档于2007年9月29日).
- ^ Lung Cancer Prevention–Patient Version (PDQ®). NCI. 2015-11-04 [2016-03-05]. (原始内容存档于2016-03-09).
- ^ Chapman S, Robinson G, Stradling J, West S, Wrightson J. Chapter 31. Oxford Handbook of Respiratory Medicine 3rd. Oxford University Press. 2014: 284. ISBN 978-0-19-870386-0.
- ^ 22.0 22.1 World Cancer Report 2014. World Health Organization. 2014: Chapter 1.1. ISBN 92-832-0429-8.
- ^ 23.0 23.1 Majumder S. Stem cells and cancer Online-Ausg. New York: Springer. 2009: 193. ISBN 978-0-387-89611-3. (原始内容存档于2015-10-18).
- ^ Sung, Hyuna; Ferlay, Jacques; Siegel, Rebecca L.; Laversanne, Mathieu; Soerjomataram, Isabelle; Jemal, Ahmedin; Bray, Freddie. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA: A Cancer Journal for Clinicians. 2021-05, 71 (3) [2023-11-24]. ISSN 0007-9235. doi:10.3322/caac.21660. (原始内容存档于2024-03-03) (英语).
- ^ Xia, Changfa; Dong, Xuesi; Li, He; Cao, Maomao; Sun, Dianqin; He, Siyi; Yang, Fan; Yan, Xinxin; Zhang, Shaoli; Li, Ni; Chen, Wanqing. Cancer statistics in China and United States, 2022: profiles, trends, and determinants. Chinese Medical Journal. 2022-02-09, 135 (5). ISSN 0366-6999. doi:10.1097/cm9.0000000000002108.
- ^ Honnorat J, Antoine JC. Paraneoplastic neurological syndromes. Orphanet Journal of Rare Diseases (BioMed Central). May 2007, 2 (1): 22. PMC 1868710
 . PMID 17480225. doi:10.1186/1750-1172-2-22. (原始内容存档于2007年9月27日).
. PMID 17480225. doi:10.1186/1750-1172-2-22. (原始内容存档于2007年9月27日).
- ^ 27.0 27.1 Frederick L G. AJCC cancer staging manual. Berlin: Springer-Verlag. 2002. ISBN 0-387-95271-3.
- ^ Brown KM, Keats JJ, Sekulic A, et al. Chapter 8. Holland-Frei Cancer Medicine 8th. People's Medical Publishing House USA. 2010. ISBN 978-1-60795-014-1.
- ^ 29.0 29.1 Hecht SS. Lung carcinogenesis by tobacco smoke. International Journal of Cancer. 2012, 131 (12): 2724–2732. PMC 3479369
 . PMID 22945513. doi:10.1002/ijc.27816.
. PMID 22945513. doi:10.1002/ijc.27816.
- ^ Kumar V, Abbas AK, Aster JC. Chapter 5. Robbins Basic Pathology 9th. Elsevier Saunders. 2013: 199. ISBN 978-1-4377-1781-5.
- ^ Peto R, Lopez AD, Boreham J, et al. Mortality from smoking in developed countries 1950–2000: Indirect estimates from National Vital Statistics. Oxford University Press. 2006. ISBN 0-19-262535-7. (原始内容存档于2007年9月5日).
- ^ Health effects of exposure to environmental tobacco smoke. California Environmental Protection Agency. Tobacco Control. 1997, 6 (4): 346–53. PMC 1759599
 . PMID 9583639. doi:10.1136/tc.6.4.346. (原始内容存档于2007年8月8日).
. PMID 9583639. doi:10.1136/tc.6.4.346. (原始内容存档于2007年8月8日).
- ^ State-specific prevalence of current cigarette smoking among adults, and policies and attitudes about secondhand smoke--United States, 2000. MMWR. Morbidity and Mortality Weekly Report (CDC). December 2001, 50 (49): 1101–6. PMID 11794619. (原始内容存档于2017年6月25日).
- ^ 34.0 34.1 34.2 Alberg AJ, Ford JG, Samet JM. Epidemiology of lung cancer: ACCP evidence-based clinical practice guidelines (2nd edition). Chest (American College of Chest Physicians). September 2007, 132 (3 Suppl): 29S–55S [2015-08-04]. PMID 17873159. doi:10.1378/chest.07-1347. (原始内容存档于2020-03-29).
- ^ Jaakkola MS, Jaakkola JJ. Impact of smoke-free workplace legislation on exposures and health: possibilities for prevention. The European Respiratory Journal. August 2006, 28 (2): 397–408. PMID 16880370. doi:10.1183/09031936.06.00001306. (原始内容存档于2013年1月29日).
- ^ Parkin DM. 2. Tobacco-attributable cancer burden in the UK in 2010. British Journal of Cancer. December 2011,. 105 Suppl 2 (Suppl. 2): S6–S13. PMC 3252064
 . PMID 22158323. doi:10.1038/bjc.2011.475.
. PMID 22158323. doi:10.1038/bjc.2011.475.
- ^ 37.0 37.1 Taylor R, Najafi F, Dobson A. Meta-analysis of studies of passive smoking and lung cancer: effects of study type and continent. International Journal of Epidemiology. October 2007, 36 (5): 1048–59. PMID 17690135. doi:10.1093/ije/dym158. (原始内容存档于2011年8月5日).
- ^ Frequently asked questions about second hand smoke. World Health Organization. [2012年7月25日]. (原始内容存档于2013年1月1日).
- ^ Schick S, Glantz S. Philip Morris toxicological experiments with fresh sidestream smoke: more toxic than mainstream smoke. Tobacco Control. December 2005, 14 (6): 396–404. PMC 1748121
 . PMID 16319363. doi:10.1136/tc.2005.011288.
. PMID 16319363. doi:10.1136/tc.2005.011288.
- ^ Greydanus DE, Hawver EK, Greydanus MM, Merrick J. Marijuana: current concepts(†). Frontiers in Public Health. October 2013, 1 (42): 42. PMC 3859982
 . PMID 24350211. doi:10.3389/fpubh.2013.00042.
. PMID 24350211. doi:10.3389/fpubh.2013.00042.
- ^ Owen KP, Sutter ME, Albertson TE. Marijuana: respiratory tract effects. Clinical Reviews in Allergy & Immunology. February 2014, 46 (1): 65–81. PMID 23715638. doi:10.1007/s12016-013-8374-y.
- ^ Joshi M, Joshi A, Bartter T. Marijuana and lung diseases. Current Opinion in Pulmonary Medicine. March 2014, 20 (2): 173–9. PMID 24384575. doi:10.1097/mcp.0000000000000026.
- ^ Tashkin DP. Effects of marijuana smoking on the lung. Annals of the American Thoracic Society. June 2013, 10 (3): 239–47. PMID 23802821. doi:10.1513/annalsats.201212-127fr.
- ^ Underner M, Urban T, Perriot J, de Chazeron I, Meurice JC. [Cannabis smoking and lung cancer]. Revue Des Maladies Respiratoires. June 2014, 31 (6): 488–98. PMID 25012035. doi:10.1016/j.rmr.2013.12.002.
- ^ Choi H, Mazzone P. Radon and lung cancer: assessing and mitigating the risk. Cleveland Clinic Journal of Medicine. September 2014, 81 (9): 567–75 [2015-08-04]. PMID 25183848. doi:10.3949/ccjm.81a.14046. (原始内容存档于2020-02-19).
- ^ Radon (Rn) Health Risks. EPA. (原始内容存档于2008-10-20).
- ^ Schmid K, Kuwert T, Drexler H. Radon in Indoor Spaces: An Underestimated Risk Factor for Lung Cancer in Environmental Medicine. Dtsch Arztebl Int. March 2010, 107 (11): 181–6. PMC 2853156
 . PMID 20386676. doi:10.3238/arztebl.2010.0181.
. PMID 20386676. doi:10.3238/arztebl.2010.0181.
- ^ EPA. Radiation information: radon. EPA. February 2013. (原始内容存档于2009年4月29日).
- ^ Tobias J, Hochhauser D. Chapter 12. Cancer and its Management 6th. Wiley-Blackwell. 2010: 199. ISBN 978-1-4051-7015-4.
- ^ Davies RJ, Lee YC. 18.19.3. Oxford Textbook Medicine 5th. OUP Oxford. 2010. ISBN 978-0-19-920485-4.
- ^ Chen H, Goldberg MS, Villeneuve PJ. A systematic review of the relation between long-term exposure to ambient air pollution and chronic diseases. Reviews on Environmental Health. Oct–Dec 2008, 23 (4): 243–97. PMID 19235364. doi:10.1515/reveh.2008.23.4.243.
- ^ Clapp RW, Jacobs MM, Loechler EL. Environmental and occupational causes of cancer: new evidence 2005-2007. Reviews on Environmental Health. Jan–Mar 2008, 23 (1): 1–37. PMC 2791455
 . PMID 18557596. doi:10.1515/REVEH.2008.23.1.1.
. PMID 18557596. doi:10.1515/REVEH.2008.23.1.1.
- ^ 53.0 53.1 Lim WY, Seow A. Biomass fuels and lung cancer. Respirology. January 2012, 17 (1): 20–31. PMID 22008241. doi:10.1111/j.1440-1843.2011.02088.x.
- ^ 54.0 54.1 Sood, A. Indoor fuel exposure and the lung in both developing and developed countries: an update.. Clinics in chest medicine. 2012年12月, 33 (4): 649–65. PMID 23153607. doi:10.1016/j.ccm.2012.08.003.
- ^ Yang IA, Holloway JW, Fong KM. Genetic susceptibility to lung cancer and co-morbidities. Journal of Thoracic Disease. October 2013,. 5 Suppl 5 (Suppl. 5): S454–62. PMC 3804872
 . PMID 24163739. doi:10.3978/j.issn.2072-1439.2013.08.06.
. PMID 24163739. doi:10.3978/j.issn.2072-1439.2013.08.06.
- ^ Dela Cruz CS, Tanoue LT, Matthay RA. Chapter 109: Epidemiology of lung cancer. Grippi MA, Elias JA, Fishman JA, Kotloff RM, Pack AI, Senior RM (编). Fishman's Pulmonary Diseases and Disorders 5th. McGraw-Hill. 2015: 1673. ISBN 978-0-07-179672-9.
- ^ Larsen JE, Minna JD. Molecular biology of lung cancer: clinical implications. Clinics in Chest Medicine. December 2011, 32 (4): 703–40. PMC 3367865
 . PMID 22054881. doi:10.1016/j.ccm.2011.08.003.
. PMID 22054881. doi:10.1016/j.ccm.2011.08.003.
- ^ Cogliano VJ, Baan R, Straif K, Grosse Y, Lauby-Secretan B, El Ghissassi F, et al. Preventable exposures associated with human cancers (PDF). Journal of the National Cancer Institute. December 2011, 103 (24): 1827–39 [2015年8月4日]. PMC 3243677
 . PMID 22158127. doi:10.1093/jnci/djr483. (原始内容 (PDF)存档于2012年9月20日).
. PMID 22158127. doi:10.1093/jnci/djr483. (原始内容 (PDF)存档于2012年9月20日).
- ^ Cooper WA, Lam DC, O'Toole SA, Minna JD. Molecular biology of lung cancer. Journal of Thoracic Disease. October 2013,. 5 Suppl 5 (Suppl. 5): S479–90. PMC 3804875
 . PMID 24163741. doi:10.3978/j.issn.2072-1439.2013.08.03. (原始内容存档 (PDF)于2017年9月10日).
. PMID 24163741. doi:10.3978/j.issn.2072-1439.2013.08.03. (原始内容存档 (PDF)于2017年9月10日).
- ^ Tobias J, Hochhauser D. Chapter 12. Cancer and its Management 6th. Wiley-Blackwell. 2010: 200. ISBN 978-1-4051-7015-4.
- ^ 61.0 61.1 61.2 61.3 Herbst RS, Heymach JV, Lippman SM. Lung cancer. The New England Journal of Medicine. September 2008, 359 (13): 1367–80. PMID 18815398. doi:10.1056/NEJMra0802714. (原始内容存档于2008年9月28日).
- ^ Aviel-Ronen S, Blackhall FH, Shepherd FA, Tsao MS. K-ras mutations in non-small-cell lung carcinoma: a review. Clinical Lung Cancer (Cancer Information Group). July 2006, 8 (1): 30–8. PMID 16870043. doi:10.3816/CLC.2006.n.030.
- ^ Kumar V, Abbas AK, Aster JC. Chapter 5. Robbins Basic Pathology 9th. Elsevier Saunders. 2013: 212. ISBN 978-1-4377-1781-5.
- ^ 64.0 64.1 Jakopovic, M; Thomas A; Balasubramaniam S. Targeting the epigenome in lung cancer: expanding approaches to epigenetic therapy (PDF). Frontiers in Oncology. 2013年10月, 3 (261) [2015-08-04]. PMC 3793201
 . PMID 24130964. doi:10.3389/fonc.2013.00261. (原始内容 (PDF)存档于2021-05-06).
. PMID 24130964. doi:10.3389/fonc.2013.00261. (原始内容 (PDF)存档于2021-05-06).
- ^ 65.0 65.1 Mulvihill MS, Kratz JR, Pham P, Jablons DM, He B. The role of stem cells in airway repair: implications for the origins of lung cancer. Chinese Journal of Cancer. February 2013, 32 (2): 71–4. PMC 3845611
 . PMID 23114089. doi:10.5732/cjc.012.10097.
. PMID 23114089. doi:10.5732/cjc.012.10097.
- ^ 66.0 66.1 Powell CA, Halmos B, Nana-Sinkam SP. Update in lung cancer and mesothelioma 2012. American Journal of Respiratory and Critical Care Medicine. July 2013, 188 (2): 157–66. PMC 3778761
 . PMID 23855692. doi:10.1164/rccm.201304-0716UP. (原始内容存档 (PDF)于2017年9月10日).
. PMID 23855692. doi:10.1164/rccm.201304-0716UP. (原始内容存档 (PDF)于2017年9月10日).
- ^ Ost D. Chapter 110: Approach to the patient with pulmonary nodules. Grippi MA, Elias JA, Fishman JA, Kotloff RM, Pack AI, Senior RM (编). Fishman's Pulmonary Diseases and Disorders 5th. McGraw-Hill. 2015: 1685. ISBN 978-0-07-179672-9.
- ^ Miller, WT. Fishman's Pulmonary Diseases and Disorders 4th. McGraw-Hill. 2008: 486. ISBN 0-07-145739-9.
- ^ Frank L, Quint LE. Chest CT incidentalomas: thyroid lesions, enlarged mediastinal lymph nodes, and lung nodules. Cancer Imaging. March 2012, 12 (1): 41–8. PMC 3335330
 . PMID 22391408. doi:10.1102/1470-7330.2012.0006.
. PMID 22391408. doi:10.1102/1470-7330.2012.0006.
- ^ 70.0 70.1 70.2 70.3 70.4 American College of Chest Physicians; American Thoracic Society. Five Things Physicians and Patients Should Question. Choosing Wisely: an initiative of the ABIM Foundation. American College of Chest Physicians and American Thoracic Society. September 2013 [2013年1月6日]. (原始内容存档于2013年11月3日).
- ^ Gao, Jian-Wei; Rizzo, Stefania; Ma, Li-Hong; Qiu, Xiang-Yu; Warth, Arne; Seki, Nobuhiko; Hasegawa, Mizue; Zou, Jia-Wei; Li, Qian. Pulmonary ground-glass opacity: computed tomography features, histopathology and molecular pathology. Translational Lung Cancer Research. 2017-2, 6 (1): 68–75 [2018-04-19]. ISSN 2218-6751. PMC 5344841
 . PMID 28331826. doi:10.21037/tlcr.2017.01.02. (原始内容存档于2021-05-06).
. PMID 28331826. doi:10.21037/tlcr.2017.01.02. (原始内容存档于2021-05-06).
- ^ Migliore, Marcello; Fornito, Mariaconcetta; Palazzolo, Manuela; Criscione, Alessandra; Gangemi, Mariapia; Borrata, Francesco; Vigneri, Paolo; Nardini, Marco; Dunning, Joel. Ground glass opacities management in the lung cancer screening era. Annals of Translational Medicine. 2017-08-31, 6 (5) [2018-04-19]. ISSN 2305-5847. doi:10.21037/16332. (原始内容存档于2021-05-06).
- ^ 本圖對於吸菸者的定義為現在正在抽菸者,或曾經吸菸超過一年者。詳細百分率請參考 維基共享資源。參考文獻:Table 2 互联网档案馆的存檔,存档日期2017-09-10. in: Kenfield SA, Wei EK, Stampfer MJ, Rosner BA, Colditz GA. Comparison of aspects of smoking among the four histological types of lung cancer. Tobacco Control. June 2008, 17 (3): 198–204. PMC 3044470
 . PMID 18390646. doi:10.1136/tc.2007.022582.
. PMID 18390646. doi:10.1136/tc.2007.022582.
- ^ 74.0 74.1 Kumar V, Abbas AK, Aster JC. 12. Robbins Basic Pathology 9th. Elsevier Saunders. 2013: 505. ISBN 978-1-4377-1781-5.
- ^ Subramanian J, Govindan R. Lung cancer in never smokers: a review. Journal of Clinical Oncology (American Society of Clinical Oncology). February 2007, 25 (5): 561–70. PMID 17290066. doi:10.1200/JCO.2006.06.8015.
- ^ Raz DJ, He B, Rosell R, Jablons DM. Bronchioloalveolar carcinoma: a review. Clinical Lung Cancer. March 2006, 7 (5): 313–22. PMID 16640802. doi:10.3816/CLC.2006.n.012.
- ^ Rosti G, Bevilacqua G, Bidoli P, Portalone L, Santo A, Genestreti G. Small cell lung cancer. Annals of Oncology. March 2006,. 17 Suppl 2 (Suppl. 2): ii5–10. PMID 16608983. doi:10.1093/annonc/mdj910.
- ^ Seo JB, Im JG, Goo JM, Chung MJ, Kim MY. Atypical pulmonary metastases: spectrum of radiologic findings. Radiographics. 2001-03-01, 21 (2): 403–17. PMID 11259704. doi:10.1148/radiographics.21.2.g01mr17403. (原始内容存档于2007年10月11日).
- ^ Tan D, Zander DS. Immunohistochemistry for Assessment of Pulmonary and Pleural Neoplasms: A Review and Update. Int J Clin Exp Pathol. 2008, 1 (1): 19–31. PMC 2480532
 . PMID 18784820.
. PMID 18784820.
- ^ 80.0 80.1 Connolly JL, Goldsmith JD, Wang HH, et al. 37: Principles of Cancer Pathology. Holland-Frei Cancer Medicine 8th. People's Medical Publishing House. 2010. ISBN 978-1-60795-014-1.
- ^ 81.0 81.1 Detterbeck, Frank C.; Boffa, Daniel J.; Kim, Anthony W.; Tanoue, Lynn T. The Eighth Edition Lung Cancer Stage Classification. Chest. 2017-01-01, 151 (1): 193–203 [2018-04-05]. ISSN 0012-3692. doi:10.1016/j.chest.2016.10.010. (原始内容存档于2022-05-25).
- ^ 82.0 82.1 82.2 Rami-Porta R, Crowley JJ, Goldstraw P. The revised TNM staging system for lung cancer (PDF). Annals of Thoracic and Cardiovascular Surgery. February 2009, 15 (1): 4–9. PMID 19262443. (原始内容存档 (PDF)于2012年5月9日).
- ^ Dela Cruz CS, Tanoue LT, Matthay RA. Lung cancer: epidemiology, etiology, and prevention. Clinics in Chest Medicine. December 2011, 32 (4): 605–44. PMC 3864624
 . PMID 22054876. doi:10.1016/j.ccm.2011.09.001. (原始内容存档 (PDF)于2017年9月10日).
. PMID 22054876. doi:10.1016/j.ccm.2011.09.001. (原始内容存档 (PDF)于2017年9月10日).
- ^ Goodman GE. Lung cancer. 1: prevention of lung cancer (PDF). Thorax. November 2002, 57 (11): 994–999. PMC 1746232
 . PMID 12403886. doi:10.1136/thorax.57.11.994. (原始内容存档 (PDF)于2017-09-10).
. PMID 12403886. doi:10.1136/thorax.57.11.994. (原始内容存档 (PDF)于2017-09-10).
- ^ McNabola A, Gill LW. The control of environmental tobacco smoke: a policy review. International Journal of Environmental Research and Public Health. February 2009, 6 (2): 741–58. PMC 2672352
 . PMID 19440413. doi:10.3390/ijerph6020741.
. PMID 19440413. doi:10.3390/ijerph6020741.
- ^ Pandey G. Bhutan's smokers face public ban. BBC. February 2005 [2007年9月7日]. (原始内容存档于2008年4月7日).
- ^ Pandey G. Indian ban on smoking in public. BBC. 2008-10-02 [2012年4月25日]. (原始内容存档于2009年1月15日).
- ^ UN health agency calls for total ban on tobacco advertising to protect young (新闻稿). United Nations News service. 2008-05-30. (原始内容存档于2016年3月4日).
- ^ Gutierrez A, Suh R, Abtin F, Genshaft S, Brown K. Lung cancer screening. Seminars in Interventional Radiology. June 2013, 30 (2): 114–20. PMC 3709936
 . PMID 24436526. doi:10.1055/s-0033-1342951.
. PMID 24436526. doi:10.1055/s-0033-1342951.
- ^ 90.0 90.1 Usman Ali M, Miller J, Peirson L, Fitzpatrick-Lewis D, Kenny M, Sherifali D, Raina P. Screening for lung cancer: A systematic review and meta-analysis. Preventive Medicine. August 2016, 89: 301–14. PMID 27130532. doi:10.1016/j.ypmed.2016.04.015.
- ^ Jaklitsch MT, Jacobson FL, Austin JH, et al. The American Association for Thoracic Surgery guidelines for lung cancer screening using low-dose computed tomography scans for lung cancer survivors and other high-risk groups. Journal of Thoracic and Cardiovascular Surgery. July 2012, 144 (1): 33–38. PMID 22710039. doi:10.1016/j.jtcvs.2012.05.060.
- ^ Bach PB, Mirkin JN, Oliver TK, et al. Benefits and harms of CT screening for lung cancer: a systematic review. JAMA: The Journal of the American Medical Association. June 2012, 307 (22): 2418–2429. PMC 3709596
 . PMID 22610500. doi:10.1001/jama.2012.5521.
. PMID 22610500. doi:10.1001/jama.2012.5521.
- ^ 93.0 93.1 Aberle DR, Abtin F, Brown K. Computed tomography screening for lung cancer: has it finally arrived? Implications of the national lung screening trial. Journal of Clinical Oncology. March 2013, 31 (8): 1002–8. PMC 3589698
 . PMID 23401434. doi:10.1200/JCO.2012.43.3110.
. PMID 23401434. doi:10.1200/JCO.2012.43.3110.
- ^ Bach PB, Mirkin JN, Oliver TK, Azzoli CG, Berry DA, Brawley OW, Byers T, Colditz GA, Gould MK, Jett JR, Sabichi AL, Smith-Bindman R, Wood DE, Qaseem A, Detterbeck FC. Benefits and harms of CT screening for lung cancer: a systematic review. JAMA. June 2012, 307 (22): 2418–29. PMC 3709596
 . PMID 22610500. doi:10.1001/jama.2012.5521.
. PMID 22610500. doi:10.1001/jama.2012.5521.
- ^ Manser R, Lethaby A, Irving LB, Stone C, Byrnes G, Abramson MJ, Campbell D. Screening for lung cancer. The Cochrane Database of Systematic Reviews. June 2013, 6 (6): CD001991. PMID 23794187. doi:10.1002/14651858.CD001991.pub3.
- ^ Krist, Alex H.; Davidson, Karina W.; Mangione, Carol M.; Barry, Michael J.; Cabana, Michael; Caughey, Aaron B.; Davis, Esa M.; Donahue, Katrina E.; Doubeni, Chyke A. Screening for Lung Cancer. JAMA. 2021-03-09, 325 (10): 962 [2021-03-16]. ISSN 0098-7484. doi:10.1001/jama.2021.1117. (原始内容存档于2021-05-06) (英语).
- ^ Moyer VA. Screening for lung cancer: U.S. Preventive Services Task Force recommendation statement. Annals of Internal Medicine. March 2014, 160 (5): 330–8. PMID 24378917. doi:10.7326/M13-2771.
- ^ Baldwin DR, Hansell DM, Duffy SW, Field JK. Lung cancer screening with low dose computed tomography. BMJ. March 2014, 348: g1970. PMID 24609921. doi:10.1136/bmj.g1970.
- ^ 存档副本. [2021-07-10]. (原始内容存档于2022-06-21).
- ^ 100.0 100.1 100.2 Fabricius P, Lange P. Diet and lung cancer. Monaldi Archives for Chest Disease = Archivio Monaldi Per Le Malattie Del Torace. July–September 2003, 59 (3): 207–11. PMID 15065316.
- ^ Fritz H, Kennedy D, Fergusson D, Fernandes R, Doucette S, Cooley K, Seely A, Sagar S, Wong R, Seely D. Vitamin A and retinoid derivatives for lung cancer: a systematic review and meta analysis. PLOS One. 2011, 6 (6): e21107. PMC 3124481
 . PMID 21738614. doi:10.1371/journal.pone.0021107.
. PMID 21738614. doi:10.1371/journal.pone.0021107. 
- ^ Herr C, Greulich T, Koczulla RA, Meyer S, Zakharkina T, Branscheidt M, Eschmann R, Bals R. The role of vitamin D in pulmonary disease: COPD, asthma, infection, and cancer. Respiratory Research. March 2011, 12 (1): 31. PMC 3071319
 . PMID 21418564. doi:10.1186/1465-9921-12-31.
. PMID 21418564. doi:10.1186/1465-9921-12-31.
- ^ 103.0 103.1 Key TJ. Fruit and vegetables and cancer risk. British Journal of Cancer. January 2011, 104 (1): 6–11. PMC 3039795
 . PMID 21119663. doi:10.1038/sj.bjc.6606032.
. PMID 21119663. doi:10.1038/sj.bjc.6606032.
- ^ Sun Y, Li Z, Li J, Li Z, Han J. A Healthy Dietary Pattern Reduces Lung Cancer Risk: A Systematic Review and Meta-Analysis. Nutrients. March 2016, 8 (3): 134. PMC 4808863
 . PMID 26959051. doi:10.3390/nu8030134.
. PMID 26959051. doi:10.3390/nu8030134.
- ^ Ferrell B, Koczywas M, Grannis F, Harrington A. Palliative care in lung cancer. The Surgical Clinics of North America. April 2011, 91 (2): 403–17, ix. PMC 3655433
 . PMID 21419260. doi:10.1016/j.suc.2010.12.003.
. PMID 21419260. doi:10.1016/j.suc.2010.12.003.
- ^ Chang L, Rivera MP. Chapter 112: Clinical evaluation, diagnosis, and staging of lung cancer. Grippi MA, Elias JA, Fishman JA, Kotloff RM, Pack AI, Senior RM (编). Fishman's Pulmonary Diseases and Disorders 5th. McGraw-Hill. 2015: 1728. ISBN 978-0-07-179672-9.
- ^ Kaiser LR. Fishman's Pulmonary Diseases and Disorders 4th. McGraw-Hill. 2008: 1855–1856. ISBN 0-07-145739-9.
- ^ Odell, DD; Kent MS; Fernando HC. Sublobar resection with brachytherapy mesh for stage I non-small cell lung cancer. Seminars in Thoracic and Cardiovascular Surgery. 2010-01-03, 22 (1): 32–37. PMID 20813314. doi:10.1053/j.semtcvs.2010.04.003.
- ^ Reznik SI, Smythe WR. Chapter 113: Treatment of non-small-cell lung cancer: surgery. Grippi MA, Elias JA, Fishman JA, Kotloff RM, Pack AI, Senior RM (编). Fishman's Pulmonary Diseases and Disorders 5th. McGraw-Hill. 2015: 1737–1738. ISBN 978-0-07-179672-9.
- ^ Alam N, Flores RM. Video-assisted thoracic surgery (VATS) lobectomy: the evidence base. Jsls. July–September 2007, 11 (3): 368–74. PMC 3015831
 . PMID 17931521.
. PMID 17931521.
- ^ Rueth NM, Andrade RS. Is VATS lobectomy better: perioperatively, biologically and oncologically?. The Annals of Thoracic Surgery. June 2010, 89 (6): S2107–11. PMID 20493991. doi:10.1016/j.athoracsur.2010.03.020.
- ^ Simon GR, Turrisi A. Management of small cell lung cancer: ACCP evidence-based clinical practice guidelines (2nd edition). Chest. September 2007, 132 (3 Suppl): 324S–339S. PMID 17873178. doi:10.1378/chest.07-1385.
- ^ 113.0 113.1 National Comprehensive Cancer Network. NCCN Guidelines 2018 - Small Cell Lung Cancer (PDF). 2018-01-17 [2018-04-08]. (原始内容 (PDF)存档于2007-04-22).
- ^ Arriagada R, Goldstraw P, Le Chevalier T. Oxford Textbook of Oncology 2nd. Oxford University Press. 2002: 2094. ISBN 0-19-262926-3.
- ^ Hatton MQ, Martin JE. Continuous hyperfractionated accelerated radiotherapy (CHART) and non-conventionally fractionated radiotherapy in the treatment of non-small cell lung cancer: a review and consideration of future directions. Clinical Oncology. June 2010, 22 (5): 356–64. PMID 20399629. doi:10.1016/j.clon.2010.03.010.
- ^ Rydzewska, Larysa (编). Postoperative radiotherapy for non-small cell lung cancer. The Cochrane Database of Systematic Reviews. April 2005, (2): CD002142. PMID 15846628. doi:10.1002/14651858.CD002142.pub2.
- ^ Le Péchoux C. Role of postoperative radiotherapy in resected non-small cell lung cancer: a reassessment based on new data. The Oncologist. 2011, 16 (5): 672–81. PMC 3228187
 . PMID 21378080. doi:10.1634/theoncologist.2010-0150.
. PMID 21378080. doi:10.1634/theoncologist.2010-0150.
- ^ Ikushima, Hitoshi. Radiation therapy: state of the art and the future. The Journal of Medical Investigation. 2010, 57 (1,2): 1–11 [2018-09-20]. ISSN 1349-6867. PMID 20299738. doi:10.2152/jmi.57.1. (原始内容存档于2021-04-24).
- ^ Reveiz L, Rueda JR, Cardona AF. Palliative endobronchial brachytherapy for non-small cell lung cancer. The Cochrane Database of Systematic Reviews. December 2012, 12: CD004284. PMID 23235606. doi:10.1002/14651858.CD004284.pub3.
- ^ Paumier A, Cuenca X, Le Péchoux C. Prophylactic cranial irradiation in lung cancer. Cancer Treatment Reviews. June 2011, 37 (4): 261–5. PMID 20934256. doi:10.1016/j.ctrv.2010.08.009.
- ^ Girard N, Mornex F. [Stereotactic radiotherapy for non-small cell lung cancer: From concept to clinical reality. 2011 update]. Cancer Radiotherapie. October 2011, 15 (6–7): 522–6. PMID 21889901. doi:10.1016/j.canrad.2011.07.241.
- ^ Fairchild A, Harris K, Barnes E, et al. Palliative thoracic radiotherapy for lung cancer: a systematic review. Journal of Clinical Oncology. August 2008, 26 (24): 4001–4011. PMID 18711191. doi:10.1200/JCO.2007.15.3312. (原始内容存档于2013-04-13).
- ^ Hann CL, Rudin CM. Management of small-cell lung cancer: incremental changes but hope for the future. Oncology (Williston Park). 2008-11-30, 22 (13): 1486–92. PMID 19133604.
- ^ Murray N, Turrisi AT. A review of first-line treatment for small-cell lung cancer. Journal of Thoracic Oncology. March 2006, 1 (3): 270–8. PMID 17409868. doi:10.1016/s1556-0864(15)31579-3.
- ^ Azim HA, Ganti AK. Treatment options for relapsed small-cell lung cancer. Anti-Cancer Drugs. March 2007, 18 (3): 255–61. PMID 17264756. doi:10.1097/CAD.0b013e328011a547.
- ^ MacCallum C, Gillenwater HH. Second-line treatment of small-cell lung cancer. Current Oncology Reports. July 2006, 8 (4): 258–64. PMID 17254525. doi:10.1007/s11912-006-0030-8.
- ^ 127.0 127.1 NSCLC Meta-Analyses Collaborative Group. Chemotherapy in Addition to Supportive Care Improves Survival in Advanced Non–Small-Cell Lung Cancer: A Systematic Review and Meta-Analysis of Individual Patient Data From 16 Randomized Controlled Trials. J. Clin. Oncol. October 2008, 26 (28): 4617–25. PMC 2653127
 . PMID 18678835. doi:10.1200/JCO.2008.17.7162.
. PMID 18678835. doi:10.1200/JCO.2008.17.7162.
- ^ Carr LL, Jett JR. Chapter 114: Treatment of non-small-cell lung cancer: chemotherapy. Grippi MA, Elias JA, Fishman JA, Kotloff RM, Pack AI, Senior RM (编). Fishman's Pulmonary Diseases and Disorders 5th. McGraw-Hill. 2015: 1752. ISBN 978-0-07-179672-9.
- ^ 129.0 129.1 Clegg A, Scott DA, Hewitson P, Sidhu M, Waugh N. Clinical and cost effectiveness of paclitaxel, docetaxel, gemcitabine, and vinorelbine in non-small cell lung cancer: a systematic review. Thorax (BMJ Publishing Group). January 2002, 57 (1): 20–8. PMC 1746188
 . PMID 11809985. doi:10.1136/thorax.57.1.20.
. PMID 11809985. doi:10.1136/thorax.57.1.20.
- ^ Fuld AD, Dragnev KH, Rigas JR. Pemetrexed in advanced non-small-cell lung cancer. Expert Opin Pharmacother. June 2010, 11 (8): 1387–402. PMID 20446853. doi:10.1517/14656566.2010.482560.
- ^ Santos FN, de Castria TB, Cruz MR, Riera R. Chemotherapy for advanced non-small cell lung cancer in the elderly population. The Cochrane Database of Systematic Reviews. October 2015, (10): CD010463. PMID 26482542. doi:10.1002/14651858.CD010463.pub2.
- ^ Carbone DP, Felip E. Adjuvant therapy in non-small cell lung cancer: future treatment prospects and paradigms. Clinical Lung Cancer. September 2011, 12 (5): 261–71. PMID 21831720. doi:10.1016/j.cllc.2011.06.002.
- ^ 133.0 133.1 Le Chevalier T. Adjuvant chemotherapy for resectable non-small-cell lung cancer: where is it going?. Annals of Oncology. October 2010,. 21 Suppl 7 (Suppl. 7): vii196–8 [2013-01-21]. PMID 20943614. doi:10.1093/annonc/mdq376. (原始内容存档于2013-01-13).
- ^ Burdett S, Pignon JP, Tierney J, Tribodet H, Stewart L, Le Pechoux C, et al. Adjuvant chemotherapy for resected early-stage non-small cell lung cancer. The Cochrane Database of Systematic Reviews. March 2015, (3): CD011430. PMID 25730344. doi:10.1002/14651858.CD011430.
- ^ He J, Shen J, Yang C, Jiang L, Liang W, Shi X, Xu X, He J. Adjuvant Chemotherapy for the Completely Resected Stage IB Nonsmall Cell Lung Cancer: A Systematic Review and Meta-Analysis. Medicine. June 2015, 94 (22): e903. PMC 4616365
 . PMID 26039122. doi:10.1097/MD.0000000000000903.
. PMID 26039122. doi:10.1097/MD.0000000000000903.
- ^ Preoperative chemotherapy for non-small-cell lung cancer: a systematic review and meta-analysis of individual participant data. Lancet. May 2014, 383 (9928): 1561–71. PMC 4022989
 . PMID 24576776. doi:10.1016/S0140-6736(13)62159-5.
. PMID 24576776. doi:10.1016/S0140-6736(13)62159-5.
- ^ Burdett SS, Stewart LA, Rydzewska L. Chemotherapy and surgery versus surgery alone in non-small cell lung cancer. The Cochrane Database of Systematic Reviews. July 2007, (3): CD006157. PMID 17636828. doi:10.1002/14651858.CD006157.pub2.
- ^ Souquet PJ, Chauvin F, Boissel JP, Bernard JP. Meta-analysis of randomised trials of systemic chemotherapy versus supportive treatment in non-resectable non-small cell lung cancer. Lung Cancer. April 1995,. 12 Suppl 1: S147–54. PMID 7551923. doi:10.1016/0169-5002(95)00430-9.
- ^ Non-Small Cell Lung Cancer Collaborative Group. Chemotherapy and supportive care versus supportive care alone for advanced non-small cell lung cancer. The Cochrane Database of Systematic Reviews. 2010-05-12, (5): CD007309 [2018-04-09]. ISSN 1469-493X. PMID 20464750. doi:10.1002/14651858.CD007309.pub2. (原始内容存档于2020-05-15).
- ^ Sörenson S, Glimelius B, Nygren P. A systematic overview of chemotherapy effects in non-small cell lung cancer. Acta Oncologica. 2001, 40 (2–3): 327–39. PMID 11441939. doi:10.1080/02841860151116402.
- ^ Clegg A, Scott DA, Sidhu M, Hewitson P, Waugh N. A rapid and systematic review of the clinical effectiveness and cost-effectiveness of paclitaxel, docetaxel, gemcitabine and vinorelbine in non-small-cell lung cancer. Health Technology Assessment. 2001, 5 (32): 1–195. PMID 12065068. (原始内容存档于2017-08-30).
- ^ Non-Small Cell Lung Cancer Collaborative, Group. Chemotherapy and supportive care versus supportive care alone for advanced non-small cell lung cancer.. The Cochrane Database of Systematic Reviews. 2010-05-12, (5): CD007309. PMID 20464750. doi:10.1002/14651858.CD007309.pub2.
- ^ D'Antonio C, Passaro A, Gori B, Del Signore E, Migliorino MR, Ricciardi S, Fulvi A, de Marinis F. Bone and brain metastasis in lung cancer: recent advances in therapeutic strategies. Therapeutic Advances in Medical Oncology. May 2014, 6 (3): 101–14. PMC 3987652
 . PMID 24790650. doi:10.1177/1758834014521110.
. PMID 24790650. doi:10.1177/1758834014521110.
- ^ 安维汀正式在华上市 将为中国患者打开希望之门. [2015-08-09]. (原始内容存档于2015-10-02).
- ^ Hellmann, Matthew D.; Ciuleanu, Tudor-Eliade; Pluzanski, Adam; Lee, Jong Seok; Otterson, Gregory A.; Audigier-Valette, Clarisse; Minenza, Elisa; Linardou, Helena; Burgers, Sjaak. Nivolumab plus Ipilimumab in Lung Cancer with a High Tumor Mutational Burden. New England Journal of Medicine. 2018-04-16, 0 (0): null. ISSN 0028-4793. PMID 29658845. doi:10.1056/NEJMoa1801946.
- ^ 146.0 146.1 146.2 146.3 146.4 Syn NL, Teng MW, Mok TS, Soo RA. De-novo and acquired resistance to immune checkpoint targeting. The Lancet. Oncology. December 2017, 18 (12): e731–e741 [2018-04-10]. PMID 29208439. doi:10.1016/s1470-2045(17)30607-1. (原始内容存档于2019-05-14).
- ^ Powell, CA; Halmos, B; Nana-Sinkam, SP. Update in lung cancer and mesothelioma 2012. American Journal of Respiratory and Critical Care Medicine. 2013年7月, 188 (2): 157–166. PMC 3778761
 . PMID 23855692. doi:10.1164/rccm.201304-0716UP.
. PMID 23855692. doi:10.1164/rccm.201304-0716UP.
- ^ Spaans JN, Goss GD. Trials to Overcome Drug Resistance to EGFR and ALK Targeted Therapies - Past, Present, and Future. Frontiers in Oncology. August 2014, 4 (233): 233. PMC 4145253
 . PMID 25221748. doi:10.3389/fonc.2014.00233.
. PMID 25221748. doi:10.3389/fonc.2014.00233.
- ^ Lazarus DR, Eapen GA. Chapter 16: Bronchoscopic interventions for lung cancer. Roth JA, Hong WK, Komaki RU (编). Lung Cancer 4th. Wiley-Blackwell. 2014. ISBN 978-1-118-46874-6.
- ^ Khemasuwan D, Mehta AC, Wang KP. Past, present, and future of endobronchial laser photoresection. Journal of Thoracic Disease. December 2015, 7 (Suppl 4): S380–8. PMC 4700383
 . PMID 26807285. doi:10.3978/j.issn.2072-1439.2015.12.55.
. PMID 26807285. doi:10.3978/j.issn.2072-1439.2015.12.55.
- ^ Parikh RB, Kirch RA, Smith TJ, Temel JS. Early specialty palliative care--translating data in oncology into practice. The New England Journal of Medicine. December 2013, 369 (24): 2347–51. PMC 3991113
 . PMID 24328469. doi:10.1056/nejmsb1305469.
. PMID 24328469. doi:10.1056/nejmsb1305469.
- ^ Kelley AS, Meier DE. Palliative care--a shifting paradigm. The New England Journal of Medicine. August 2010, 363 (8): 781–2. PMID 20818881. doi:10.1056/NEJMe1004139.
- ^ 153.0 153.1 Prince-Paul M. When hospice is the best option: an opportunity to redefine goals. Oncology. April 2009, 23 (4 Suppl Nurse Ed): 13–7. PMID 19856592.
- ^ Ridge CA, McErlean AM, Ginsberg MS. Epidemiology of lung cancer. Seminars in Interventional Radiology. June 2013, 30 (2): 93–8. PMC 3709917
 . PMID 24436524. doi:10.1055/s-0033-1342949.
. PMID 24436524. doi:10.1055/s-0033-1342949.
- ^ Lung cancer survival statistics. Cancer Research UK. (原始内容存档于2014年10月7日).
- ^ Lung cancer survival statistics. [2014年10月28日]. (原始内容存档于2014年10月9日).
- ^ Non-Small Cell Lung Cancer Treatment. PDQ for Health Professionals. National Cancer Institute. [2015-11-17]. PMID 26389304. (原始内容存档于2021-08-28).
- ^ Small Cell Lung Cancer Treatment. PDQ for Health Professionals. National Cancer Institute. 2012 [2012年5月16日]. (原始内容存档于2012年5月13日).
- ^ Spiro SG. 18.19.1. Oxford Textbook Medicine 5th. OUP Oxford. 2010. ISBN 978-0-19-920485-4.
- ^ SEER data (SEER.cancer.gov) Median Age of Cancer Patients at Diagnosis 2002–2003 互联网档案馆的存檔,存档日期2011-05-16.
- ^ SEER data (SEER.cancer.gov) Median Age of Cancer Patients at Death 2002–2006 互联网档案馆的存檔,存档日期2011-07-22.
- ^ Slatore CG, Au DH, Gould MK. An official American Thoracic Society systematic review: insurance status and disparities in lung cancer practices and outcomes. American Journal of Respiratory and Critical Care Medicine. November 2010, 182 (9): 1195–205 [2012-11-22]. PMID 21041563. doi:10.1164/rccm.2009-038ST. (原始内容存档于2020-06-13).
- ^ Stewart, edited by Bernard W.; Wild, Christopher P. World cancer report 2014. Lyon: IARC Press. 2014: 350–352. ISBN 9789283204299.
- ^ Lung cancer statistics. Cancer Research UK. [2014-10-28]. (原始内容存档于2015-05-12).
- ^ Jemal A, Tiwari RC, Murray T, Ghafoor A, Samuels A, Ward E, Feuer EJ, Thun MJ. Cancer statistics, 2004. Ca. 2004, 54 (1): 8–29. PMID 14974761. doi:10.3322/canjclin.54.1.8.
- ^ Proctor RN. The history of the discovery of the cigarette-lung cancer link: evidentiary traditions, corporate denial, global toll. Tobacco Control. March 2012, 21 (2): 87–91. PMID 22345227. doi:10.1136/tobaccocontrol-2011-050338.
- ^ Lum KL, Polansky JR, Jackler RK, Glantz SA. Signed, sealed and delivered: "big tobacco" in Hollywood, 1927-1951. Tobacco Control. October 2008, 17 (5): 313–23. PMC 2602591
 . PMID 18818225. doi:10.1136/tc.2008.025445. (原始内容存档于2009年4月4日).
. PMID 18818225. doi:10.1136/tc.2008.025445. (原始内容存档于2009年4月4日).
- ^ Lovato C, Watts A, Stead LF. Impact of tobacco advertising and promotion on increasing adolescent smoking behaviours. The Cochrane Database of Systematic Reviews. October 2011, (10): CD003439. PMID 21975739. doi:10.1002/14651858.CD003439.pub2.
- ^ Kemp FB. Smoke free policies in Europe. An overview. Pneumologia. Jul–Sep 2009, 58 (3): 155–8. PMID 19817310.
- ^ SEER stat fact sheets: Lung and Bronchus. Surveillance Epidemiology and End Results. National Cancer Institute. 2010 [2012-11-22]. (原始内容存档于2016-03-04).
- ^ Gender in lung cancer and smoking research (PDF). World Health Organization. 2004 [2007年5月26日]. (原始内容存档 (PDF)于2007年6月14日).
- ^ Zhang J, Ou JX, Bai CX. Tobacco smoking in China: prevalence, disease burden, challenges and future strategies. Respirology. November 2011, 16 (8): 1165–72. PMID 21910781. doi:10.1111/j.1440-1843.2011.02062.x.
- ^ Behera D, Balamugesh T. Lung cancer in India (PDF). The Indian Journal of Chest Diseases & Allied Sciences. 2004, 46 (4): 269–81. PMID 15515828. (原始内容存档 (PDF)于2008年12月17日).
- ^ HONORING VETERANS WITH GOOD HEALTH. 2014-11-07 [2015-12-01]. (原始内容存档于2015-11-28).
- ^ Lung Cancer As It Affects Veterans And Military. [2015-12-01]. (原始内容存档于2015-12-08).
- ^ Cancer incidence statistics. Cancer Research UK. [2016-12-20]. (原始内容存档于2017-01-02).
- ^ Lung cancer statistics. Cancer Research UK. [2016-12-20]. (原始内容存档于2015-05-12).
- ^ Caicun, Zhou. Lung cancer molecular epidemiology in China: recent trends. doi:10.3978/j.issn.2218-6751.2014.09.01.
- ^ Bing-Yen, Wang; Jing-Yang Huang; Ching-Yuan Cheng; Ching-Hsiung Lin; Jiunn- Liang Ko; Yung-Po Liaw. Lung Cancer and Prognosis in Taiwan: A Population-Based Cancer Registry. doi:10.1097/JTO.0b013e31829ceba4.
- ^ Charloux A, Quoix E, Wolkove N, Small D, Pauli G, Kreisman H. The increasing incidence of lung adenocarcinoma: reality or artefact? A review of the epidemiology of lung adenocarcinoma. International Journal of Epidemiology. February 1997, 26 (1): 14–23. PMID 9126499. doi:10.1093/ije/26.1.14. (原始内容存档于2008年12月5日).
- ^ Kadara H, Kabbout M, Wistuba II. Pulmonary adenocarcinoma: a renewed entity in 2011. Respirology. January 2012, 17 (1): 50–65. PMID 22040022. doi:10.1111/j.1440-1843.2011.02095.x.
- ^ Morgagni GB. De sedibus et causis morborum per anatomen indagatis. 1761. OL 24830495M.
- ^ Bayle GL. Recherches sur la phthisie pulmonaire. Paris. 1810. OL 15355651W (法语).
- ^ 184.0 184.1 Witschi H. A short history of lung cancer. Toxicological Sciences. November 2001, 64 (1): 4–6. PMID 11606795. doi:10.1093/toxsci/64.1.4. (原始内容存档于2007年3月9日).
- ^ Adler, I. Primary Malignant Growths of the Lungs and Bronchi. New York: Longmans, Green, and Company. 1912. OCLC 14783544. OL 24396062M., cited in Spiro SG, Silvestri GA. One hundred years of lung cancer. American Journal of Respiratory and Critical Care Medicine. September 2005, 172 (5): 523–9. PMID 15961694. doi:10.1164/rccm.200504-531OE.
- ^ Grannis FW. History of cigarette smoking and lung cancer. smokinglungs.com. [2007年8月6日]. (原始内容存档于2007年7月18日).
- ^ Proctor R. The Nazi War on Cancer. Princeton University Press. 2000: 173–246. ISBN 0-691-00196-0.
- ^ Doll R, Hill AB. Lung cancer and other causes of death in relation to smoking; a second report on the mortality of British doctors. British Medical Journal. November 1956, 2 (5001): 1071–81. PMC 2035864
 . PMID 13364389. doi:10.1136/bmj.2.5001.1071.
. PMID 13364389. doi:10.1136/bmj.2.5001.1071.
- ^ US Department of Health Education and Welfare. Smoking and health: report of the advisory committee to the Surgeon General of the Public Health Service (PDF). Washington, DC: US Government Printing Office. 1964. (原始内容存档 (PDF)于2008年12月17日).
- ^ 190.0 190.1 Greaves M. Cancer: the Evolutionary Legacy. Oxford University Press. 2000: 196–197. ISBN 0-19-262835-6.
- ^ Greenberg M, Selikoff IJ. Lung cancer in the Schneeberg mines: a reappraisal of the data reported by Harting and Hesse in 1879. The Annals of Occupational Hygiene. February 1993, 37 (1): 5–14. PMID 8460878. doi:10.1093/annhyg/37.1.5.
- ^ Samet JM. Radiation and cancer risk: a continuing challenge for epidemiologists. Environmental Health. April 2011, 10 (Suppl. 1): S4. PMC 3073196
 . PMID 21489214. doi:10.1186/1476-069X-10-S1-S4.
. PMID 21489214. doi:10.1186/1476-069X-10-S1-S4.
- ^ Horn L, Johnson DH. Evarts A. Graham and the first pneumonectomy for lung cancer. Journal of Clinical Oncology. July 2008, 26 (19): 3268–75 [2010-03-09]. PMID 18591561. doi:10.1200/JCO.2008.16.8260. (原始内容存档于2020-03-17).
- ^ Edwards AT. Carcinoma of the bronchus. Thorax. March 1946, 1 (1): 1–25. PMC 1018207
 . PMID 20986395. doi:10.1136/thx.1.1.1.
. PMID 20986395. doi:10.1136/thx.1.1.1.
- ^ Kabela M. [Experience with radical irradiation of bronchial cancer] [Experience with radical irradiation of bronchial cancer]. Ceskoslovenska Onkologia. 1956, 3 (2): 109–15. PMID 13383622 (德语).
- ^ Saunders M, Dische S, Barrett A, Harvey A, Gibson D, Parmar M. Continuous hyperfractionated accelerated radiotherapy (CHART) versus conventional radiotherapy in non-small-cell lung cancer: a randomised multicentre trial. CHART Steering Committee. Lancet (Elsevier). July 1997, 350 (9072): 161–5. PMID 9250182. doi:10.1016/S0140-6736(97)06305-8.
- ^ Lennox SC, Flavell G, Pollock DJ, Thompson VC, Wilkins JL. Results of resection for oat-cell carcinoma of the lung. Lancet (Elsevier). November 1968, 2 (7575): 925–7. PMID 4176258. doi:10.1016/S0140-6736(68)91163-X.
- ^ Miller AB, Fox W, Tall R. Five-year follow-up of the Medical Research Council comparative trial of surgery and radiotherapy for the primary treatment of small-celled or oat-celled carcinoma of the bronchus. Lancet (Elsevier). September 1969, 2 (7619): 501–5. PMID 4184834. doi:10.1016/S0140-6736(69)90212-8.
- ^ Cohen MH, Creaven PJ, Fossieck BE, Broder LE, Selawry OS, Johnston AV, Williams CL, Minna JD. Intensive chemotherapy of small cell bronchogenic carcinoma. Cancer Treatment Reports. 1977, 61 (3): 349–54. PMID 194691.
- ^ 200.0 200.1 200.2 Forde PM, Brahmer JR, Kelly RJ. New strategies in lung cancer: epigenetic therapy for non-small cell lung cancer. Clinical Cancer Research. May 2014, 20 (9): 2244–8. PMC 4325981
 . PMID 24644000. doi:10.1158/1078-0432.ccr-13-2088.
. PMID 24644000. doi:10.1158/1078-0432.ccr-13-2088.
- ^ 201.0 201.1 Jamal-Hanjani M, Hackshaw A, Ngai Y, Shaw J, Dive C, Quezada S, et al. Tracking genomic cancer evolution for precision medicine: the lung TRACERx study. PLoS Biology. July 2014, 12 (7): e1001906. PMC 4086714
 . PMID 25003521. doi:10.1371/journal.pbio.1001906.
. PMID 25003521. doi:10.1371/journal.pbio.1001906.
- ^ TRACERx project, Cancer Research UK science blog 互联网档案馆的存檔,存档日期2014-11-29.
- ^ Zeltsman, Masha; Dozier, Jordan; McGee, Erin; Ngai, Daniel; Adusumilli, Prasad S. CAR T-cell therapy for lung cancer and malignant pleural mesothelioma. Translational Research: The Journal of Laboratory and Clinical Medicine. 09 2017, 187: 1–10 [2018-04-14]. ISSN 1878-1810. PMC 5581988
 . PMID 28502785. doi:10.1016/j.trsl.2017.04.004. (原始内容存档于2020-05-17).
. PMID 28502785. doi:10.1016/j.trsl.2017.04.004. (原始内容存档于2020-05-17).
外部連結[编辑]
| |||||||
| 维基共享资源上的相关多媒体资源:肺癌 |
| |||||||||||||||||||||||||||||||||||||||||
|
