銀
銀(英語:Silver),俗稱白銀,是一種化學元素,其化學符號为Ag(源于拉丁語:argentum),原子序數为47,原子量為107.8682 u。銀是柔軟且帶有白色光澤的金屬,它的導電率、導熱率、反射率在金屬中名列前茅。銀在地殼中以高純度的元素(自然銀)存在,或與其他金屬以合金形式存在,也以礦石的形式存在(如輝銀礦和角銀礦)。大部分的銀是銅、金、鉛和鋅精煉的副產品。
銀長期以來被視為貴金屬。金融上,銀金屬被用於許多投資型硬幣中,有時與金一起使用,形成金銀複本位制度[2]。雖然銀的豐度高於金,但它作為自然金屬的豐度低於金[3][需要較佳来源]。
銀的純度通常用千分比描述,例如純度94%的銀合金在英文中被稱為「0.940 fine」。銀的用途廣泛,除了貨幣和投資媒介(硬幣和金條)以外,也用於太陽能電池、淨水器、珠寶、裝飾品、高價值餐具和器具(因此有銀器之稱)、電氣接觸、導電材料、特殊用途的鏡面及窗戶塗料、催化劑、彩繪玻璃的著色劑,以及糖果中的食用色素。此外,銀的化合物用於照相底片和X光底片。硝酸銀和其他銀化合物的稀溶液可作為消毒劑,添加到繃帶和傷口敷料、醫用導管和其他醫療器材中。
性质[编辑]

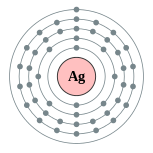
銀原子具有47個電子,電子組態為Kr4d105s1,價電子組態類似於銅(Ar3d104s 1)和金(Xe4f145d106s1),這導致金、銀、銅的物理和化學性質相似,三者都被歸類為元素週期表中的11族元素;11族也是d區元素中少數電子組態完全一致的族[5]。銀的價電子組態比較特別,在全滿的d副殼層上還有一個半滿的s副殼層,這是許多奇異性質(例如導電性、標準電極電位等等,詳見下文)的成因。[6]
銀以面心立方晶格結晶,體積配位數為12,這點也類似於銅和金。[7]
物理性质[编辑]
纯白银颜色白,有金属光泽ff质软,掺有杂质后变硬,颜色呈灰、红色。纯白银的比重为10.5,熔点961.78 °C。[來源請求]
因為獨特的電子組態,銀原子之間的金屬鍵缺乏共價特徵,而且強度相對較弱。這種特性可以解釋單晶銀的低硬度和高延展性。[8]因此可以碾压成只有0.3微米厚的透明箔,1克重的银粒就可以拉成约两公里长的细丝。[來源請求]
銀具有明亮的白色金屬光澤[9],這一特性也成為「銀色」的名稱來源[6]此外,銀還可以進行高度拋光[9]。銀的反射率甚佳;當入射光的波長大於450 nm時,銀的反射率大於鋁。[10]不過當波長小於450 nm時,銀的反射率低於鋁,並在310 nm附近下降到零。[11]
11族元素普遍具有極高的導電性和導熱性。因為它們有半滿的s副殼層,而且s副殼層不跟全滿的d副殼層產生相互作用;這種相互作用發生在其他過渡金屬中,會降低電子的躍遷。[12]
銀的導電率是所有金屬中最高的,接觸電阻則是所有金屬中最低的[5]。不過由於銀的成本較高,所以沒有廣泛運用在導線,反而是銅線比較常用;但射頻工程是一個例外(尤其是特高頻和更高的頻率),這是因為交流電在射頻下有較為顯著的集膚效應(亦即電流傾向在導體表面流動),所以鍍銀可以改善導線的導電性[13]。另外,美國在二戰期間使用了13540噸的銀製造電磁鐵,用來濃縮鈾,主要是因為戰時銅的短缺。[14][15][16]
純銀的熱導率高於其他所有金屬,不過低於非金屬碳(金剛石)和超流體氦-4[5]。
銀容易與銅、金以及鋅形成合金。鋅濃度較低的鋅-銀合金可視為「鋅溶於銀」的面心立方固體溶液,其結構與純銀類似。而隨著鋅的濃度上升,價電子濃度也上升,晶體結構會逐步轉換成體心立方(電子濃度 1.5)、複雜立方(電子濃度 1.615)和六方最密堆積(電子濃度 1.75)。[7]
同位素[编辑]
自然界存在的銀有两种稳定同位素:107Ag和109Ag,其中前者的豐度略高(51.839%)。銀的两种同位素豐度幾乎相同,這在元素周期表中十分罕見(溴是另一個例子)。銀的原子量是107.8682(2) 克/摩爾[17][18]。由於銀化合物(尤其是鹵化銀)在重量分析法中很重要,所以銀的原子量也是分析化學中一項非常重要的參數。[17]就核合成而言,銀的兩種穩定同位素都是透過中子捕獲產生的(一種是在恆星中透過S-過程產生的,另一種是在超新星中透過R-過程產生的)[19]。
銀有二十八個放射性同位素的特性已被測定,其中最穩定的依次是105Ag(半衰期41.29天)、111Ag(半衰期7.45天)、112Ag(半衰期3.13小時)。銀也有很多亚稳态核素,其中最穩定的依次是108mAg(半衰期418年)、110mAg(半衰期249.79天)、106mAg(半衰期8.28天)。其餘的放射性同位素的半衰期均短於一小時,大部分短於三分鐘[20]。
銀的同位素原子量从92.950(94Ag)到129.950(130Ag)不等。[21][22]丰度最高的稳定同位素(107Ag)之前的同位素的衰变类型主要是電子捕獲,生成钯(46号元素)的同位素,而107Ag之后的同位素的衰变类型则主要是β衰變,生成镉(48号元素)的同位素[23]。
107Pd β衰變成107Ag的半衰期為650萬年。鐵隕石是仅有的「鈀-銀比」高到可以測量107Ag富度變化的物体。由放射性产生的107Ag首次发现于1978年美國聖塔克拉拉的隕石[24]。發現者提出,一些小型鐵核的行星與其異體,可能是在一千多萬年前的核合成事件中產生的。從這熔化過的星球本體中,觀察到的107Pd–107Ag比值,反映出早期太陽系的吸積中應存在著不穩定的核種[25]。
化學[编辑]
| 氧化态 | 配位数 | 立體化學 | 代表的化合物 |
|---|---|---|---|
| 0(d10s1) | 3 | 平面 | Ag(CO)3 |
| 1(d10) | 2 | 線性 | [Ag(CN)2]- |
| 3 | 三角形平面 | AgI(PEt2Ar)2 | |
| 4 | 四面體 | [Ag(diars)2]+ | |
| 6 | 八面體 | AgF,AgCl,AgBr | |
| 2(d9) | 4 | 方形平面 | [Ag(py)4]2+ |
| 3(d8) | 4 | 方形平面 | [AgF4]- |
| 6 | 八面體 | [AgF6]3- |
就氧化性來說,銀是一種相當不活潑的金屬。銀的標準電極電位很高(E0(Ag+/Ag)= +0.799 V)[6]。這是因為它的4d副殼層全滿,不能有效屏蔽最外層5s軌域的靜電力。
在11族元素中,銀的第一游離能最低(730.8 kJ/mol,表現出5s軌域的不穩定性),不過第二和第三游離能高於銅和金(表現出4d軌域的穩定性),因此銀最常見的化合價是+1。在同一週期的過渡元素中,化合價的範圍由左至右越來越小,這是因為隨著d副殼層逐漸被填滿,能量也趨於穩定[27]。
在形成離子方面,銀和銅有些許差異;雖然銅(II)離子(Cu2+)缺乏穩定填滿的d副殼層,但是它的水合焓大於銅(I)離子(Cu+,舊稱亞銅離子),這造成Cu2+在水溶液和固體中更穩定;銀本來也應該出現這種效應,但是由於銀的第二游離能太大,所以Ag2+的穩定性較差,反而讓Ag+成為水溶液和固體中較穩定的離子[27]。
由於銀的原子半徑較小,第一游離能較高,大多數銀化合物都有顯著的共價性[6]。此外,銀的電負度為1.93,高於鉛(1.87);電子親和力方面,為125.6 kJ/mol,遠遠高於氫(72.8 kJ/mol),並且略低於氧(141.0 kJ/mol)[28]。由於d副殼層全滿,銀在化合價為+1的時候不太像4族到10族的過渡金屬;它通常可以形成相當不穩定的有機金屬化合物、線性錯合物(配位數非常低,只有2)、兩性氧化物[29]以及後過渡金屬之類的秦特相[30]。另外,即使沒有π受體配基,銀的+1氧化態也是穩定的,這點也與其他過渡金屬不同[27]。
化學反應[编辑]
與酸的反應[编辑]
銀不易與稀硫酸反應,因此硫酸在珠寶製造中用來清洗银焊及退火后留下的氧化铜火痕。
不過銀可以溶解於溶於熱濃硫酸:
- 2Ag + 2H
2SO
4 (濃) → Ag
2SO
4 + SO
2↑ + 2H
2O
銀溶於硝酸,生成硝酸銀,其副產物取決於溫度與硝酸濃度。與濃硝酸反應時,連帶生成二氧化氮;與稀硝酸反應時,則是生成一氧化氮[註 1]。
- Ag + 2HNO
3(濃) → AgNO
3 + NO
2↑ + H
2O - 3Ag + 4HNO
3(稀) → 3AgNO
3 + NO↑ + 2H
2O
與鹼的反應[编辑]
在空氣存在下,特別是在過氧化氫存在下,銀容易溶解在氰化物的水溶液中[26]。
與鹵素的反應[编辑]
- 2Ag + F
2 → 2AgF(暗棕色) - 2Ag + Cl
2 → 2AgCl(白色) - 2Ag + Br
2 → 2AgBr(淡黃色) - 2Ag + I
2 → 2AgI(黃色)
銀也可能與氟形成+2價的二氟化銀:
- Ag + F
2 → AgF
2
與氧族元素的反應[编辑]
即使在炙熱下,銀也不會和氧氣發生反應,其反應性大於銅[註 2]、小於金。
銀會與硫及硫化物發生反應[註 3]。例如銀與硫加熱化合成硫化銀(Ag
2S):
- 2Ag + S → Ag
2S
又如:銀在空氣中與硫化氫(H
2S)反應,形成黑色的硫化銀(Ag
2S)。
- 4 Ag + O
2 + 2 H
2S → 2 Ag
2S + 2 H
2O
這是銀幣或銀製物品失去光澤的原因之一。當銀製電器觸點在富含硫化氫的環境下工作時,觸點上的硫化銀會還原生成銀晶鬚[31]。
- 2 Ag + Se → Ag2Se
- 2 Ag + Te → Ag2Te
化合物[编辑]
銀的常見氧化態為+1價(最穩定的狀態),較少見也較不穩定的為+2價(例如二氟化銀)、甚至是+3價(例如三氟化銀)[32]。
+1價化合物[编辑]
硝酸鹽[编辑]
硝酸銀是一種透明或白色晶體,易溶於水,成為無色透明溶液。實驗室中,硝酸銀是銀(I)離子的主要來源;在工業上,硝酸银是合成许多其他銀化合物的原料,也可作為防腐劑,还用于彩色玻璃中的黄色添加剂。
鹵化物[编辑]

銀的鹵化物稱為鹵化銀。銀(I)離子的鹵化物包含氟化银(AgF)、氯化银(AgCl)、溴化銀(AgBr)、碘化銀(AgI),其中除了氟化银溶於水以外,其餘三者皆難溶於水,所以它們透過向銀(I)離子中加入鹵素離子而沉澱出來:
- Ag+
+ Cl−
→ AgCl↓(白色) - Ag+
+ Br−
→ AgBr↓(淡黃色) - Ag+
+ I−
→ AgI↓(黃色)
銀(I)離子因而常用於檢驗氟以外的鹵素離子,也用於重量分析法。
氯化銀可用於製造檢測pH值和測量電位的玻璃電極,以及用于玻璃的透明水泥。將碘化銀撒入雲層中,可以製造人工降雨。
氟化銀的二水合物[33][34]、氯化銀、溴化銀和碘化銀都是感光性物質,後三者可製造黑白照相術中的感光乳劑,目前較常用的是後兩者。在照相術等領域中,銀鹽(英語:silver salt)常代指鹵化銀。
氧化物與氫氧化物[编辑]
向銀(I)離子加入氫氧化鈉,可短暫形成白色的氫氧化銀沉澱,但不穩定,會立即分解為棕黑色的氧化銀(Ag
2O),所以化學反應一般寫成:
- 2 Ag−
+ 2 OH−
→ Ag
2O↓ + H
2O
氨錯合物[编辑]
雖然銀(I)離子與氨水也可形成氧化銀沉澱:
- 2 Ag−
+ 2 NH
4OH → Ag
2O ↓ + H
2O + 2 NH+
4
但是當銨離子過量時,可形成二氨合銀(I)錯離子([Ag(NH
3)
2]+
),因而使氧化銀溶於氨水:
- Ag
2O + 4HN
3 + H
2O → [Ag(NH
3)
2]+
+ 2OH−
[Ag(NH
3)
2]+
溶液也稱為銀氨溶液或者多侖試劑,具有弱氧化性,可使醛基的有機化合物(例如醛類、甲酸、葡萄糖等)氧化,同時使銀(I)還原為金屬銀,這稱為銀鏡反應,實驗室中可用來檢驗醛基的存在[35],工業上可以在玻璃上鍍銀、製造鏡子。
碳酸鹽[编辑]
銀(I)離子遇碳酸根可沉澱得黃色的碳酸銀(Ag
2CO
3)[36]:
- 2 Ag−
+ CO2−
3 → Ag
2CO
3 ↓
碳酸銀可溶於酸,變回銀(I)離子,並分解出二氧化碳:
- Ag
2CO
3 + 2H+
→ 2Ag−
+ H
2O + CO
2 ↑
氰化物與氰錯合物[编辑]
- Ag−
+ CN−
→ AgCN ↓
但是溶液如果有過量的CN−
,就可形成錯離子[Ag(CN)
2]−
和[Ag(CN)
3]−
,於是可進一步溶於水。氰化銀鉀(KAg(CN)
2)為Ag(CN)−
2與鉀離子形成之錯鹽,可以用於電鍍銀[36]。
硫氰酸鹽[编辑]
- AgNO
3 + KSCN → AgSCN ↓ + KNO
3
具有爆炸性的鹽[编辑]
在乙醇(C
2H
5OH)的存在下,銀與硝酸反應可形成雷酸銀(AgONC),這是一種對碰撞很敏感的強烈炸藥,可用於雷管。其他危險易爆的銀化合物包括疊氮化銀(AgN
3),由硝酸银与叠氮化钠 (NaN
3)反应得到;[37]還有乙炔银(Ag
2C
2),由硝酸银或银氨溶液与乙炔(C
2H
2)反应得到。
其它價態的化合物[编辑]
银還能形成其它價態的化合物,如+½價的氟化亚银(Ag
2F)、+2價的二氟化银(AgF
2)、一氧化银(AgO)、+3價的三氟化銀等。銀的+3價化合物需要非常強的氧化劑(例如氟或過二硫酸鹽)才能得到。而且有些+3價化合物會與大氣中的水分反應,並腐蝕玻璃[38]。實際上,三氟化銀通常是由銀或氟化銀(I)與已知最強的氧化劑二氟化氪反應而獲得。[39]
語源[编辑]
銀的拉丁文為argentum(比較古希臘語 ἄργυρος, árgyros),源於原始印歐語字根 h₂erǵ-,意為「白色」或「閃亮的」[40]。argentum也是其化學符號Ag的來源。
銀的英文silver在古英語中有許多拼法,例如seolfor和siolfor。同源詞有古高地德語的silabar、哥德語的silubr、古諾斯語的silfr,這些全都源自原始日耳曼語的*silubra。
漢語族的「銀」[註 4]與藏語དངུལ(dngul)、緬甸語ငွေ(ngwe)同源。日語漢音ぎん、韓語은、越南語儒字ngân均源自中古漢語。
歷史[编辑]
| 此章节需要扩充。 (2023年12月25日) |
因為銀的活躍性低,其元素型態容易被發現,也容易被萃取,故此在古時的中國和西方分別已認定為五金和煉金術七金之一。古代西方的煉金術和占星術也將七金中的銀與七曜中的月連結,排序在金和日之後。
-
銀製花瓶,约2400 BC
-
以白銀作為原料鑄造的貨幣(墨西哥銀圓)
應用[编辑]
- 製造銀器,如燭台、餐具,還有勋章、獎座、獎盃、獎牌(銀牌)等等。
- 製成銀飾,如首飾、戒指。較好的材質為925銀,即92.5%銀加入7.5%的銅,為Tiffany & Co.所開創的標準。
- 與汞、錫等其他金屬在室溫混合成的混合物,得廣泛用於牙醫上。
- 製造控制棒來控制核連鎖反應。
- 工業上或實驗室中用作催化劑。
- 在電子工業上是重要的導電材料。
- 製造合金、硝酸银和其它銀的化合物等。
- 用作製造鏡子反光面。
金融用途[编辑]
貨幣[编辑]
已知最早的硬幣是在公元前600年左右在小亞細亞的利底亞王國鑄造的;利底亞的硬幣是琥珀金製成的,這是一種天然存在的金和銀的合金,可在利底亞境內使用。自從那時,人類金融史發展出銀本位制(以固定重量的白銀作為標準會計計量單位),散佈至世界各地,直到20世紀為止都是主流的貨幣制度。歷史上著名的銀幣包括古希臘的德拉克馬、古羅馬的第納里烏斯、伊斯蘭的迪拉姆、古印度的卡夏帕那(自莫臥兒帝國時代起成為盧比,混合了金、銀、銅)、古中國的銀兩以及西班牙銀圓等。由於銀幣這個用途,在許多語言中,「銀」這個詞也有金錢的意涵(例如法語argent),或者被當作金錢的量詞(例如客家話「個銀」)。此外,漢語族、日語、韓語等語言均以「銀行」指稱金融機構。
銀幣的製造過程如下:將棒狀或錠狀鑄銀壓製成正確的厚度、進行熱處理、再切割,成為胚板,然後用壓鑄機壓模機研磨、壓製這些胚板;現代壓鑄機每小時可生產8000個銀幣[41]。
用於造幣的銀相對其他用途的佔比隨時間波動很大,例如在戰時,人們往往用更多的銀來鑄造錢幣,為戰爭提供資金[41]。
金融商品[编辑]
如今,白銀是四種貴金屬商品中的一種(其他為鈀、鉑和金),它的ISO 4217代碼為XAG[42]。除了現貨以外,白銀也是期貨、選擇權、權證、ETF等衍生性金融商品的標的物。
白銀價格通常以金衡盎司为单位計算。1金衡盎司等於31.1034公克。不過2015年中國恢復了公制,目前銀和金的價格是以公克為單位。
和黃金一樣,儘管白銀的實體市場分佈在全球,但大多數批發櫃檯買賣交易都是透過倫敦金銀市場進行清算的,所交易的商品在中文圈又被稱為「倫敦銀」。價格每天在倫敦時間的中午發布一次,交易週期為24小時,世界各國的銀行會以倫敦金銀市場協會(LBMA)成員的身份參與交易;據統計,倫敦金銀市場每天清算的白銀重量可達2億金衡盎司[43],交易額超過5億美元[44]。在倫敦金銀市場,白銀通常是用美元(USD)、英鎊(GBP)和歐元(EUR)報價。
1980年3月27日星期四銀價曾大幅下跌,史稱白銀星期四。2024年1月,白銀的價值為落在每金衡盎司23.06美元左右,約合每公斤745.58美元[45][46]。近50年來黃金和白銀的價格比大約是55:1,兩者的價格沒有恆久不變的關係[47]。
在生物中作用[编辑]
银的离子以及化合物对某些细菌、病毒、藻类以及真菌显现出毒性,但对人体却几乎是完全无害的。银的这种杀菌效应使得它在活体外就能够将生物杀死。然而,银制品的测试以及标准化却存在很大难度。
希波克拉底曾经有描述银在治疗和防止疾病方面的功用。腓尼基人曾经用银瓶子来盛放水、酒和醋,以此防止这些液体變壞。20世纪初期,人们也曾把银币放在牛奶,以此来延长牛奶的保鲜期。银的杀菌机制长期以来一直为人们所争论探讨,但至此还没有确凿的定论。其中一个很好的例子是微动力效应,成功的解释了银离子对微生物的作用,但却不能解释其对病毒的作用。
凝胶以及绷带大量使用銀。银的抗菌性来源于银离子。由于银离子可以和一些微生物用于呼吸的物质(比如一些含有氧、硫、氮元素的分子)形成强烈的结合键,以此使得这些物质不能为微生物所利用,从而使得微生物窒息而亡。
在抗生素發明之前,银的相关化合物曾在第一次世界大战时用于防止感染。
银作为效用广泛的抗菌剂正在进行新的应用。其中一方面就是将硝酸银溶于海藻酸盐中,用于防止伤口的感染,尤其是烧伤伤口的感染。2007年,一个公司设计出一种表面镀上银的玻璃杯,这种杯子号称具有良好的抗菌性。除此之外,美国食品和药品管理协会(FDA)最近也审批通过了一种内层镀银的导气管的应用,因为研究表明这种导气管能够有效的降低导气管型肺炎。
銀並不會對人的身體產生毒性,但長期接觸銀金屬和無毒銀化合物也會引致銀質沉著症,在皮膚表面會顯現灰藍色[48][49]。
參見[编辑]
| 维基共享资源中相關的多媒體資源:銀(分類) |
備註[编辑]
参考资料[编辑]
- ^ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip J. H.; Gröning, Manfred; Holden, Norman E.; Meijer, Harro A. J. Standard atomic weights of the elements 2021 (IUPAC Technical Report). Pure and Applied Chemistry. 2022-05-04. ISSN 1365-3075. doi:10.1515/pac-2019-0603 (英语).
- ^ Bullion vs. Numismatic Coins: Difference between Bullion and Numismatic Coins. www.providentmetals.com. [2017-12-17]. (原始内容存档于2018-11-19) (英语).
- ^ ‘World has 5 times more gold than silver' | Latest News & Updates at Daily News & Analysis. dna. 2009-03-03 [2023-12-25]. (原始内容存档于2018-02-14) (美国英语).
- ^ Masuda, Hideki. Combined Transmission Electron Microscopy – In situ Observation of the Formation Process and Measurement of Physical Properties for Single Atomic-Sized Metallic Wires. Janecek, Milos; Kral, Robert (编). Modern Electron Microscopy in Physical and Life Sciences. InTech. 2016. ISBN 978-953-51-2252-4. doi:10.5772/62288 (英语).
- ^ 5.0 5.1 5.2 Hammond, C. R. The Elements, in Handbook of Chemistry and Physics
 81st. CRC press. 2004. ISBN 978-0-8493-0485-9 (英语).
81st. CRC press. 2004. ISBN 978-0-8493-0485-9 (英语).
- ^ 6.0 6.1 6.2 6.3 Greenwood and Earnshaw, p. 1177
- ^ 7.0 7.1 Greenwood and Earnshaw, p. 1178
- ^ George L. Trigg; Edmund H. Immergut. Encyclopedia of applied physics. 4: Combustion to Diamagnetism. VCH Publishers. 1992: 267–72 [2 May 2011]. ISBN 978-3-527-28126-8. (原始内容存档于2021-05-18) (英语).
- ^ 9.0 9.1 Alex Austin. The Craft of Silversmithing: Techniques, Projects, Inspiration. Sterling Publishing Company, Inc. 2007: 43. ISBN 1600591310 (英语).
- ^ Edwards, H.W.; Petersen, R.P. Reflectivity of evaporated silver films. Physical Review. 1936, 50 (9): 871. Bibcode:1936PhRv...50..871E. doi:10.1103/PhysRev.50.871 (英语).
- ^ Silver vs. Aluminum. Gemini Observatory. [2014-08-01]. (原始内容存档于2018-11-06) (英语).
- ^ Russell, Alan M.; Lee, Kok Loong. Structure-Property Relations in Nonferrous Metals. New York: John Wiley & Sons. 2005: 302. ISBN 9780471649526. doi:10.1002/0471708542. (原始内容存档于2023-03-23).
- ^ Wire Plating Options. New England Wire Technologies. (原始内容存档于2020-08-09).
- ^ Nichols, Kenneth D. The Road to Trinity. Morrow, NY: Morrow. 1987: 42. ISBN 978-0-688-06910-0.
- ^ Young, Howard. Eastman at Oak Ridge During World War II. 11 September 2002. (原始内容存档于2012-02-08).
- ^ Oman, H. Not invented here? Check your history. Aerospace and Electronic Systems Magazine. 1992, 7 (1): 51–53. doi:10.1109/62.127132.
- ^ 17.0 17.1 Atomic Weights of the Elements 2007 (IUPAC). [11 November 2009]. (原始内容存档于6 September 2017).
- ^ Atomic Weights and Isotopic Compositions for All Elements (NIST). [11 November 2009]. (原始内容存档于2006-12-31).
- ^ Cameron, A.G.W. Abundance of the Elements in the Solar System (PDF). Space Science Reviews. 1973, 15 (1): 121–146 [2023-12-25]. Bibcode:1973SSRv...15..121C. S2CID 120201972. doi:10.1007/BF00172440. (原始内容存档 (PDF)于2016-12-28) (英语).
- ^ Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik. The NUBASE evaluation of nuclear and decay properties. Nuclear Physics A. 2003, 729: 3–128. Bibcode:2003NuPhA.729....3A. ISSN 0375-9474. doi:10.1016/j.nuclphysa.2003.11.001.
- ^ Isotope data for Silver94 in the Periodic Table. [2012-01-15]. (原始内容存档于2021-05-15).
- ^ Isotope data for Silver130 in the Periodic Table. [2012-01-15]. (原始内容存档于2019-07-01).
- ^ Isotope data for Silver107 in the Periodic Table. [2012-01-15]. (原始内容存档于2021-05-18).
- ^ Kelly, William R.; Wasserburg, G. J. Evidence for the existence of 107Pd in the early solar system. Geophysical Research Letters. 1978, 5: 1079. Bibcode:1978GeoRL...5.1079K. doi:10.1029/GL005i012p01079.
- ^ Russell, Sara S.; Gounelle, Matthieu; Hutchison, Robert. Origin of Short-Lived Radionuclides. Philosophical Transactions: Mathematical, Physical and Engineering Sciences. 2001, 359 (1787): 1991. Bibcode:2001RSPTA.359.1991R. JSTOR 3066270. doi:10.1098/rsta.2001.0893.
- ^ 26.0 26.1 Greenwood and Earnshaw, p. 1179
- ^ 27.0 27.1 27.2 Greenwood and Earnshaw, p. 1180
- ^ Greenwood and Earnshaw, p. 1176
- ^ Lidin RA 1996, Inorganic substances handbook, Begell House, New York, ISBN 1-56700-065-7. p. 5
- ^ Goodwin F, Guruswamy S, Kainer KU, Kammer C, Knabl W, Koethe A, Leichtfreid G, Schlamp G, Stickler R & Warlimont H 2005, 'Noble metals and noble metal alloys', in Springer Handbook of Condensed Matter and Materials Data, W Martienssen & H Warlimont (eds), Springer, Berlin, pp. 329–406, ISBN 3-540-44376-2. p. 341
- ^ Chudnovsky, Bella H. Degradation of power contacts in industrial atmosphere: silver corrosion and whiskers (PDF). Proceedings of the 48th IEEE Holm Conference on Electrical Contacts. IEEE. 2002 [2024-01-05]. doi:10.1109/HOLM.2002.1040834. (原始内容存档 (PDF)于2020-03-09) –通过NASA Electronic Parts and Packaging Program (英语).
- ^ Riedel, Sebastian; Kaupp, Martin. The highest oxidation states of the transition metal elements. Coordination Chemistry Reviews. 2009, 253 (5–6): 606–24. doi:10.1016/j.ccr.2008.07.014.
- ^ Slayter, Elizabeth. Light and Electron Microscopy. Cambridge University Press. 1992: 286. ISBN 9780521339483 (英语).
- ^ Palmer, William George. Experimental Inorganic Chemistry. CUP Archive. 1954: 150. ISBN 9780521059022 (英语).
- ^ 謝孟樺; 楊水平. 化學實驗室實驗:銀鏡反應與美感的結合〔I〕. 科學Online 高瞻自然科學教學資源平台. 國立臺灣大學. 2011-04-25 [2024-01-05]. (原始内容存档于2024-03-24) (中文(臺灣)).
- ^ 36.0 36.1 Bjelkhagen, Hans I. Silver-halide recording materials: for holography and their processing. Springer. 1995: 156–66. ISBN 978-3-540-58619-7.
- ^ Meyer, Rudolf; Köhler, Josef and Homburg, Axel publisher = Wiley–VCH. Explosives. 2007: 284. ISBN 3-527-31656-6.
- ^ Greenwood and Earnshaw, p. 1188
- ^ Greenwood and Earnshaw, p. 903
- ^ Mallory, James P.; Adams, Douglas Q. The Oxford Introduction to Proto-Indo-European and the Proto-Indo-European World. Oxford University Press. 2006: 241–242. ISBN 978-0-19-928791-8 (英语).
- ^ 41.0 41.1 Brumby et al., pp. 63–65
- ^ Current currency & funds code list – ISO Currency. SIX Group. [2023-12-25]. (原始内容存档于2020-07-04) (英语).
- ^ Clearing Data. LBMA. [2024-01-14]. (原始内容存档于2024-04-18).
- ^ 伦敦银市场:全球最大的白银交易中心. 领峰贵金属. 2023-05-11 [2024-01-14]. (原始内容存档于2024-01-14).
- ^ 白銀價格走勢. Truney貴金屬交易中心. [2023-08-25]. (原始内容存档于2023-08-25).
- ^ SilverPrice.Org. [2024-01-14]. (原始内容存档于2024-04-18).
- ^ 銀(Silver)的投資需求、市場以及價格詳細說明. OANDA Lab. OANDA Global Markets Ltd. [2024-01-14]. (原始内容存档于2024-01-14).
- ^ 孙睿康. 银:华丽外观背后,一段有趣的药用历史. 2021-09-24 [2023-01-17]. (原始内容存档于2023-09-02) (中文(中国大陆)).
- ^ 孙睿康,魏文秀,展鹏,刘新泳. 含银药物在传统医学中的应用概述. 亚太传统医药. 2021-02, 17 (02): 192-183 [2023-01-17]. doi:10.11954/ytctyy.202102058. (原始内容存档于2023-01-17).
引用文獻[编辑]
- Brumby, Andreas; Braumann, Peter, Silver, Silver Compounds, and Silver Alloys, Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, 2005, doi:10.1002/14356007.a24_107.pub2
- Greenwood, Norman Neill; Earnshaw, Alan. Chemistry of the elements. 2016. ISBN 978-0-7506-3365-9. OCLC 1040112384 (英语).
- Weeks, Mary Elvira; Leichester, Henry M. Discovery of the Elements. Easton, PA: Journal of Chemical Education. 1968. ISBN 978-0-7661-3872-8. LCCN 68-15217 (英语).
延伸阅读[编辑]
[在维基数据编辑]
外部連結[编辑]
- 元素銀在洛斯阿拉莫斯国家实验室的介紹(英文)
- EnvironmentalChemistry.com —— 銀(英文)
- 元素銀在The Periodic Table of Videos(諾丁漢大學)的介紹(英文)
- 元素銀在Peter van der Krogt elements site的介紹(英文)
- WebElements.com – 銀(英文)
| 元素周期表(过渡金属) | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| IA 1 |
IIA 2 |
IIIB 3 |
IVB 4 |
VB 5 |
VIB 6 |
VIIB 7 |
VIIIB 8 |
VIIIB 9 |
VIIIB 10 |
IB 11 |
IIB 12 |
IIIA 13 |
IVA 14 |
VA 15 |
VIA 16 |
VIIA 17 |
VIIIA 18 | ||||||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||||
| |||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||
| |||||||||||||||||