铵
| 铵 | |||
|---|---|---|---|
| |||
| |||
| 系统名 Ammonium | |||
| 识别 | |||
| CAS号 | 14798-03-9 | ||
| PubChem | 16741146 | ||
| ChemSpider | 218 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | QGZKDVFQNNGYKY-IKLDFBCSAZ | ||
| ChEBI | CHEBI:28938 | ||
| MeSH | D000644 | ||
| 性质 | |||
| 化学式 | H4N | ||
| 摩尔质量 | 18.04 g·mol−1 | ||
| pKa | 9.25 | ||
| 结构 | |||
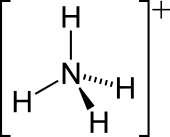
| 分子构型 | 正四面体 | ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||

结构[编辑]
存在[编辑]

酸性环境下,溶解在水中的氨分子以铵根离子的形式存在。氨水可电离出铵根离子和氢氧根离子,浓氨水容易挥发为氨气。液氨自耦电离能产生铵离子。
铵盐[编辑]
铵根离子还可以和阴离子结合形成盐,大部分铵盐都可溶。常见的铵盐有氯化铵、硝酸铵、硫酸銨、碳酸氢铵等。
命名[编辑]
由于NH4+的化学性质类似于金属离子,故命名为金部的“铵”。
“铵”的普通话拼音為“ǎn”,区别于阴平(第1声)的“氨”和去声(第4声)的“胺”。但在台灣,「銨」和「氨」讀音均為「ān」。
一般的铵盐命名和普通的盐的命名一样,为某化铵或某酸铵,如氯化铵、醋酸铵等。
用途[编辑]
用于铵盐中含氮,盐可用作氮肥,称为“铵态氮肥”。此类肥料不宜与碱性肥料混用,否则铵离子会被反应掉从而肥效降低。
常见的铵态氮肥有硫铵(硫酸铵)、碳铵(碳酸铵)、硝铵(硝酸铵)。
检验[编辑]
铵盐的检验方法通常是与碱混合并加热[註 1],会产生能使湿润红色石蕊试纸变蓝的气体(氨气)。例如:
原理是铵盐与碱发生复分解反应,生成新盐和氨水,氨水易挥发为氨气和水。
- 铵盐可以与奈斯勒试剂反应生成黄棕色沉淀,用于定性检验。
对于碳酸氢铵[编辑]
要区别碳酸氢铵于其他的铵盐,可以通过加热的方式。[來源請求]
但请注意:这个方法不應在銨鹽可能是硝酸铵的情況下使用,因为硝酸铵遇高温容易发生爆炸。
衍生物[编辑]
铵金属[编辑]
在高压下,浸在大量自由电子海中的铵离子可能会表现出类似于金属的性质。冰巨星天王星与海王星的内部就可能存在这种“铵金属”。[1][2]
註解[编辑]
- ^ Stevenson, D. J. Does metallic ammonium exist?. Nature. 1975-11, 258 (5532) [2022-10-14]. Bibcode:1975Natur.258..222S. ISSN 1476-4687. doi:10.1038/258222a0. (原始内容存档于2022-10-14) (英语).
- ^ Bernal, M. F. M.; Massey, H. S. W. Metallic Ammonium. Monthly Notices of the Royal Astronomical Society. 1954-04-01, 114 (2) [2022-10-14]. Bibcode:1954MNRAS.114..172B. ISSN 0035-8711. doi:10.1093/mnras/114.2.172. (原始内容存档于2021-11-29) (英语).
注释[编辑]
- ^ 铵盐与碱反应多为吸热反应
参见[编辑]
| |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||




![{\displaystyle {\ce {{NH4}^{+}+ 2{[HgI4]}^{2-}+ 4OH- -> HgO*Hg(NH2)I + 7I- + 3H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ec2cdfdb9af44bdf5e577d90e7a03b53eaac2c4c)
![{\displaystyle {\ce {=[{\text{△}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0478caeebea240591c5974d34cc8fcdb82b0a60b)