User:Merphisto/藥物設計
药物设计,通常称为合理药物设计或简称为合理设计,是基于生物靶点知识寻找新药物的创造性过程。 [1]最常见的药物类型如有机小分子,可激活或抑制蛋白质等生物分子功能,进而为患者在治疗中获益。药物设计狭义地可定义为药物分子设计,这些药物的分子形状和原子电荷与生物分子靶标存在互补即“锁钥模型”(lock and key model),因此药物分子会与生物靶标存在结合力。药物设计通常而不一定基于计算机建模技术。 [2]该类建模也被称为计算机辅助药物设计,而基于生物分子靶标三维结构知识的药物设计被称为基于结构的药物设计。 [2]除小分子外,包括多肽[3] [4]内的生物药物,尤其以治疗用抗体药物在该领域变得越发重要。与此同时,各种提高药物亲和力、选择性和稳定性的算法在基于蛋白质治疗的领域中也持续发展。 [5]
“药物设计”在某种意义中存在歧义。更准确的术语应是配体设计(如设计某分子使其与靶标紧密结合标)。 [6]尽管现有技术对于预测结合亲和力相当成功,还有众多因素在配体分子成为安全有效的药物之前须对其进行优化,如生物利用度、代谢半衰期、药物副作用等。这些特性基于现有技术通常很难进行预测。然而,由于药物设计的高失败率,尤其在药物开发的临床阶段高失败率,在药物设计过程的早期,药物化学家通常将更多精力集中在选择候选药物上。这些候选药物的物理化学性质会基于避免药物不良反应进行考量,从而更有可能将候选药物推向获批的上市药物。 [7]此外,药物体外实验与计算辅助设计相辅相成,越来越多地用于早期药物发现阶段,以挑选出更优ADME(吸收、分布、代谢和排泄)性质和毒理学性质的化合物。 [8]
药物靶点[编辑]
生物分子靶标如最常见的蛋白质或核酸,是参与特定代谢或信号通路的关键分子,该通路与特定疾病的病理学成因或微生物病原体的传染性相关。潜在的药物靶点不必是直接致病,而需是与改善影响疾病相关联。 [9]在某些情况下,小分子被设计用于增强或抑制特定疾病中修饰途径的目标功能。诸如受体激动剂、拮抗剂、反向激动剂或调节剂;酶激活剂或抑制剂;或离子通道开放剂或阻滞剂[10]的小分子药物被设计为与靶标结合位点通过结合力互补。[11]由于药物分子与脱靶分子的相互作用可能会导致不良反应,小分子药物可以设计为不影响任何其他重要“脱靶”分子(通常称为抗靶标)。 [12]由于结合位点的相似性,通过序列同源性鉴定的密切相关的靶标具有更优的反应性,因此相较更可能导致潜在不良反应。
药物中的一大类是通过化学合成的有机小分子,而通过生物过程生产的生物药物正变得越来越普遍。[13]此外,基于mRNA的基因沉默技术越来越多的进入新的治疗领域。 [14]
合理的药物发现[编辑]
区别于传统的药物发现方法(亦称为正向药理学)基于不同化合物与培养细胞或动物进行反复试验,通过匹配化合物结构与疗效以寻找候选药物,合理的药物设计(亦称为反向药理学)初始于调节即定生物靶标可具有治疗价值的设想。选择某生物分子作为药物靶标需要两个基本要素:首先有证据表明调节靶标可缓解病症。如研究发现表明:生物靶标的突变与某些疾病之间存在关联性;[15]其次靶标是“可成药”的,即靶标可结合小分子,并可通过小分子的活性进行调控。 [16]
一旦确定了合适的靶标,通常通过克隆、生产和纯化手段合成靶标分子。将纯化的蛋白质靶标用于建立药物筛选试验平台,并确定靶标的三维结构。
如果存在化合物库资源,通常先通过化合物库筛选潜在可与靶标结合的小分子,也称为高通量筛选。此外如果靶点为确定结构的蛋白质,还可对候选化合物进行虚拟筛选。理想情况下,候选药物化合物同时具有“类似性”,如预计有足够的口服生物利用度、化学稳定性、代谢稳定性及足够低的毒副作用。 [17]有诸多方法可评估类药性,如里宾斯基五规则和其他评估手段如亲脂性等。[18]此外众多药物化学家也提出了许多预测类药性的方法。 [19]
的[20]
计算机辅助药物设计[编辑]
药物设计中的最初目标是预测某分子是否会与靶标结合,如果结合其强度如何。通常基于分子力学或分子动力学估算小分子与其生物靶标之间的分子-分子间相互作用强度。该方法还用于预测小分子的空间构象,并模拟小分子与之结合时可能导致的靶标构象变化。[3] [4]半经验的、从头算量子化学方法或密度泛函理论通常用于为分子力学计算提供优化参数,并估算候选药物的电子特性如:静电势、极化率等),从而影响药物-靶标亲和力。 [21]
分子力学方法也可提供靶标结合亲和力的半定量预测。此外,基于药物设计知识的评分函数也可用于估算结合亲和力。这些评分函数使用线性回归、机器学习、神经网络或其他统计技术,通过将实验亲和力拟合至计算的小分子与靶标之间的相互作用能量,来推导预测结合亲和力方程。 [22] [23]
理想情况下,计算机辅助设计能够预测合成化合物的亲和力,因此理论上只需要合成一类化合物便可预测成药可行性,从而节省药物研发中的大量时间和成本。而现实中,该辅助设计并不理想,通常充其量只定性准确地估算亲和力。实际操作层面,发现较优的药物分子前,需要进行多次设计、合成和测试反复迭代。计算机辅助药物设计通过减少所需的迭代次数以加速药物发现过程,并提供更多的新颖结构。 [24] [25]
基于计算机辅助药物设计可实现于药物发现的以下任何阶段:
- 使用虚拟筛选(基于结构或配体的设计)以寻找苗头化合物
- 基于结构的药物设计、QSAR等知识,对于苗头化合物至先导化合物的亲和力与选择性的优化
- 在维持亲和力条件下,对于先导化合物的成药性优化

为了解决评分函数计算中结合亲和力预测不准确性,通常可进行蛋白质-配体相互作用与化合物三维结构信息进行分析。对于基于结构的药物设计,已经开发了几种侧重于蛋白质-配体相互作用的筛选后分析,以提高发现潜在候选药物的效率:
- 共识评分[26] [27]
- 通过对多个评分函数的评估以决定候选化合物
- 可能导致蛋白质-配体结构信息与评分标准之间失去关联性
- 聚类分析[28] [29]
- 根据蛋白质-配体三维信息展现候选化合物
- 需要展现有意义的蛋白质-配体相互作用模型
类型[编辑]
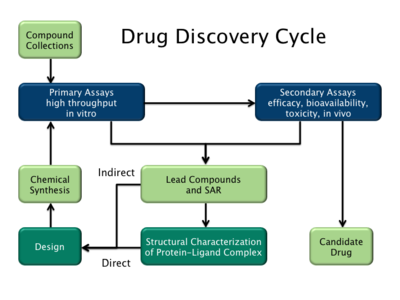
现在主流存在两种类型药物设计策略:第一种称为基于配体的药物设计,第二种称为基于结构的药物设计。[2]
基于配体的药物设计[编辑]
基于配体的药物设计(或间接药物设计)基于与已知生物靶标与确定分子结合的数据。这些分子可用于推测药效团模型,即分子中可结合靶标中最小且必要的结构片段。[30]同样的,构建生物靶标模型可基于与其结合的分子,同时该建模反之可用于设计与靶标相互作用的新分子实体。又或者,该建模还可归纳量化结构-活性关系(QSAR),即计算出的分子性质与其实验测定的生物活性之间的关联度。这些QSAR关系还可继续迭代,用于预测新类似化合物的活性。[31]
基于结构的药物设计[编辑]
基于结构的药物设计(或直接药物设计)基于通过X 射线晶体学或核磁共振光谱学等方法获得的生物靶标的三维结构数据。 [32]如果得不到靶标的测定结构,则可根据相关蛋白质的实验测定结构创建靶标的同源模型。通过生物靶标结构,可以使用化合物-靶标相互作用模型和药物化学家的直觉以设计预测高亲和力和选择性结合靶标的候选药物。又或者可以基于各种自动运算程序推选新候选药物。[33]
当前基于结构的药物设计方法大致可分为三大类:[34]其一通过搜索小分子三维结构的大型数据库以识别既定受体的新配体分子,以使用快速对接程序找到适合受体结合口袋的配体分子。这类方法称为虚拟筛选。第二类方法为新配体的从头设计。在这类方法中,配体分子通过组装分子小片段并在结合口袋的空间约束下逐步构建形成。这些化学片段可以是单个原子或分子结构碎片。这种方法的优点主要是可不被任何化学数据库中的结构所束缚,进行较自由的结构创造。 [35] [36] [37]第三类方法是通过评价结合腔内拟定的类似物,对已知配体进行不断优化。 [34]
结合位点鉴定[编辑]
结合位点识别是基于结构的设计的第一个步骤。 [16] [38]如果在存在结合配体的情况下确定靶标或足够相似的同源物的结构,则应在结构中观察到配体,在这种情况下,结合位点的位置是微不足道的。然而,可能存在感兴趣的未占用的变构结合位点。此外,可能只有载脂蛋白(无配体的蛋白质)结构可用,并且可靠地识别有可能以高亲和力结合配体的未占据位点并非易事。简而言之,结合位点识别通常依赖于识别蛋白质上的凹面,这些凹面可以容纳药物大小的分子,这些分子也具有驱动配体结合的适当“热点”(疏水表面、氢键位点等)。 [16] [38]
评分函数[编辑]
基于结构的药物设计试图通过应用分子识别原理,以蛋白质的结构作为设计新配体的基础。与靶标的选择性高亲和力结合通常是可取的,因为它会导致更有效的药物和更少的副作用。因此,设计或获得潜在新配体的最重要原则之一是预测特定配体与其靶标(和已知的反靶标)的结合亲和力,并将预测的亲和力作为选择标准。 [39]
Böhm 开发了一种早期的通用经验评分函数来描述配体与受体的结合能。 [40] [41]该经验评分函数采用以下形式:
此处:
- ΔG 0 – 经验推导的偏移量,部分对应于配体在结合时的平移和旋转熵的总体损失。
- ΔG hb – 来自氢键的贡献
- ΔG ionic – 离子相互作用的贡献
- ΔG lip – 来自亲脂相互作用的贡献,其中 |A lipo |是配体和受体之间亲脂性接触的表面积
- ΔG rot——由于在结合时冻结配体键中的可旋转物而导致的熵损失
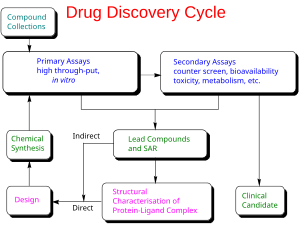
一个更一般的热力学“主”方程如下: [42]
基本思想是可以将整体结合自由能分解为已知对结合过程很重要的独立成分。每个成分都反映了配体与其靶受体结合过程中某种自由能的变化。主方程是这些分量的线性组合。根据吉布斯自由能方程,建立了解离平衡常数K d与自由能组分之间的关系。
各种计算方法用于估计主方程的每个分量。例如,配体结合后极性表面积的变化可用于估计去溶剂化能量。配体结合时冻结的可旋转键的数量与运动项成正比。可以使用分子力学计算来估计配置或应变能。最后,可以使用非极性表面的变化、平均力的统计推导势、形成的氢键数等方法估算相互作用能。在实践中,主方程的组成部分使用多元线性回归拟合实验数据。这可以通过包括多种类型的配体和受体的多样化训练集来完成,以生成不太准确但更通用的“全局”模型,或者使用一组更受限制的配体和受体来生成更准确但不太通用的“局部”模型。 [43]
示例[编辑]
合理药物设计的一个具体例子涉及使用从 X 射线晶体学和 NMR 光谱学等技术获得的有关生物分子的三维信息。当目标蛋白的高分辨率结构与有效配体结合时,计算机辅助药物设计尤其容易处理。这种药物发现方法有时被称为基于结构的药物设计。碳酸酐酶抑制剂多佐胺是应用基于结构的药物设计并获得批准的第一个明确例子,它于 1995 年获得批准。 [44] [45]
合理药物设计的另一个重要案例研究是伊马替尼,这是一种酪氨酸激酶抑制剂,专门针对费城染色体阳性白血病(慢性粒细胞性白血病和偶尔的急性淋巴细胞性白血病)特有的bcr-abl融合蛋白而设计。伊马替尼与以前的癌症药物有很大不同,因为大多数化疗药物只针对快速分裂的细胞,而不区分癌细胞和其他组织。 [46]
其他示例包括:
实例研究[编辑]
评论[编辑]
有人认为,合理药物设计的高度严格和集中的性质会抑制药物发现的偶然性。 [47]
参见[编辑]
参考文献[编辑]
- ^ Madsen U, Krogsgaard-Larsen P, Liljefors T. Textbook of Drug Design and Discovery. Washington, D.C.: Taylor & Francis. 2002. ISBN 978-0-415-28288-8.
- ^ 2.0 2.1 2.2 Drug Design: Structure- and Ligand-Based Approaches 1. Cambridge, UK: Cambridge University Press. 2010. ISBN 978-0521887236. 引证错误:带有name属性“Reynolds_2010”的
<ref>标签用不同内容定义了多次 - ^ 3.0 3.1 Fosgerau K, Hoffmann T. Peptide therapeutics: current status and future directions. Drug Discovery Today. January 2015, 20 (1): 122–128. PMID 25450771. doi:10.1016/j.drudis.2014.10.003
 . 引证错误:带有name属性“sciencedirect.com”的
. 引证错误:带有name属性“sciencedirect.com”的<ref>标签用不同内容定义了多次 - ^ 4.0 4.1 Ciemny M, Kurcinski M, Kamel K, Kolinski A, Alam N, Schueler-Furman O, Kmiecik S. Protein-peptide docking: opportunities and challenges. Drug Discovery Today. August 2018, 23 (8): 1530–1537. PMID 29733895. doi:10.1016/j.drudis.2018.05.006
 . 引证错误:带有name属性“ReferenceA”的
. 引证错误:带有name属性“ReferenceA”的<ref>标签用不同内容定义了多次 - ^ Shirai H, Prades C, Vita R, Marcatili P, Popovic B, Xu J, et al. Antibody informatics for drug discovery. Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics. November 2014, 1844 (11): 2002–2015. PMID 25110827. doi:10.1016/j.bbapap.2014.07.006.
- ^ Tollenaere JP. The role of structure-based ligand design and molecular modelling in drug discovery. Pharmacy World & Science. Apr 1996, 18 (2): 56–62. PMID 8739258. S2CID 21550508. doi:10.1007/BF00579706.
- ^ Waring MJ, Arrowsmith J, Leach AR, Leeson PD, Mandrell S, Owen RM, Pairaudeau G, Pennie WD, Pickett SD, Wang J, Wallace O, Weir A. An analysis of the attrition of drug candidates from four major pharmaceutical companies. Nature Reviews Drug Discovery. 2015, 14 (7): 475–86. PMID 26091267. S2CID 25292436. doi:10.1038/nrd4609.
- ^ Yu H, Adedoyin A. ADME-Tox in drug discovery: integration of experimental and computational technologies. Drug Discovery Today. Sep 2003, 8 (18): 852–61. PMID 12963322. doi:10.1016/S1359-6446(03)02828-9.
- ^ Dixon SJ, Stockwell BR. Identifying druggable disease-modifying gene products. Current Opinion in Chemical Biology. Dec 2009, 13 (5–6): 549–55. PMC 2787993
 . PMID 19740696. doi:10.1016/j.cbpa.2009.08.003.
. PMID 19740696. doi:10.1016/j.cbpa.2009.08.003.
- ^ Imming P, Sinning C, Meyer A. Drugs, their targets and the nature and number of drug targets. Nature Reviews. Drug Discovery. Oct 2006, 5 (10): 821–34. PMID 17016423. S2CID 8872470. doi:10.1038/nrd2132.
- ^ Anderson AC. The process of structure-based drug design. Chemistry & Biology. Sep 2003, 10 (9): 787–97. PMID 14522049. doi:10.1016/j.chembiol.2003.09.002
 .
.
- ^ Recanatini M, Bottegoni G, Cavalli A. In silico antitarget screening. Drug Discovery Today: Technologies. Dec 2004, 1 (3): 209–15. PMID 24981487. doi:10.1016/j.ddtec.2004.10.004.
- ^ Wu-Pong S, Rojanasakul Y. Biopharmaceutical drug design and development 2nd. Totowa, NJ Humana Press: Humana Press. 2008. ISBN 978-1-59745-532-9.
- ^ Scomparin A, Polyak D, Krivitsky A, Satchi-Fainaro R. Achieving successful delivery of oligonucleotides - From physico-chemical characterization to in vivo evaluation. Biotechnology Advances. Apr 2015, 33 (6): 1294–309. PMID 25916823. doi:10.1016/j.biotechadv.2015.04.008.
- ^ Ganellin CR, Jefferis R, Roberts SM. https://books.google.com/books?id=342JY314Fl4C&q=target+validation+disease+linkage&pg=PA83
|chapterurl=缺少标题 (帮助). The small molecule drug discovery process — from target selection to candidate selection. Elsevier. 2013. ISBN 9780123971760. - ^ 16.0 16.1 16.2 Yuan Y, Pei J, Lai L. Binding site detection and druggability prediction of protein targets for structure-based drug design. Current Pharmaceutical Design. Dec 2013, 19 (12): 2326–33. PMID 23082974. doi:10.2174/1381612811319120019. 引证错误:带有name属性“Yuan_2013”的
<ref>标签用不同内容定义了多次 - ^ Rishton GM. Nonleadlikeness and leadlikeness in biochemical screening. Drug Discovery Today. Jan 2003, 8 (2): 86–96. PMID 12565011. doi:10.1016/s1359644602025722.
- ^ Hopkins AL. https://books.google.com/books?id=Qmt1_DQkCpEC&q=druggability+Lipinski%27s+Rule+of+Five+lipophilic+efficiency&pg=PA527
|chapterurl=缺少标题 (帮助). Wermuth CG (编). Chapter 25: Pharmacological space 3. Academic Press. 2011: 521–527. ISBN 978-0-12-374194-3. - ^ Kirchmair J. Drug Metabolism Prediction. Wiley's Methods and Principles in Medicinal Chemistry 63. Wiley-VCH. 2014. ISBN 978-3-527-67301-8.
- ^ Ethiraj SK, Levinthal D. Bounded Rationality and the Search for Organizational Architecture: An Evolutionary Perspective on the Design of Organizations and Their Evolvability. Administrative Science Quarterly (Sage Publications, Inc. on behalf of the Johnson Graduate School of Management, Cornell University). Sep 2004, 49 (3): 404–437. JSTOR 4131441. S2CID 142910916. SSRN 604123
 . doi:10.2307/4131441.
. doi:10.2307/4131441.
- ^ Lewis RA. Chapter 4: The Development of Molecular Modelling Programs: The Use and Limitations of Physical Models. RSC Drug Discovery. Royal Society of Chemistry. 2011: 88–107. ISBN 978-1849731669. doi:10.1039/9781849733410-00088.
- ^ Rajamani R, Good AC. Ranking poses in structure-based lead discovery and optimization: current trends in scoring function development. Current Opinion in Drug Discovery & Development. May 2007, 10 (3): 308–15. PMID 17554857.
- ^ de Azevedo WF, Dias R. Computational methods for calculation of ligand-binding affinity. Current Drug Targets. Dec 2008, 9 (12): 1031–9. PMID 19128212. doi:10.2174/138945008786949405.
- ^ Singh J, Chuaqui CE, Boriack-Sjodin PA, Lee WC, Pontz T, Corbley MJ, Cheung HK, Arduini RM, Mead JN, Newman MN, Papadatos JL, Bowes S, Josiah S, Ling LE. Successful shape-based virtual screening: the discovery of a potent inhibitor of the type I TGFbeta receptor kinase (TbetaRI). Bioorganic & Medicinal Chemistry Letters. Dec 2003, 13 (24): 4355–9. PMID 14643325. doi:10.1016/j.bmcl.2003.09.028.
- ^ Becker OM, Dhanoa DS, Marantz Y, Chen D, Shacham S, Cheruku S, Heifetz A, Mohanty P, Fichman M, Sharadendu A, Nudelman R, Kauffman M, Noiman S. An integrated in silico 3D model-driven discovery of a novel, potent, and selective amidosulfonamide 5-HT1A agonist (PRX-00023) for the treatment of anxiety and depression. Journal of Medicinal Chemistry. Jun 2006, 49 (11): 3116–35. PMID 16722631. doi:10.1021/jm0508641.
- ^ Liang S, Meroueh SO, Wang G, Qiu C, Zhou Y. Consensus scoring for enriching near-native structures from protein-protein docking decoys. Proteins. May 2009, 75 (2): 397–403. PMC 2656599
 . PMID 18831053. doi:10.1002/prot.22252.
. PMID 18831053. doi:10.1002/prot.22252.
- ^ Oda A, Tsuchida K, Takakura T, Yamaotsu N, Hirono S. Comparison of consensus scoring strategies for evaluating computational models of protein-ligand complexes. Journal of Chemical Information and Modeling. 2006, 46 (1): 380–91. PMID 16426072. doi:10.1021/ci050283k.
- ^ Deng Z, Chuaqui C, Singh J. Structural interaction fingerprint (SIFt): a novel method for analyzing three-dimensional protein-ligand binding interactions. Journal of Medicinal Chemistry. Jan 2004, 47 (2): 337–44. PMID 14711306. doi:10.1021/jm030331x.
- ^ Amari S, Aizawa M, Zhang J, Fukuzawa K, Mochizuki Y, Iwasawa Y, Nakata K, Chuman H, Nakano T. VISCANA: visualized cluster analysis of protein-ligand interaction based on the ab initio fragment molecular orbital method for virtual ligand screening. Journal of Chemical Information and Modeling. 2006, 46 (1): 221–30. PMID 16426058. doi:10.1021/ci050262q.
- ^ Guner OF. Pharmacophore Perception, Development, and use in Drug Design. La Jolla, Calif: International University Line. 2000. ISBN 978-0-9636817-6-8.
- ^ Tropsha A. https://books.google.com/books?id=EOInhAYMae4C&q=QSAR%20drug%20design&pg=PA151
|chapterurl=缺少标题 (帮助). Drug Design: Structure- and Ligand-Based Approaches 1st. Cambridge, UK: Cambridge University Press. 2010: 151–164. ISBN 978-0521887236. - ^ Leach AR, Harren J. Structure-based Drug Discovery. Berlin: Springer. 2007. ISBN 978-1-4020-4406-9.
- ^ Mauser H, Guba W. Recent developments in de novo design and scaffold hopping. Current Opinion in Drug Discovery & Development. May 2008, 11 (3): 365–74. PMID 18428090.
- ^ 34.0 34.1 Klebe G. Recent developments in structure-based drug design. Journal of Molecular Medicine. 2000, 78 (5): 269–81. PMID 10954199. S2CID 21314020. doi:10.1007/s001090000084.
- ^ Wang R, Gao Y, Lai L. LigBuilder: A Multi-Purpose Program for Structure-Based Drug Design. Journal of Molecular Modeling. 2000, 6 (7–8): 498–516. S2CID 59482623. doi:10.1007/s0089400060498.
- ^ Schneider G, Fechner U. Computer-based de novo design of drug-like molecules. Nature Reviews. Drug Discovery. Aug 2005, 4 (8): 649–63. PMID 16056391. S2CID 2549851. doi:10.1038/nrd1799.
- ^ Jorgensen WL. The many roles of computation in drug discovery. Science. Mar 2004, 303 (5665): 1813–8. Bibcode:2004Sci...303.1813J. PMID 15031495. S2CID 1307935. doi:10.1126/science.1096361.
- ^ 38.0 38.1 Leis S, Schneider S, Zacharias M. In silico prediction of binding sites on proteins. Current Medicinal Chemistry. 2010, 17 (15): 1550–62. PMID 20166931. doi:10.2174/092986710790979944.
- ^ Warren GL, Warren SD. Chapter 16: Scoring Drug-Receptor Interactions. RSC Drug Discovery. Royal Society of Chemistry. 2011: 440–457. ISBN 978-1849731669. doi:10.1039/9781849733410-00440.
- ^ Böhm HJ. The development of a simple empirical scoring function to estimate the binding constant for a protein-ligand complex of known three-dimensional structure. Journal of Computer-Aided Molecular Design. Jun 1994, 8 (3): 243–56. Bibcode:1994JCAMD...8..243B. PMID 7964925. S2CID 2491616. doi:10.1007/BF00126743.
- ^ Liu J, Wang R. Classification of Current Scoring Functions. Journal of Chemical Information and Modeling. 23 March 2015, 55 (3): 475–482. PMID 25647463. doi:10.1021/ci500731a.
- ^ Ajay, Murcko MA. Computational methods to predict binding free energy in ligand-receptor complexes. J. Med. Chem. 1995, 38 (26): 4953–67. PMID 8544170. doi:10.1021/jm00026a001.
- ^ Gramatica P. https://books.google.com/books?id=YTguNlEpmnoC&q=drug+design+local+global+models&pg=PA466
|chapterurl=缺少标题 (帮助). Chapter 17: Modeling Chemicals in the Environment. RSC Drug Discovery. Royal Society of Chemistry. 2011: 466. ISBN 978-1849731669. doi:10.1039/9781849733410-00458. - ^ Greer J, Erickson JW, Baldwin JJ, Varney MD. Application of the three-dimensional structures of protein target molecules in structure-based drug design. Journal of Medicinal Chemistry. Apr 1994, 37 (8): 1035–54. PMID 8164249. doi:10.1021/jm00034a001.
- ^ Timmerman H, Gubernator K, Böhm HJ, Mannhold R, Kubinyi H. Structure-based Ligand Design (Methods and Principles in Medicinal Chemistry). Weinheim: Wiley-VCH. 1998. ISBN 978-3-527-29343-8.
- ^ Capdeville R, Buchdunger E, Zimmermann J, Matter A. Glivec (STI571, imatinib), a rationally developed, targeted anticancer drug. Nature Reviews. Drug Discovery. Jul 2002, 1 (7): 493–502. PMID 12120256. S2CID 2728341. doi:10.1038/nrd839.
- ^ Klein DF. The loss of serendipity in psychopharmacology. JAMA. Mar 2008, 299 (9): 1063–5. PMID 18319418. doi:10.1001/jama.299.9.1063.
外部链接[编辑]
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
[[Category:药物化学]] [[Category:药物发现]] [[Category:實驗設計]]


![{\displaystyle {\begin{array}{lll}\Delta G_{\text{bind}}=-RT\ln K_{\text{d}}\\[1.3ex]K_{\text{d}}={\dfrac {[{\text{Ligand}}][{\text{Receptor}}]}{[{\text{Complex}}]}}\\[1.3ex]\Delta G_{\text{bind}}=\Delta G_{\text{desolvation}}+\Delta G_{\text{motion}}+\Delta G_{\text{configuration}}+\Delta G_{\text{interaction}}\end{array}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ba49ddd9dec7415d129787213744ca1afcd2d021)