鈈
1940年,格倫·西奧多·西博格和埃德溫·麥克米倫首度在柏克萊加州大學實驗室,以氘撞擊鈾-238合成出鈈元素,是繼鎿之後第二個被合成出的超鈾元素。[2][3]麥克米倫將這個新元素取名Pluto(意為冥王星),西博格便開玩笑提議定其元素符號為Pu(音類似英語中表嫌惡時的口語「pew」)。科學家隨後在鈾礦中發現了微量的鈈,是礦石中的鈾-238經過中子俘獲緊接着發生兩次β衰變而成的:(238U → 239U → 239Np → 239Pu),因此鈈是少數存在於自然界中的超鈾元素,也是天然存在於自然界中原子序最大的元素。
鈈沒有穩定同位素,最長壽的同位素是鈈-244,半衰期約為八千萬年。而工業及軍事上最重要的鈈同位素是鈈-239,半衰期為2.41萬年,常被用來製造核武器。[4] 鈈-239和鈈-241都易於裂變,即它們的原子核可以在慢速熱中子撞擊下產生核分裂,釋出能量、伽馬射線以及中子輻射,從而形成核連鎖反應,並應用在核武器與核反應堆上。而鈈-240自發裂變的比率很高,容易造成中子通量激增,因而影響了鈈作為核武及核燃料的適用性。另外,鈈-238的半衰期為88年,衰變時會放出α粒子和大量熱能,它是放射性同位素熱電機的熱量來源,常用於驅動太空船。製造鈈的特定同位素時幾乎都是以特殊反應合成,分離鈈同位素的過程成本極高又耗時費力,因此有些材料只有特定國家在生產。
第二次世界大戰期間,曼哈頓計劃首度將製造微量鈈元素列為主要任務之一,曼哈頓計劃後來成功研製出第一個原子彈。1945年7月的第一次核試驗「三一試驗」,以及第二次、投於長崎市的「胖子原子彈」,都使用了鈈製作內核部分。[5]關於鈈元素的人體輻射實驗研究並在未經受試者同意之下進行,二次大戰期間及戰後都有數次核試驗相關意外,其中有的甚至造成傷亡。核能發電廠核廢料的清除,以及冷戰期間所打造的核武建設在核武裁減後的費用,都延伸出日後核武器擴散以及環境等問題。非陸上核試驗也會釋出殘餘的原子塵,現已依《部分禁止核試驗條約》明令禁止。
歷史
[編輯]發現
[編輯]1934年,恩里科·費米和羅馬大學的研究團隊發佈消息,表示他們發現了元素94[6]。費米將元素取名 hesperium,並曾在他1938年的諾貝爾獎演說中提及[7]。然而,他們的研究成果其實是鋇、氪等許多其他元素的混合物,但由於當時核分裂尚未發明,這個誤會便一直延續[8]。

1940年12月14日,鈈(特別是鈈-238)才首度被製造、獨立分離出。1941年2月23日,格倫·西奧多·西博格、埃德溫·麥克米倫、約瑟夫·甘迺迪和歐亞哲博士在柏克萊加州大學,在一個60英吋(150公分)的迴旋加速器中以氘核撞擊鈾、首度成功地以物理方法得到鈈元素[9]。在1940年的實驗裏,科學家以撞擊直接製造出鎿-238,但在二天後產生β衰變,後被認定是元素94的形成[10]。
1941年3月,科學家團隊將報告寄給《物理評論》雜誌[10],但由於發現了新元素的同位素(鈈-239)能產生核分裂、往後或許能用於製造原子彈,而在出版前遭到撤回。基於安全因素,報告延遲了一年、直到二次大戰結束後才順利登載[11]。
埃德溫·麥克米倫將前發現的超鈾元素以行星海王星(Neptune)命名,並提議以冥王星(Pluto)為系列的下一個元素、即元素94取名[12]。西博格原先屬意取名「plutium」,但後來認為它的發音不如「plutonium」[13]。他在一次玩笑中選擇「Pu」作為元素符號,卻在沒有被事先通知的情況下,意外被正式納入元素週期表。西博格亦曾因為誤信他們已經找到週期表中最後一個可能存在的元素,而考慮過「ultimium」(意為「最終」)或「extremium」(意為「極度」)等名稱。[14]
曼哈頓項目
[編輯]
世界上第一座鈈生產堆是1943年3月杜邦公司在橡樹嶺建設的X-10石墨反應堆及配套的鈈化學分離廠。反應堆是邊長為7.3 m的立方體,重1,500噸,由厚達2.1 m的高密度混凝土牆構成輻射防護屏障。鈾燃料裝在鋁質外殼的燃料棒內。空氣強制冷卻。1943年11月3日裝入30噸鈾後臨界運行,功率500至4000 kW,月產鈈500毫克。

為了批產鈈239,1943年10月10日杜邦公司開始在華盛頓州漢福德區建設大型石墨水冷反應堆。功率25萬千瓦。混凝土廠房高37米。計劃建造6座反應堆,1944年2月反應堆動工,三座反應堆分別於1944年9月13日、12月17日、1945年2月5日啟動。
1944年4月,Emilio Segrè發現反應堆增殖鈈的自發裂變率是加速器製造鈈的5倍,這是因為前者含有一定量的鈈-240,因此不適用槍型原子彈,只能用於內爆原子彈。
冷戰的使用與濫用
[編輯]冷戰期間,蘇聯和美方都密集貯存大量的武器級鈈元素。美國在華盛頓州漢福德基地(Hanford Site)和薩凡納河基地(Savannah River Site)的核反應器便製造了103公噸鈈元素[15],俄國估計也有170公噸產量的武器級鈈元素[16]。核能工業每年約產出20公噸的副產物鈈元素[17]。多達1000公噸的鈈受到儲存,其中超過200公噸或用於製作、或提煉自核武器之中[10]。斯德哥爾摩國際和平研究所(SIPRI)估計迄2007年全球約有500公噸的鈈庫存量,平均分配於軍用和民用[18]。
醫學實驗
[編輯]自二次大戰起,曼哈頓計劃和其他核武研究計劃的科學家便着手研究鈈對實驗動物及人體的影響[19]。科學家發現,動物組織內只要含達每公斤數毫克的鈈就能致死[20]。
人體實驗方面,科學家以醫院內邁入絕症末期,或因年齡或慢性疾病使預期壽命低於十年的患者為對象,在體內注射五微克劑量的鈈溶液[19]。1945年7月,科學家在動物研究發現鈈在骨骼中擴散的情形危險程度更甚於鐳後,將人體注射劑量改降至一微克[20]。
其中十八名人體實驗對象是在非知後同意的情況下被注射鈈溶液。人體實驗的目的是為了製作測定人體對鈈的吸收速度的診斷工具,以訂定對鈈相關工作的安全標準[19]。
現在人們認為這次事件違反醫學倫理和希波克拉底誓詞。許多評論者雖認同此舉確實違背了信任及道德原則,但「鈈物質注射對人體的影響並不像初期新聞故事所描繪的那麼嚴重、有害」,不過「也不像當時和現今科學家所相信的、沒有絲毫的負面作用」[21]。
特性
[編輯]物理性質
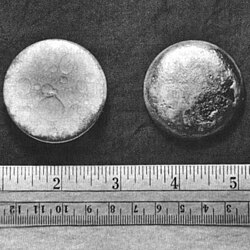
[編輯]鈈和多數金屬一樣具銀灰色外表,尤與鎳特別相似,但它在氧化後會迅速轉為暗灰色(有時呈黃色或橄欖綠),而將其氧化後,會產生一定的熱能。[22][23]。鈈在室溫下以α型存在,是鈈元素最普遍的結構型態(同素異形體),質地如鑄鐵般堅而易脆,但與其他金屬製成合金後又變得柔軟而富延展性。鈈和多數金屬不同,它不是熱和電的良好導體。它的熔點很低(640 °C),而沸點異常的高(3327 °C)[22]。
鈈最普遍釋放的致電離輻射類型是α粒子發射(即釋放出高能的氦原子核)[24]。最典型的一種核子武器核心即是以5公斤(約12.5 × 1024個)鈈原子構成。由於鈈的半衰期為24,100年,故其每秒約有11.5 × 1012個鈈原子產生衰變,發射出5.157 MeV的α粒子,相當於9.68瓦特能量。α粒子的減速會釋放出熱能,使觸摸時感覺溫暖[25]。
電阻率是表物質所能抵抗電流流經強度的物理量。鈈於室溫時的電阻率比一般金屬高很多,而且鈈和多數金屬相反,其電阻率隨溫度降低而提高[26]。但近期研究指出,當溫度降至100K以下時,鈈的電阻率會急遽降低[26]。電阻率由於輻射損傷,會在20K之後逐漸提高,速率因同位素結構而異[26]。
鈈具有自發輻射性質,使得晶體結構產生疲勞,即原有秩序的原子排列因為輻射而隨時間產生紊亂[27]。然而,當溫度上升超過100K時,自發輻射也能導致退火,削弱疲勞現象[28]。
鈈和多數金屬不同:它的密度在熔化時變大(約2.5%),但液態金屬的密度又隨溫度呈線性下降[26]。另外,接近熔點時,鈈的液態金屬具有很高的黏性和表面張力(相較於其他金屬)[27]。
同素異形體
[編輯]
在一般情況下,鈈有六種同素異形體,並在高溫、限定壓強範圍下有第七種(ζ)存在[29]。這些同素異形體的內能相近,但擁有截然不同的密度和晶體結構。因此鈈對溫度、壓強以及化學性質的變化十分敏感,各同素異形體的體積並隨相變而具有極大差異性[27]。密度因同素異形體而異,範圍自16.00 g/cm3到19.86 g/cm3不等[17]。
諸多同素異形體的存在,造成鈈的狀態易變,使鈈元素的製造變得非常困難。例如,α型存在於室溫的純鈈中。它和鑄鐵有許多相似加工後性質,但只要稍微提高溫度,便會轉成具有可塑性和可鍛造性的β型[30]。造成鈈複雜相圖的背後因素迄今仍未被完整解惑。α型屬於低對稱性的單斜結構,因此促成它的易碎性、強度、壓縮性及低傳導性[29]。
化合物與化學性質
[編輯]
室溫時,純鈈金屬是銀灰色、但因氧化而鏽蝕[31]。鈈在水溶液中形成四種離子氧化態[17]:
- Pu(III) — Pu3+(藍紫色)
- Pu(IV) — Pu4+(黃棕色)
- Pu(V) — PuO2+(粉紅色?)[註 1]
- Pu(VI) — PuO22+(粉桔色)
- Pu(VII) — PuO53−(綠色)–七價離子較稀有
鈈溶液所呈現的顏色決定於氧化態和酸陰離子的性質[32]。鈈的酸陰離子種類影響了錯合(原子與中心原子結合)的程度。
核分裂
[編輯]
鈈是一種具放射性的錒系元素。它的5f電子是離域和定域之間的過渡界線;鈈因此常被認為是最複雜的元素之一[33]。它的同位素鈈-239是三個最重要的易裂變同位素之一(另外二者為鈾-233和鈾-235)[34];鈈-241也具有高度易裂變性。所謂的具「易裂變性」(fissile),是指同位素的原子核受到慢中子撞擊後,能夠產生核分裂,並另釋放出足以支持核連鎖反應、進一步促使原子核分裂的中子。
同位素
[編輯]鈈有二十種已知的同位素,全部都具有放射性。其中壽命最長的是鈈-244(半衰期為8080萬年),也是所有超鈾元素中半衰期最長的核種。其他較長壽的同位素有鈈-242(半衰期為373300年)及鈈-239(半衰期為24110年)。其餘的放射性同位素半衰期都低於7000年。鈈也有八種同核異構體,但並不穩定、半衰期都不超過一秒[24]。鈈-244存在於太空中。[35]
已知的鈈同位素的質量數範圍從228到247不等。其中質量數低於鈈-244(最穩定的鈈同位素)的同位素,主要的衰變方式是自發裂變和α衰變,衰變產物通常生成鈾(92個質子)和鎿(93個質子)的同位素(忽略裂變過程產生之二子核的大範圍)。質量數大於鈈-244的同位素則以β衰變為主要衰變方式,衰變產物多為鎇(95個質子)。鈈-241是鎿衰變系的母同位素,透過β衰變變成鎇-241。[24][36]。
鈈-238和鈈-239是最常用的人造同位素[12]。鈈-239是用中子轟擊鈾,透過下列反應合成的[37]:
鈾-235裂變中的中子被鈾-238原子核俘獲、形成鈾-239;β衰變將一個中子轉變成質子,形成鎿-239(半衰期為2.36日),另一次β衰變則形成鈈-239[38]。合金管工程的學者曾在1940年推導出此反應式。
鈈-238是以氘核(D,重氫的原子核)撞擊鈾-238,透過下列反應合成[39]:
在此反應過程中,一個氘核撞擊鈾-238,生成兩個中子和鎿-238;鎿-238再發射β-粒子,形成鈈-238。[40]鈈-238也可以由鎿-237中子活化而成。[41]
衰變熱與裂變性質
[編輯]鈈同位素會發生放射性衰變,釋放出衰變熱。不同的同位素,單位質量所釋出的熱量也有所差異。衰變熱的單位通常以「瓦特/公斤」或「毫瓦特/公克」計。所有同位素在衰變時都會釋放出微弱的伽馬射線。
| 同位素 | 衰變方式 | 半衰期(年) | 衰變熱(W/kg) | 自發裂變中子(1/(g·s)) | 簡介 |
|---|---|---|---|---|---|
| 鈈-238 | α衰變成為鈾-234 | 87.74 | 560 | 2600 | 衰變熱極高。即使量少也能顯著自燃。使用於放射性同位素熱電機。 |
| 鈈-239 | α衰變成為鈾-235 | 24100 | 1.9 | 0.022 | 現最主要使用的易裂變同位素。 |
| 鈈-240 | α衰變成為鈾-236 自發裂變 |
6560 | 6.8 | 910 | 鈈-239同位素的主要雜質。 |
| 鈈-241 | β衰變成為鎇-241 | 14.4 | 4.2 | 0.049 | 衰變成為鎇-241;輻射危害的早期研究對象。 |
| 鈈-242 | α衰變成為鈾-238 | 376000 | 0.1 | 1700 |
存量
[編輯]
鈈是天然存在於自然界中原子序最大的元素。在自然界中可以找到痕量的鈈-238、鈈-239、鈈-240和鈈-244。鈈-239是鈾礦中的鈾-238經過中子俘獲緊接着發生兩次β衰變而成的:(238U → 239U → 239Np → 239Pu)[43][44]。鈾礦中可能還含有極少量的鈈-238,為鈾-238極其罕見地發生雙β衰變所產生(概率只有2.19×10−10%),科學家目前已在天然鈾礦石樣本中檢測到其存在。[45]
由於其相對較長的半衰期(約 8000 萬年),有人認為鈈-244 作為原始核種 自然存在,但其檢測的早期報告無法得到證實。[46]然而,它的長半衰期確保了它在滅絕之前在整個太陽系中循環,[47] 事實上,已經在隕石中發現了滅絕的244Pu自發裂變的證據。[48] 244Pu 在早期太陽系中的存在已得到證實,因為它今天表現為其子體的過量,即 232Th (來自α衰變途徑)或氙同位素(來自其自發裂變)。 後者通常更有用,因為釷和鈈的化學性質非常相似(兩者主要都是四價),因此過量的釷並不能有力地證明其中一些鈈是作為鈈子體形成的。[49] 244Pu 是所有超鈾核種中半衰期最長的,僅在 超新星e 和碰撞 中子星 的 r 過程 中產生; 當原子核從這些事件中高速噴射到地球時,244超鈾核種中只有鈈有足夠長的半衰期,可以在整個旅程中存活下來,因此會留下微小的生命星際痕跡244 在深海海底發現了Pu。 由於240Pu也出現在244Pu的衰變鏈中,因此它也必定存在於長期平衡中,儘管數量更小 。[50]
由於已經進行了550次大氣和水下核試驗,以及少數重大核事故,人體中通常會發現微量鈈痕跡。1963 年,美國、英國、蘇聯和其他國家簽署並批准了《有限禁止核試驗條約》,停止了大多數大氣層和水下核試驗。 非條約國家自 1963 年以來持續進行的大氣層核武器試驗包括中國的試驗(1964 年在戈壁沙漠上空進行原子彈試驗,1967 年氫彈試驗,以及 後續測試)和法國(最近於 20 世紀 90 年代進行測試)。 由於鈈239是專門為核武器和核反應堆製造的,因此它是迄今為止最豐富的鈈同位素。[51]
應用
[編輯]原子彈
[編輯]
同位素鈈-239是核武器中最重要的裂變成份。將鈈核置入反射體(質量數大的物質的反射層)中,能使逃逸的中子再反射回彈心,減少中子的損失,進而降低鈈達到臨界質量的標準量:從原需16公斤的鈈,可減少至10公斤,即一個直徑約10公分的球體的量[52]。它的臨界質量約僅有鈾-235的三分之一[12]。
曼哈頓計劃期間製造的「胖子原子彈」型鈈彈,為了達到極高的密度而選擇使用易爆炸、壓縮的鈈,再結合中心中子源,以刺激反應進行、提高反應效率。因此,鈈彈只需6.2公斤鈈便可達到爆炸當量,相當於2萬噸的三硝基甲苯(TNT)[53][54](參見核武器設計)。在理想假設中,僅僅4公斤的鈈原料(甚至更少),只要搭配複雜的裝配設計,就可製造出一個原子彈[54]。
核燃料
[編輯]鈈-239常用作核反應堆的核燃料。鈈-239可以在反應堆內合成,是人造易分裂元素,其臨界質量比鈾小,在有水的情況下,650克的鈈即可發生臨界事故。金屬態的鈈較脆弱,熔點低(640℃);從室溫到熔點有六種同素異形體,結構變化複雜;導熱系數低,僅為鈾的1/6左右;線膨脹系數大,各向異性十分明顯;化學穩定性很差,並極易氧化,易與氫氣和二氧化碳發生反應。這些缺點使金屬態的鈈不適合作為核燃料,一般都以氧化物的形式與氧化鈾混合使用,即混合氧化物燃料。這種鈈與鈾的組合可以實現快中子增殖,因而成為當今着重研究的核燃料之一。
核廢料
[編輯]一般輕水反應堆所產生的核廢料中含有鈈,但為鈈-242、鈈-239和鈈-238的混合物。它的濃度不足以製作成核武器,不過可以改用作一次性的混氧燃料(MOX fuel)。在反應堆中以慢速熱中子放射線照射鈈時,會偶然發生中子俘獲,而增加鈈-242和鈈-240的量。因此反應進行到第二輪之後,鈈只能和快中子反應堆反應、消耗。在反應器中沒有快中子時(普遍情況下),剩餘的鈈通常會被遺棄,形成壽命長、處理棘手的核廢料成分。
能源與熱源
[編輯]
同位素鈈-238的半衰期為87.74年[55]。它會放出大量熱能,伴隨着低能的伽馬和自發裂變射線/粒子[56]。它是α輻射體,同時具有高輻射能及低穿透性,故僅需低度防護措施。單一紙張就可以抵擋鈈-238所放射出的α粒子;同時,每公斤的鈈-238可產生約570瓦特熱能[12][56]。以上特性使鈈-238適宜用於製作放射性同位素熱電機。
謠傳
[編輯]中國大陸百科網站百度百科曾經謠傳只要約一粒方糖大小(約5克)的鈈便足以令全球人類死亡。香港無線電視的新聞節目曾引用此謠傳,結果被廣播事務管理局警告,指報道令觀眾驚恐,未有提供足夠證據確保報道準確[57]。
參見
[編輯]註釋
[編輯]- ^ PuO2+離子在溶液中十分不穩定,所佔比例不比Pu4+和PuO22+;Pu4+又會將剩餘PuO2+氧化成PuO22+,自身還原為Pu3+。因此,鈈水溶液會漸漸趨向Pu3+ 和PuO22+的混合溶液。
- Crooks, William J. Nuclear Criticality Safety Engineering Training Module 10 – Criticality Safety in Material Processing Operations, Part 1 (PDF). 2002 [2006-02-15]. (原始內容 (PDF)存檔於2006-03-20).
參考資料
[編輯]- ^ Magnetic susceptibility of the elements and inorganic compounds 互聯網檔案館的存檔,存檔日期2011-03-03., in Lide, D. R. (編), CRC Handbook of Chemistry and Physics 86th, Boca Raton (FL): CRC Press, 2005, ISBN 0-8493-0486-5
- ^ Yang, Sarah. Historic plutonium sample traced to Seaborg, Manhattan Project. Berkeley News. 2015-01-16 [2019-07-21]. (原始內容存檔於2021-05-16) (美國英語).
- ^ University of California, Berkeley. Atomic Heritage Foundation. [2019-07-21]. (原始內容存檔於2021-05-12) (英語).
- ^ 'Detection of Plutonium-244 in Nature,' Nature 234, 132-134 (19 November 1971). [2010-09-17]. (原始內容 (PDF)存檔於2016-03-03).
- ^ Little Boy and Fat Man. Atomic Heritage Foundation. [2019-07-21]. (原始內容存檔於2017-12-24) (英語).
- ^ Holden, Norman E. A Short History of Nuclear Data and Its Evaluation. 51st Meeting of the USDOE Cross Section Evaluation Working Group. Upton (NY): National Nuclear Data Center, Brookhaven National Laboratory. 2001 [2009-01-03]. (原始內容存檔於2017-11-08).
- ^ Fermi, Enrico. Artificial radioactivity produced by neutron bombardment: Nobel Lecture (PDF). Royal Swedish Academy of Sciences. 1938-12-12 [2010-09-20]. (原始內容 (PDF)存檔於2011-08-05).
- ^ Darden, Lindley. Enrico Fermi: "Transuranium" Elements, Slow Neutrons. The Nature of Scientific Inquiry. College Park (MD): Department of Philosophy, University of Maryland. 1998 [2008-01-03]. (原始內容存檔於2012-08-17).
- ^ LBNL contributors. Elements 93 and 94. Advanced Computing for Science Department, Lawrence Berkeley National Laboratory. [2008-09-17]. (原始內容存檔於2008-09-20).
- ^ 10.0 10.1 10.2 Emsley 2001
- ^ Stwertka 1998
- ^ 12.0 12.1 12.2 12.3 Heiserman 1992,第338頁.
- ^ Clark, David L.; Hobart, David E. Reflections on the Legacy of a Legend: Glenn T. Seaborg, 1912–1999 (PDF). Los Alamos Science. 2000, 26: 56–61, on 57 [2009-02-15]. (原始內容 (PDF)存檔於2011-06-04).
- ^ PBS contributors. Frontline interview with Seaborg. Frontline. Public Broadcasting Service. 1997 [2008-12-07]. (原始內容存檔於2009-01-05).
- ^ DOE contributors. Historic American Engineering Record: B Reactor (105-B Building). Richland (WA): U.S. Department of Energy. 2001: 110 [2008-12-24]. DOE/RL-2001-16. (原始內容存檔於2021-03-07).
- ^ Cochran, Thomas B. Safeguarding nuclear weapons-usable materials in Russia (PDF). International Forum on Illegal Nuclear Traffic. Washington (DC): Natural Resources Defense Council, Inc. 1997 [2008-12-21]. (原始內容 (PDF)存檔於2013-07-05).
- ^ 17.0 17.1 17.2 CRC 2006,第4–27頁
- ^ Stockholm International Peace Research Institute. SIPRI Yearbook 2007: Armaments, Disarmament, and International Security. Oxford University Press. 2007: 567. ISBN 9780199230211.
- ^ 19.0 19.1 19.2 Moss, William; Eckhardt, Roger. The Human Plutonium Injection Experiments (PDF). Los Alamos Science (Los Alamos National Laboratory). 1995, 23: 188, 205, 208, 214 [2006-06-06]. (原始內容 (PDF)存檔於2021-02-20).
- ^ 20.0 20.1 Voelz, George L. Plutonium and Health: How great is the risk?. Los Alamos Science (Los Alamos (NM): Los Alamos National Laboratory). 2000, (26): 78–79.
- ^ Yesley, Michael S. 'Ethical Harm' and the Plutonium Injection Experiments (PDF). Los Alamos Science. 1995, 23: 280–283 [2009-02-15]. (原始內容 (PDF)存檔於2021-03-27).
- ^ 22.0 22.1 NIH contributors. Plutonium, Radioactive. Wireless Information System for Emergency Responders (WISER). Bethesda (MD): U.S. National Library of Medicine, National Institutes of Health. [2008-11-23]. (原始內容存檔於2011-08-22). (public domain text)
- ^ ARQ staff. Nitric acid processing. Actinide Research Quarterly (Los Alamos (NM): Los Alamos National Laboratory). 2008, (3rd quarter) [2010-02-09]. (原始內容存檔於2010-05-27).
While plutonium dioxide is normally olive green, samples can be various colors. It is generally believed that the color is a function of chemical purity, stoichiometry, particle size, and method of preparation, although the color resulting from a given preparation method is not always reproducible.
- ^ 24.0 24.1 24.2 NNDC contributors; Alejandro A. Sonzogni (Database Manager). Chart of Nuclides. Upton (NY): National Nuclear Data Center, Brookhaven National Laboratory. 2008 [2008-09-13]. (原始內容存檔於2011-07-21).
- ^ Rhodes, Richard. The Making of the Atomic Bomb. New York: Simon & Schuster. 1986: 659–660. ISBN 0-671-65719-4. Leona Marshall: "When you hold a lump of it in your hand, it feels warm, like a live rabbit"
- ^ 26.0 26.1 26.2 26.3 Miner 1968,第544頁
- ^ 27.0 27.1 27.2 Hecker, Siegfried S. Plutonium and its alloys: from atoms to microstructure (PDF). Los Alamos Science. 2000, 26: 290–335 [2009-02-15]. (原始內容 (PDF)存檔於2021-03-19).
- ^ Hecker, Siegfried S.; Martz, Joseph C. Aging of Plutonium and Its Alloys (PDF). Los Alamos Science (Los Alamos, New Mexico: Los Alamos National Laboratory). 2000, (26): 242 [2009-02-15]. (原始內容 (PDF)存檔於2021-04-28).
- ^ 29.0 29.1 29.2 Baker, Richard D.; Hecker, Siegfried S.; Harbur, Delbert R. Plutonium: A Wartime Nightmare but a Metallurgist's Dream (PDF). Los Alamos Science (Los Alamos National Laboratory). 1983: 148, 150–151 [2009-02-15]. (原始內容 (PDF)存檔於2011-10-17).
- ^ Miner 1968,第542頁
- ^ Heiserman 1992,第339頁.
- ^ Matlack, George. A Plutonium Primer: An Introduction to Plutonium Chemistry and its Radioactivity. Los Alamos National Laboratory. 2002. LA-UR-02-6594.
- ^ Dumé, Belle. Plutonium is also a superconductor. PhysicsWeb.org. 2002-11-20 [2010-09-18]. (原始內容存檔於2012-01-12).
- ^ EPA contributors. Fissile Material. Radiation Glossary. United States Environmental Protection Agency. 2008 [2008-11-23]. (原始內容存檔於2011-07-20).
- ^ Wallner, A.; Faestermann, T.; Feige, J.; Feldstein, C.; Knie, K.; Korschinek, G.; Kutschera, W.; Ofan, A.; Paul, M.; Quinto, F.; Rugel, G.; Steier, P. Abundance of live 244Pu in deep-sea reservoirs on Earth points to rarity of actinide nucleosynthesis. Nature Communications. 2015, 6: 5956. Bibcode:2015NatCo...6.5956W. ISSN 2041-1723. PMC 4309418
 . PMID 25601158. arXiv:1509.08054
. PMID 25601158. arXiv:1509.08054  . doi:10.1038/ncomms6956.
. doi:10.1038/ncomms6956.
- ^ Heiserman 1992,第340頁.
- ^ Kennedy, J. W.; Seaborg, G. T.; Segrè, E.; Wahl, A. C. Properties of Element 94. Physical Review. 1946, 70 (7–8): 555–556. doi:10.1103/PhysRev.70.555.
- ^ Greenwood 1997,第1259頁
- ^ Seaborg, Glenn T.; McMillan, E.; Kennedy, J. W.; Wahl, A. C. Radioactive Element 94 from Deuterons on Uranium. Physical Review. 1946, 69 (7–8): 366–367. doi:10.1103/PhysRev.69.367.
- ^ Bernstein 2007,第76–77頁.
- ^ Miotla, Dennis. Assessment of Plutonium-238 Production of Alternatives: Briefing for Nuclear Energy Advisory Committee (PDF). Energy.gov. 21 April 2008 [28 February 2022]. (原始內容存檔 (PDF)於March 16, 2022).
- ^ Can Reactor Grade Plutonium Produce Nuclear Fission Weapons?. Council for Nuclear Fuel Cycle Institute for Energy Economics, Japan. May 2001 [2010-09-19]. (原始內容存檔於2021-02-24).
- ^ Bernstein 2007,第75–77頁.
- ^ Hoffman, D. C.; Lawrence, F. O.; Mewherter, J. L.; Rourke, F. M. Detection of Plutonium-244 in Nature. Nature. 1971, 234 (5325): 132–134. Bibcode:1971Natur.234..132H. doi:10.1038/234132a0.
- ^ Peterson, Ivars. Uranium displays rare type of radioactivity. Science News (Wiley-Blackwell). December 7, 1991, 140 (23): 373. JSTOR 3976137. doi:10.2307/3976137.
- ^ Hoffman, D. C.; Lawrence, F. O.; Mewherter, J. L.; Rourke, F. M. Detection of Plutonium-244 in Nature. Nature. 1971, 234 (5325): 132–134. Bibcode:1971Natur.234..132H. doi:10.1038/234132a0. Nr. 34.
- ^ Turner, Grenville; Harrison, T. Mark; Holland, Greg; Mojzsis, Stephen J.; Gilmour, Jamie. Extinct 244Pu in Ancient Zircons (PDF). Science. 2004-01-01, 306 (5693): 89–91. Bibcode:2004Sci...306...89T. JSTOR 3839259. PMID 15459384. doi:10.1126/science.1101014. (原始內容 (PDF)存檔於2020-02-11).
- ^ Hutcheon, I. D.; Price, P. B. Plutonium-244 Fission Tracks: Evidence in a Lunar Rock 3.95 Billion Years Old. Science. 1972-01-01, 176 (4037): 909–911. Bibcode:1972Sci...176..909H. JSTOR 1733798. PMID 17829301. doi:10.1126/science.176.4037.909.
- ^ Kunz, Joachim; Staudacher, Thomas; Allègre, Claude J. Plutonium-Fission Xenon Found in Earth's Mantle. Science. 1998-01-01, 280 (5365): 877–880. Bibcode:1998Sci...280..877K. JSTOR 2896480. doi:10.1126/science.280.5365.877.
- ^ Wallner, A.; Faestermann, T.; Feige, J.; Feldstein, C.; Knie, K.; Korschinek, G.; Kutschera, W.; Ofan, A.; Paul, M.; Quinto, F.; Rugel, G.; Steiner, P. Abundance of live 244Pu in deep-sea reservoirs on Earth points to rarity of actinide nucleosynthesis. Nature Communications. 30 March 2014, 6: 5956. Bibcode:2015NatCo...6E5956W. arXiv:1509.08054
 . doi:10.1038/ncomms6956.
. doi:10.1038/ncomms6956.
- ^ Emsley 2001,第324–329頁
- ^ Martin, James E. Physics for Radiation Protection 1st. Wiley-Interscience. 2000: 532. ISBN 0471353736.
- ^ Malik, John. The Yields of the Hiroshima and Nagasaki Explosions (PDF). Los Alamos. September 1985: Table VI [2009-02-15]. LA-8819. (原始內容 (PDF)存檔於2021-03-14).
- ^ 54.0 54.1 FAS contributors. Nuclear Weapon Design. Federation of American Scientists. 1998 [2008-12-07]. (原始內容存檔於2016-08-28).
- ^ Science for the Critical Masses: How Plutonium Changes with Time. Institute for Energy and Environmental Research. [2010-10-02]. (原始內容存檔於2012-02-14).
- ^ 56.0 56.1 ARQ contributors. From heat sources to heart sources: Los Alamos made material for plutonium-powered pumper. Actinide Research Quarterly (Los Alamos (NM): Los Alamos National Laboratory). 2005, (1) [2009-02-15]. (原始內容存檔於2013-02-16).
- ^ 錯報核新聞 無線遭警告[失效連結],《明報》,2011年10月4日
<references>標籤中name屬性為「FOOTNOTEHeiserman1992338」的參考文獻沒有在文中使用參考書目
[編輯]- CRC contributors. David R. Lide , 編. Handbook of Chemistry and Physics 87th. Boca Raton (FL): CRC Press, Taylor & Francis Group. 2006. ISBN 0849304873.
- Emsley, John. Plutonium. Nature's Building Blocks: An A-Z Guide to the Elements. Oxford (UK): Oxford University Press. 2001: 324–329. ISBN 0198503407.
- Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Oxford (UK): Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4.
- Heiserman, David L. Element 94: Plutonium. Exploring Chemical Elements and their Compounds. New York (NY): TAB Books. 1992: 337–340. ISBN 0-8306-3018-X.
- Miner, William N.; Schonfeld, Fred W. Plutonium. Clifford A. Hampel (editor) (編). The Encyclopedia of the Chemical Elements. New York (NY): Reinhold Book Corporation. 1968: 540–546. LCCN 68-29938.
- Stwertka, Albert. Plutonium. Guide to the Elements Revised. Oxford (UK): Oxford University Press. 1998. ISBN 0-19-508083-1.
外部連結
[編輯]- 元素鈈在洛斯阿拉莫斯國家實驗室的介紹(英文)
- EnvironmentalChemistry.com —— 鈈(英文)
- 元素鈈在The Periodic Table of Videos(諾丁漢大學)的介紹(英文)
- 元素鈈在Peter van der Krogt elements site的介紹(英文)
- WebElements.com – 鈈(英文)
- Sutcliffe, W.G.; et al. A Perspective on the Dangers of Plutonium. Lawrence Livermore National Laboratory. 1995. (原始內容存檔於2006-09-29).
- Johnson, C.M.; Davis, Z.S. Nuclear Weapons: Disposal Options for Surplus Weapons-Usable Plutonium. CRS Report for Congress # 97-564 ENR. 1997 [2009-02-15]. (原始內容存檔於2021-03-07).
- IEER contributors. Physical, Nuclear, and Chemical, Properties of Plutonium. IEER. 2005 [2009-02-15]. (原始內容存檔於2011-08-05).
- Bhadeshia, H. Plutonium crystallography. [2010-09-19]. (原始內容存檔於2018-05-08).
- Samuels, D. End of the Plutonium Age. Discover Magazine. 2005, 26 (11) [2010-09-19]. (原始內容存檔於2011-11-08).
- Pike, J.; Sherman, R. Plutonium production. Federation of American Scientists. 2000 [2009-02-15]. (原始內容存檔於2009-02-03).
- Nuclear Weapon Archive contributors. Plutonium Manufacture and Fabrication. Nuclearweaponarchive.org.
- Ong, C. World Plutonium Inventories. Nuclear Files.org. 1999 [2009-02-15]. (原始內容存檔於2011-06-21).
- LANL contributors. Challenges in Plutonium Science. Los Alamos Science. 2000, I & II (26) [2009-02-15]. (原始內容存檔於2017-01-18).
- NLM contributors. Plutonium, Radioactive. NLM Hazardous Substances Databank. [2009-02-15]. (原始內容存檔於2016-01-12).
- Alsos contributors. Annotated Bibliography on plutonium. Alsos Digital Library for Nuclear Issues. [2009-02-15]. (原始內容存檔於2009-02-03).
- Chemistry in its element podcast (MP3) from the Royal Society of Chemistry's Chemistry World: Plutonium (頁面存檔備份,存於互聯網檔案館)



![{\displaystyle \mathrm {^{238}_{\ 92}U\ +\ _{0}^{1}n\ \longrightarrow \ _{\ 92}^{239}U\ {\xrightarrow[{23.5\ min}]{\beta ^{-}}}\ _{\ 93}^{239}Np\ {\xrightarrow[{2.3565\ d}]{\beta ^{-}}}\ _{\ 94}^{239}Pu} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/ca14d0d7115d4a0e1c82696e40c9ef5bd86d1b5a)
![{\displaystyle \mathrm {^{238}_{\ 92}U\ +\ _{1}^{2}D\ \longrightarrow \ _{\ 93}^{238}Np\ +\ 2\ _{0}^{1}n\quad ;\quad _{\ 93}^{238}Np\ {\xrightarrow[{2.117\ d}]{\beta ^{-}}}\ _{\ 94}^{238}Pu} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/b5abd19c409e081b987cfbd597daa54af8029f82)

