雷帕黴素
 | |
 | |
| 臨床資料 | |
|---|---|
| 核准狀況 | |
| 懷孕分級 |
|
| 給藥途徑 | 口服 |
| ATC碼 | |
| 法律規範狀態 | |
| 法律規範 | |
| 藥物動力學數據 | |
| 生物利用度 | 20%,在攝入高脂肪食物後則更小 |
| 血漿蛋白結合率 | 92% |
| 藥物代謝 | 肝臟 |
| 生物半衰期 | 57–63小時 |
| 排泄途徑 | 主要為糞便 |
| 識別資訊 | |
| |
| CAS號 | 53123-88-9 |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| CompTox Dashboard (EPA) | |
| ECHA InfoCard | 100.107.147 |
| 化學資訊 | |
| 化學式 | C51H79NO13 |
| 摩爾質量 | 914.19 g·mol−1 |
| 3D模型(JSmol) | |
| |
| |
雷帕黴素(rapamycin)[1],藥品通用名西羅莫司(INN/USAN:sirolimus)[2],商品名雷帕明(Rapamune)[3],是一種含氮三烯32環的大環內酯類化合物,具有抗真菌、抗腫瘤、強免疫抑制活性,現主要運用於腎移植的抗排異治療。雷帕黴素通過抑制白血球介素-2從而阻礙激活T細胞及B細胞來抑制免疫。
雷帕黴素首次發現於復活節島土壤樣品內吸水鏈黴菌(Streptomyces hygroscopicus)產物中[4],雷帕黴素即得名於復活節島在玻里尼西亞語中的名字雷帕島(Rapa Nui)[5][6]。雷帕黴素最初設想開發為抗真菌藥物,但發現其具有強烈的免疫抑制及抗增殖作用而被放棄用於抗真菌治療。1999年9月,美國食品藥品管理局批准將雷帕黴素作為免疫抑制劑用於腎移植。2009年,美國國家老年研究所資助的研究顯示雷帕黴素可延長小鼠的壽限,特別是其最大壽限可延長達60%。同時其也正被研究用於癌症等疾病的治療。[7]
藥用發展
[編輯]1964年,加拿大麥基爾大學的斯坦利·斯科利納在復活節島採集了一份土壤樣本。他將該樣本交給了惠氏藥廠實驗室,以尋求研發新型抗生素。1972年,研究員篩選出了一種可抑制真菌的物質,並預想用於治療酵母菌感染。但之後的細胞培養實驗顯示,它會阻礙免疫細胞增殖。1999年,美國食品藥品管理局批准雷帕黴素作為免疫抑制劑用於腎移植。20世紀80年代,研究發現雷帕黴素可抑制腫瘤生長。2007年起,雷帕黴素的兩種衍生物開發用於治療癌症,分為為輝瑞公司的坦羅莫司和諾華公司的依維莫司。2009年,巴夏普長壽與衰老研究所的蘭迪·斯特朗實驗室、傑克遜實驗室的戴維·E·哈里森小組和密西根大學安阿伯分校的理察·A·米勒實驗室聯合報道稱雷帕黴素可延長小鼠的壽限。[7]
作用機制
[編輯]雷帕黴素的作用機制為與細胞質基質中的胞漿蛋白FK506結合蛋白12(FKBP12)結合,形成雷帕黴素-FKBP12複合物。該複合物再與mTORC1結合,抑制哺乳動物雷帕黴素靶蛋白(mTOR)通路,產生免疫抑制等作用。哺乳動物雷帕黴素靶蛋白(mTOR)也稱為FKBP-雷帕黴素相關蛋白(FRAP)、雷帕黴素與FKBP靶蛋白(RAFT)、RAPT1或SEP。早期使用的名稱FRAP及RAFT反應了雷帕黴素必須先與FKBP12結合,只有FKBP12-雷帕黴素複合物才能與mTOR結合。
TOR基因
[編輯]在發現雷帕黴素對酵母和人類細胞都具有抗增殖作用後,研究人員意識到調控生長的基因是一個在長期進化中保留下來的高度保守基因。1991年,瑞士巴塞爾大學在對雷帕黴素耐藥突變酵母的遺傳及分子生物學研究中發現了兩個有關雷帕黴素抑制作用的基因,分別為TOR1和TOR2。1994年,美國哈佛大學和懷特黑德生物醫學研究所分別在哺乳動物中找到了TOR基因。[7]
TOR基因會編碼一種可與其他幾種蛋白質結合的酶,並與細胞內的其他蛋白形成蛋白複合物(TORC),調控多種與生長相關的細胞生理過程。其中,雷帕黴素主要影響TORC1。
TOR蛋白
[編輯]mTOR蛋白能夠感知細胞內營養物的變化、缺氧、DNA損傷等壓力。當機體受壓力時,TOR蛋白活性將降低,通過抑制合成和分裂保存能量,並通過自噬再利用營養物,用於必要之處,等待環境的改善;而當機體壓力較小時,TOR蛋白活性將提高,加速分裂生長,更快的成熟。對果蠅TOR蛋白研究後發現,其細胞在受環境壓力時會選擇優先合成粒線體等關鍵組件。[7]
TOR蛋白與胰島素信號通路相互聯繫。胰島素可在相關蛋白的協助下激活TOR信號通路。TOR蛋白與胰島素通路為負反饋,TOR蛋白激活後可降低細胞對胰島素的敏感性。因此,營養過剩引起的TOR蛋白過度活化將導致細胞對胰島素耐受,從而引發高血糖及糖尿病。[7]
從生命發育的整體看,在哺乳動物幼年時期:環境壓力小時,mTORC1受到胰島素及相關生長因子激活,促進細胞成分的合成,加速細胞生長和增殖,同時抑制自噬作用;而環境壓力大時,mTORC1活性降低,細胞停止複製並增強自噬作用,為細胞修復及能量系統重建提供能量和原材料。在哺乳動物成年後:若mTORC1活性持續維持於高水平,將導致蛋白質合成過度,蓄積錯誤摺疊的蛋白質等;細胞異常增殖,導致動脈粥樣硬化等疾病;細胞功能損害,導致胰島素耐受引起的糖尿病;誘發細胞衰老,對鄰近細胞產生毒性。而mTORC1的高活性又會抑制細胞自噬,從而使得細胞無法清除異常蛋白質及細胞器,最終導致機體衰老。若mTORC1活性降低,那麼上述進程將減緩,從而減緩機體衰老。[7]
TOR蛋白的功能即是在生命的不同階段調控機體的生長,有助於機體應對惡劣環境,並又在環境適宜時促進生長繁殖。通過抑制TOR蛋白活性,阻礙T細胞和B細胞的分化分裂即可抑制免疫及抑制癌症,而抑制蛋白質合成則可對阿爾茨海默氏症等合成異常類疾病產生效果。此外,總體在小鼠上顯示可達到減緩衰老,延長壽限的作用。
臨床應用
[編輯]預防排異反應
[編輯]雷帕黴素相比鈣調磷酸酶抑制劑的優點為較低的腎臟毒性。長期應用調鈣磷酸酶抑制劑的器官移植患者會傾向於發展為腎功能受損,甚至慢性腎功能衰竭,而使用雷帕黴素則可避免。雷帕黴素尤其適用於因溶血性尿毒症而進行腎移植的患者,若使用鈣調磷酸酶抑制劑則可能引起該病的復發。但2008年10月7日,美國食品藥品管理局批准了雷帕黴素的安全性標示變更,以警告與其使用相關的腎功能下降風險。
雷帕黴素可單獨使用,也可與鈣調磷酸酶抑制劑合用,如他克莫司或霉酚酸酯。雷帕黴素可能存在傷口癒合障礙及血小板減少的副作用;因此,一些器官移植中心並不會在移植手術後立即使用雷帕黴素,而是在術後數周或數月才開始應用。
雷帕黴素的最佳應用量尚未確定,現正進行著一系列臨床試驗。每位患者從小腸吸收雷帕黴素至血液系統的程度都不盡相同。同劑量下,部分患者的血藥濃度最高可為其他患者的八倍。因此,需將血藥濃度控制於適合於患者最佳濃度。這取決於下一次給藥前的血藥低谷濃度。
不過,其血藥濃度與藥物暴露量之間存在良好的相關性。雷帕黴素與他克莫司的藥時曲線下面積近似,所以僅需了解兩者的藥代動力學類型即可。此外,在同時服藥時,兩者的藥代動力學類型不變。他克莫司劑量校正的藥物暴露量與雷帕黴素相關,所以其生物利用度類似。[8]
冠狀動脈支架塗層
[編輯]雷帕黴素的抗增殖作用可用於冠狀動脈支架的塗層,以防止冠狀動脈球狀囊血管成形術可能的形成的再狹窄。雷帕黴素配製於聚合物塗層中緩控釋放,可用於冠狀動脈介入治療癒合期治療。幾個大型的臨床研究已證明,使用雷帕黴素洗脫支架的患者與使用裸金屬支架的患者相比,其再狹窄率更低,從而能減少重複手術的概率。一種雷帕黴素洗脫冠狀動脈支架已由強生公司下的分公司上市銷售。[9]但該支架可能會增加血管栓塞的風險。[10]
晚期腎細胞癌
[編輯]mTORC1參與的細胞功能包含營養、能量代謝、氧化還原的感測、控制蛋白質合成等。[11]若感測生長環境壓力大,例如缺氧或營養不足,mTOR將受抑制,降低細胞生長與複製的速度;相反地,若環境合適則推動細胞生長與複製,不受控制的mTOR活化則可能導致細胞的癌化。mTOR蛋白接收來自上游PI3K/AKT途徑的刺激後,帶動下游蛋白質如4EBP, S6K的訊號傳遞。
而雷帕黴素具抑制mTORC1途徑的功能,Everolimus即是抑制mTOR蛋白的標靶藥物。[12]藉由抑制mTOR蛋白,以抑制腫瘤細胞生長、血管增生及代謝功能,達到減緩腫瘤細胞生長、擴散或凋亡。唯其降低免疫的副作用,服用後可能造成白血球數目降低、血小板缺乏、皮疹與口腔發炎。[13]
目前美國FDA已核准使用於治療晚期腎細胞癌,衛生福利部也於2011年2月1日後納入健保給付,可以用於經「sunitinib或sorafenib治療失敗之晚期腎細胞癌病患」之後,作為晚期腎細胞癌的第二線標靶藥物。[14]
副作用
[編輯]肺毒性
[編輯]雷帕黴素治療過程中可出現嚴重的肺毒性併發症[15][16][17][18][19][20][21],特別是肺移植患者[22]。雷帕黴素與其他大環內酯類mTOR抑制劑引起間質性肺炎的機制目前尚不清楚,可能與mTOR通路無關。[23][24][25]該間質性肺病非劑量依賴,但更常見於已有肺部疾病的患者。[15][26]
癌症風險
[編輯]與所有免疫抑制劑一樣,雷帕黴素可能會降低人體的抗癌能力,並使得一些可被自然消滅的癌細胞得以存活並增殖。在接受鈣調磷酸酶抑制劑治療的器官移植患者中,約有10%的患者在70個月後會發展出皮膚腫瘤或淋巴腫瘤。但也有研究稱在紫外線誘發癌症相關過程中,如DNA修復,腫瘤抑制蛋白及MMP酶,鈣調磷酸酶抑制劑與雷帕黴素具不同的生化機制。[27]不過,雷帕黴素似乎也能降低一些器官移植患者的癌症風險。[28]
類糖尿病症狀
[編輯]雷帕黴素通過抑制mTORC1取得大部分有益藥理作用,包括動物使用中的延長壽限。但雷帕黴素也能作用於一種相關的複合物mTORC2。對mTORC2的活性的干擾可產生類似糖尿病的症狀,如糖耐量下降及胰島素不敏感。[29]
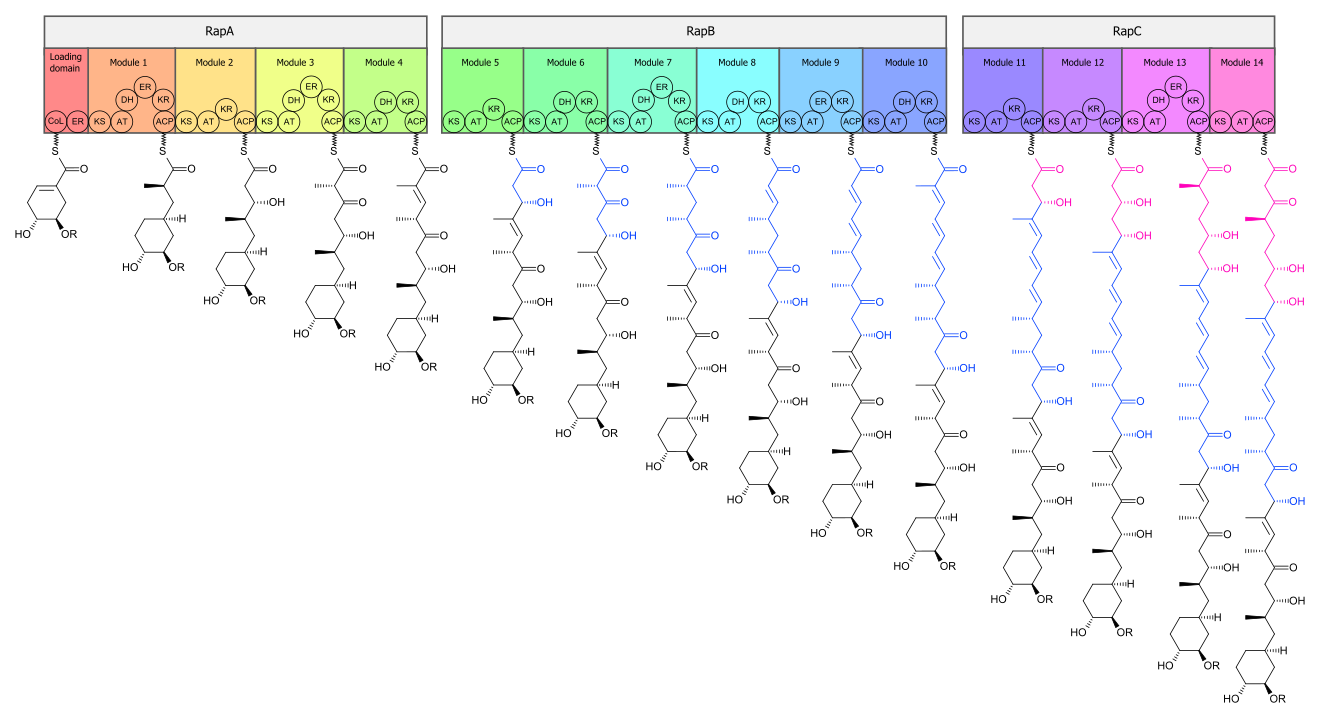
生物合成
[編輯]雷帕黴素生物合成的核心由聚酮合酶1型(PKS)聯合非核糖體肽合成酶(NRPS)完成。雷帕黴素線性聚酮生物合成的酶域由三種多酶組成,包括RapA、RapB及RapC,共包含了14個模塊。這三個多酶中,RapA完成前4個聚酮合成鏈延伸,後6個位於RapB,最後4個位於RapC。[30]然後,線性聚酮合成由NRPS(RapP)修飾,於聚酮合成終端增加L-六氫吡啶羧酸。最後,分子環化,生成前體產物,前雷帕黴素(prerapamycin)。[31]
前雷帕黴素核心大環通過5種酶的修飾將最終形成雷帕黴素。首先,核心大環由RapI,腺苷甲硫氨酸依賴型氧甲基化酶(MTase)修飾,C39甲氧基化。第二,由RapJ,細胞色素P450修飾,C9加羰基。第三,另一個甲基化酶,RapM甲氧基化C16。第四,另一個P-450,RapN在C27加羥基,並緊接著由不同的甲基化酶,RapQ將C27甲氧基化,最終形成雷帕黴素。[32]
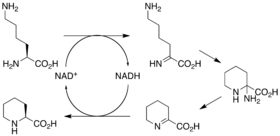
負責雷帕黴素生物合成的基因已被確定。其具三個巨型的開放閱讀框,分布為rapA、rapB和rapC,其分別編碼巨型複合酶RapA、RapB和RapC。[30]rapL基因編碼輔酶Ⅰ依賴賴氨酸環化脫氨酶,其可將L-賴氨酸轉化為聚酮合成末端所需的L-六氫吡啶羧酸。[33][34]rapP基因嵌於PKS基因之間,並與rapC翻譯耦合。rapC編碼NPRS,其功能為結合L-六氫吡啶羧酸、鏈末端終止及前雷帕黴素的環化。此外,rapI、rapJ、rapM、rapN、rapO和rapQ都已被確定為編碼修飾前雷帕黴素核心大環的修飾酶。最後,rapG和rapH已被確定為編碼通過控制PKS基因的表達來積極調節雷帕黴素合成的酶。[35]
核心大環的生物合成起始於4,5-二羥環己基-1-烯羧酸酸,其來源於莽草酸途徑。[30]但要注意的是,起始化合物在轉運至模塊1時失去環己烷環。之後,起始化合物通過一系列以連接在醯基載體蛋白(ACP)上的丙二醯或甲基丙二醯為底物的克萊森縮合反應進行修飾,每個聚酮合成反應增加2個碳原子。每一次縮合後,聚酮將被酶域進一步修飾,如消除或脫水。當線性聚酮合成完成時,NRPS將會把由賴氨酸環化脫氨酶合成的L-六氫吡啶羧酸結合至聚酮末端。之後,NSPS環化聚酮,形成前雷帕黴素。核心大環之後通過一系列的甲基化酶甲氧基化及P-450氧化,最終生存雷帕黴素。
研究
[編輯]
癌症
[編輯]雷帕黴素的抗增殖作用有可能被運用於治療癌症。雷帕黴素可抑制腎移植患者所患卡波西氏肉瘤的進程。其他mTOR抑制劑,如西羅莫司及依維莫司正在被測試用於多形性成膠質細胞瘤及套細胞淋巴瘤的治療。
現已被證明,阿黴素與雷帕黴素聯用可推動緩解小鼠AKT陽性淋巴瘤。AKT信號可促進AKT陽性淋巴瘤細胞存活,並影響化療藥物如阿黴素或環磷醯胺的細胞毒性。雷帕黴素可阻斷AKT信號,使細胞失去化療藥物抗性。此外,雷帕黴素對Bcl-2陽性淋巴瘤細胞完全無效,eIF4E表達淋巴瘤也對雷帕黴素不敏感。[36][37][38][39]
延長老鼠壽限
[編輯]2006年,雷帕黴素是第一個發現具有延長真核生物壽限的藥物。[40]並發現雷帕黴素對酵母細胞壽限存在劑量反應影響。2009年發現,投餵雷帕黴素的雄性小鼠和雌性小鼠壽限分別延長了28%和38%,最高壽限分別延長了9%和14%。值得注意的是,9月齡和20月齡小鼠運用雷帕黴素的效果相同,而20月齡的小鼠相當於人類年齡的60歲。[7]這表明,對於人類的有效抗衰老治療可能只需運用於高齡階段,而非終身。[41]不過,因雷帕黴素存在強烈的免疫抑制作用,人類服用雷帕黴素存在嚴重感染的風險。[42]因不確定雷帕黴素對於人類是否具有類似的延長壽限的作用,所以研究者警告健康人群不應為此使用雷帕黴素。
美國羅斯威爾·帕克癌症研究所的米哈伊爾·V·布拉格斯克隆尼認為TOR蛋白在機體成熟後,將會推動機體衰老死亡。TOR蛋白活性抑制後產生的延長壽限作用是TOR蛋白功能的「異常」效果。[7]
結節性硬化症
[編輯]研究還顯示,雷帕黴素對於結節性硬化症(TSC)具療效。結節性硬化症為先天性疾病,會在腦部、心臟、腎臟、皮膚及其他器官出現良性腫瘤。數個研究確定性指出mTOR抑制劑可緩解結節性硬化症,特別是兒童的室管膜下巨細胞星形細胞瘤及成人的血管平滑肌脂肪瘤。美國在進行許多涉及結節性硬化症的雷帕黴素類似物兒童及成人臨床試驗。[43]
大多數研究已注意到停止治療後腫瘤將會復發。理論上來說,它可改善如面部血管纖維瘤、兒童多動症及自閉症等結節性硬化症症狀,但這些研究還處於動物試驗階段。
小鼠自閉症
[編輯]研究者在研究雷帕黴素對結節性硬化症中發現雷帕黴素對於自閉症引起的發育遲緩具作用。他們使用3至6月大的成年自閉症小鼠試驗,發現在短短3天內就可將自閉症小鼠的智力恢復至正常水平。[44]
小鼠阿爾茨海默氏症
[編輯]雷帕黴素可減少阿爾茨海默氏症腦部病變,減緩患有阿爾茲海默氏症的實驗小鼠在水迷宮模型試驗中的成績下滑。[45]
其他疾病
[編輯]雷帕黴素可通過不同機制抑制愛滋病病毒的複製,包括下調輔助受體CCR5表達[46]及誘導自噬[47]。
雷帕黴素也正在被評估作為常染色體顯性多囊腎病(ADPKD)的治療藥物。研究中顯示雷帕黴素可減少常染色體顯性多囊腎病患者的腎臟體積,並減緩腎功能喪失進程。[48]
雷帕黴素已被初步研究用於治療早衰症。該疾病可導致人體快速衰老,於十幾歲即死於中風或心臟病。[49]
參見
[編輯]- 雷帕黴素機理靶(Mechanistic target of rapamycin/mTOR)
參考文獻
[編輯]- ^ Hobby, Gerren; Clark, Rebecca; Woywodt, Alexander. A treasure from a barren island: the discovery of rapamycin. Clinical Kidney Journal. 2022, 15 (10): 1971–1972. ISSN 2048-8505. PMC 9494524
 . PMID 36158154. doi:10.1093/ckj/sfac116.
. PMID 36158154. doi:10.1093/ckj/sfac116.
- ^ Sehgal, S. N. Sirolimus: its discovery, biological properties, and mechanism of action. Transplantation Proceedings. 2003, 35 (3 Suppl): 7S–14S. ISSN 0041-1345. PMID 12742462. doi:10.1016/s0041-1345(03)00211-2.
- ^ 程元榮. 新型强效免疫抑制剂西罗莫司(Sirolimus)的作用机理、药物代谢和临床. 四川生理科學雜誌. 2000, 22 (4). doi:10.3969/j.issn.1671-3885.2000.04.007.
- ^ Vézina C, Kudelski A, Sehgal SN. Rapamycin (AY-22,989), a new antifungal antibiotic. J. Antibiot. October 1975, 28 (10): 721\u20136. PMID 1102508.
- ^ Pritchard DI. Sourcing a chemical succession for cyclosporin from parasites and human pathogens. Drug Discovery Today. 2005, 10 (10): 688–691. PMID 15896681. doi:10.1016/S1359-6446(05)03395-7.
- ^ Meng, Yanyan; Zhang, Nan; Xiong, Yan. Novel Links in the Plant Target of Rapamycin Signaling Networks. Chinese Bulletin of Botany. 2022-01-01, 57 (1): 1. doi:10.11983/CBB21183.
- ^ 7.0 7.1 7.2 7.3 7.4 7.5 7.6 7.7 David stipp. A New Path to Longevity. Scientific American. [2024-08-21].
- ^ McAlister VC, Mahalati K, Peltekian KM, Fraser A, MacDonald AS. A clinical pharmacokinetic study of tacrolimus and sirolimus combination immunosuppression comparing simultaneous to separated administration.. Ther Drug Monit. June 2002, 24 (3): 346–50 [2012-07-26]. PMID 12021624. (原始內容存檔於2012-10-08).
- ^ Cypher Sirolimus-eluting Coronary Stent. Cypher Stent. [2008-04-01]. (原始內容存檔於2003-04-27).
- ^ Shuchman M. Trading restenosis for thrombosis? New questions about drug-eluting stents. New England Journal of Medicine (N Engl J Med). 2006, 355 (19): 1949–52. PMID 17093244. doi:10.1056/NEJMp068234.
- ^ Saxton, Robert A.; Sabatini, David M. mTOR Signaling in Growth, Metabolism, and Disease. Cell. 2017-03-09, 168 (6): 960–976. ISSN 1097-4172. PMC 5394987
 . PMID 28283069. doi:10.1016/j.cell.2017.02.004.
. PMID 28283069. doi:10.1016/j.cell.2017.02.004.
- ^ Hasskarl, Jens. Everolimus. Recent Results in Cancer Research. Fortschritte Der Krebsforschung. Progres Dans Les Recherches Sur Le Cancer. 2014, 201: 373–392. ISSN 0080-0015. PMID 24756805. doi:10.1007/978-3-642-54490-3_23.
- ^ Paplomata, Elisavet; Zelnak, Amelia; O'Regan, Ruth. Everolimus: side effect profile and management of toxicities in breast cancer. Breast Cancer Research and Treatment. 2013, 140 (3): 453–462. ISSN 1573-7217. PMID 23907751. doi:10.1007/s10549-013-2630-y.
- ^ 衛生福利部. 晚期腎細胞癌新藥everolimus列入健保給付. 2011-02-10 [2020-12-14].
- ^ 15.0 15.1 Chhajed, Prashant N.; Dickenmann, Michael; Bubendorf, Lukas; Mayr, Michael; Steiger, Jurg; Tamm, Michael. Patterns of pulmonary complications associated with sirolimus. Respiration; International Review of Thoracic Diseases. 2006, 73 (3): 367–374. ISSN 0025-7931. PMID 16127266. doi:10.1159/000087945.
- ^ Morelon, E.; Stern, M.; Israël-Biet, D.; Correas, J. M.; Danel, C.; Mamzer-Bruneel, M. F.; Peraldi, M. N.; Kreis, H. Characteristics of sirolimus-associated interstitial pneumonitis in renal transplant patients. Transplantation. 2001-09-15, 72 (5): 787–790. ISSN 0041-1337. PMID 11571438. doi:10.1097/00007890-200109150-00008.
- ^ Filippone, E. J.; Carson, J. M.; Beckford, R. A.; Jaffe, B. C.; Newman, E.; Awsare, B. K.; Doria, C.; Farber, J. L. Sirolimus-induced pneumonitis complicated by pentamidine-induced phospholipidosis in a renal transplant recipient: a case report. Transplantation Proceedings. 2011, 43 (7): 2792–2797. ISSN 1873-2623. PMID 21911165. doi:10.1016/j.transproceed.2011.06.060.
- ^ Pham PT, Pham PC, Danovitch GM; et al. Sirolimus-associated pulmonary toxicity. Transplantation. April 2004, 77 (8): 1215–20 [2012-07-26]. PMID 15114088. doi:10.1097/01.TP.0000118413.92211.B6. (原始內容存檔於2012-06-07).
- ^ Mingos MA, Kane GC. Sirolimus-induced interstitial pneumonitis in a renal transplant patient (PDF). Respir Care. December 2005, 50 (12): 1659–61 [2012-07-26]. PMID 16318648. (原始內容 (PDF)存檔於2012-07-22).
- ^ Das BB, Shoemaker L, Subramanian S, Johnsrude C, Recto M, Austin EH. Acute sirolimus pulmonary toxicity in an infant heart transplant recipient: case report and literature review. J. Heart Lung Transplant. March 2007, 26 (3): 296–8 [2012-07-26]. PMID 17346635. doi:10.1016/j.healun.2006.12.004. (原始內容存檔於2018-07-27).
- ^ Delgado JF, Torres J, José Ruiz-Cano M; et al. Sirolimus-associated interstitial pneumonitis in 3 heart transplant recipients. J. Heart Lung Transplant. September 2006, 25 (9): 1171–4 [2012-07-26]. PMID 16962483. doi:10.1016/j.healun.2006.05.013. (原始內容存檔於2018-07-27).
- ^ McWilliams TJ, Levvey BJ, Russell PA, Milne DG, Snell GI. Interstitial pneumonitis associated with sirolimus: a dilemma for lung transplantation. J. Heart Lung Transplant. February 2003, 22 (2): 210–3 [2012-07-26]. PMID 12581772. doi:10.1016/S1053-2498(02)00564-8. (原始內容存檔於2018-06-10).
- ^ Aparicio G, Calvo MB, Medina V; et al. Comprehensive lung injury pathology induced by mTOR inhibitors. Clin Transl Oncol. August 2009, 11 (8): 499–510. PMID 19661024. doi:10.1007/s12094-009-0394-y.
- ^ Paris, A.; Goupil, F.; Kernaonet, E.; Foulet-Rogé, A.; Molinier, O.; Gagnadoux, F.; Lebas, F. X. Pneumopathie médicamenteuse sous sirolimus : interaction avec l’atorvastatine ?. Revue Des Maladies Respiratoires. 2012, 29 (1): 64–69. ISSN 1776-2588. PMID 22240222. doi:10.1016/j.rmr.2010.03.026 (法語).
- ^ Maroto, Jose Pablo; Hudes, Gary; Dutcher, Janice P.; Logan, Theodore F.; White, Charles S.; Krygowski, Mizue; Cincotta, Maria; Shapiro, Mark; Duran, Ignacio; Berkenblit, Anna. Drug-related pneumonitis in patients with advanced renal cell carcinoma treated with temsirolimus. Journal of Clinical Oncology: Official Journal of the American Society of Clinical Oncology. 2011-05-01, 29 (13): 1750–1756. ISSN 1527-7755. PMID 21444868. doi:10.1200/JCO.2010.29.2235.
- ^ Errasti, P.; Izquierdo, D.; Martín, P.; Errasti, M.; Slon, F.; Romero, A.; Lavilla, F. J. Pneumonitis associated with mammalian target of rapamycin inhibitors in renal transplant recipients: a single-center experience. Transplantation Proceedings. 2010, 42 (8): 3053–3054. ISSN 1873-2623. PMID 20970608. doi:10.1016/j.transproceed.2010.07.066.
- ^ Weischer; et al. Calcineurin Inhibitors.... Experimental Dermatology. May 2007, 16 (5): 385–393 [2012-07-26]. PMID 17437481. doi:10.1111/j.1600-0625.2007.00555.x. (原始內容存檔於2014-01-07).
- ^ Law BK. Rapamycin: an anti-cancer immunosuppressant?. Crit. Rev. Oncol. Hematol. October 2005, 56 (1): 47–60. PMID 16039868. doi:10.1016/j.critrevonc.2004.09.009.
- ^ Lamming DW, Ye L, Katajisto P; et al. Rapamycin-induced insulin resistance is mediated by mTORC2 loss and uncoupled from longevity. Science. March 2012, 335 (6076): 1638–43. PMID 22461615. doi:10.1126/science.1215135.
- ^ 30.0 30.1 30.2 Schwecke T, Aparicio JF, Molnár I; et al. The biosynthetic gene cluster for the polyketide immunosuppressant rapamycin. Proc. Natl. Acad. Sci. U.S.A. August 1995, 92 (17): 7839–43. PMC 41241
 . PMID 7644502. doi:10.1073/pnas.92.17.7839.
. PMID 7644502. doi:10.1073/pnas.92.17.7839.
- ^ Gregory MA, Gaisser S, Lill RE; et al. Isolation and characterization of pre-rapamycin, the first macrocyclic intermediate in the biosynthesis of the immunosuppressant rapamycin by S. hygroscopicus. Angew. Chem. Int. Ed. Engl. May 2004, 43 (19): 2551–3. PMID 15127450. doi:10.1002/anie.200453764.
- ^ Gregory MA, Hong H, Lill RE; et al. Rapamycin biosynthesis: Elucidation of gene product function. Org. Biomol. Chem. October 2006, 4 (19): 3565–8. PMID 16990929. doi:10.1039/b608813a.
- ^ Graziani EI. Recent advances in the chemistry, biosynthesis and pharmacology of rapamycin analogs. Nat Prod Rep. May 2009, 26 (5): 602–9. PMID 19387497. doi:10.1039/b804602f.
- ^ Gatto, G. J., Jr.; Boyne, M. T., II; Kelleher,N. L.; Walsh, C. T. Biosynthesis of Pipecolic Acid by RapL, a Lysine Cyclodeaminase Encoded in the Rapamycin Gene Cluster. J. Am. Chem. Soc. 2006, 128 (11): 3838–3847. PMID 16536560. doi:10.1021/ja0587603.
- ^ Aparicio JF, Molnár I, Schwecke T; et al. Organization of the biosynthetic gene cluster for rapamycin in Streptomyces hygroscopicus: analysis of the enzymatic domains in the modular polyketide synthase. Gene. February 1996, 169 (1): 9–16. PMID 8635756. doi:10.1016/0378-1119(95)00800-4.
- ^ Sun SY, Rosenberg LM, Wang X; et al. Activation of Akt and eIF4E survival pathways by rapamycin-mediated mammalian target of rapamycin inhibition. Cancer Res. August 2005, 65 (16): 7052–8 [2012-07-26]. PMID 16103051. doi:10.1158/0008-5472.CAN-05-0917. (原始內容存檔於2009-07-14).
- ^ Chan S. Targeting the mammalian target of rapamycin (mTOR): a new approach to treating cancer. Br J Cancer. 2004, 91 (8): 1420–4. PMC 2409926
 . PMID 15365568. doi:10.1038/sj.bjc.6602162.
. PMID 15365568. doi:10.1038/sj.bjc.6602162.
- ^ Wendel HG, De Stanchina E, Fridman JS; et al. Survival signalling by Akt and eIF4E in oncogenesis and cancer therapy. Nature: 332–7. PMID 15029198. doi:10.1038/nature02369.
- ^ Novak, Kristine. Therapeutics: Means to an end. Nature Reviews Cancer. May 2004, 4 (5): 332 [2012-07-26]. doi:10.1038/nrc1349. (原始內容存檔於2008-02-10).
- ^ Powers R.W.; et al. Extension of chronological life span in yeast by decreased TOR pathway signaling. Genes & Development. January 15, 2006, 20 (2): 174–184. PMC 356109
 . PMID 16418483. doi:10.1101/gad.1381406.
. PMID 16418483. doi:10.1101/gad.1381406.
- ^ Harrison DE, Strong R, Sharp ZD; et al. Rapamycin fed late in life extends lifespan in genetically heterogeneous mice. Nature. July 8, 2009, 460 (7253): 392–5 [2009-07-08]. PMC 2786175
 . PMID 19587680. doi:10.1038/nature08221. (原始內容存檔於2009-07-12). 簡明摘要 – The Times (2009-07-08).
. PMID 19587680. doi:10.1038/nature08221. (原始內容存檔於2009-07-12). 簡明摘要 – The Times (2009-07-08).
- ^ Jocelyn Rice. First Drug Shown to Extend Life Span in Mammals. Technology Review (Massachusetts Institute of Technology). July 8, 2009: 1–2 [2009-07-09]. (原始內容存檔於2011-09-12).
- ^ Tuberous Sclerosis Alliance. Current Clinical Trials. October 2009 [2009-10-14]. (原始內容存檔於2009-01-22).
- ^ Ehninger D, Han S, Shilyansky C; et al. Reversal of learning deficits in a Tsc2+/- mouse model of tuberous sclerosis. Nat. Med. August 2008, 14 (8): 843–8 [2012-07-26]. PMC 2664098
 . PMID 18568033. doi:10.1038/nm1788. (原始內容存檔於2012-10-09). 簡明摘要 – Scientific American (2008-06-25).
. PMID 18568033. doi:10.1038/nm1788. (原始內容存檔於2012-10-09). 簡明摘要 – Scientific American (2008-06-25).
- ^ ScienceDaily.com Report. [2012-07-26]. (原始內容存檔於2012-07-08).
- ^ Donia M, McCubrey JA, Bendtzen K, Nicoletti F. Potential use of rapamycin in HIV infection. Br J Clin Pharmacol. December 2010, 70 (6): 784–93. PMC 3014061
 . PMID 21175433. doi:10.1111/j.1365-2125.2010.03735.x.
. PMID 21175433. doi:10.1111/j.1365-2125.2010.03735.x.
- ^ Campbell GR, Spector SA. Hormonally active vitamin D3 (1{alpha},25-dihydroxycholecalciferol) triggers autophagy in human macrophages that inhibits HIV-1 infection. J Biol Chem. March 2011, 286 (21): 18890–902. PMID 21454634. doi:10.1074/jbc.M110.206110.
- ^ Peces R, Peces C, Pérez-Dueñas V; et al. Rapamycin reduces kidney volume and delays the loss of renal function in a patient with autosomal-dominant polycystic kidney disease. NDT Plus (Oxford Journals). January 16, 2009, 2 (2): 133–5. ISSN 1753-0792. doi:10.1093/ndtplus/sfn210.
- ^ CNN.com Clue to kids' early aging disease found (頁面存檔備份,存於網際網路檔案館), July 1, 2011