人類免疫缺陷病毒
| 此條目需要补充更多可靠的醫學來源,或過於依賴第一手來源。 |
| 人類免疫缺陷病毒 | |
|---|---|

| |
| 从培养的淋巴细胞出芽的HIV-1(绿色)的扫描电子显微镜照片。细胞表面的多圆颠簸代表病毒聚集的地点和病毒粒子的出芽释放。 | |
| 病毒分類 | |
| (未分级): | 病毒 Virus |
| 域: | 核糖病毒域 Riboviria |
| 界: | 副核糖病毒界 Pararnavirae |
| 门: | 逆转录酶病毒门 Artverviricota |
| 纲: | 逆转录酶病毒纲 Revtraviricetes |
| 目: | 逆转录病毒目 Ortervirales |
| 科: | 逆转录病毒科 Retroviridae |
| 属: | 慢病毒属 Lentivirus |
| 种: | 人類免疫缺陷病毒 Human immunodeficiency virus
|
| 种类 | |
人類免疫缺乏病毒(英語:human immunodeficiency virus,簡稱HIV,又稱愛滋病毒[1])是一種感染人類免疫系統細胞的慢病毒,屬反轉錄病毒的一種。普遍認為,人類免疫缺乏病毒的感染導致艾滋病,艾滋病是後天性細胞免疫功能出現缺陷而導致嚴重隨機感染及/或繼發腫瘤並致命的一種疾病。愛滋病毒起源於1920年代的非洲金沙萨,自1981年在美國被識別並發展為全球大流行疾病。人類免疫缺乏病毒通常也俗稱為「艾滋病病毒」或「艾滋病毒」。
人類免疫缺乏病毒作為反轉錄病毒,在感染後會整合入宿主細胞的基因組中,而目前的抗病毒治療並不能將病毒根除。2016年世界衛生組織(WHO)估計,全球約有3670萬名愛滋病毒感染者[2],流行狀況最為嚴重的是撒哈拉以南非洲、其次是南亞與東南亞,成長幅度最快的地區是東亞、東歐及中亞。
在人類免疫缺乏病毒感染病程的一些時期,特別是早期及末期,具有感染性的病毒顆粒會存在於含有免疫細胞、血漿、淋巴液或組織液的某些體液中,如血液、精液、前列腺液、陰道分泌液、乳汁或傷口分泌液;另一方面,病毒在體外環境中極不穩定。因此,人類免疫缺乏病毒的傳播途徑主要是不安全性行為、靜脈注射、輸血、分娩、哺乳等;而通常的工作、學習、社交或家庭接觸,比如完整皮膚間的接觸、共用坐便器、接觸汗液等,不會傳播人類免疫缺陷病毒;與唾液或淚液的通常接觸(如社交吻禮或短暫接吻)也未有導致傳播人類免疫缺陷病毒的報告;但美國疾病控制與預防中心說已感染病毒的母親,可將病毒透過先嚼過的食物(唾液內含血液)傳給孩子。[3]
與愛滋病的差異[编辑]
雖然HIV與愛滋病(Acquired Immune Deficiency Syndrome, 簡稱AIDS,又稱後天免疫缺乏症候群)常一起提到,但是兩者是不同的概念。簡單來說,HIV指的是「病毒」,但是愛滋病指的是因免疫系統能力下降而出現的「感染」, HIV感染者不會馬上發病,而是要呈現發病的狀況才會稱為愛滋病。[4]
歷史與現狀[编辑]
起源[编辑]
病毒最早出現在1920年代的非洲金沙萨,由非洲中西部的灵长类动物傳給人類,後來愛滋病毒由此處開始蔓延全球。[5][6][7]
發現[编辑]
艾滋病最早是於1981年在美國被識別,受到當時里根保守政府的忽視。但在美國疾病控制與預防中心以及有識的醫生與科學家的持續工作下,累積了信服性的流行病學數據,顯示艾滋病有一定的傳染性致因。
在巴黎巴斯德研究所專門研究逆轉錄病毒與癌症關係的法國病毒學家吕克·蒙塔尼及其研究組於1983年首次從一位罹患晚期卡波西氏肉瘤的愛滋病人(首字縮寫LAI)的血液及淋巴結樣品中,分離到一種的新的反轉錄病毒;他們發現這種病毒不同於人類T細胞白血病病毒,而是一種慢病毒,他們將之命名為「免疫缺陷相關病毒」(Immune Deficiency-Associated Virus, IDAV)。大西洋另一邊,蒙塔尼埃當時的合作者,美國國家癌症研究所的美國生物醫學科學家羅伯特·加羅(Robert Gallo)及屬下也從一些細胞株系中分離到新病毒,並將之命名為「IIIB/H9型人類T細胞白血病病毒」(Human T cell Leukemia Virus-IIIB/H9, HTLV-IIIB/H9);加羅小組首次於1984年在《科學》期刊發表論文,論證了這種新病毒與艾滋病的病原關係。
1986年,該病毒的名稱被統一為「人類免疫缺陷病毒」(Human Immunodeficiency Virus, HIV),以更明確的反映出病毒導致免疫缺陷而不是導致癌症的性質。
全球大流行[编辑]
根據世界衛生組織的HIV/AIDS統計報告 (页面存档备份,存于互联网档案馆),在2004年,全球估計有四千萬人(3590至4430萬人)與人類免疫缺陷病毒相伴生存(被感染),其中五百萬人(430至640萬人)屬於新發感染病例,另外,有三百萬人(280至350萬人)死於艾滋病。這些數字並在不斷增長中,其中,東亞、東歐、中亞等地區漲幅最快。感染最嚴重的地區仍然是撒哈拉以南非洲,其次是南亞與東南亞。
U=U[编辑]
測不到(undetectable)=不具傳染力(untransmittable)[8]
2016年7月,由感染者與相關領域專家發起的共識聲明。
有來自100個國家的760 組織認同,佐證文獻來源包含美国疾控中心(CDC)、美国国家过敏症和传染病研究所(NIH)、联合国艾滋病规划署(UNAIDS)、柳叶刀杂志(Lancet),中文版聲明由社團法人台灣露德協會翻譯。[9][10]
HIV 90-90-90[编辑]
2014 年世界衛生組織(WHO)公布防治目標「HIV 90-90-90」:2020年,90%感染者知道自己病況、90%知道病況者服用藥物、90%服用藥物者病毒量成功抑制[11]
2018年荷蘭,阿姆斯特丹已達成此防治目標,數據為:94-93-95[12]
阴谋论[编辑]
冷战時期,蘇聯國家安全委員會(KGB)為了詆毀美國,精心策劃了一場宣傳運動,指稱HIV病毒是美國實驗室製造出來的生化武器。此假说由生物學家同時也是KGB特工的雅各布·塞加爾提出,稱愛滋病由兩種不同的病毒混合而成。[14]
生物學[编辑]
| 亚型 | 致病性 | 感染性 | 传播范围 | 跨物种来源 |
|---|---|---|---|---|
| HIV-1 | 高 | 高 | 全球 | 黑猩猩 |
| HIV-2 | 较低 | 低 | 西非 | 乌白眉猴 |
人類免疫缺陷病毒(HIV)屬於慢病毒屬,是一種潛伏期極長的逆轉錄病毒。HIV分為兩型:HIV-1與HIV-2。多數國家的HIV感染是由HIV-1造成的,並且感染HIV-1後超過90%的患者會在10-12年內發病成為艾滋病;HIV-2主要分布在西部非洲,其感染往往沒有相關的病症。
演化史[编辑]

HIV-1與HIV-2兩者都來自非洲中西部,並從靈長類動物傳到人類。HIV-1可能是從黑猩猩的猴免疫缺陷病毒跨種感染演化而來;HIV-2則可能是從幾內亞比索的烏白眉猴(Sooty Mangabey, Cercocebus atys)的另一種猴免疫缺陷病毒跨種感染而來。
結構[编辑]
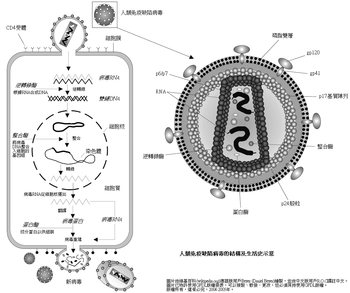
人類免疫缺陷病毒直徑約120納米,呈二十面体。病毒外膜是磷脂雙分子層,來自宿主細胞,並嵌有病毒的蛋白gp120與gp41;gp41是跨膜蛋白,gp120位於表面,並與gp41通過非共價作用結合。向內是由蛋白p17形成的球形基質(Matrix),以及蛋白p24形成的半錐形衣殼(Capsid),衣殼在電鏡下呈高電子密度。衣殼內含有病毒的RNA基因組、酶(逆轉錄酶、整合酶、蛋白酶)以及其他來自宿主細胞的成分(如tRNAlys3,作為逆轉錄的引物)。
基因組及其表達與調控[编辑]
病毒基因组是兩條相同的正股RNA,每條RNA长约9.2-9.8kb。兩端是長末端重複序列(long terminal repeats, LTR),含顺式调控序列,控制前病毒的表达。已证明在LTR有启动子和增强子并含负调控区。LTR之間的序列編碼了至少9個蛋白,可分為三類:結構蛋白、調控蛋白、輔助蛋白。
- 結構蛋白
- Gag
- gag基因產生55kD的蛋白p55。p55由病毒編碼的一個蛋白酶切成四個小蛋白:MA(p17基質)、CA(p24衣殼)、NC(p9核衣殼)、及p6。
- Pol
- Gag-Pol融合蛋白是經過mRNA上一個順式調控模件(cis-acting motif)導致的核糖體移位(frame shifting)事件產生,使得pol基因的閱讀框(reading frame)被使用。這種情況發生的機率是5%,所以,Gag與Gag-Pol產物的比率維持在20:1。融合蛋白由病毒編碼的一個蛋白酶切為四個小蛋白:Pro(p10蛋白酶)、RT(p50逆轉錄酶)、RNase H(p15 RNA酶H)、及IN(p31整合酶)。
- Env
- Env起先是160kD的蛋白,在高爾基體中經糖基化,在天冬酰胺上被加上25至30個複雜的N連糖鏈,成為gp160;這個糖基化過程對感染性是必要的。之後,宿主細胞的一個蛋白酶將gp160切為gp41與gp120。
- 調控蛋白
- Tat
- Tat是一抗终止蛋白,可以促使HIV的基因呈有效表达,它作用机制是使RNA-pol II在经过转录终止点的时候能够继续转录,避免HIV基因组过早的停止转录过程。[15]
醫學[编辑]

| 感染途徑 | 估計感染幾率 |
|---|---|
| 輸血 | 90%[17] |
| 分娩(傳給胎兒) | 25%[18] |
| 注射性毒品使用共用針頭 | 0.67%[19] |
| 经皮针扎 | 0.30%[20] |
| 肛交受方* | 0.50%[21][22] |
| 肛交插入者* | 0.065%[21][22] |
| 陰莖陰道交媾女方* | 0.10%[21][22][23] |
| 陰莖陰道交媾男方* | 0.05%[21][22] |
| 口交接受者 *§ | 0.01%[22] |
| 口交插入者*§ | 0.005%[22] |
| * 假設未使用安全套 § 資料指的口交 是男性作出的 | |
傳播途徑[编辑]
愛滋病毒是透過交換體液來傳播的,具體是指:
最常見的傳染途徑是:進行陰道或肛門性交,共用沾污了的針筒,受病毒感染的母親傳播給嬰兒 (懷孕、分娩或哺乳)。[24] 相反,以下途徑不傳播病毒:
預防[编辑]
正確的避孕套可大幅降低感染HIV的機率,但亦非天衣無縫。
暴露愛滋病毒「後」預防性投藥( Post-Exposure Prophylaxis, PEP):暴露於感染風險後(如發生危險性行為、針扎或其他血液體液交換接觸),72小時内服用抗愛滋病毒藥物(每次療程28天)可有效降低愛滋病毒感染機率。[26]
治療作為預防(Treatment as Prevention):已感染者服用愛滋病藥物對預防傳播的效果極佳,血清相異伴侶中之血清陽性一方可經由穩定服藥,避免將病毒傳染給陰性之一方。[27]
暴露愛滋病毒「前」預防性投藥( Pre-Exposure Prophylaxis, PrEP):於暴露愛滋病毒之風險行為前使用抗愛滋病毒藥物也可大幅減少服用期間的感染機率。[28]目前針對PrEP的藥物,僅有舒發泰一款,分為每日服用(daily)或有可能感染前先服用(event-driven)。針對愛滋病毒血清相異伴侶而言,陰性之一方若每日服用,其避免感染愛滋病毒的效果可達100%。[29][30]
治療[编辑]
今天病人通过服用不同的药物攻击在不同的阶段艾滋病病毒。这些药物包括:
- 抑制蛋白酶抑制艾滋病病毒活动所需要的蛋白酶的活动。通常也可以用来抑制复制活动。如Saquinavir, Indinavir, Ritonavir, Kaletra, Nelfinavir等藥物。
- 抑制逆转录酶(reverse transcriptase inhibitors,RTIs)抑制逆转录酶的活动。逆转录酶是艾滋病病毒用于复制的酶,缺乏这种酶可以阻止艾滋病病毒建立RNA和DNA。它有三种形式:
- 非核苷酸反转录酶抑制剂如Nevirapine, Efavirenz等藥物
- 核苷酸反转录酶抑制剂如齐多夫定(AZT), 司它夫定Stavudine(d4T), Didanosine(ddI), Zalcitabine(ddC), 拉米夫定3TC), Abacavir(AZT+3TC)
- 抑制进入的药物抑制艾滋病通过溶解寄主细胞的膜进入细胞内。
建立对HIV疗法的课题面临很多困难。每一种有效的药物都有副作用,通常是严重的或是致命的。常见的副作用包括严重的恶心、腹泻、肝臟的损毁和衰竭、黄疸、高血脂、糖尿病、脂肪組織移位、貧血、腎結石。致命的副作用包含史蒂芬斯-強森症候群、猛爆性肝炎、胰臟炎、乳酸血症。每一种疗法都要求经常性的血液检查以确定疗效和肝脏功能。
目前台灣單藥錠(Single-Tablet Regimens)抗愛滋病毒藥物組合:[31]
- 舒發錠/亞翠佩 (Atripla) = Tenofovir (惠立妥) + Emtricitabine (類似速汰滋) + Efavirenz (希寧)[32]
- 康普萊 (Complera)
- 三恩美 (Triumeq)
- 安以斯 (Odefsey)
- 吉他韋 (Biktarvy)
相關條目[编辑]
参考文献[编辑]
引用[编辑]
- ^ 愛滋病毒與愛滋病. 衛生福利部疾病管制署. 2019-07-26 [2020-01-22]. (原始内容存档于2021-02-07).
- ^ 世界愛滋病日 WHO:全球逾3千萬人感染. 新頭殼 Newtalk. 2017-11-30 [2021-12-07]. (原始内容存档于2021-02-07) (中文(臺灣)).
- ^ HIV can be passed to babies in pre-chewed food. Reuters. 2008-02-06 [2021-12-07]. (原始内容存档于2022-02-27) (英语).
- ^ 風傳媒:他一出生就染上HIV,卻生了3個健康的小孩!. [2015-09-16]. (原始内容存档于2021-02-07).
- ^ 艾滋病"零号病人"污名洗脱? 科学家确定病毒起源于刚果. (原始内容存档于2018年6月4日).
- ^ 艾滋病大流行揭秘:源自同一祖先进化不到100年. [2017-11-04]. (原始内容存档于2021-02-08).
- ^ 研究︰愛滋源於剛果(金)首都. 文匯報. [2017-11-04]. (原始内容存档于2021-01-18).
- ^ Prevention Access Compaign. U=U , United States , Prevention Access Campaign. [2018-11-28]. (原始内容存档于2021-02-10) (英语).
- ^ 網軟股份有限公司:www.intersoft.com.tw. U=U共識聲明 測不到=不具傳染力 │ 露德協會. 網軟架站軟體-NPOWEB. [2018-11-28]. (原始内容存档于2021-02-07).
- ^ 露德協會. U=U共識常見問題集. 露德協會. [2018-11-28]. (原始内容存档于2018-11-28) (中文(臺灣)).
- ^ 愛滋防治宣導-財團法人台灣紅絲帶基金會-篩檢諮詢. www.taiwanaids.org.tw. [2018-11-28]. (原始内容存档于2021-02-07) (中文(臺灣)).
- ^ AIDS 2018:阿姆斯特丹如何利用聯合國永續發展目標提前達成 90-90-90 目標!? | 財團法人台灣關愛基金會. www.twhhf.org. [2018-11-28]. (原始内容存档于2021-02-07) (中文(臺灣)).
- ^ 莊苹. 90-90-90:從第24屆世界愛滋大會談起. Hornet. 2018-08-09 [2018-12-11]. (原始内容存档于2021-02-07) (中文(繁體)).
- ^ 法新社. 川普息怒 假新聞早存在數世紀. 中央廣播電臺. [2018-07-13]. (原始内容存档于2022-05-01) (中文(臺灣)).
- ^ 第三部分 生物化学. 贺银成2013考研西医综合辅导讲义. 中国: 北京航空航天大学出版社. 2012: 280. ISBN 978-7-5124-0656-8 (中文(简体)).
- ^ Smith DK; Grohskopf LA; Black RJ; et al. Antiretroviral Postexposure Prophylaxis After Sexual, Injection-Drug Use, or Other Nonoccupational Exposure to HIV in the United States. MMWR. 2005, 54 (RR02): 1–20 [2009-03-31]. (原始内容存档于2009-04-02).
- ^ Donegan, E.; Stuart, M.; Niland, J. C.; Sacks, H. S.; Azen, S. P.; Dietrich, S. L.; Faucett, C.; Fletcher, M. A.; Kleinman, S. H. Infection with human immunodeficiency virus type 1 (HIV-1) among recipients of antibody-positive blood donations. Annals of Internal Medicine. 1990-11-15, 113 (10): 733–739 [2021-12-07]. ISSN 0003-4819. PMID 2240875. doi:10.7326/0003-4819-113-10-733. (原始内容存档于2022-01-12).
- ^ Coovadia H. Antiretroviral agents—how best to protect infants from HIV and save their mothers from AIDS. N. Engl. J. Med. 2004, 351 (3): 289–292. PMID 15247337. doi:10.1056/NEJMe048128.
- ^ Kaplan, E. H.; Heimer, R. HIV incidence among New Haven needle exchange participants: updated estimates from syringe tracking and testing data. Journal of Acquired Immune Deficiency Syndromes and Human Retrovirology: Official Publication of the International Retrovirology Association. 1995-10-01, 10 (2): 175–176 [2021-12-07]. ISSN 1077-9450. PMID 7552482. doi:10.1097/00042560-199510020-00010. (原始内容存档于2022-03-15).
- ^ Bell, D. M. Occupational risk of human immunodeficiency virus infection in healthcare workers: an overview. The American Journal of Medicine. 1997-05-19, 102 (5B): 9–15 [2021-12-07]. ISSN 0002-9343. PMID 9845490. doi:10.1016/s0002-9343(97)89441-7. (原始内容存档于2022-05-02).
- ^ 21.0 21.1 21.2 21.3 Comparison of female to male and male to female transmission of HIV in 563 stable couples. European Study Group on Heterosexual Transmission of HIV. BMJ (Clinical research ed.). 1992-03-28, 304 (6830): 809–813 [2021-12-07]. ISSN 0959-8138. PMC 1881672
 . PMID 1392708. doi:10.1136/bmj.304.6830.809. (原始内容存档于2022-03-20).
. PMID 1392708. doi:10.1136/bmj.304.6830.809. (原始内容存档于2022-03-20).
- ^ 22.0 22.1 22.2 22.3 22.4 22.5 Varghese, Beens; Maher, Julie E.; Peterman, Thomas A.; Branson, Bernard M.; Steketee, Richard W. Reducing the risk of sexual HIV transmission: quantifying the per-act risk for HIV on the basis of choice of partner, sex act, and condom use. Sexually Transmitted Diseases. 2002-01, 29 (1): 38–43 [2021-12-07]. ISSN 0148-5717. PMID 11773877. doi:10.1097/00007435-200201000-00007. (原始内容存档于2022-03-02).
- ^ Leynaert, B.; Downs, A. M.; de Vincenzi, I. Heterosexual transmission of human immunodeficiency virus: variability of infectivity throughout the course of infection. European Study Group on Heterosexual Transmission of HIV. American Journal of Epidemiology. 1998-07-01, 148 (1): 88–96 [2021-12-07]. ISSN 0002-9262. PMID 9663408. doi:10.1093/oxfordjournals.aje.a009564. (原始内容存档于2022-05-04).
- ^ HIV Transmission. Centers for Disease Control and Prevention. [2020-06-16]. (原始内容存档于2016-12-29).
- ^ How Is HIV Transmitted? (页面存档备份,存于互联网档案馆). HIV.gov. June 24, 2019. [2020-06-17]
- ^ 衛生福利部疾病管制署. 暴露愛滋病毒「後」預防性投藥Q&A. [2018-05-21]. (原始内容存档于2018-05-21).
- ^ Rodger, Alison J.; Cambiano, Valentina; Bruun, Tina; Vernazza, Pietro; Collins, Simon; van Lunzen, Jan; Corbelli, Giulio Maria; Estrada, Vicente; Geretti, Anna Maria. Sexual Activity Without Condoms and Risk of HIV Transmission in Serodifferent Couples When the HIV-Positive Partner Is Using Suppressive Antiretroviral Therapy. JAMA. 2016-07-12, 316 (2): 171 [2022-05-29]. ISSN 0098-7484. doi:10.1001/jama.2016.5148. (原始内容存档于2020-06-02) (英语).
- ^ 台灣愛滋病學會. 臺灣暴露前口服預防性投藥使用指引 (PDF) 第二版. 2018-03-22 [2018-05-21]. (原始内容 (PDF)存档于2019-02-22).
- ^ Molina, Jean-Michel; Charreau, Isabelle; Spire, Bruno; Cotte, Laurent; Chas, Julie; Capitant, Catherine; Tremblay, Cecile; Rojas-Castro, Daniela; Cua, Eric. Efficacy, safety, and effect on sexual behaviour of on-demand pre-exposure prophylaxis for HIV in men who have sex with men: an observational cohort study. The Lancet HIV. 2017-09, 4 (9): e402–e410 [2021-12-07]. doi:10.1016/S2352-3018(17)30089-9. (原始内容存档于2022-04-01) (英语).
- ^ Tan, Darrell Hoi-San. PrEP on demand or every day?. The Lancet HIV. 2017-09, 4 (9): e379–e380 [2021-12-07]. doi:10.1016/S2352-3018(17)30088-7. (原始内容存档于2022-01-12) (英语).
- ^ 許瑋婷、劉旺達、蔡宛臻、洪健清. 臺灣現有單藥錠(Single-Tablet Regimens) 抗愛滋病毒藥物組合的介紹 (PDF). 愛之關懷. 2017, (100) [2018-11-28]. (原始内容存档 (PDF)于2021-02-07).
- ^ 羅一鈞. 心之谷: 將於今年3月增列的第一線用藥--Atripla (舒發錠). 心之谷. 2014-01-21 [2018-11-28]. (原始内容存档于2021-02-07).
来源[编辑]
- 英文
- 美國疾病控制與預防中心在艾滋病首次報告二十週年紀念時的專題報告 (页面存档备份,存于互联网档案馆):《发病率和死亡率周报》(Morbidity and Mortality Weekly Report)June 1, 2001 / Vol. 50 / No. 21.
- 加拿大艾滋病的早期歷史
- 人類免疫缺陷病毒的發現歷史(A History of HIV Discovery) (页面存档备份,存于互联网档案馆):路克·蒙塔尼埃(Luc Montagnier)《科學》Volume 298, Number 5599, Issue of 29 Nov 2002, pp. 1727–1728. 美國科學促進會.
- 人類免疫缺陷病毒/艾滋病的早期時代(The Early Years of HIV/AIDS) (页面存档备份,存于互联网档案馆):羅伯特·加羅(Robert Gallo)《科學》Volume 298, Number 5599, Issue of 29 Nov 2002, pp. 1728–1730. 美國科學促進會.
- 中文
外部連結[编辑]
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
