磷
性狀[編輯]
磷是一種易起化學反應的、有毒的氮族非金屬元素。它的化學反應活性和毒性取決於形態不同而有所區別。
單質磷的同素異構體[編輯]
- 紫磷
- 化學結構為層狀,但與黑磷不同。
- 化學式一般寫為。
化學性質[編輯]
白煙:
在有催化劑存在的情況下,白磷、紅磷和水經過幾步反應生成H3PO4、H2及很少量的H3PO3和PH3:
發現[編輯]
在化學史上第一個發現磷元素的人,當推十七世紀的一個德國漢堡商人亨尼格·布蘭德(Henning Brand,約1630年~約1710年)。他是一個相信鍊金術的人,在三十年戰爭時他擔任初級軍官,戰爭結束後成為玻璃工匠的學徒。後來他娶了一位有錢人的女兒。豐饒的嫁妝讓他從此不愁吃穿,所以他開始追求他真正的興趣,也就是尋找賢者之石。當時的社會相信賢者之石要透過煉金術才能製成,可以把所有東西變成黃金,甚至可以讓人長生不老。
然而,反覆的實驗失敗終究還是花光了他的所有積蓄。更不幸的是他妻子也過世了。之後他又娶了另一位女人,這位後來娶的妻子不只帶給他財富讓他可以繼續實驗,也給他一個兒子可以在實驗室幫他的忙。
由於他相信人體本身就是一種煉金術,因為從嘴巴吃進去的跟排泄出來的物質完全不一樣。所以他使用尿作了大量實驗。1669年,他在一次實驗中,將砂、木炭、石灰等和尿混合,加熱蒸餾,雖沒有得到黃金,而竟意外地得到一種十分美麗的物質,它色白質軟,能在黑暗的地方放出閃爍的亮光,於是波蘭特給它取了個名字,叫「冷光」,這就是今日稱之為白磷的物質。波蘭特對制磷之法,起初極守秘密,不過,他發現這種新物質的消息立刻傳遍了德國。[8]
德國化學家孔克爾曾用盡種種方法想打聽出這一秘密的製法,終於探知這種所謂發光的物質,是由尿裡提取出來的,於是他也開始用尿做試驗,經過苦心摸索,終於在1678年也告成功。他是把新鮮的尿蒸餾,待蒸到水分快乾時,取出黑色殘渣,放置在地窯里,使它腐爛,經過數日後,他將黑色殘渣取出,與兩倍於「尿渣」重的細砂混合。一起放置在曲頸瓶中,加熱蒸餾,瓶頸則接連盛水的收容器。起初用微火加熱,繼用大火乾餾,及至尿中的揮發性物質完全蒸發後,磷就在收容器中凝結成為白色蠟狀的固體。後來,他為介紹磷,曾寫過一本書,名叫《論奇異的磷質及其發光丸》。
在磷元素的發現上,英國化學家羅伯特·波義耳差不多與孔克爾同時,用與他相近的方法也製得了磷。波義耳的學生漢克維茨(Codfrey Hanckwitz)曾用這種方法在英國製得較大量的磷,作為商品運到歐洲其他國家出售。他在1733年曾發表論文,介紹製磷的方法,不過說得十分含糊,以後,又有人從動物骨質中發現了磷。
名稱由來[編輯]
由於單質磷在空氣中會自燃或緩慢氧化而放熱發光,因此磷的拉丁文名稱Phosphorum來源於希臘文Φωσφόρος的拉丁化,原指「啟明星」,意為「光亮」。
而在中文裡,磷的本字為粦,根據晉代《博物志》記載,「戰鬬死亡之處,有人馬血,積中爲粦,著地入艸木,如霜露不可見。有觸者,著人體後有光,拂拭即散無數,又有吒聲如鬻豆。舛者,人足也。言光行著人。」可見上部"米"字乃代表鬼火之"炎"字轉寫,下部"舛"字則指人足部。
「磷」字本與「粦」無關,如司馬相如在作賦時將其與"嶙"、"粼"混用,指光亮。南朝時期的字典《玉篇》中記載為雲母之意。本作為鬼火之源的"粦"後加石字偏旁以作為其元素性質之辨,指鬼火之源所含的元素。此與"磷"之原來諸義皆有所不同。
分布[編輯]
磷在地殼中的含量為0.09%。磷不以單質存在,通常在磷酸鹽中天然存在,尤其是磷灰石。磷也存在於生物體當中,是原生質的基本成分。
製備[編輯]
磷的現代製法是將磷酸鈣與砂(主要成分為二氧化矽)及焦炭一起放在電爐中加熱。為使反應式易於理解,可寫成兩步如下:
同位素[編輯]
已發現磷的同位素共有13種,包括磷27至磷39,其中只有磷31是穩定的,其他同位素都帶有放射性。
化合物[編輯]
含氧酸[編輯]
磷的含氧酸非常豐富,結構較為複雜,且大多具有商業價值。這些含氧酸都有和氧相連的氫原子,可以體現酸性,也有些有不體現酸性的直接連在磷上的氫原子。縱然許多磷的含氧酸已經被合成,但僅有以下幾種是較常見的。其中的三種——次磷酸、亞磷酸和磷酸尤為重要。
| 名稱 | 化學式 | 磷的氧化數(化合價) | 結構式 | N元酸 | 化合物形態 |
|---|---|---|---|---|---|
| 次磷酸 | +1 |  |
1 | 酸、鹽 | |
| 亞磷酸 | +3 |  |
2 | 酸、鹽 | |
| 偏亞磷酸 | +3 |  |
1 | 鹽 | |
| 原亞磷酸(與亞磷酸為互變異構體) | +3 |  |
3 | 酸、鹽 | |
| 連二磷酸 | +4 | 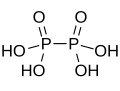 |
4 | 酸、鹽 | |
| n(聚)偏磷酸 | +5 | 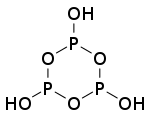   |
n | 鹽(n=3、4、6) | |
| 磷酸(正磷酸) | +5 |  (n聚磷酸n=1時) (n聚磷酸n=1時) |
3 | 酸、鹽 | |
| n(聚)磷酸 | +5 |  |
n+2 | 酸、鹽(n=1-6) | |
| 焦磷酸 | +5 |  (n聚磷酸n=2時) (n聚磷酸n=2時) |
4 | 酸、鹽 | |
| 三磷酸 | +5 | 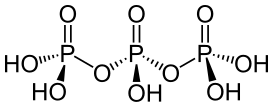 (n聚磷酸n=3時) (n聚磷酸n=3時) |
5 | 鹽 |
磷(V)化合物[編輯]
含氧化合物[編輯]
最常見的磷化合物是磷酸鹽(),它是一個呈四面體的陰離子。[9]其一個很重要的作用是用作化肥。磷酸根離子是(正)磷酸的共軛鹼。磷酸是一個三元酸,所以它可以逐步轉變為以下三種共軛鹼:
- Ka1= 7.25×10−3
- Ka2= 6.31×10−8
- Ka3= 3.98×10−13
磷酸及其衍生物有聚合成鏈或環而形成鍵的傾向。目前已知的聚磷酸衍生物已經有很多,比如ATP。它們通過磷酸氫鹽(例如和)脫水得到。例如,下列縮合反應在工業上非常廣泛地用於生產三磷酸鈉(俗稱五鈉):
十氧化四磷(P4O10)是磷酸的酸酐。它是白色的固體,與水反應非常劇烈。
和兩種化合物具有共同點:它們都較不穩定,且都是白色或淺色的。和的空間構型都是五角雙錐,並且它們都是路易斯酸。後者可以形成離子,它和互為等電子體。至於另外兩種磷的鹵化物和都是極不穩定的。而磷最主要的鹵氧化物是三氯氧磷(),它的空間構型是四面體型的。
以往一直認為磷(V)化合物中磷的d軌道參與了雜化。然而經過計算機大量計算,事實並非如此:磷只用了s和p軌道雜化[10]。這可用分子軌道理論來解釋。
含硫化合物[編輯]
磷酸根中的氧可以被硫取代,如硫代磷酸。
多種硫化磷也是已知的。
用途[編輯]
磷可用於安全火柴、煙花、燃燒彈和化肥,還可以保護金屬表面免於腐蝕。
磷酸的用途也十分廣泛。
對人體的影響[編輯]
磷是骨骼和牙齒的構成材料之一。正常成年人骨中的含磷總量約為600~900克,人體每100毫升全血中含磷35-45毫克。磷能保持人體內代謝平衡,在調節能量代謝過程中發揮重要作用。它是生命物質核苷酸的基本成分。它參與體內的酸鹼平衡的調節,參與體內脂肪的代謝。
磷缺乏可以出現低磷血症,引起紅血球、白血球、血小板的異常,軟骨病。磷過多將導致高磷血症,使血液中血鈣降低導致骨質疏鬆。
短時間內攝取一定分量的白磷單質,可造成急性白磷中毒。
參考文獻[編輯]
- ^ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip J. H.; Gröning, Manfred; Holden, Norman E.; Meijer, Harro A. J. Standard atomic weights of the elements 2021 (IUPAC Technical Report). Pure and Applied Chemistry. 2022-05-04. ISSN 1365-3075. doi:10.1515/pac-2019-0603 (英語).
- ^ cf. "Memoir on Combustion in General (頁面存檔備份,存於網際網路檔案館)" Mémoires de l'Académie Royale des Sciences 1777, 592–600. from Henry Marshall Leicester and Herbert S. Klickstein, A Source Book in Chemistry 1400–1900 (New York: McGraw Hill, 1952)
- ^ webelements. [2013-09-01]. (原始內容存檔於2008-05-12).
- ^ Ellis, Bobby D.; MacDonald, Charles L. B. Phosphorus(I) Iodide: A Versatile Metathesis Reagent for the Synthesis of Low Oxidation State Phosphorus Compounds. Inorganic Chemistry. 2006, 45 (17): 6864–74. PMID 16903744. doi:10.1021/ic060186o.
- ^ Magnetic susceptibility of the elements and inorganic compounds 網際網路檔案館的存檔,存檔日期2012-01-12., in Lide, D. R. (編), CRC Handbook of Chemistry and Physics 86th, Boca Raton (FL): CRC Press, 2005, ISBN 0-8493-0486-5
- ^ 夏征農、陳至立 (編). 《辞海》第六版彩图本. 上海: 上海辭書出版社. 2009年: 第3227頁. ISBN 9787532628599.
- ^ 無機化學叢書.第四卷.P195.張青蓮 主編
- ^ TodayIFoundOut.com, Matt Blitz-. How One Man’s Love of Urine Led to the Discovery of Phosphorus. Gizmodo. [2020-02-06]. (原始內容存檔於2020-02-06) (美國英語).
- ^ D. E. C. Corbridge "Phosphorus: An Outline of its Chemistry, Biochemistry, and Technology" 5th Edition Elsevier: Amsterdam 1995. ISBN 978-0-444-89307-9.
- ^ Kutzelnigg, W. Chemical Bonding in Higher Main Group Elements (PDF). Angewandte Chemie Int. (English) Ed. 1984, 23 (4): 272–295 [2014-04-27]. doi:10.1002/anie.198402721. (原始內容存檔 (PDF)於2020-04-16).
外部連結[編輯]
- 元素磷在洛斯阿拉莫斯國家實驗室的介紹(英文)
- EnvironmentalChemistry.com —— 磷(英文)
- 元素磷在The Periodic Table of Videos(諾丁漢大學)的介紹(英文)
- 元素磷在Peter van der Krogt elements site的介紹(英文)
- WebElements.com – 磷(英文)
| 氮族元素 | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| IA 1 |
IIA 2 |
IIIB 3 |
IVB 4 |
VB 5 |
VIB 6 |
VIIB 7 |
VIIIB 8 |
VIIIB 9 |
VIIIB 10 |
IB 11 |
IIB 12 |
IIIA 13 |
IVA 14 |
VA 15 |
VIA 16 |
VIIA 17 |
VIIIA 18 | ||||||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||||
| |||||||||||||||||||||||||||||||||||||
| ||||||||||||



























![{\displaystyle {\ce {2Na2[(HO)PO3] + Na[(HO)2PO2] -> Na5[O3P-O-P(O)2-O-PO3] + 2H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/52711a40d6a0e31fd31153f5630d880711fce8ab)






