氯代烷
氯代烷(![]() ),又名氯代烷烃,是指烷烃分子中的一个或多个氢原子被氯取代的有机化合物,属卤代烃的一种。大部分的氯代烷都不溶于水、溶于大部分的有机溶剂[1]。跟其他卤代烷一样,氯代烷可分为一级、二级及三级氯代烷。一般来说,连着氯原子的碳连接着多少个烷基,就是几级的氯代烷。例如,氯乙烷是一级氯代烷,2-氯丙烷是二级氯代烷,而2-氯-2-甲基丙烷(叔丁基氯)是三级氯代烷。一氯甲烷是最简单的氯代烷。
),又名氯代烷烃,是指烷烃分子中的一个或多个氢原子被氯取代的有机化合物,属卤代烃的一种。大部分的氯代烷都不溶于水、溶于大部分的有机溶剂[1]。跟其他卤代烷一样,氯代烷可分为一级、二级及三级氯代烷。一般来说,连着氯原子的碳连接着多少个烷基,就是几级的氯代烷。例如,氯乙烷是一级氯代烷,2-氯丙烷是二级氯代烷,而2-氯-2-甲基丙烷(叔丁基氯)是三级氯代烷。一氯甲烷是最简单的氯代烷。
氯代烷的命名跟其他卤代烃很相似,同样以IUPAC命名法来命名,找出相应烷烃作为母体,将氯视作取代基,并以数字标明其位置[2]。而不少氯代烷都有俗名,例如氯仿(即三氯甲烷)。同时,亦可以先写烷基再写氯,例如甲基氯、叔丁基氯等[3]。
氯代烷天然存在于大自然中。海藻中可以提取到二氯甲烷、三氯甲烷、四氯甲烷等氯代烷。[4]而且,山火、火山和分解作用会产生氯甲烷。[5]
氯仿、二氯甲烷和1,1,1-三氯乙烷等分子量较小的氯代烷可以用作溶剂;而氯代烷是合成中间体,可以用来合成不同的化合物,例如氯甲烷是氯硅烷等物质的前驱物。[6]
例子[编辑]
-
三氯甲烷
-
氯乙烷
-
氯甲烷
历史[编辑]
氯代烷在很久以前已被合成和应用。如氯仿的人工合成方法是由法国化学家Eugène Soubeiran、美国物理学家Samuel Guthrie[9]、德国化学家李比希[10]三个研究者于各自独立发现的。又例如,在1835年,法国化学家让-巴蒂斯特·杜马和尤金·皮里哥发现一氯甲烷的制备方法。关于氯仿的应用,在1847年苏格兰医生詹姆斯·杨·辛普森及其朋友发现它可以用作麻醉剂[11][12]。在氯代烷的结构与性质的方面,不同化学家的发现和理论使人们更了解其结构。例如,让-巴蒂斯特·杜马观察烷烃的氯化,并提出对取代反应的了解[13],又例如热拉尔认为氯代烷为“盐酸型”有机化合物(即是指氯化氢的氢被烷基取代的化合物)[14]。而且,于1857年凯富勒发现碳有四价[15]、1861年布特列洛夫提出化学结构理论、1974年范霍夫和勒·贝尔提出碳的正四面体构型假说(又称范托浩夫—勒·贝尔模型),这些都使化学家更加认识氯代烷的结构。后来,随着有机化学的发展,化学家发现更多合成氯代烷的方法,例如卤仿反应。
制备[编辑]
自由基取代反应[编辑]
氯代烃可由烷烃和氯气反应得到,属于自由基卤代反应的一种。反应分“链引发”、“链转移”、“链终止”三步骤[16]。由于这个反应是个连锁反应,因此在生成了一氯烷烃之后,会继续生成二氯烷烃、三氯烷烃、四氯烷烃[17],因此产物通常是多个氯代烷的混合物。[18]详细机理如下:
- 键引发:
- 键转移:
- 一、氯自由基跟一分子烷烃反应,生成氯化氢和相应的烷基自由基。
- 二、烷烃自由基跟另一分子的氯气反应,生成一分子氯代烷和另一氯自由基。
- 键终止:有三个终止的反应,直到所有自由基消失,则反应结束。
- 一、两个氯自由基反应,生成一分子的氯气。
- 二、两个烷基自由基反应,生成另一碳链更长的烷烃。
- 三、一个氯自由基和一个烷基自由基反应,生成一分子氯代烷。
烯烃、炔烃的加成反应[编辑]
烯类、炔类跟盐酸反应,经过卤氢化作用可生成氯代烷。反应机理为亲电加成反应,在第一步中,氢氯酸中带部分正电荷的氢接近烯烃或炔烃,π电子与氢氯酸发生反应,生成碳阳离子和氯离子,然后氯离子进攻碳阳离子生成氯代烷[20],因为机理中涉及到碳阳离子,反应遵从马氏规则。[21]而由于碳阳离子会发生重排,因此有机会生成重排产物。同时,碳阳离子是个平面,氯离子可以从平面上方或下方进攻,如果所生成的氯代烷带手性,那么两种产物都会出现。机理如下:
而烯烃或炔烃可以跟氯气发生亲电加成反应,分别生成1,2-二氯代烷和1,1,2,2-四氯代烷,反应属于卤素加成反应。第一步,烯烃或炔烃的π电子与氯反应,生成一个碳正离子和氯离子,这步较慢,是速率控制步骤。然后,氯离子进攻碳正离子,生成相应的氯代烷,反应完成。反应同时生成顺式加成及反式加成两种产物。[22]例如,1,2-二氯乙烷可以由乙烯和氯气直接反应而制得[23]。
醇的亲核取代反应[编辑]
醇类与盐酸和氯化锌的混合物、光气、三氯化磷等含氯的试剂反应亦可生成相应的氯代烷[24]。例如,叔丁醇与浓盐酸发生单分子亲核取代反应,可以生成叔丁基氯。首先叔丁醇的氧被质子化。然后水作为离去基团离去,生成碳阳离子和水分子,此步速率较慢。最后氯离子进攻碳阳离子,生成叔丁基氯。反应机理如下图所示:

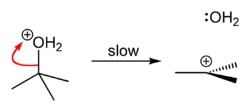

反应中除了生成氯代烷,亦会生成二氧化硫和氯化氢。而由于这两个产物都是气体,产物易于分离。
而反应中可以加入不同的物质来控制其立体选择性。反应过程如下图:

反应由醇进攻亚硫酰氯开始,生成氯代亚硫酸酯(上中)。然后,根据添加的不同化合物,反应机理会有所不同。例如,如果添加1,4-二𫫇烷(最左),反应物经过两次双分子亲核取代反应,得到构型保持的产物。如果添加吡啶(中),反应物经过一次双分子亲核取代,生成构型翻转的产物。[27]而如果没有添加任何额外试剂(最右),氯代亚硫酸酯分解生成离子对,离去基团中的氯进攻碳阳离子,发生分子内亲核取代,得到构型保持的产物。
其他反应[编辑]
在阿佩尔反应中,醇可以被三苯基膦和四氯化碳转化为氯代烃[28]。例如,香叶醇经过反应,得到香叶基氯。[29]
首先三苯基膦与四氯化碳生成𬭸正离子和三氯甲基负离子离子对。反应的第二步是个酸碱反应,三氯甲基负离子夺取醇的质子,生成氯仿;而醇被三氯甲基负离子去质子化,生成烷氧负离子。接着烷氧负离子进攻𬭸正离子,氯离去,得到含P-O键的中间体(5)和氯离子。最后氯离子亲核进攻(5),产生三苯基氧膦(7)和氯代烷(6)。
在高知反应中,羧酸与四乙酸铅和氯化锂反应,脱羧氯化生成氯代烃[30][31]二级和三级脂肪族羧酸最易发生反应,不过一级脂肪酸的效果比较差。反应式如下:
而且,可以透过卤仿反应,将含乙酰基的有机化合物转变成氯仿[32]。
在反应的第一步,羰基的α-氢在碱性环境之下三次被氯所取代[33],直到所有的氢原子都被换成氯原子。然后,氢氧根离子进攻羰基碳,离子离去。离子被碳上三个吸电子基团(氯气)所稳定。最后一步为酸碱反应,从羧酸取得一质子,生成羧酸根离子和氯仿(三氯甲烷)。所生成的羧酸比原本的羰基化合物少一个碳[34]。
反应[编辑]
亲核取代反应[编辑]
氯的电负性大,是一个稳定的离去基团,因此氯代烷可以作为亲电试剂,与亲核试剂发生亲核取代反应。
在单分子亲核取代反应里面,氯以氯离子的形式离开,生成碳阳离子,其后氯离子进攻碳阳离子生成新化合物。而由于反应中的碳阳离子有机会发生重排,因此单分子亲核取代反应有机会生成重排产物,构型保持和构型翻转产物的量为1:1。三级氯代烷因为位阻较大使双分子机理进行得较慢,而且能生成较稳定的三级碳阳离子,所以通常以单分子机理进行反应[35]。
在双分子亲核取代反应中,亲核试剂攻击连着氯的碳原子,然后形成一个五配位的过渡态。氯很快离去,形成新化合物。由于位阻效应较小和所生成的一级碳阳离子不稳定,一级氯代烷通常按双分子的机理进行亲核取代[36]。例如氯乙烷与氢氧根离子发生SN2生成乙醇和氯离子:
- EtCl + NaOH → EtOH + NaCl
科尔贝腈合成[编辑]
氰离子作为亲核试剂,进攻氯代烷,生成比原本氯代烷多一个碳的腈[37],在有机合成上非常重要。
烷基化反应[编辑]
氯代烷是个亲电试剂,可以被亲核试剂进攻,氯为离去基团,以氯离子的形式离开。以下列举常见的烷基化反应:
| 反应 | 反应式 |
|---|---|
| 威廉姆逊合成反应 |  |
| 加布里尔伯胺合成反应 | 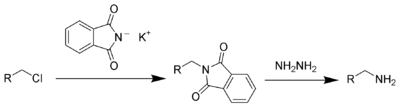 |
| 羰基化合物(如酮)的烷基化 |  |
| 乙酰乙酸酯合成 |  |
| 丙二酸酯合成 |  |
消除反应[编辑]
氯代烷可以发生消除反应,生成烯烃。反应大部分时候生成柴瑟夫产物,即比较稳定的烯烃。[50]
在强碱作用下,反应一般按著双分子消除反应的机理而进行,正因为此反应机理的限制,离去的氯和β氢必须处于反式共平面的状态[51]。由于反应由一步完成(碱拉走质子(进攻β-氢)时与离去基同时离去),因此双分子消除反应与二种反应物浓度皆有关,在反应动力学上是属于二级反应。
而三级氯代烷的溶剂解反应一般按单分子消除反应的机理进行。第一步为氯离去,生成碳阳离子,此为速率控制步骤;接着碱夺取质子,生成烯烃。由于反应的速率控制步骤是氯离去的一步,只与一个底物分子有关,因此反应是单分子过程,在反应动力学上是一级反应。而由于反应中的碳阳离子有机会发生重排,因此单分子消除反应有机会生成重排产物。机理如下:

还原[编辑]
氯代烷可以被氢化铝锂还原成烷烃,而由于氢化铝锂与水反应,因此这反应必须在无水的环境进行,例如使用无水乙醚等溶剂。这种方法一级氯代烷的反应性能最佳,并且得到构型翻转的产物。二级、三级氯代烷亦可被硼氢化钠在碱性水溶液或醇溶液中还原。其他方法,如催化氢解等,都可以将氯代烷还原。[52]
与金属的反应[编辑]
有机金属化合物的制备[编辑]
格氏试剂一般由氯代烷与金属镁在无水乙醚或四氢呋喃中直接反应而制备的[53]。由于格氏试剂非常活泼,因此制备时不能接触水、二氧化碳,或其他含有活泼氢的化合物(如醇),需要在惰性气体保护下制备格氏试剂。卤代烃与镁金属的反应活性为碘代烃>溴代烃>氯代烃>氟代烃,而反应必须在低温环境下进行。[14]格氏试剂是一个很好的亲核试剂,可以与不同的化合物反应(如醛、酮、二氧化碳等),增长有机化合物的碳链,在有机合成中非常重要。[53][54]
而由于有机锂试剂比格氏试剂更为活泼,所以制备的条件也要更为严格。
偶联反应[编辑]
在科里-豪斯合成中,二烃基铜(吉尔曼试剂)可以跟氯代烷发生偶联反应[56],生产烷烃。氯代烷为甲基氯代烷、一级氯代烷和环状的二级氯代烷时,反应进行得比较顺利。

吉尔曼试剂与有机卤化物的化学反应方程式
在武兹反应里,两分子的氯代烷与钠发生反应,生成更长的碳链,可用来制备对称烷烃。[57]

参见[编辑]
参考资料[编辑]
- ^ E. Cheng, J. Chow, Y.F. Chow ,A. Kai , S.L. Lee, W.H.Wong. HKDSE Chemistry A Modern View Second Edition. : 42.18. ISBN 9789888242948 (英语).
- ^ 有机化合物命名原则2017 (页面存档备份,存于互联网档案馆). 中国化学会. [2018-1-17]
- ^ 卤代烷 (PDF). 太平洋化工资源网: p.5. [2021-08-31]. (原始内容存档 (PDF)于2021-08-31) (中文).
把卤烷看作是烷基和卤素结合而成的化合物而命名,称为某烷某卤。
- ^ Gribble, G. W. Naturally occurring organohalogen compounds - A comprehensive survey. Progress in the Chemistry of Organic Natural Products. 1996, 68 (10): 1–423. PMID 8795309. doi:10.1021/np50088a001.
- ^ Public Health Statement - Chloromethane (页面存档备份,存于互联网档案馆), Centers for Disease Control, Agency for Toxic Substances and Disease Registry
- ^ Rossberg, Manfred; Lendle, Wilhelm; Pfleiderer, Gerhard; Tögel, Adolf; Dreher, Eberhard-Ludwig; Langer, Ernst; Rassaerts, Heinz; Kleinschmidt, Peter; Strack, Chlorinated Hydrocarbons, Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, 2005, doi:10.1002/14356007.a06_233.pub2
- ^ Chloroethane. pubChem. [2021-08-04]. (原始内容存档于2021-12-25) (英语).
CHEMICAL INTERMEDIATE;Refrigerant, solvent, alkylating agent, starting point in the mfr of tetraethyl lead, topical anesthetic
- ^ 一氯甲烷. chemicalbook. [2021-08-04]. (原始内容存档于2021-08-04) (中文).
有机合成的重要原料。用作有机合成中的溶剂。
- ^ Samuel Guthrie. New mode of preparing a spirituous solution of Chloric Ether. Am. J. Sci. And Arts. 1832, 21: 64.
- ^ Justus Liebig. Ueber die Verbindungen, welche durch die Einwirkung des Chlors auf Alkohol, Aether, ölbildendes Gas und Essiggeist entstehen. Annalen der Pharmacie. 1832, 1 (2): 182–230. doi:10.1002/jlac.18320010203.
- ^ Gordon, H. Laing. Sir James Young Simpson and Chloroform (1811-1870). The Minerva Group, Inc. 2002-11: 106–109 [11 November 2011]. ISBN 978-1-4102-0291-8. (原始内容存档于2020-08-19).
- ^ 陈炳圣. 《萬物簡史》. 源桦. 2007. ISBN 986828421X.
- ^ Nye, Mary. Before Big Science: The Pursuit of Modern Chemistry and Physics 1800-1940. Twayne Publishers. 1996: 122–124.
- ^ 14.0 14.1 邢其毅; 裴坚; 裴伟伟; 徐瑞秋. 第6章. 基礎有機化學. 北京大学出版社. : 349-350 [2016]. ISBN 9787301272121 (中文).
- ^ Aug. Kekulé. Über die s. g. gepaarten Verbindungen und die Theorie der mehratomigen Radicale. Annalen der Chemie und Pharmacie. 1857, 104 (2): 129–150. doi:10.1002/jlac.18571040202.
- ^ Dr. Ian Hunt,. Chapter 4: Alcohols and Alkyl Halides. [2021-07-28]. (原始内容存档于2021-07-28) (英语).
Note that it contains three distinct type of steps
- ^ E. Cheng, J. Chow, Y.F. Chow ,A. Kai , S.L. Lee, W.H.Wong. HKDSE Chemistry A Modern View Second Edition. : 44.4. ISBN 9789888242948 (英语).
- ^ H. B. Hass, E. T. McBee, Paul Weber. Chlorination of Paraffins 1. Industrial & Engineering Chemistry. 1936-03, 28 (3): 333–339 [2020-07-12]. ISSN 0019-7866. doi:10.1021/ie50315a017. (原始内容存档于2021-08-04) (英语).
- ^ 国际纯化学和应用化学联合会,化学术语概略,第二版。(金皮书)(1997)。在线校正版: (2006–) "homolysis (homolytic)"。doi:10.1351/goldbook.H02851
- ^ March, Jerry; (1985). Advanced Organic Chemistry reactions, mechanisms and structure (3rd ed.). New York: John Wiley & Sons, inc. ISBN 0-471-85472-7
- ^ M Conte, T Davies, A Carley, A Herzing, C Kiely, G Hutchings. Selective formation of chloroethane by the hydrochlorination of ethene using zinc catalysts. Journal of Catalysis. 2007-11-15, 252 (1): 23–29 [2020-07-12]. doi:10.1016/j.jcat.2007.09.002. (原始内容存档于2018-07-02) (英语).
- ^ 邢, 其毅; 裴, 伟伟; 徐, 瑞秋; 裴, 坚. 第8章. 基礎有機化學. 北京. 2016: 349–350. ISBN 978-7-301-27212-1 (中文).
- ^ 1,2-二氯乙烷. ChemicalBook. [2022-07-29] (中文).
其制备方法是将乙烯和氯气同时鼓泡通入充有二氯乙烷的氯化器中,乙烯被氯化生成1,2-二氯乙烷
- ^ 吕以仙, 有机化学第七版. 有机化学第七版. 人民卫生出版社. 2008年: 313.
- ^ Mondanaro, K. R.; Dailey, W. P. (2004). "3-Chloro-2-(chloromethyl)-1-propene". Org. Synth.; Coll. Vol. 10: 212.
- ^ Krakowiak, K. E.; Bradshaw, J. S. (1998). "4-Benzyl-10,19-diethyl-4,10,19-triaza-1,7,13,16-tetraoxacycloheneicosane". Org. Synth.; Coll. Vol. 9: 34.
- ^ 邢, 其毅; 裴, 伟伟; 徐, 瑞秋; 裴, 坚. 第7章. 基礎有機化學. 北京. 2016: 289. ISBN 978-7-301-27212-1 (中文).
- ^ Rolf Appel. Tertiary Phosphane/Tetrachloromethane, a Versatile Reagent for Chlorination, Dehydration, and P-N Linkage. Angewandte Chemie International Edition in English. 1975, 14 (12): 801–811. doi:10.1002/anie.197508011.
- ^ Jose G. Calzada and John Hooz. "Geranyl chloride". Org. Synth.; Coll. Vol. 6: 634.
- ^ Jay K. Kochi. A New Method for Halodecarboxylation of Acids Using Lead(IV) Acetate. J. Am. Chem. Soc. 1965, 87 (11): 2500–2502. doi:10.1021/ja01089a041.
- ^ Jay K. Kochi. Formation of Alkyl Halides from Acids by Decarboxylation with Lead(IV) Acetate and Halide Salts. J. Org. Chem. 1965, 30 (10): 3265–3271. doi:10.1021/jo01021a002.
- ^ Chakrabartty, in Trahanovsky, Oxidation in Organic Chemistry, pp 343-370, Academic Press, New York, 1978
- ^ March, Jerry; Smith, Michael B. Knipe, A.C. , 编. March's Advanced Organic Chemistry Reactions, Mechanisms, and Structure. 6th. Hoboken: John Wiley & Sons. 2007: 484. ISBN 9780470084946.
- ^ Reynold C. Fuson and Benton A. Bull. The Haloform Reaction. Chemical Reviews. 1934, 15 (3): 275–309. doi:10.1021/cr60052a001.
- ^ SN1 and SN2 Reactions (pdf). [2021-07-28]. (原始内容存档 (PDF)于2019-05-12) (英语).
- ^ 8.4 Comparison and Competition Between SN1, SN2, E1 and E2. Pressbooks. [2021-07-28]. (原始内容存档于2021-07-28) (英语).
- ^ Organikum, 22. Edition (German), Wiley-VCH, Weinheim, 2004, ISBN 3-527-31148-3
- ^ Theory of Aetherification. Philosophical Magazine. 1850, 37: 350–356.)
- ^ Gabriel, S. Ueber eine Darstellung primärer Amine aus den entsprechenden Halogenverbindungen. Ber. 1887, 20: 2224 [2021-09-15]. (原始内容存档于2020-04-10).
- ^ Sheehan, J. C.; Bolhofer, V. A. An Improved Procedure for the Condensation of Potassium Phthalimide with Organic Halides. J. Am. Chem. Soc. 1950, 72: 2786. doi:10.1021/ja01162a527.
- ^ Gibson, M.S.; Bradshaw, R.W. The Gabriel Synthesis of Primary Amines. Angew. Chem. Int. Ed. Engl. 1968, 7: 919. doi:10.1002/anie.196809191.
- ^ Mitsunobu, O. Comp. Org. Syn. 1991, 6, 79-85.(综述)
- ^ Khan, M. N. Suggested Improvement in the Ing-Manske Procedure and Gabriel Synthesis of Primary Amines: Kinetic Study on Alkaline Hydrolysis of N-Phthaloylglycine and Acid Hydrolysis of N-(o-Carboxybenzoyl)glycine in Aqueous Organic Solvents. J. Org. Chem. 1996, 61, 8063-8068.
- ^ Stolz, Daniel; Kazmaier, Uli. Metal Enolates as Synthons in Organic Chemistry. PATai's Chemistry of Functional Groups. 2010. ISBN 9780470682531. doi:10.1002/9780470682531.pat0423.
- ^ Hart, David J.; Ha, Deok Chan. The ester enolate-imine condensation route to .beta.-lactams. Chemical Reviews. 1989, 89 (7): 1447–1465. doi:10.1021/cr00097a003.
- ^ Wu, George; Huang, Mingsheng. Organolithium Reagents in Pharmaceutical Asymmetric Processes. Chemical Reviews. 2006, 106 (7): 2596–2616. PMID 16836294. doi:10.1021/cr040694k.
- ^ Curti, Claudio; Battistini, Lucia; Sartori, Andrea; Zanardi, Franca. New Developments of the Principle of Vinylogy as Applied to π-Extended Enolate-Type Donor Systems. Chemical Reviews. 2020, 120 (5): 2448–2612. PMID 32040305. doi:10.1021/acs.chemrev.9b00481
 .
.
- ^ Smith, Janice Gorzynski. Organic Chemistry: Second Ed. 2008. pp 905-906
- ^ House, Herbert O. Modern Synthetic Reactions. Menlo Park, CA.: W. A. Benjamin. 1972. ISBN 0-8053-4501-9.
- ^ Saytzeff, Alexander. Zur Kenntniss der Reihenfolge der Analgerung und Ausscheidung der Jodwasserstoffelemente in organischen Verbindungen. Justus Liebigs Annalen der Chemie. 1875, 179 (3): 296–301. doi:10.1002/jlac.18751790304.
- ^ David R. Klein. 有機化學天堂秘笈. Taiwan: 天下远见出版股份有限公司. Oct 19, 2007: 302~309. ISBN 978-986-216-008-4 (中文(香港)).
- ^ 邢, 其毅; 裴, 伟伟; 徐, 瑞秋; 裴, 坚. 第六章. 基礎有機化學. 北京. 2016: 259–260. ISBN 978-7-301-27212-1 (中文).
- ^ 53.0 53.1 Smith, M. B.; March, J. Advanced Organic Chemistry, 5th ed.; John-Wiley & Sons: New York, 2001. ISBN 0-471-58589-0 - 包含格氏试剂的若干反应。
- ^ Kürti, L.; Czakó, B. Storategic Applications of Named Reactions in Organic Chemistry; Elsevier: Amsterdam, 2005; pp 188–189. ISBN 0-12-429785-4
- ^ Stent, M. Generation of a Highly Basic and Nucleophilic Organolithium; Isopropyllithium. Synthetic Pages. 2002, (195) [2021-07-29]. (原始内容存档于2016-03-10).
- ^ J. F. Normant. Organocopper(I) Compounds and Organocuprates in Synthesis. Synthesis. 1972, 1972 (02): 63–80. doi:10.1055/s-1972-21833.
- ^ Adolphe Wurtz. Sur une nouvelle classe de radicaux organiques. Annales de chimie et de physique. 1855, 44: 275–312 [2021-07-28]. (原始内容存档于2020-04-10).
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||








![{\displaystyle {\ce {RCOOH{+}Pb(OAc)_{4}{+}LiCl->[80^{\circ }\mathrm {C} ]RCl{+}CO_{2}{+}Pb(OAc)_{2}{+}HOAc{+}LiOAc}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/29be37630e93574fb4a0e596443bcaccc0399899)




