鹼金屬
鹼金屬是指在元素周期表中同屬第1族(舊稱ⅠA族[1])的六個金屬元素:鋰(Li)、鈉(Na)、鉀(K)、銣(Rb)、銫(Cs)、鈁(Fr)[2],其中鈁具有強烈的放射性。
鹼金屬均有一個屬於s軌道的最外層電子,[3][4][5],因此這一族屬於元素周期表的s區。[6]鹼金屬的化學性質顯示出十分明顯的同族元素相似性,是化學元素周期性的例證之一。[3]儘管氫也同屬於第1族[2][7],但其顯現的化學性質和鹼金屬相差甚遠,[8]因此通常不被認為是鹼金屬。[9][10]
鹼金屬有很多相似的性質;它們都是銀白色的金屬、密度小、熔點和沸點都比較低、標準狀況下有很高的反應活性。[3]它們易失去價電子形成帶一個單位正電荷的陽離子。[11]:28 它們一般質地較為柔軟,可以用刀切開,露出銀白色的剖面;由於能和空氣中的氧氣反應,剖面暴露於空氣中將很快失去光澤。[3]由於鹼金屬化學性質都很活潑,貯存時一般將它們放在礦物油中,或封於稀有氣體中保存,以防止其與空氣或水發生反應。[12]在自然界中,鹼金屬元素只有化合態,不能以游離態存在。[12] 鹼金屬都能和水發生激烈的反應,生成鹼性的氫氧化物,其反應能力與劇烈程度隨着原子序數的增大而越強。 [3][13]
所有已發現的鹼金屬均天然存在於自然界中。按照化學元素豐度順序,自然界化學豐度最高的是鈉,其次是鉀,接下來是鋰、銣、銫,最後是鈁。鈁的放射性很強,半衰期很短,十分不穩定,因此只能作為天然衰變鏈的產物,在自然界中痕量存在。[14][15]已有實驗試圖合成可能的第七個鹼金屬Uue,但截至目前均以失敗告終。[16]此外,由於相對論效應會極大影響包括Uue在內的超重元素的性質,因此Uue可能不是鹼金屬;[17]即使它真的是鹼金屬,它的物理性質和化學性質也可能會和其它六個鹼金屬有較大差異。[18]:1729–1733
鹼金屬有多種用途。銣或銫的原子鐘是游離態鹼金屬元素最著名的應用實例之一,[19]其中以銫原子鐘最為精準。[20][21]鈉化合物較為常見的一種用途是製作鈉燈,一種高效光源。[22][23] 人類對食鹽(氯化鈉)的使用可追溯到古代。鈉和鉀是生物體中的電解質,具有重要的生物學功能,屬於膳食礦物質。[24][25]儘管其它鹼金屬並非膳食礦物質,它們同樣會對身體產生或有益或有害的影響。[26][27][28][29]
性質
[編輯]化學性質
[編輯]
這一族的核外電子結構(特別是最外層電子)模式特殊,因此它們的化學性質呈規律性變化:
| Z | 元素 | 核外電子構型 | 電子排布[註解 1] |
|---|---|---|---|
| 3 | 鋰 | 2, 1 | [He] 2s1 |
| 11 | 鈉 | 2, 8, 1 | [Ne] 3s1 |
| 19 | 鉀 | 2, 8, 8, 1 | [Ar] 4s1 |
| 37 | 銣 | 2, 8, 18, 8, 1 | [Kr] 5s1 |
| 55 | 銫 | 2, 8, 18, 18, 8, 1 | [Xe] 6s1 |
| 87 | 鈁 | 2, 8, 18, 32, 18, 8, 1 | [Rn] 7s1 |
由於具有強烈的放射性,鈁可展現的化學性質十分有限,因此它的化學性質並未得到深入研究。[3]對鹼金屬元素的化學性質研究主要針對這一族的前五個元素。
已知的鹼金屬元素均為活潑金屬,至今尚未發現鹼金屬的天然單質。[30] 因此,鹼金屬通常泡在礦物油或煤油中保存。 [12] 鹼金屬和鹵素劇烈反應生成鹵化物,為白色的離子晶體,除氟化鋰外均可溶於水。[3] 鹼金屬和水反應生成強鹼性的氫氧化物溶液,因此應當妥善保存。原子量越大(越「重」)的鹼金屬,反應越為劇烈:比如銫加入水中引發的爆炸比鉀更劇烈,就是一個例子。[3][13] [20]
由於擁有較低的有效核電荷,且只需失去一個電子就能達到稀有氣體電子結構,[3]鹼金屬元素的第一電離能是同周期元素中最低的。[5]與之相對的是,鹼金屬的第二電離能普遍很高,因為失去一個電子的鹼金屬離子為稀有氣體電子結構,而且電子和原子核的距離下降了。這一能量差異導致鹼金屬在反應中通常失去一個電子,形成一價正離子。[11]:28
化學家起初認為鹼金屬不會形成負離子,但後來的研究發現了一類含負一價鹼金屬離子的不穩定化合物,稱作鹼化物。鹼化物中的鹼金屬負離子有充滿的s亞層,這使得它更加穩定。「反氫化鈉」,H+Na-,是這類化合物中一個引人注目的例子。通常的氫化鈉應當是Na+H-,[31]反氫化鈉具有與之相反的電荷分布。因此,反氫化鈉的能量高,純淨物很不穩定,但它的幾種衍生物已被預測為穩定或亞穩定的。[31][32]根據目前已知的信息,除鋰之外的鹼金屬都能形成鹼化物。[33][34][35]鹼化物的化學性質和電子鹽(一種以束縛電子為負離子的鹽)類似。[36]由於擁有不同尋常的化學計量和低電離電位,鹼化物有很高的理論研究價值。
鋰離子(Li+)的半徑很小(76pm),會極化化合物中的陰離子,使化合物具有一定共價性;[3] 因此,鋰的化學性質和這一族中的其他元素有一些差異。例如,氟化鋰是唯一不溶於水的鹼金屬鹵化物;[3]氫氧化鋰是唯一不潮解的鹼金屬氫氧化物。[3]鋰和鎂存在對角線規則,[3]鋰的某些化學性質和鎂相近。比如說,鋰可以形成穩定的氮化物,這一性質在鎂所在的鹼土金屬中很普遍,但在鹼金屬中則顯得獨特。[37]此外,在各自所在的族中,只有鋰和鎂可以形成共價有機金屬化合物。[38]此外,高氯酸鋰和其它含有無法被極化的大陰離子的鋰鹽比類似的鹼金屬鹽穩定,可能是因為 Li+ 有高溶劑化能。[11]:76此效應也使最簡單的鋰鹽基本以水合物的形式存在,因為無水物極易潮解:這也是氯化鋰和溴化鋰可以用作除濕器和空調的原因。[11]:76 根據推測,鈁和其它鹼金屬也會有一些性質差異。鈁的原子量很高,它的電子運動較快,會引發更明顯的相對論效應,鈁具有的7s電子因而會更穩定。根據推測,鈁的電負性、電離能會比銫更高,這和鹼金屬從上到下電負性和電離能的變化趨勢相反。此外,鈁的原子半徑可能會反常地低。[18]:1729[39]已經考慮到相對論效應而預測鈁的幾個特性是電子親和能 (47.2 kJ/mol)[40] 和 Fr2 分子的鍵解離能 (42.1 kJ/mol)。[41] CsFr 分子的極性為 Cs+Fr−,顯示鈁的 7s 殼層比銫的 6s 殼層更受到相對論效應的影響。[42] 此外,超氧化鈁 (FrO2) 預測有可觀的共價性,這和其它鹼金屬超氧化物不同。這是由於鈁的6p 電子成鍵導致的。[42]
化合物及反應
[編輯]和水的反應(鹼金屬氫氧化物)
[編輯]
所有的鹼金屬都可和冷水劇烈反應——乃至產生爆炸——生成強鹼性的鹼金屬氫氧化物水溶液,釋放氫氣。[43]沿這一族從上到下,反應逐漸加劇:鋰和水反應平緩進行,伴有冒泡現象;鈉和鉀與水反應可產生燃燒;銣和銫沉入水中,迅速產生大量氫氣並產生衝擊波,足以將玻璃容器擊碎。[3]鹼金屬放入水中時產生的爆炸分為兩個獨立階段:首先,金屬和水反應,產生氫氣。這一步中,反應性更強的重鹼金屬元素能更快地產生氫氣。接下來,反應第一階段產生的熱量通常會點燃新產生的氫氣,使其在空氣中爆炸性燃燒。這一氫氣爆炸可在水面上產生可見的火焰,而剛開始的金屬和水的反應主要在水下進行,因此不產生火焰。[13]
但是鹼金屬在水中發生爆炸原因仍存在爭議。2015年國外的一份文獻中稱,鹼金屬與水反應在其接觸水的一瞬間就被決定了,鹼金屬與水反應中鹼金屬會瞬間釋放自己的電子,使之無法束縛自己內部的正電荷繼而引發爆炸。[44]
和第14族(第IVA族,碳族)元素的反應
[編輯]鋰和鈉可與碳反應生成乙炔化合物(Li2C2和Na2C2),這類化合物也可由金屬與乙炔反應製得。鉀、鈉、銣和銫可與石墨反應,鹼金屬原子嵌入到六邊形的石墨層中,形成石墨層間化合物MC60(深灰色、近乎黑色)、MC48(深灰色、近乎黑色)、MC36(藍色)、MC24(鋼藍色)、MC8(銅黃色)。它們的導電性比純石墨強200倍,說明鹼金屬的價電子轉移到石墨層中,形成M+Cx-的化合物。[45]加熱KC8時,鉀原子發生脫嵌。隨着加熱時間的增長,逐漸形成KC24、KC36、KC48直到KC60。KC8是強還原劑,可自燃,接觸水則爆炸。[46][47]和石墨反應時,較大的鹼金屬原子(鉀、銣、銫)開始時形成KC8,而小的鹼金屬原子開始時形成KC6。[48]
鹼金屬和碳族其它的元素反應時,生成含籠狀結構的離子化合物。例如硅化物M4Si4(M=K,Rb,Cs),含有M+和四面體Si44−離子。[45]鹼金屬鍺化物中含有簡單的Ge4-離子,以及其它的簇合(津特耳相)離子,Ge42−, Ge94−, Ge92−, 以及 [(Ge9)2]6−,其化學性質和相應的硅化物相近。[11]鹼金屬錫化物主要為離子化合物。陰離子有Sn4-離子,[49]有時有更複雜的簇合離子,例如K4Sn9 中的 Sn94−, [50]簡單的鉛陰離子(Pb4-)尚未發現;鹼金屬鉛化物均含有複雜的簇合離子。[11]
和第15族(第VA族,氮族)元素的反應
[編輯]
鋰是唯一在標準狀況下和氮氣反應的鹼金屬,它的氮化物也是唯一穩定的鹼金屬氮化物。破壞N2分子中的N-N三鍵需要很高的能量,因而N2顯惰性。形成鹼金屬氮化物需要消耗能量,從而將鹼金屬電離生成M+離子,破壞N2分子的三鍵並形成N3-離子;這些能量由形成鹼金屬氮化物釋放的晶格能進行補償。離子半徑越小,電荷越高,晶格能越大;而鹼金屬無法形成高電荷離子,因而鹼金屬氮化物的晶格能只取決於金屬離子的半徑。所以,只有半徑最小的鋰能夠釋放足夠的晶格能,讓形成氮化物的反應成為一個放熱反應,形成Li3N。而其它的鹼金屬無法釋放足夠的晶格能,形成氮化物的反應是吸熱的,因而在標準條件下不生成氮化物。[37] Na3N和K3N極不穩定,容易分解為原來的組成元素(氮氣和鹼金屬)。[52][53]空間位阻禁止了氮化銣和氮化銫的存在。[11]:417 不過,鈉和鉀可以形成無色的疊氮化物,包含線性的 N−
3 。由於鹼金屬陽離子很大,它們是熱力學穩定的,融化時仍未分解。[11]:417
鹼金屬均易於和磷、砷反應,生成M3P/M3As. P3- 和As3-的半徑更大,形成化合物需要提供的能量更低,因而不需要很高的晶格能。[45] M3P/M3As不是僅有的鹼金屬磷化物或砷化物。鉀有9種不同的已知磷化物:K3P, K4P3, K5P4, KP, K4P6, K3P7, K3P11,KP10.3 以及 KP15。 [54]大多數金屬可生成砷化物,而只有鹼金屬、鹼土金屬可生成離子型砷化物。Na3As的結構很複雜:其中的Na-Na距離為328-330pm,比金屬鈉單質中的Na-Na距離更短。這說明即使和低電負性的鹼金屬形成的化學鍵也不是純粹的離子鍵。[11]已發現M3As以外的鹼金屬砷化物。比如LiAs,它帶有金屬光澤和強導電性,說明其中可能存在金屬鍵。[11]鹼金屬銻化物中的Sb3-離子是強還原劑,因此鹼金屬銻化物不穩定,易發生反應。鹼金屬銻化物和酸反應形成不穩定的劇毒氣體SbH3。[55]鉍化物不完全為離子性,而是含有部分離子鍵和部分金屬鍵的金屬互化物。[56] 實際上,它們具有某些金屬性質,化學計量比MSb的鹼金屬銻化物包含以螺旋Zintl結構鍵合的銻原子。 [57] 鉍化物甚至不是完全離子化的;它們是含有部分金屬鍵和部分離子鍵的金屬間化合物。 [58]
和第16族(VIA族,氧族)元素的反應
[編輯]9O
2 簇合物, 由兩個共面的 正八面體 組成
標準狀況下,鹼金屬均可和氧氣劇烈反應,形成多種多樣的氧化物。比如簡單氧化物(含O2-離子),過氧化物(含O2−
2 離子,氧原子間存在單鍵),超氧化物(含O−
2離子)等。鋰在空氣中燃燒生成氧化鋰;鈉和氧氣反應生成氧化鈉和過氧化鈉的混合物;鉀則形成過氧化鉀和超氧化鉀的混合物;銣和銫只形成超氧化物。鋰、鈉和鉀在空氣中僅僅是燃燒,而銣和銫可在空氣中自燃,這也說明鹼金屬從上到下反應性增強。[37]
半徑小的鹼金屬離子趨向於極化複雜的負離子(過氧化物和超氧化物),將複雜離子中的電子吸引到其中的一個氧原子中,形成一個O2-離子和一個氧原子。因此,鋰在室溫下和氧氣反應只生成簡單氧化物;而鈉和鉀的半徑更大,極化效應更弱,因而可以形成較不穩定的過氧化物。這一族中最下方的銣和銫半徑很大,可以形成最不穩定的超氧化物。形成超氧化物釋放的能量最多,因此較大的鹼金屬原子和氧氣反應更趨向於生成超氧化物。銣和銫的簡單氧化物和過氧化物確實存在,但是無法在標準狀況下由鹼金屬和氧氣反應製得。[37]不過如果控制反應條件,除鈁之外的所有鹼金屬都能形成簡單氧化物,過氧化物和超氧化物。鹼金屬過氧化物和超氧化物是強氧化劑。過氧化鈉和超氧化鉀可與二氧化碳反應,形成鹼金屬碳酸鹽和氧氣,因而在潛艇的空氣淨化器中被使用。呼出氣體中的水蒸氣可使超氧化鉀除去二氧化碳的反應更加高效。[45][59]
銣和銫可形成比超氧化物更複雜的氧化物。銣在空氣中被氧化可生成Rb6O和Rb9O2.銫生成的氧化物種類豐富得多,比如臭氧化物CsO3, [60][61]以及幾種色彩鮮明的低氧化物,如Cs
7O, Cs
4O, Cs
11O
3, Cs
3O (深綠色[62]), CsO, Cs
3O
2,[63]以及Cs
7O
2.[64][65]真空下加熱Cs
7O
2可生成Cs
2O.[66]
鹼金屬可和較重的氧族元素(硫、硒、碲、釙)發生類似反應。除鈁之外,所有的M2Ch(M為鹼金屬,Ch=S、Se、Te、Po)都是已知的。鹼金屬和過量的氧族元素反應生成M2Chx,其中的氧族元素原子連接成鏈狀。比如,鈉可和硫反應生成硫化鈉(Na2S)以及各種多硫化鈉(Na2Sx, x=2~6),其中含有S2−
x 離子。[45] Se2-和Te2-的鹼性使得鹼金屬硒化物水溶液和碲化物水溶液呈鹼性。鹼金屬和硒、碲直接反應時,除生成M2Se或M2Te之外,還生成多硒化物和多碲化物。[67]鹼金屬在300-400 °C下和釙直接反應,形成含Po2-離子的鹼金屬釙化物,後者化學上十分穩定。[11][68][69]
和第17族(VIIA族,鹵素)元素,以及氫氣的反應
[編輯]鹼金屬是元素周期表中電負性最低的元素,因而趨向於和電負性最高的鹵素形成離子鍵,產物為鹼金屬鹵化物。氯化鈉,也就是通常所說的食鹽,就是其中之一。鹼金屬和鹵素的反應性呈規律性變化:從鋰到銫,反應性越來越強;從氟到碘,反應性越來越弱。鹼金屬鹵化物化學式均為MX(M為鹼金屬,X為鹵素),均為白色離子晶體,常溫下為固態。[3][37]除氟化鋰之外,鹼金屬鹵化物均可溶於水。氟化鋰中的Li+和F-的半徑都很小,二者間靜電相互作用很強,因而氟化鋰的晶格能很高,因此不溶於水。[3]
鹼金屬也和氫反應,形成離子型氫化物,其中的氫負離子可作為擬鹵素。它們可用作還原劑,合成氫化物、氫配合物和氫氣。[11]:83[45] 其它擬鹵化物也是已知的,其中最著名的是氰化物。除了氰化鋰,它們的晶體結構類似真正的鹼金屬鹵化物,而氰離子可以自由旋轉。[11]:322 三元鹼金屬鹵氧化物,像是 Na3ClO、K3BrO (黃色)、 Na4Br2O、 Na4I2O和 K4Br2O也是已知的。[11]:83 鹼金屬多鹵化物不穩定,儘管超大的銣和銫通過極弱的極化性來穩定這些化合物。[11]:835
配位化合物
[編輯]鹼金屬的半徑很大,而電荷僅有+1,所以鹼金屬通常不和簡單的路易斯鹼生成配合物。半徑最小的Li+有最多的配合物,隨着離子半徑增大,形成的配合物越來越少。水溶液中,鹼金屬離子以八面體的六水合離子([M(H2O)6]+)存在;由於鋰離子半徑小,因而形成的是正四面體的四水合離子[Li(H2O)4]+.由於水分子的極性,二者由靜電力相互吸引,形成水合離子。因此,含鹼金屬離子的無水鹽常被用做乾燥劑。[45]同樣由於靜電相互作用的原因,鹼金屬易於和冠醚、穴醚形成配合物。比如,Li+可和12-冠-4形成配合物,Na+與15-冠-5形成配合物,K+與18-冠-6形成配合物。[45]
氨溶液
[編輯]和大多數金屬不同,鹼金屬在液氨中緩慢溶解,生成氫氣和鹼金屬氨基化合物(MNH2).使用催化劑可加速這一過程。形成的氨基化合物不溶於液氨,從體系中析出;剩餘的液體是有明顯顏色的鹼金屬液氨溶液。這類溶液中含有溶劑化電子,因而顏色明顯,具有強導電性。濃度小於3mol/L時,溶液呈深藍色,導電性是氯化鈉水溶液的10倍;濃度大於3mol/L時,溶液顯銅黃色,導電性能和液態金屬(如汞)相近。[11][45][71]除了氨基化合物與溶劑化電子,溶液中還有鹼金屬離子(M+),鹼金屬原子(M),鹼金屬雙原子分子(M2)和鹼金屬負離子(M-)。後三種粒子均不穩定,最終生成熱力學穩定的鹼金屬氨基化合物和氫氣。氨合電子為強還原劑,常在化學合成中使用。[45]
金屬有機化學
[編輯]
鋰形成的有機金屬化合物種類最多,相對最為穩定,成鍵為共價鍵。有機鋰試劑為不導電的固體或液體,熔點低,易揮發,趨向於生成化學式為(RLi)x的多聚物(R為有機基團)。以甲基鋰為例,其化學式為(CH3Li)x,x=4或6,結構分別為正四面體型和正八面體型。[45][72]有機鈉化物和有機鉀化物也是多聚的。[73]鋰的電負性低,因而鋰-碳鍵的電荷密度主要集中在碳原子上,可有效形成碳負離子;因此,有機鋰化合物是非常強力的鹼,也是強力的親核試劑。丁基鋰常被用做強鹼,已經投入商業化生產。
有機鈉試劑在化學中的應用較為有限。相比較而言,有機鋰試劑已投入商業化生產,且反應性能更易於使用。有些有機鈉試劑具有商業意義,其中最主要的是環戊二烯基鈉。四苯硼鈉也可歸類為有機鈉化物,因為在固態下這一化合物中的鈉和芳基形成化學鍵。更重的鹼金屬形成的有機金屬化合物反應性更強,應用更為受限。施洛瑟鹼是這類化合物中的一種重要試劑。它是正丁基鋰和叔丁醇鉀的混合物,可和丙烯反應,生成丙烯鉀(KCH2CHCH2)。 順-2-丁烯和反-2-丁烯在和鹼金屬接觸時實現化學平衡。所用的鹼金屬為鋰和鈉時,這一異構化反應進行得較快;而使用鉀、銣、銫時進行得較慢。鉀、銣、銫更傾向高位阻的構象。[74]有機鈉、有機鉀、有機銣和有機銫化合物成鍵以離子性為主,在非極性溶劑中幾乎不可溶。[45]
物理性質
[編輯]銫有金色光澤,其它的鹼金屬均為銀白色。[75]鹼金屬都很軟,具有較低的密度、熔點以及沸點。[3]
下表總結了鹼金屬的物理性質和原子性質。標有問號的數據尚未確定,或者是由元素周期律推斷所得,並非實際測量結果。
| 鹼金屬 | 標準原子量 (u)[註解 2][77][78] |
熔點 | 沸點[5] | 密度 (g/cm3) |
電負性 (鮑林標度) |
第一電離能 (kJ•mol−1) |
原子半徑 (pm) |
焰色反應 | |
|---|---|---|---|---|---|---|---|---|---|
| 鋰 | 6.94(1)[註解 3] | 453.69 K, 180.54 °C, 356.97 °F |
1615 K, 1342 °C, 2448 °F |
0.534 | 0.98 | 520.2 | 152 | 紅色[3][79] | |
| 鈉 | 22.98976928(2) | 370.87 K, 97.72 °C, 207.9 °F |
1156 K, 883 °C, 1621 °F |
0.968 | 0.93 | 495.8 | 186 | 橙黃色[3][79] | |
| 鉀 | 39.0983(1) | 336.53 K, 63.38 °C, 146.08 °F |
1032 K, 759 °C, 1398 °F |
0.89 | 0.82 | 418.8 | 227 | 紫丁香色 或粉色[3][79] | |
| 銣 | 85.4678(3) | 312.467 K, 39.31 °C, 102.76 °F |
961 K, 688 °C, 1270 °F |
1.532 | 0.82 | 403.0 | 248 | 紅色或紫紅色[3][79] | |
| 銫 | 132.9054519(2) | 301.59 K, 28.44 °C, 83.19 °F |
944 K, 671 °C, 1240 °F |
1.93 | 0.79 | 375.7 | 265 | 藍色或紫色[3][79] | 
|
| 鈁 | [223][註解 4] | ? 300 K, ? 27 °C, ? 80 °F |
? 950 K, ? 677 °C, ? 1250 °F[80] |
? 1.87 | ? 0.7 | 380 | ? | ? | |
元素周期律
[編輯]元素周期表中,鹼金屬族是族內元素性質最為相近的一族。[3]沿着周期表從上到下,鹼金屬元素的原子半徑逐漸升高,[81] 電負性逐漸降低,[81] 反應性逐漸升高,[3]熔沸點逐漸降低。[81]總體而言,鹼金屬的密度從上到下逐漸升高;鉀是一個例外,它的密度比上面的鈉略低。[81]
原子半徑和離子半徑
[編輯]
沿周期表從上到下,已知的鹼金屬原子半徑逐漸升高。[81]由於屏蔽效應,當一個原子有多於一個電子層時,每個電子被原子核吸引的同時都受到其他電子的排斥。[82]鹼金屬價電子只受到一個+1的淨電荷的作用,因為部分有效核電荷被內層電子(除去最外層的所有電子)所抵消,而鹼金屬內層電子的數量永遠比核電荷數少一個。因此,鹼金屬原子半徑只和電子層數有關;電子層數隨周期數增加而增加,因此鹼金屬原子半徑從上到下逐漸增大。[81]
鹼金屬的離子半徑比原子半徑小得多。失去最外層電子後,鹼金屬離子比鹼金屬少一層電子,因而半徑更小。此外,鹼金屬離子的有效核電荷升高了,原子核對核外電子的吸引更強烈,導致半徑減小。[3]
第一電離能
[編輯]
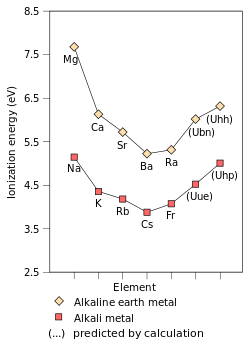
元素或分子的第一電離能指將最容易解離的電子從氣態原子/分子中解離出來,形成帶+1電荷的氣態離子所需的能量。第一電離能受有效核電荷數、內層電子的屏蔽效應、最易解離的電子(對主族元素而言,通常是最外層電子)到原子核距離的影響。核電荷數與屏蔽效應影響作用於易解離電子的有效電荷。作用於鹼金屬最外層電子的有效電荷相同(均為+1),因此影響第一電離能的只有最外層電子到原子核的距離。沿這一族從上到下,外層電子到原子核的距離逐漸升高,核對最外層電子的吸引逐漸減弱, 第一電離能因而逐漸降低。[81]鈁是這一趨勢的特例。由於相對論效應的作用和7s軌道的收縮,鈁的價層電子比非相對論模型的預測值更為接近原子核,價電子受到更多的吸引力,因此鈁的第一電離能比銫略高。[18]:1729由於鹼金屬原子的最外層電子只受到一個有效電荷作用,且失去一個電子後能形成穩定的稀有氣體電子構型,因此鹼金屬的第一電離能是同周期元素中最低的。
鹼金屬元素的第二電離能遠高於第一電離能,因為第二易解離的電子位於一個全充滿的電子軌道中,因此難以解離。[3]
反應活性
[編輯]沿周期表從上到下,鹼金屬反應性逐漸升高,這是鹼金屬的第一電離能和原子化能共同作用的結果。由於鹼金屬的第一電離能從上到下逐漸降低,外層電子逐漸易於在反應中解離,反應性逐漸升高。 原子化能被用來衡量元素的金屬鍵強度,隨着鹼金屬從上到下原子半徑上升,金屬原子核間距上升,金屬鍵的離域電子到原子核的距離上升,原子化能下降。將原子化能與第一電離能相加,可以得到一個數值,它和鹼金屬參與反應所需的活化能密切相關(但不相等)。從上到下,這個數值逐漸降低,鹼金屬的反應活化能也逐漸降低。因此,化學反應可以更快進行,反應性因而從上到下逐漸增加。[43]
電負性
[編輯]
電負性描述原子或官能團吸引電子的能力。[87]假如氯化鈉中氯和鈉之間形成的是共價鍵,由於氯的電負性更高,兩個原子間的共用電子對會被吸引到靠近氯的一側。由於氯和鈉的電負性相差實在太大,共用電子對過於靠近氯,實際上已經可以看做鈉上的電子被氯奪走,因此在氯化鈉固體中實際形成的是離子鍵。如果將鈉換成鋰的話,電子對就不會離氯這麼近。由於鋰原子半徑小,電子對與鋰的有效核電荷的距離更近,鹼金屬原子和共用電子對之間的吸引力增強了。由此得出,半徑較大的鹼金屬原子吸引共用電子對的能力更差,電負性越低。[81]
由於鋰的電負性較高,鋰的某些化合物顯共價性。比如,碘化鋰可溶於有機溶劑中,大多數共價化合物擁有這一性質;[81] 氟化鋰是唯一不溶於水的鹼金屬鹵化物;[3] 以及氫氧化鋰是唯一不潮解的鹼金屬氫氧化物。[3]
熔沸點
[編輯]
加熱金屬至其熔點時,原本將金屬原子束縛在一起的金屬鍵變弱,原子因而可以自由移動;加熱至沸點時,金屬鍵完全斷裂。[81][89]因此,鹼金屬熔沸點的變化規律說明鹼金屬的金屬鍵強度從上到下逐漸變弱。[81]金屬原子由原子核與離域電子之間的靜電引力束縛在一起。[81][89]從上到下鹼金屬的原子半徑升高,離域電子和原子核的距離增大,金屬鍵因而變弱,導致熔沸點降低。[81]由於內層電子的屏蔽效應,核電荷的變化可忽略。[81]
密度
[編輯]鹼金屬晶體均為體心立方結構。[11],因此影響密度的只有兩個因素:單位體積可容納的原子數,以及單一原子的質量。單位體積可容納的原子數由原子半徑決定,因此如果知道鹼金屬的原子半徑和原子量數值,就可計算鹼金屬的密度。由結果來看,鹼金屬的密度從上到下依次增高,鉀是一個例外。由於擁有同一周期中最小的原子量和最大的原子半徑,鹼金屬是同一周期中密度最低的金屬。[81]鋰、鈉、鉀是僅有的三個密度小於水的金屬元素。[3]
原子核穩定性
[編輯]| Z |
鹼金屬 |
穩定同位素 |
原生核素 |
斜體字表示不穩定核素 奇數-奇數同位素以粉色表示
| ||
|---|---|---|---|---|---|---|
| 3 | 鋰 | 2 | — | 7 Li |
6 Li |
|
| 11 | 鈉 | 1 | — | 23 Na |
||
| 19 | 鉀 | 2 | 1 | 39 K |
41 K |
40 K |
| 37 | 銣 | 1 | 1 | 85 Rb |
87 Rb |
|
| 55 | 銫 | 1 | — | 133 Cs |
||
| 87 | 鈁 | — | — | 無原生核素 | ||
鹼金屬的原子序數均為奇數,因此它們的同位素只可能為奇數-奇數核素(質子數和中子數均為奇數,質量數為偶數)或奇數-偶數核素(質子數為奇數,中子數為偶數,質量數為奇數)。奇數-奇數原生核素較為罕見——這類核素通常會發生β衰變,衰變產物為偶數-偶數核素,後者擁有更高的束縛能,因而更加穩定。 [90]
由於奇數-奇數核素十分罕見,鹼金屬幾乎所有的主要同位素均是奇數-偶數核素。鹼金屬奇數-奇數同位素中,鋰-6是穩定的,鉀的放射性同位素鉀-40也有較長的壽命。對一個給定的奇數質量數,只能有一種β衰變穩定同位素(不產生β衰變的同位素)。和偶數-偶數核素與奇數-奇數核素間的束縛能差距相比,奇數-偶數核素與偶數-奇數核素的束縛能幾乎沒有差距,因此和β衰變穩定同位素質量相等的其它核素(同量素)會產生β衰變,生成能量最低的核素。總之,質子數和/或中子數為奇數的核素相對不穩定,這就導致擁有奇數原子序數的元素——例如鹼金屬—— 擁有的穩定同位素數量比原子序數為偶數的元素少。26種單一同位素元素中,除鈹之外的所有成員的質子數均為奇數,中子數均為偶數。(鈹的質子數為偶數,中子數為奇數)[90]
鈉、鉀、銣、鈁擁有天然存在的放射性同位素: 鈉-22和鈉-24為宇生的痕量放射同位素 [91],鉀-40和銣-87有很長的 半衰期,得以在自然界中存在,[92]鈁的所有同位素均具有放射性。[92] 20世紀初,人們認為銫是放射性的,[93][94]儘管它沒有天然放射性同位素。[92][註解 13]鉀的天然放射性同位素K-40約占自然界中的鉀的0.012%,因此自然界的鉀存在微弱的放射性。[95]正是鉀產生的這一微弱輻射,導致1925年有人錯誤地聲稱發現了87號元素。[96][97]
銫-137是一種β放射源,也是一種強γ放射源。它的半衰期為30.17 年,是兩種主要的中等壽命裂變產物之一(另一種為鍶-90)。這兩種裂變產物是核燃料棒使用完畢後數年到數百年產生的輻射的主要來源。137
Cs
經過高能β衰變,最終生成穩定的鋇-137。137
Cs
捕獲中子的速度很慢,因而不能通過中子照射的方法進行處理,只能任其衰變。[98]在水文學研究中,137
Cs
被用做示蹤物,和氚在這方面的應用類似。[99]幾乎所有的核試驗都會向環境中釋放少量的銫-134與銫-137。某些核事故也會釋放這兩種同位素,比如切爾諾貝利核事故和福島第一核電站事故。截至2005年,銫-137仍是切爾諾貝利核電廠附近隔離區的主要輻射源。[100]
延伸
[編輯]
儘管目前只發現了6個鹼金屬元素,目前已有研究預測比鈁更重的鹼金屬元素的物理性質與化學性質。據推測,鈁之後的第一個鹼金屬元素是目前尚未發現的第119號元素Uue。它是第八周期的第一個元素,性質和可能同族的其它元素類似。[18]:1729–1730它的化學性質可能更接近鉀[102]或銣[18]:1729–1730;而根據元素周期律,Uue的性質應當與銫或鈁更為相近,乃至比它們更易反應。Uue的價電子運動速度高,產生相對論效應,導致Uue的第一電離能升高,金屬半徑和離子半徑降低,反應性下降。[102]目前已發現相對論效應對鈁的性質產生了類似影響。[18]:1729–1730相對論效應可能導致Uue元素不像其它鹼金屬那樣反應。[17] Uue的8s軌道因相對論效應而變得穩定,導致 Uue的電子親合能升高——遠高於銫和鈁的電子親合能,甚至比其它所有的鹼金屬元素都高。 相對論效應同樣會導致Uue的極化性大幅下降。[18]:1729–1730另一方面, Uue的熔點可能仍符合鹼金屬元素的熔點變化規律,也就是比鈁更低。據推測,Uue的熔點可能在0 °C 到 30 °C之間。[18]:1724

Uue的價層電子穩定性導致8s軌道的收縮,繼而導致原子半徑降低。據預測Uue的原子半徑為240 pm,[18]:1729–1730,比銣原子(247 pm)略小。[3] 因此,+1氧化態的Uue的化學性質應當更接近銣,而不是鈁。與之相反,據預測Uue+ 的離子半徑比Rb+大。Uue+的最外層7p軌道不穩定,因而比低層數的p軌道更大。除鹼金屬特徵的+1氧化態之外,Uue還可能擁有其它鹼金屬沒有的+3氧化態。[11]:28[18]:1729–1730 Uue中7p3/2亞層不穩定且有膨脹,導致7p3/2亞層的最外電子的電離能比其他方式的預測值低,因此可能解離更多電子產生+3氧化態。[11]:28[18]:1729–1730 很多Uue化合物中可能有7p3/2電子參與成鍵,這些化合物因而顯現部分共價性[42]
關於比Uue更重的鹼金屬元素的預測研究相對較少。根據元素周期表向下推測,下一個鹼金屬應該是第169號元素Uhn;而根據狄拉克-福克方法計算,下一個鹼金屬應當是第165號元素Uhp,其核外電子排布為[Uuo] 5g18 6f14 7d10 8s2 8p1/22 9s1.[18]:1729–1730[101] 深入的計算顯示Uhp的電離能會比Uup、鈁、銫更高,與鈉相近。Uhp的原子半徑也會符合自銫開始的遞減趨勢:它的原子半徑可能和鉀相近。 [18]:1729–1730除9s電子外,Uhp的7d電子也可能一道參與化學反應,形成比+1更高的氧化態,因而比起鹼金屬Uhp可能和硼族元素的行為更加接近。[18]:1732–1733
截至2012年,尚未有關於Uhp以後的鹼金屬性質的研究。第八周期之後的元素擁有強烈的相對論效應和層結構效應,由較輕元素性質變化規律做出的外推因而變得完全不準確。 相對論效應使s軌道穩定,層結構效應使層數高的電子層的p,d,f,g軌道變得不穩定,二者產生的效果相反。因此,對第八周期之後的元素而言,相對論計算和非相對論計算得出的結果差距更加明顯。[18]:1732–1733由於鹼金屬和鹼土金屬均為s區元素,對Uue和Uhp性質及變化趨勢做出的預測可能同樣適用於相應的鹼土金屬: Ubn和Uhh.[18]:1729–1733
具有部分類似性質的其它元素或基團
[編輯]很多物質和鹼金屬一樣傾向於形成一價陽離子。類似擬鹵素,這些物質有時稱作「擬鹼金屬」。它們包括一些元素和更多的原子團,這些原子團在大小和極化性的方面和鹼金屬類似。[103]
氫
[編輯]
氫擁有一個核外電子,通常出於方便起見將其放在元素周期表第1族的最上側。然而,氫通常不被看做是一個鹼金屬元素。[9] 一般條件下,氫以雙原子分子(H2)的形式存在;[104] 然而,鹼金屬只有在高溫下變成氣態後才能形成雙原子分子(如Li2)。[105]
和鹼金屬一樣,氫擁有一個價電子[8],易於和鹵素反應,[8]但是氫和鹼金屬的相似性也只有這些了。[8] [8]將氫放在鋰上方,主要是由於它的電子構型和鹼金屬相似,並非出於化學性質的考慮。[9][8]有時它被放在碳的上方,因為氫和碳的電負性相近;[106]有時會放在擁有某些相似化學性質的氟上方。[8][106]
氫的第一電離能為 (1312.0 kJ/mol),遠高於鹼金屬的第一電離能。[83][84]由於只需一個電子就可形成稀有氣體構型,氫的行為有時更接近鹵素。和鹵素一樣,氫可以形成-1價的氫負離子。[8]儘管在鹼化物中,鹼金屬也可形成負離子,然而這類產物很不穩定,只用於實驗室研究。[31][32]在極端高壓的作用下(比如木星核心和土星核心的高壓),氫發生相變生成金屬氫,性質和鹼金屬類似。[107] 反對這种放置的論點是,與鹵素放熱形成鹵化物的反應不同,氫形成氫化物的反應是吸熱的。 H− 陰離子的大小也違反鹵素離子越往下大小越大的趨勢。實際上,H -的擴散性很強,因為它的單個質子不能輕易控制兩個電子。 [57]:15–6 當它們經受非金屬過渡到金屬的作用時,在3000 K下的液體金屬氫的電阻率約等於在2000 K壓力下的銣和銫的液體的電阻率。[108]
氫的 1s1 電子構型類似鹼金屬 (ns1),不過由於不存在 1p 亞層,氫的這個構型很特殊。 它可以失去一個電子,形成氫正離子 H+,或是再獲得一個電子,形成氫負離子 H−。[11]:43 前者可以說明氫和鹼金屬類似,而後者顯示氫和鹵素相似。不過,由於 1p 軌道不存在,不管歸類到鹼金屬或是鹵素都不能完美解決問題。[11]:43 在熱力學性質如電離能和電子親和能方面,碳族元素也很合適,但是氫不能以四價存在。 所以,沒有一種排法是令人滿意的, 儘管鹼金屬是最常見的放置位置(如果選擇一個放置位置),因為在所有單原子氫物種中,水合氫離子目前為止是最重要的,它是酸鹼化學的基礎。 [106] 氫因其異常的電子構型和小尺寸,產生的非正統性質的一個例子是氫離子非常小(半徑約為0.15 pm,而大多數其他原子和離子的大小為50-220pm),因此除了與其他原子或分子締合以外,它在縮合體系中不存在。 實際上,質子在化學物質之間的轉移是酸鹼理論的基礎。 [11]:43 氫形成氫鍵的能力也是獨特的,這是電荷轉移,靜電和電子相關貢獻現象的影響。 [106] 雖然類似的鋰鍵是已知的,但它們大多是有靜電的。 [106] 然而,在某些分子晶體中,氫可以起到與鹼金屬相同的結構作用,並且與輕的鹼金屬(尤其是鋰)有着密切的關係。 [109]
銨及其衍生物
[編輯]銨離子(NH+
4)的性質像是一種介於鉀和銣之間的「中間鹼金屬」[103][110],經常被看做鹼金屬的近親。[111][112][113]舉例來說,絕大多數的鹼金屬鹽易溶於水,絕大多數的銨鹽也溶於水。[114]根據推測,在極高壓下,銨可以形成穩定的金屬銨(由NH+
4離子和游離電子構成)。這一反應可能在天王星和海王星的內部進行,這兩顆行星的內部磁場可能受到了該反應的顯著影響。[112][113]據估計,從氨氣與氫氣的混合物轉變為金屬銨所需的壓強為25 GPa 左右,低於將游離態物質轉化為金屬態通常所需的壓強100 GPa[112]
其它「擬鹼金屬」包括銨的烷基衍生物,其中銨的一些氫原子被替換成烷基或芳基。季銨鹽(NR+
4)可用於替代昂貴的Cs+來穩定又大又容易極化的陰離子(如 HI−
2)。[11]:812–9季銨氫氧化物和鹼金屬氫氧化物一樣是強鹼,會和空氣中的二氧化碳反應,生成碳酸鹽。[57]:256此外,銨的氮原子可以被更重的氮族元素取代,生成鏻(PH+
4)或鉮(AsH+
4)陽離子,它們的氫原子也可以被烷基或芳基取代。四氫銻陽離子(SbH+
4)本身仍未被發現,但它的衍生物已獲得表徵。[103]
二茂鈷和其衍生物
[編輯]二茂鈷, Co(C5H5)2,是一種茂金屬,是 二茂鐵的鈷類似物。 它是一種暗紫色固體。 二茂鈷有 19 個價電子,比有機過渡金屬化合物的常見價電子數量—18個多一個。它非常穩定的類似物二茂鐵有18個電子,符合18電子規則。 該額外的電子占據一個於Co-C鍵的反鍵軌道。 因此, Co(C5H5)2 的很多化學反應都傾向於失去這個多餘的電子, 形成極度穩定的 18電子陽離子二茂鈷陽離子。 許多二茂鈷鹽與銫鹽會共沉澱,而氫氧化二茂鈷是可以吸收大氣中二氧化碳,形成碳酸二茂鈷的強鹼。 [57]:256 與鹼金屬一樣,二茂鈷是一種強還原劑,由於十個甲基的誘導效應,十甲基二茂鈷的還原性更強。 [115] 鈷可以被其較重的同類物銠取代,從而得到更強的還原劑二茂銠。 [116] 二茂銥(用 銥代替鈷)可能會更強,但由於其不穩定性,因此並未得到很好的研究。 [117]
鉈
[編輯]
和所有的鹼金屬一樣,鉈擁有+1氧化態。[11]:28Tl+的離子半徑為164 pm,和K+ (152 pm)、Ag+(129 pm)相仿,因此含Tl+的鉈化合物性質通常和相應的鉀化合物或銀化合物相近。[118][119]在鉈被發現後的數年裡,歐洲大陸認為鉈是一種鹼金屬;[119]:126在尤利烏斯·洛塔爾·邁耶爾1868年編制的周期表以及門捷列夫1869年編制的元素周期表中,鉈被當做第六個鹼金屬,位置與銫相鄰。[120]後來兩人都對周期表進行了修改。在邁耶爾1870年的周期表和門捷列夫1871年的周期表中,鉈被放在了硼族,也就是如今它所在的位置;而銫下方的一格為空缺。[120]不過鉈同樣有+3氧化態,而已知的鹼金屬都不具備這一氧化態。[11]:28 [註解 14]如今人們認為鈁是第六個鹼金屬元素。[2]
第11族元素
[編輯]11族元素(又稱貨幣金屬)銅,銀和金,由於它們可以形成具有不完整d軌道的離子,因此通常歸類為過渡金屬。 在物理上,它們相對於其它過渡金屬,有較低的熔點和較高的電負性值,更像是後過渡金屬。 Cu,Ag和Au被填充的d軌道和自由s電子形成它們的高電導率和熱導率。第11族左側的過渡金屬會經歷s電子和部分填充的d殼層之間的相互作用,從而降低電子遷移率。[121] 化學上,第11族金屬的行為類似於主族金屬,處於+1價態,因此在某種程度上與鹼金屬有關:這是其先前被標記為IB族,與鹼金屬的 IA族有關的原因。它們有時被分類為後過渡金屬。[122] 它們的光譜類似於鹼金屬。[123] 它們的一價正離子是順磁性的,並且與鹼金屬的鹽一樣,它們的鹽沒有顏色(除非陰離子有顏色)。[124]
在門捷列夫 1871年元素周期表中,銅、銀和金被列出了兩次,一次在VIII族下(鐵系元素和鉑族金屬),另一次在IB族下。 儘管如此,IB族裡的它們還是用括號括了起來,指出它是暫定的。 門捷列夫對元素進行分配的主要標準是元素的最大氧化態:在此基礎上,由於當時已知存在二價銅和三價金化合物,因此無法將第11族元素歸為IB族。[123] 但是,消除IB族將使IA族成為唯一缺乏A–B分叉的主族(VIII族被標記為過渡族)。[123] 此後不久,大多數化學家選擇對IB族中的這些元素進行分類,並將它們從VIII族中刪除,以得到對稱性:這是主要的分類方法,直到現代的中長18列元素周期表的出現使鹼金屬和第11族金屬分離。[123]
傳統上,第11族金屬被視為鹼金屬的一部分,因為它們具有鹼金屬特徵性的 s1電子構型(第1族:p6s1;第11族:d10s1)。 然而,相似性主要限於兩組的+1化合物的化學計量數,而不是它們的化學性質。[11]:1177 這是由於被完全填充的d殼層比被完全填充的p殼層對最外層s電子的屏蔽作用弱得多,因此第11族金屬比相應的鹼金屬具有更高的第一電離能和更小的離子半徑。[11]:1177 此外,它們具有較高的熔點,硬度和密度,並且在液氨中具有較低的反應性和溶解度,在其化合物中具有更大的共價性。[11]:1177 最後,鹼金屬在標準電極電勢表的頂部,而第11族金屬幾乎在底部。[11]:1177 第11族元素的d殼層比鹼金屬的p殼層更容易被破壞,因此第二和第三電離能更低,能夠實現比+1高的氧化態和更豐富的配位化學,從而使第11族金屬的性質更像過渡金屬。[11]:1177 特別值得一提的是與銣和銫可以和金形成離子化合物,在其中形成金離子(Au-)。金離子以溶劑化形式出現在液氨溶液中:此處的金的表現為擬鹵素,因為它的5d106s1構型比准封閉殼5d106s2少一個電子,也就是很穩定的汞的電子構型。[11]:1177
歷史
[編輯]鹼金屬族的出現
[編輯]1865年左右,約翰·紐蘭茲發表了一系列論文,列出了這些元素,以原子量增加和物理化學性質相似的順序出現,第一個元素會和第八個元素的性質類似。他將這種周期性比作音樂的八度。在這種情況下,分開了一個八度的音符具有相似的音樂功能。[125][126] 他將所有已知的鹼金屬(鋰到銫)以及銅,銀和鉈(它們表示出鹼金屬的+1氧化態特徵)放入當時的元素周期表,一起成為一個族。他的周期表把氫歸類為鹵素。[120]
1869年後,德米特里·伊萬諾維奇·門捷列夫提出了他的元素周期表,將鋰放在鈉,鉀、銣、銫和鉈形成的族的頂部。[127] 兩年後,門捷列夫修改了元素周期表,將第1族中的氫置於鋰上方,並且將鉈移至硼族元素。 在此版本,銅、銀和金被放置了兩次,一次是11族元素的一部分,另一次是包含當今 8至11族元素的VIII族。[123][註解 15] 引入18列元素周期表後,第11族元素移動到了d區中的當前位置,而鹼金屬則留在了 IA組中。後來該組的名稱在1988年更改為第1族。[1] 鹼金屬這個名稱來自以下事實:當鹼金屬溶於水中時,它們所形成的氫氧化物均為強鹼。[3]
鋰
[編輯]
1800年,巴西化學家若澤·博尼法西奧·德·安德拉達在瑞典的於特島上發現了透鋰長石(LiAlSi4O10)[128][129][130]然而直到1817年,正在貝采里烏斯的實驗室工作的約翰·奧古斯特·阿韋德松才在分析透鋰長石時發現了一種新元素。[131][132]這種新元素形成的化合物和鈉、鉀的化合物相似;它的碳酸鹽和氫氧化物在水中的溶解度比鈉、鉀的對應化合物低。[133]貝采里烏斯將這一未知的材料命名為"lithion/lithina",這一名稱來自希臘語的λιθoς (lithos,意為「岩石」)。當時已知的另外兩種鹼金屬中,鈉因在動物血液中含量豐富而知名,鉀是在植物灰燼中發現的,因此lithos這一名稱體現了這種材料的獨特來源——礦石。貝采里烏斯將這一材料中的金屬命名為"lithium".[30][129][132]
鈉
[編輯]
人類從遠古時期開始就知道鈉的化合物了。食鹽(氯化鈉)是人類活動的重要物資。羅馬歷史學家老普林尼在他的《博物志》海水部分的一處旁註中提到:「在羅馬……士兵的薪餉曾經是食鹽,『薪水』(salarium)這個詞就來自『鹽』(sal)」。[134]受拉丁語影響的語言中的「薪水」一詞多是salarium的變形,比如英語中的salary,意大利語和西班牙語中的salario. 鈉的英文名Sodium來自蘇打(soda),而蘇打的名稱源自阿拉伯語的suda (صداع),意為「頭痛」。人們很早知道碳酸鈉有緩解頭痛的功效,蘇打因此得名。[135] 1807年,漢弗萊·戴維用之前分離鉀的類似方法電解熔融苛性鈉(氫氧化鈉),首次將鈉分離出來。[136]
鉀
[編輯]
從古代起人們就使用白草木灰了,然而它的使用史的大部分時間中,人們並不了解草木灰和鈉礦物鹽是完全不同的物質。1702年,格奧爾格·恩斯特·斯塔爾獲取了一些實驗證據,提出草木灰和礦物鹽有本質上的差異,[137]到了1736年 亨利·路易·杜默·德·孟梭證明了這一差異。[138]而那時人們仍然不知道鉀、鈉化合物的準確化學組成,也不知道鉀、鈉這兩種元素。因此,安托萬-洛朗·德·拉瓦錫並沒有將鹼金屬收錄進他1789年編制的元素表中。[139][140]純鉀的首次分離發生在1807年,由漢弗萊·戴維爵士在英國完成。戴維用當時新發明的伏打電堆電解熔融的苛性鉀,得到了這一元素。鉀是首個用電解法分離出的元素。[141]同年,戴維宣布用相似的方法從苛性鈉中分離出金屬鈉,從而說明了兩種元素及相應化合物的本質差異。[136]
銣
[編輯]
銣在1861年由羅伯特·本生和古斯塔夫·基爾霍夫在德國的海德堡發現。本生和基爾霍夫最早提出用光譜學方法尋找新的元素;他們用分光鏡分析鱗雲母礦石時發現了銣。銣的名稱rubidium來自拉丁語的rubidus,意為「深紅」或「鮮紅」,這一名稱來自銣的發射光譜中的亮紅色譜線。[142][143]銣的發現緊隨銫的發現,而銫同樣是由本生和基爾霍夫用分光鏡發現的。[144]
銫
[編輯]1860年,羅伯特·本生和古斯塔夫·基爾霍夫在德國巴德迪爾克海姆的礦泉水中發現了銫。銫的名稱caesium來自拉丁語的caesius,意為「天藍色」。這一名稱來自銫的發射光譜中的藍色譜線。[142][註解 16][146]銫在本生和基爾霍夫發明分光鏡僅一年後即被發現,是首個通過光譜學方法發現的元素。[144]
鈁
[編輯]1939年之前,第87號元素被錯誤或者不完整地發現了至少四次。[96][97][147][148] 1939年,居里研究所的瑪格麗特·佩里在巴黎提純一份錒-227樣品時真正發現了鈁。錒-227的衰變能為220 keV,然而佩里發現其中一些衰變粒子的能量低於80 keV。佩里認為這是一種之前未被分辨出的衰變產物,於是在提純過程中將其分離出來,但是後來在提純的後錒-227中又產生了這種物質。後續的大量實驗證明這種未知物質不可能是釷、鐳、鉛、鉍或者鉈,而顯現出可鹼金屬相近的化學性質(比如和銫鹽形成共沉澱)。佩里因而認為這種未知物是第87號元素,由錒-227的α衰變產生。[15]於是佩里試圖測定錒-227中α衰變與β衰變的比率。她的第一次實驗測定的α衰變比率為0.6%,後來她將這一數值修正為1%。[149]鈁是最後一種在自然界中發現的元素。[註解 17]
鈁下元素(Eka-鈁)
[編輯]鈁下方的元素(Eka-Francium, 類鈁)極有可能是第119號元素Uue;[18]:1729–1730然而相對論效應使得這一結論存在一些不確定性。[17]合成Uue的首次嘗試發生在1985年:科學家在美國加州伯克利的超重離子直線加速器(superHILAC)中用鈣-48轟擊鎄-254,結果未鑑別出任何原子。因而其收率限制為300nb。[16][150]
這一反應選擇了254Es做為原料。254Es的質量數大,半衰期相對較長(270天),可獲得性高(數毫克),因此常被用來合成超重元素。[152]然而這一反應近期極不可能生成Uue原子,因為很難生產足夠多的鎄-254來製作一個尺寸足夠大的靶,從而將實驗的靈敏度提升到所需級別。[16]鎄尚未在自然界中發現,只能在實驗室製取。不過,由於Uue是擴展元素周期表第8周期的第一個元素,未來極有可能用其它反應來製取它。德國達姆施塔特的GSI亥姆霍茲重離子研究中心正在嘗試用鈦核轟擊錇製取Uue.[153]目前還沒有發現位於第8周期的元素;而且由於液滴不穩定性,或許只有原子序數較低的第8周期元素(原子序數低於128)在物理上可能存在。[102][154]比Uue更重的鹼金屬原子序數太高,因此尚未有合成嘗試。[18]:1737–1739
存在範圍
[編輯]太陽系
[編輯]
奧多-哈爾金斯規則說明:除氫以外,質子數為偶數的元素比質子數為奇數的元素更為常見——後者擁有未成對的質子,趨向於捕獲另一個質子,原子序數因此增加。而偶數原子數的元素中的質子均為成對質子,自旋彼此抵消,使得原子更加穩定。[156][157][158]所有的鹼金屬的原子序數均為奇數,它們在太陽系中的豐度低於鄰近的兩族元素(稀有氣體和鹼土金屬)。銣之後的鹼金屬只能在超新星中生成,而不能由恆星核合成獲得,所以較重的鹼金屬比輕的鹼金屬稀有。鋰的豐度低於鈉、鉀,因為它在太初核合成和恆星中都極少生成——大爆炸只能生成痕量的鋰、鈹和硼,因為這些元素缺少穩定的5核子或8核子核素;而恆星核合成反應會通過3氦過程生成碳來通過這一瓶頸。[155]
地球
[編輯]
地球是由形成太陽的物質雲構成的,但是在太陽系的形成和演化過程中,行星獲得了不同的組成。此外,地球的自然史導致地球某些部分擁有不同的元素分布。地球質量約為5.98×1024 kg. 其中主要的成分是鐵(32.1%,質量分數,下同), 氧 (30.1%), 硅 (15.1%), 鎂 (13.9%), 硫 (2.9%), 鎳 (1.8%), 鈣 (1.5%)以及鋁 (1.4%);另外的1.2%為剩下的所有元素。由於質量層化,地球的核心區可能主要由鐵構成(88.8%),此外可能還有鎳(5.8%)、硫(4.5%),以及剩餘0.9%的其它元素。[159]
由於反應活性很高的緣故,鹼金屬在自然界不以單質形式存在。它們屬於親石元素,極易和氧結合,因而和二氧化硅緊密關聯,形成不會沉入地球核心的低密度礦物,因而停留在地球表面附近。鉀、銣、銫屬於地球化學中的不相容成分,因為它們的離子半徑大,不能進入礦物中的陽離子聚集區域。[160]
鈉和鉀在土壤中十分豐富。[14][161] 鈉在地殼中的質量分數約為2.6%,是地殼中豐度排在第六的元素;[162]鉀的質量分數約為1.5%,排在第七。[162]許多礦物中都含有鈉,其中最常見的是大量溶解在海水中食鹽(氯化鈉)。很多固態礦物中也含有鈉,比如岩鹽、角閃石、冰晶石、鈉硝石、沸石等。[162]
鋰的反應活性相對較低,因而可以在海水中大量發現。據估計鋰在海水中的質量分數約為0.14~0.25ppm[163][164] ,若以體積莫爾濃度表示就是25μM.[165]
銣的豐度和鋅大抵相同,比銅要高,可在白榴石、銫榴石、光鹵石、鐵鋰雲母和透鋰長石中找到。[166]銫的豐度低於銣,但比很多為人們所熟知的元素(比如鎘、錫、銻、鎢)更高。[20]
鈁-223是鈁的唯一一種天然存在的同位素。[77][78]它是錒-227的α衰變產物,在鈾和釷的礦物中極少量存在。[167] 在鈾礦石中,大概有1018 個鈾原子才會出現一個鈁原子。[168][169] 鈁的半衰期極短,為22分鐘;因此據估計地殼中最多只會有30 g的鈁。[170][171]
製備與分離
[編輯]製取純的鹼金屬較為困難。鹼金屬的反應活性很高,這導致它們極易和常見的物質(例如水、空氣)反應,且無法用其他元素置換製備。因此,鹼金屬只能用電解一類的高能方法分離。[3][45]鋰和鈉通常用電解熔融氯化物的方法獲得,為了降低熔點,通常會在混合物中加氯化鈣。其它幾種較重的鹼金屬一般用還原劑(通常是鎂或者鈣)還原的方法製備。用還原反應可獲得液態或氣態的鹼金屬,產物經分餾可獲得純化的鹼金屬。[45]
鋰鹽必須從礦物泉水中、 滷水池或者滷水礦產生的滷水中提取。電解熔融的氯化鋰和氯化鉀混合物,便可以得到金屬鋰。[172]
鉀存在於多種礦物中,例如鉀石鹽(氯化鉀)等。[3]有時會用分解氯化鉀來製取金屬鉀,但鉀更常見的製備方法是電解氫氧化鉀,[173] 和19世紀末20世紀初製取鈉的方法類似。[174]氫氧化鉀礦物廣泛存在於加拿大、俄羅斯、白俄羅斯、德國、以色列、美國和約旦等地。含鉀礦物也可以從海水中提取。 鈉主要存在於海水和乾涸的海床中。[3]現在的製備方法是用唐士電解池電解,過程中會加入一些鈣、鍶、鋇鹽,以將氯化鈉的熔點降至700 °C以下。[175][176] 超純鈉可通過疊氮化鈉分解製備。[177]

在20世紀50年代到60年代的數年間,銣主要從鹼金屬混合碳酸鹽(英語:Alkarb)中提取。鹼金屬混合碳酸鹽是鉀生產過程中的一種副產物,包含21%的銣,剩餘部分是鉀和少量的銫。[178]如今通常用分級結晶法將銣和鉀、銫分開:將一種含銣和銫的礬(Cs,Rb)Al(SO4)2•12H2O經30步反應處理,可得到純淨的銣礬,從而進一步製取銣。[179][180]銣的生產方法有限,礦物豐度低,導致含銣化合物的產量只有每年2到4噸。[179] 然而銫並不是用這一反應分離製取的。銫主要從 銫榴石礦中提取,有三種常見的提取方法:酸消化、鹼分解以及直接還原。 [179][181]
鈁-223是唯一一種存在於自然界的鈁的同位素,[77][78]由錒-227的α衰變生成。據計算地殼中最多只會有30g的鈁[170],極為稀少。因此鈁主要通過核反應製備:197Au + 18O → 210Fr + 5 n,產物可以是鈁-209、鈁-210、鈁-211.[182]至今最大的一份鈁樣品含有300,000個鈁中性原子,[183]合成方法正是上述的核反應。 [183]
所有的鹼金屬都可以從硅酸鹽中用同樣的步驟獲得:首先用硫酸將鋁和所需的鹼金屬從礦石中溶出;溶液中加鹼將鋁離子以氫氧化鋁的形式沉澱出來,將鋁和鹼金屬分離。將剩餘的鹼金屬離子以碳酸鹽的形式選擇性沉澱出來,再用鹽酸溶解沉澱;濃縮所得溶液可得鹼金屬氯化物,將其電解即得鹼金屬。[45]
應用
[編輯]除鈁以外的鹼金屬均有很多種商業應用。鋰常被用做電池材料,氧化鋰可用來處理二氧化硅。鋰還可用來製作潤滑脂,處理空氣,對鋁的生產也有輔助作用[184]
純鈉可用於製作鈉燈,一種十分高效的光源;[22][23] 還可以用來拋光其它金屬的表面。[185][186]鈉化合物也有十分廣泛的用途,比如常見的食鹽就是氯化鈉;常用的肥皂是鈉或鉀的脂肪酸鹽。[187]
鉀是植物重要的營養元素,因此鉀的化合物常被用做化肥。[11]:73[188] 氫氧化鉀是一種強鹼,被用來控制各種體系的pH值。[189][190]
銣和銫常用於製作原子鐘。[19]銫原子鐘極其精確,如果一台銫原子鐘從8千萬年前的恐龍時代開始運行到今天,它的偏差不會超過4秒。[20]因此銫原子被用來定義「秒」單位。[21]銫常添加在石油工業所用的鑽井液中。[20][191]銣離子常用於製作紫色焰火。[192]
鈁沒有商業應用,[168][169][193]但鈁的原子結構相對簡單,因而在光譜學實驗中有廣泛應用。鈁的光譜學研究可以提供和能級、次原子粒子間的耦合常數相關的信息。[194]科學家研究激光束縛的鈁-210粒子發射的光,獲得了原子能級躍遷的準確數據,和量子論的預測相近。[195]
生物學作用及防護
[編輯]
通常在生物系統中只有痕量的鋰。鋰沒有已知的生物學作用,但是攝入鋰確實對身體有影響。[26] 精神病學中常用每天0.5 到 2 克的碳酸鋰,做為精神穩定劑治療雙極性情感疾患(躁鬱症),不過這種治療有一些副作用。[26]攝入過量的鋰會導致呆滯、言語不清、嘔吐等症狀,[26]乃至引發中樞神經中毒。[26]而用於治療躁鬱症的鋰用量僅僅略低於中毒劑量。[26][196] 鋰在人體中的天然生物學功能尚待研究;不過從生物化學特性、被人體處理的方式以及在老鼠、山羊身上的實驗結果來看,鋰是一種必要的稀有元素。[197][198]
鈉和鉀存在於一切已知的生物學系統中,通常作為細胞內外的電解質存在。[24][25] 鈉是控制血容量、血壓、滲透平衡和pH的必須營養素,人類對鈉的最小生理需求量為每天500毫克。[199] 氯化鈉——也就是俗稱的食鹽——是食物中主要的鈉源,用作調味品和食物處理(比如泡菜、臘肉)。氯化鈉主要來自處理過的食物。[200]鈉的DRI為每天1.5g,[201]然而根據2010年的調查,中國城市居民平均每日攝入的鈉相當於13.5g食鹽(5.31 g鈉)。[202]而每天攝入的鈉超過2.3克就會提高患高血壓的幾率。[203] 由鈉攝入過量導致的高血壓每年在全球導致了760萬例早逝。[204]
鉀是細胞內的主要陽離子,[24]而鈉是動物細胞外的主要陽離子。[24][25] 這兩種帶電粒子的濃度差異導致了細胞內外的電勢差,也就是膜電勢。細胞膜兩側的鈉鉀濃度平衡由細胞膜內的離子泵維持。[205]由鈉鉀濃度差產生的膜電勢讓細胞可以產生動作電位——一次急劇的細胞放電過程。細胞放電的能力是很多種身體機能(神經傳導、肌肉收縮、心臟功能等)的基礎。[205]

銣沒有已知的生物學作用,不過或許可能促進代謝。[27][206][207]由於鉀、銣、銫的化學性質相似,銣和銫有可能取代身體中的鉀離子引發低鉀血症,因此它們具有輕微的毒性。[27][207][28]絕大多數人極少攝入銫。攝入大量的銫會導致劇烈過敏和痙攣,但通常不可能通過自然途徑攝入這種劑量的銫,因此銫不屬於主要化學污染物。[208] 氯化銫在小鼠身上的LD50為2.3 g 每千克體重,和氯化鉀、氯化鈉的LD50相仿。[209]一些癌症替代療法用氯化銫作為治療藥物,[210]這種未經科學證實的療法可能和至少50名患者的死亡有聯繫。[211] 銫的放射性同位素需要格外小心處理,若對銫-137γ放射源處理不當,可能導致這种放射性核素泄露,引發輻射傷害。最著名的例子是1987年的戈亞尼亞事故:巴西戈亞尼亞的一處廢品堆積場中掃出了一台放療儀,這台放療儀屬於一家廢棄的診所,未經妥善處理。放療儀中發光的銫鹽被賣給了好奇又缺乏教育的買家。事件造成了4人死亡及大量的輻射傷害。銫-137是切爾諾貝利核事故釋放的對健康威脅最大的四种放射性同位素之一(另外三種為銫-134、碘-131和鍶-90)。[100]
鈁沒有生物學功能。[212]其強放射性可能引發輻射中毒,因此鈁極可能有毒。 [29] 然而至今為止最大的鈁樣品只有約300,000個中性鈁原子,[183]因此絕大多數人不可能攝入鈁。
參看
[編輯]註解
[編輯]- ^ 為了簡潔,用稀有氣體標記法表示核外電子排布:先寫出之前一個稀有氣體元素的符號,再繼續寫下除去該稀有氣體元素之外的電子排布。
- ^ 括號中給出的數據為原子量的不確定度。這一數字表示的是該數值有效數字末位的變化範圍。比如,1.00794(7) 表示 1.00794±0.00007,而 1.00794(72) 表示 1.00794±0.00072.[76]
- ^ 列出的這一數值為便於商業和貿易使用的通用值。實際值範圍在6.938和6.997之間,具體數值取決於樣品的同位素豐度。[78]
- ^ 這一元素沒有穩定核素, 方括號中標出的是該元素壽命最長的同位素的原子量。[77][78]
- ^ 單位為 皮米 (pm)。單元格背景從紅色到黃色,表示的半徑逐漸增高。 原子半徑和離子半徑的顏色標度一致。
- ^ 單元格背景從紅色到黃色,表示的電離能逐漸降低。
- ^ 另有來源提供數據為 4.0712 ± 0.00004 eV (392.811(4) kJ/mol).[39]
- ^ 單元格背景從紅色到黃色,表示的電負性降低,。
- ^ 鮑林推斷鈁的電負性在鮑林標度上為0.7,和銫相同[85] 此後銫的電負性數值被修正為0.79,然而由於缺乏相應的實驗數據,無法對鈁的電負性數值進行修正。[86] 由於相對論效應的作用,鈁的電離能為392.811(4) kJ/mol ,比銫(375.7041(2) kJ/mol )略高,[39] 這說明銫的電負性應當比鈁更低。
- ^ 單元格背景從紅色到黃色,表示的熔點/沸點逐漸降低。熔點和沸點的顏色標度不同。
- ^ 11.0 11.1 曾有計算顯示鈁的熔點為 27 °C (80 °F, 300 K).[88] 然而,因為鈁的稀缺和強放射性,它的熔點仍未確定。因此,估計的沸點數值也是不確定的,一種說法為677 °C (1250 °F, 950 K). 由於放射性元素會產生熱量,如果有足夠多的鈁,它在標準狀況下幾乎一定是液體。
- ^ 單元格背景從紅色到黃色,表示的密度逐漸升高。
- ^ 那時還沒有發現鈁。
- ^ 研究顯示第七個鹼金屬Uue可能擁有+3氧化態,但它尚未被發現。[18]:1729–1730
- ^ 在1869年,門捷列夫的元素周期表中,銅和銀與氫和汞排在同一族中,而金暫定在鈾和當時未發現的鋁下元素之下,屬於硼族元素。
- ^ 本生此處引用了奧盧斯•格利烏斯在《阿提卡之夜》第二卷第26章中記載的說法,文中提到尼基狄烏斯•費古盧斯用caesia形容天藍色:Nostris autem veteribus "caesia" dicta est, quae a Graecis glaukopis, ut Nigidius ait, "de colore caeli quasi caelia".(翻譯:「……此外,我們的早期作家用caesia一詞作為希臘語γλαυκῶπις的同義詞,就像尼基狄烏斯曾說:『來自天空的顏色,就像它原本就是caelia一樣』」)[145]
- ^ 一些元素——如鍀和鈈——起初由人工製得,後來在自然界中發現了。
- ^ 星號表示激發態。
參考文獻
[編輯]- ^ 1.0 1.1 Fluck, E. New Notations in the Periodic Table (PDF). Pure Appl. Chem. (IUPAC). 1988, 60 (3): 431–436 [24 March 2012]. doi:10.1351/pac198860030431. (原始內容存檔 (PDF)於2012-03-25).
- ^ 2.0 2.1 2.2 國際純粹與應用化學聯合會 (2005). 無機化學命名法 (IUPAC 2005年推薦). Cambridge (UK): RSC–IUPAC. ISBN 0-85404-438-8. pp. 51. 電子版。.
- ^ 3.00 3.01 3.02 3.03 3.04 3.05 3.06 3.07 3.08 3.09 3.10 3.11 3.12 3.13 3.14 3.15 3.16 3.17 3.18 3.19 3.20 3.21 3.22 3.23 3.24 3.25 3.26 3.27 3.28 3.29 3.30 3.31 3.32 3.33 3.34 Royal Society of Chemistry. Visual Elements: Group 1 – The Alkali Metals. Visual Elements. Royal Society of Chemistry. [2012-01-13]. (原始內容存檔於2012-08-05).
- ^ Periodic Table: Atomic Properties of the Elements (PDF). nist.gov. National Institute of Standards and Technology. September 2010 [2012-02-17]. (原始內容存檔 (PDF)於2012-08-09).
- ^ 5.0 5.1 5.2 5.3 5.4 5.5 5.6 Lide, D. R. (編). CRC Handbook of Chemistry and Physics 84th. Boca Raton, FL: CRC Press. 2003.
- ^ Leach, Mark R. The Internet Database of Periodic Tables. meta-synthesis.com. 1999–2012 [2012-05-20]. (原始內容存檔於2014-08-10).
- ^ IUPAC Periodic Table of the Elements (PDF). iupac.org. International Union of Pure and Applied Chemistry. 2011-01-21 [2012-02-22]. (原始內容存檔 (PDF)於2012-02-27).
- ^ 8.0 8.1 8.2 8.3 8.4 8.5 8.6 8.7 Vinson, Greg. Hydrogen is a Halogen. HydrogenTwo.com. 2008 [2012-01-14]. (原始內容存檔於2012-01-10).
- ^ 9.0 9.1 9.2 International Union of Pure and Applied Chemistry > Periodic Table of the Elements. IUPAC. [2011-05-01]. (原始內容存檔於2018-09-27).
- ^ Folden, Cody. The Heaviest Elements in the Universe (PDF). Saturday Morning Physics at Texas A&M. 2009-01-31 [2012-03-09]. (原始內容 (PDF)存檔於2014-08-10).
- ^ 11.00 11.01 11.02 11.03 11.04 11.05 11.06 11.07 11.08 11.09 11.10 11.11 11.12 11.13 11.14 11.15 11.16 11.17 11.18 11.19 11.20 11.21 11.22 11.23 11.24 11.25 11.26 11.27 11.28 11.29 11.30 11.31 Greenwood, Norman Neill; Earnshaw, Alan. Chemistry of the elements. 2016. ISBN 978-0-7506-3365-9. OCLC 1040112384 (英語).
- ^ 12.0 12.1 12.2 The OpenLearn team. Alkali metals. OpenLearn. The Open University. 2012 [2012-07-09]. (原始內容存檔於2014-11-29).
- ^ 13.0 13.1 13.2 Gray, Theodore. Alkali Metal Bangs. Theodore Gray. [2012-05-13]. (原始內容存檔於2014-10-31).
- ^ 14.0 14.1 Abundance in Earth's Crust. WebElements.com. [2007-04-14]. (原始內容存檔於2007-03-09).
- ^ 15.0 15.1 Adloff, Jean-Pierre; Kaufman, George B. (2005-09-25).Francium (Atomic Number 87), the Last Discovered Natural Element (頁面存檔備份,存於網際網路檔案館). The Chemical Educator 10 (5). Retrieved on 26 March 2007.
- ^ 16.0 16.1 16.2 Lougheed, R.W.; Landrum, J.H.; Hulet, E.K.; Wild, J.F.; Dougan, R.J.; Dougan, A.D.; Gäggeler, H.; Schädel, M; Moody, K.J.; Gregorich, K.E.; Seaborg, G.T. Search for superheavy elements using 48Ca + 254Esg reaction. Physical Review C. 1985, 32 (5): 1760–1763. Bibcode:1985PhRvC..32.1760L. doi:10.1103/PhysRevC.32.1760.
- ^ 17.0 17.1 17.2 Gäggeler, Heinz W. Gas Phase Chemistry of Superheavy Elements (PDF). Lecture Course Texas A&M. 5–7 November 2007 [2012-02-26]. (原始內容 (PDF)存檔於2012-02-20).
- ^ 18.00 18.01 18.02 18.03 18.04 18.05 18.06 18.07 18.08 18.09 18.10 18.11 18.12 18.13 18.14 18.15 18.16 18.17 18.18 18.19 18.20 18.21 Hoffman, Darleane C.; Lee, Diana M.; Pershina, Valeria. Transactinides and the future elements. Morss; Edelstein, Norman M.; Fuger, Jean (編). The Chemistry of the Actinide and Transactinide Elements 3rd. Dordrecht, The Netherlands: Springer Science+Business Media. 2006. ISBN 1-4020-3555-1.
- ^ 19.0 19.1 Cesium Atoms at Work. Time Service Department—U.S. Naval Observatory—Department of the Navy. [2009-12-20]. (原始內容存檔於2015-02-23).
- ^ 20.0 20.1 20.2 20.3 20.4 Butterman, William C.; Brooks, William E.; Reese, Jr., Robert G. Mineral Commodity Profile: Cesium (PDF). United States Geological Survey. 2004 [2009-12-27]. (原始內容存檔 (PDF)於2009-11-22).
- ^ 21.0 21.1 The NIST reference on Constants, Units, and Uncertainty. National Institute of Standards and Technology. [2013-10-19]. (原始內容存檔於2018-07-26).
- ^ 22.0 22.1 Lindsey, Jack L. Applied illumination engineering. 1997: 112. ISBN 978-0-88173-212-2.
- ^ 23.0 23.1 Kane, Raymond; Sell, Heinz. Revolution in lamps: A chronicle of 50 years of progress. 2001: 241. ISBN 978-0-88173-351-8.
- ^ 24.0 24.1 24.2 24.3 Winter, Mark. WebElements Periodic Table of the Elements | Potassium | biological information. WebElements. [2012-01-13]. (原始內容存檔於2012-01-21).
- ^ 25.0 25.1 25.2 Winter, Mark. WebElements Periodic Table of the Elements | Sodium | biological information. WebElements. [2012-01-13]. (原始內容存檔於2012-01-20).
- ^ 26.0 26.1 26.2 26.3 26.4 26.5 Winter, Mark. WebElements Periodic Table of the Elements | Lithium | biological information. Webelements. [2011-02-15]. (原始內容存檔於2011-03-07).
- ^ 27.0 27.1 27.2 Winter, Mark. WebElements Periodic Table of the Elements| Rubidium | biological information. Webelements. [2011-02-15]. (原始內容存檔於2011-06-28).
- ^ 28.0 28.1 Winter, Mark. WebElements Periodic Table of the Elements | Caesium | biological information. WebElements. [2012-01-13]. (原始內容存檔於2012-02-11).
- ^ 29.0 29.1 Francium – Element information, properties and uses | Periodic Table. Visual Elements Periodic Table. Royal Society of Chemistry. 2012 [2012-06-27]. (原始內容存檔於2012-06-02).
- ^ 30.0 30.1 Krebs, Robert E. The History and Use of Our Earth's Chemical Elements: A Reference Guide. Westport, Conn.: Greenwood Press. 2006. ISBN 0-313-33438-2.
- ^ 31.0 31.1 31.2 M. Y. Redko, M. Vlassa, J. E. Jackson, A. W. Misiolek, R. H. Huang RH, J. L. Dye. "Inverse sodium hydride": a crystalline salt that contains H+ and Na−. J. Am. Chem. Soc. 2002, 124 (21): 5928–5929. doi:10.1021/ja025655.
- ^ 32.0 32.1 Agnieszka Sawicka, Piotr Skurski, and Jack Simons. Inverse Sodium Hydride: A Theoretical Study (PDF). J. Am. Chem. Soc. 2003, 125: 3954–3958 [2013-09-17]. (原始內容存檔 (PDF)於2013-02-09).
- ^ J. L. Dye, J. M. Ceraso, Mei Lok Tak, B. L. Barnett, F. J. Tehan. Crystalline salt of the sodium anion (Na−). J. Am. Chem. Soc. 1974, 96 (2): 608–609. doi:10.1021/ja00809a060.
- ^ F. J. Tehan, B. L. Barnett, J. L. Dye. Alkali anions. Preparation and crystal structure of a compound which contains the cryptated sodium cation and the sodium anion. J. Am. Chem. Soc. 1974, 96 (23): 7203–7208. doi:10.1021/ja00830a005.
- ^ J. L. Dye. Compounds of Alkali Metal Anions. Angew. Chem. Int. Ed. Engl. 1979, 18 (8): 587–598. doi:10.1002/anie.197905871.
- ^ M. Y. Redko, R. H. Huang, J. E. Jackson, J. F. Harrison, J. L. Dye. Barium azacryptand sodide, the first alkalide with an alkaline Earth cation, also contains a novel dimer, (Na2)2−. J. Am. Chem. Soc. 2003, 125 (8): 2259–2263. PMID 12590555. doi:10.1021/ja027241m.
- ^ 37.0 37.1 37.2 37.3 37.4 Clark, Jim. Reaction of the Group 1 Elements with Oxygen and Chlorine. chemguide. 2005 [2012-06-27]. (原始內容存檔於2012-03-16).
- ^ Shriver, Duward; Atkins, Peter. Inorganic Chemistry. W. H. Freeman. 2006: 259 [2012-11-10]. ISBN 978-0716748786. (原始內容存檔於2013-02-09).
- ^ 39.0 39.1 39.2 Andreev, S.V.; Letokhov, V.S.; Mishin, V.I.,. Laser resonance photoionization spectroscopy of Rydberg levels in Fr. Phys. Rev. Lett.. 1987, 59: 1274–76. Bibcode:1987PhRvL..59.1274A. PMID 10035190. doi:10.1103/PhysRevLett.59.1274.
- ^ Landau, A.; Eliav, E.; Ishikawa, Y.; Kaldor, U. Benchmark calculations of electron affinities of the alkali atoms sodium to eka-francium (element 119). J. Chem. Phys. 2001, 115 (6): 2389 [2021-03-21]. Bibcode:2001JChPh.115.2389L. doi:10.1063/1.1386413. (原始內容存檔於2020-07-31).
- ^ Jones, Cameron; Mountford, Philip; Stasch, Andreas; Blake, Matthew P. s-block Metal-Metal Bonds. Liddle, Stephen T. (編). Molecular Metal-Metal Bonds: Compounds, Synthesis, Properties. John Wiley and Sons. 22 June 2015: 23–24. ISBN 978-3-527-33541-1.
- ^ 42.0 42.1 42.2 Thayer, John S. Chemistry of heavier main group elements. 2010: 81, 84. doi:10.1007/9781402099755_2.
- ^ 43.0 43.1 Clark, Jim. Reaction of the Group 1 Elements with Water. chemguide. 2005 [2012-06-18]. (原始內容存檔於2012-05-31).
- ^ 疯狂化学. 北京: 人民郵電出版社. 2015年: 第二章 化學之烈 35頁. ISBN 978-7-115-39166-7.
- ^ 45.00 45.01 45.02 45.03 45.04 45.05 45.06 45.07 45.08 45.09 45.10 45.11 45.12 45.13 45.14 Averill, Bruce A.; Eldredge, Patricia. 21.3: The Alkali Metals. Chemistry: Principles, Patterns, and Applications with Student Access Kit for Mastering General Chemistry 1st. Prentice Hall. 2007 [24 June 2013]. ISBN 978-0-8053-3799-0. (原始內容存檔於2013-05-26).
- ^ Catherine E. Housecroft; Alan G. Sharpe. Chapter 14: The group 14 elements. Inorganic Chemistry, 3rd Edition. Pearson. 2008: 386. ISBN 978-0-13-175553-6.
- ^ NIST Ionizing Radiation Division 2001 - Technical Highlights. [2013-09-17]. (原始內容存檔於2014-11-29).
- ^ N. Emery; et al. Review: Synthesis and superconducting properties of CaC6. Sci. Technol. Adv. Mater. (free download pdf). 2008, 9 (4): 044102. Bibcode:2008STAdM...9d4102E. doi:10.1088/1468-6996/9/4/044102.
- ^ S.M. Kauzlarich,(1994), Zintl Compounds, Encyclopedia of Inorganic Chemistry, John Wiley & sons, ISBN 978-0-471-93620-6
- ^ Tetrapotassium nonastannide, K4Sn9,C. Hoch, M. Wendorff and C. Röhr, Acta Cryst. (2002). C58, i45-i46 doi:10.1107/S0108270102002032
- ^ Duncan H. Gregory, Paul M. O'Meara, Alexandra G. Gordon, Jason P. Hodges, Simine Short, and James D. Jorgensen. Structure of Lithium Nitride and Transition-Metal-Doped Derivatives, Li3−x−yMxN (M = Ni, Cu): A Powder Neutron Diffraction Study. Chem. Mater. 2002, 14 (5): 2063–2070. doi:10.1021/cm010718t.
- ^ Fischer, D., Jansen, M. Synthesis and structure of Na3N. Angew Chem. 2002, 41 (10): 1755. doi:10.1002/1521-3773(20020517)41:10<1755::AID-ANIE1755>3.0.CO;2-C.
- ^ Fischer, D.; Cancarevic, Z.; Schön, J. C.; Jansen, M. Z. Synthesis and structure of K3N. Z. anorg allgem Chemie. 2004, 630 (1): 156. doi:10.1002/zaac.200300280.. 'Elusive Binary Compound Prepared' (頁面存檔備份,存於網際網路檔案館) Chemical & Engineering News 80 No. 20 (20 May 2002)
- ^ H.G. Von Schnering, W. Hönle Phosphides - Solid-state Chemistry Encyclopedia of Inorganic Chemistry Ed. R. Bruce King (1994) John Wiley & Sons ISBN 978-0-471-93620-6
- ^ Kahlenberg, Louis. Outlines of Chemistry – A Textbook for College Students. READ BOOKS. 2008: 324–325. ISBN 1-4097-6995-X.
- ^ Welcome to Arthur Mar's Research Group. University of Alberta. University of Alberta. 1999–2013 [2013-06-24]. (原始內容存檔於2012-12-04).
- ^ 57.0 57.1 57.2 57.3 King, R. Bruce. Inorganic Chemistry of Main Group Elements. Wiley-VCH. 1995. ISBN 978-0-471-18602-1.
- ^ Welcome to Arthur Mar's Research Group. University of Alberta. University of Alberta. 1999–2013 [24 June 2013]. (原始內容存檔於2012-12-04).
- ^ Lindsay, D. M.; Garland, D. A. ESR spectra of matrix-isolated lithium superoxide. The Journal of Physical Chemistry. 1987, 91 (24): 6158–61. doi:10.1021/j100308a020.
- ^ Vol'nov, I. I.; Matveev, V. V. Synthesis of cesium ozonide through cesium superoxide. Bulletin of the Academy of Sciences, USSR Division of Chemical Science. 1963, 12 (6): 1040–1043. doi:10.1007/BF00845494.
- ^ Tokareva, S. A. Alkali and Alkaline Earth Metal Ozonides. Russian Chemical Reviews. 1971, 40 (2): 165–174. Bibcode:1971RuCRv..40..165T. doi:10.1070/RC1971v040n02ABEH001903.
- ^ Tsai, Khi-Ruey; Harris, P. M.; Lassettre, E. N. The Crystal Structure of Tricesium Monoxide. Journal of Physical Chemistry. 1956, 60 (3): 345–347. doi:10.1021/j150537a023.
- ^ Okamoto, H. Cs-O (Cesium-Oxygen). Journal of Phase Equilibria and Diffusion. 2009, 31: 86. doi:10.1007/s11669-009-9636-5.
- ^ Band, A.; Albu-Yaron, A.; Livneh, T.; Cohen, H.; Feldman, Y.; Shimon, L.; Popovitz-Biro, R.; Lyahovitskaya, V.; Tenne, R. Characterization of Oxides of Cesium. The Journal of Physical Chemistry B. 2004, 108 (33): 12360–12367. doi:10.1021/jp036432o.
- ^ Brauer, G. Untersuchungen ber das System Cäsium-Sauerstoff. Zeitschrift für anorganische Chemie. 1947, 255: 101. doi:10.1002/zaac.19472550110.
- ^ Butterman, William C.; Brooks, William E.; Reese, Jr., Robert G. Mineral Commodity Profile: Cesium (PDF). United States Geological Survey. 2004 [2009-12-27]. (原始內容存檔 (PDF)於2007-02-07).
- ^ House, James E. Inorganic chemistry. Academic Press. 2008: 524. ISBN 0-12-356786-6.
- ^ Moyer, Harvey V., Chemical Properties of Polonium, Moyer, Harvey V. (編), Polonium, Oak Ridge, Tenn.: United States Atomic Energy Commission: 33–96, 1956 [2013-09-17], doi:10.2172/4367751, TID-5221, (原始內容存檔於2019-07-01)
- ^ Bagnall, K. W., The Chemistry of Polonium, Adv. Inorg. Chem. Radiochem., 1962, 4: 197–229, ISBN 978-0-12-023604-6
- ^ Alberto, R.; Ortner, K.; Wheatley, N.; Schibli, R.; Schubiger, A. P. Synthesis and properties of boranocarbonate: a convenient in situ CO source for the aqueous preparation of [99mTc(OH2)3(CO)3]+. J. Am. Chem. Soc. 2001, 121 (13): 3135–3136. doi:10.1021/ja003932b.
- ^ Cotton, F.A; G. Wilkinson. Advanced Inorganic Chemistry. John Wiley and Sons Inc. 1972. ISBN 0-471-17560-9.
- ^ Brown, T. L.; Rogers, M. T. The Preparation and Properties of Crystalline Lithium Alkyls. Journal of the American Chemical Society. 1957, 79 (8): 1859–1861. doi:10.1021/ja01565a024.
- ^ William Clegg, Ben Conway, Alan R. Kennedy, Jan Klett, Robert E. Mulvey, Luca Russo "Synthesis and Structures of [(Trimethylsilyl)methyl]sodium and -potassium with Bi- and Tridentate N-Donor Ligands" Eur. J. Inorg. Chem. 2011, 721–726. doi:10.1002/ejic.201000983
- ^ Manfred Schlosser. Superbases for organic synthesis. Pure and Appl. Chem. 1988, 60 (11): 1627–1634. doi:10.1351/pac198860111627.
- ^ Gray, Theodore. Facts, pictures, stories about the element Cesium in the Periodic Table. The Wooden Periodic Table Table. [2012-01-13]. (原始內容存檔於2014-01-28).
- ^ Standard Uncertainty and Relative Standard Uncertainty. CODATA reference. National Institute of Standards and Technology. [2011-09-26]. (原始內容存檔於2011-10-16).
- ^ 77.0 77.1 77.2 77.3 Wieser, Michael E.; Berglund, Michael. Atomic weights of the elements 2007 (IUPAC Technical Report) (PDF). Pure Appl. Chem. (IUPAC). 2009, 81 (11): 2131–2156 [2012-02-07]. doi:10.1351/PAC-REP-09-08-03. (原始內容存檔 (PDF)於2012-11-02).
- ^ 78.0 78.1 78.2 78.3 78.4 Wieser, Michael E.; Coplen, Tyler B. Atomic weights of the elements 2009 (IUPAC Technical Report) (PDF). Pure Appl. Chem. (IUPAC). 2011, 83 (2): 359–396 [2012-02-11]. doi:10.1351/PAC-REP-10-09-14. (原始內容存檔 (PDF)於2012-02-11).
- ^ 79.0 79.1 79.2 79.3 79.4 Clark, Jim. Flame Tests. chemguide. 2005 [2012-01-29]. (原始內容存檔於2017-12-04).
- ^ 80.0 80.1 Klehr, Wolfram. Francium. apsidium.com. 2007-05-21 [2012-04-25]. (原始內容存檔於2008-05-09).
- ^ 81.00 81.01 81.02 81.03 81.04 81.05 81.06 81.07 81.08 81.09 81.10 81.11 81.12 81.13 81.14 Clark, Jim. Atomic and Physical Properties of the Group 1 Elements. chemguide. 2005 [2012-01-30]. (原始內容存檔於2014-10-09).
- ^ L. Brown, Theodore; H. Eugene LeMay, Jr.; Bruce E. Bursten; Julia R. Burdge. Chemistry: The Central Science 8th. US: Pearson Education. 2003 [2013-10-24]. ISBN 0-13-061142-5. (原始內容存檔於2015-05-02).
- ^ 83.0 83.1 J.E. Huheey, E.A. Keiter, and R.L. Keiter in Inorganic Chemistry : Principles of Structure and Reactivity, 4th edition, HarperCollins, New York, USA, 1993.
- ^ 84.0 84.1 A.M. James and M.P. Lord in Macmillan's Chemical and Physical Data, Macmillan, London, UK, 1992.
- ^ Pauling, Linus. The Nature of the Chemical Bond Third. Cornell University Press. 1960: 93. ISBN 978-0-8014-0333-0.
- ^ Allred, A. L. Electronegativity values from thermochemical data. J. Inorg. Nucl. Chem. 1961, 17 (3–4): 215–221. doi:10.1016/0022-1902(61)80142-5.
- ^ 國際純化學和應用化學聯合會,化學術語概略,第二版。(金皮書)(1997)。在線校正版: (2006–) "Electronegativity"。doi:10.1351/goldbook.E01990
- ^ Francium. Los Alamos National Laboratory. 2003-12-15 [2012-02-19]. (原始內容存檔於2016-11-28).
- ^ 89.0 89.1 Clark, Jim. Metallic Bonding. chemguide. 2000 [2012-03-23]. (原始內容存檔於2017-07-25).
- ^ 90.0 90.1 Various authors. Lide, David R. , 編. Handbook of Chemistry & Physics 88th. CRC. 2002 [2008-05-23]. ISBN 0-8493-0486-5. OCLC 179976746. (原始內容存檔於2018-04-30).
- ^ Universal Nuclide Chart. Nucleonica. Institute for Transuranium Elements. 2007–2012 [2011-04-17]. (原始內容存檔於2020-11-11).
- ^ 92.0 92.1 92.2 Sonzogni, Alejandro. Interactive Chart of Nuclides. National Nuclear Data Center: Brookhaven National Laboratory. [2012-10-04]. (原始內容存檔於2011-08-22).
- ^ Patton, I. Jocelyn; Waldbauer, L. J. The Radioactivity of the Alkali Metals. Chemical Reviews. 1926, 3: 81. doi:10.1021/cr60009a003.
- ^ McLennan, J. C.; Kennedy, W. T. On the radioactivity of potassium and other alkali metals. Philosophical Magazine. 6. 1908, 16 (93): 377–395. doi:10.1080/14786440908636519.
- ^ Potassium-40 (PDF). Human Health Fact Sheet. Argonne National Laboratory, Environmental Science Division. August 2005 [2012-02-07]. (原始內容 (PDF)存檔於2012-03-07).
- ^ 96.0 96.1 Fontani, Marco. The Twilight of the Naturally-Occurring Elements: Moldavium (Ml), Sequanium (Sq) and Dor (Do). International Conference on the History of Chemistry. Lisbon: 1–8. 2005-09-10 [2007-04-08]. (原始內容存檔於2006-02-24).
- ^ 97.0 97.1 Van der Krogt, Peter. Francium. Elementymology & Elements Multidict. 2006-01-10 [2007-04-08]. (原始內容存檔於2010-01-23).
- ^ National Institute of Standards and Technology. Radionuclide Half-Life Measurements. [2011-11-07]. (原始內容存檔於2016-08-12).
- ^ Radioisotope Brief: Cesium-137 (Cs-137). [2013-10-25]. (原始內容存檔於2016-03-29).
- ^ 100.0 100.1 The Radiological Accident in Goiânia. IAEA. 1988 [2013-09-18]. (原始內容存檔於2011-01-20).
- ^ 101.0 101.1 101.2 101.3 Pyykkö, Pekka. A suggested periodic table up to Z ≤ 172, based on Dirac–Fock calculations on atoms and ions. Physical Chemistry Chemical Physics. 2011, 13 (1): 161–8. Bibcode:2011PCCP...13..161P. PMID 20967377. doi:10.1039/c0cp01575j.
- ^ 102.0 102.1 102.2 Seaborg, G. T. transuranium element (chemical element). Encyclopædia Britannica. ca. 2006 [2010-03-16]. (原始內容存檔於2010-11-30).
- ^ 103.0 103.1 103.2 Dietzel, P. D.; Kremer, R. K.; Jansen, M. Superoxide compounds of the large pseudo-alkali-metal ions tetramethylammonium, -phosphonium, and -arsonium.. Chemistry: An Asian Journal. 8 January 2007, 2 (1): 66–75. PMID 17441140. doi:10.1002/asia.200600306.
- ^ Emsley, J. The Elements. Oxford: Clarendon Press. 1989: 22–23.
- ^ Chemical Bonding, Mark J. Winter, Oxford University Press, 1994, ISBN 978-0-19-855694-7
- ^ 106.0 106.1 106.2 106.3 106.4 Cronyn, Marshall W. The Proper Place for Hydrogen in the Periodic Table (PDF). Journal of Chemical Education. 2003年8月, 80 (8): 947–951 [2013-09-19]. Bibcode:2003JChEd..80..947C. doi:10.1021/ed080p947. (原始內容存檔 (PDF)於2013-06-02).
- ^ Wigner, E.; Huntington, H.B. On the possibility of a metallic modification of hydrogen. Journal of Chemical Physics. 1935, 3 (12): 764. Bibcode:1935JChPh...3..764W. doi:10.1063/1.1749590.
- ^ Nellis, W. J.; Weir, S. T.; Mitchell, A. C. Metallization of fluid hydrogen at 140 GPa (1.4 Mbar) by shock compression. Shock Waves. 1999, 9 (5): 301–305 [2020-09-09]. Bibcode:1999ShWav...9..301N. doi:10.1007/s001930050189. (原始內容存檔於2020-08-18).
- ^ Cousins, David M.; Davidson, Matthew G.; García-Vivó, Daniel. Unprecedented participation of a four-coordinate hydrogen atom in the cubane core of lithium and sodium phenolates. Chem. Commun. 2013, 49 (100): 11809–11811 [7 August 2014]. PMID 24217230. doi:10.1039/c3cc47393g
 . (原始內容存檔於2020-07-29).
. (原始內容存檔於2020-07-29).
- ^ Mark R. Leach. 2002 Inorganic Chemist's Periodic Table. [2012-10-16]. (原始內容存檔於2013-03-09).
- ^ Holleman, Arnold Frederik; Wiberg, Egon, Wiberg, Nils , 編, Inorganic Chemistry, 由Eagleson, Mary; Brewer, William翻譯, San Diego/Berlin: Academic Press/De Gruyter, 2001, ISBN 0-12-352651-5
- ^ 112.0 112.1 112.2 Stevenson, D. J. Does metallic ammonium exist?. 自然 (Nature Publishing Group). 1975-11-20, 258 (5532): 222–223 [2012-01-13]. Bibcode:1975Natur.258..222S. doi:10.1038/258222a0. (原始內容存檔於2014-11-04).
- ^ 113.0 113.1 Bernal, M. J. M.; Massey, H. S. W. Metallic Ammonium (PDF). Monthly Notices of the Royal Astronomical Society (Wiley-Blackwell for the Royal Astronomical Society). 1954-02-03, 114: 172–179 [2020-09-15]. Bibcode:1954MNRAS.114..172B. (原始內容存檔 (PDF)於2018-01-12).
- ^ Solubility Rules!. chem.sc.edu. [2020-07-11]. (原始內容存檔於2015-07-13).
- ^ Connelly, Neil G.; Geiger, William E. Chemical Redox Agents for Organometallic Chemistry. Chemical Reviews. 1996, 96 (2): 877–910. PMID 11848774. doi:10.1021/cr940053x.
- ^ El Murr, N.; Sheats, J. E.; Geiger, W. E.; Holloway, J. D. L. Electrochemical Reduction Pathways of the Rhodocenium Ion. Dimerization and Reduction of Rhodocene. Inorg. Chem. 1979, 18 (6): 1443–1446. doi:10.1021/ic50196a007.
- ^ Keller, H. J.; Wawersik, H. Spektroskopische Untersuchungen an Komplexverbindungen. VI. EPR-spektren von (C5H5)2Rh und (C5H5)2Ir. J. Organomet. Chem. 1967, 8 (1): 185–188. doi:10.1016/S0022-328X(00)84718-X (德語).
- ^ R. D. Shannon. Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides. Acta Cryst. 1976, A32: 751–767. Bibcode:1976AcCrA..32..751S. doi:10.1107/S0567739476001551.
- ^ 119.0 119.1 Crookes, William. On Thallium. The Journal of the Chemical Society, London (Harrison & Sons). 1864, XVII: 112–152 [2012-01-13]. (原始內容存檔於2012-08-19).
- ^ 120.0 120.1 120.2 Leach, Mark R. The Internet Database of Periodic Tables. meta-synthesis.com. 1999–2012 [2012-04-06]. (原始內容存檔於2012-03-19).
- ^ Russell AM & Lee KL (2005) Structure-property relations in nonferrous metals (頁面存檔備份,存於網際網路檔案館). Wiley-Interscience, New York. p. 302. ISBN 0-471-64952-X
- ^ Deming HG (1940) Fundamental Chemistry, John Wiley & Sons, New York, pp. 705–7
- ^ 123.0 123.1 123.2 123.3 123.4 Jensen, William B. The Place of Zinc, Cadmium, and Mercury in the Periodic Table (PDF). Journal of Chemical Education (American Chemical Society). 2003, 80 (8): 952–961 [2012-05-06]. Bibcode:2003JChEd..80..952J. doi:10.1021/ed080p952. (原始內容 (PDF)存檔於2010-06-11).
- ^ Bailar, J. C. (1973) Comprehensive inorganic chemistry, vol. 3, p. 16. ISBN 1-57215-291-5
- ^ Newlands, John A. R. On Relations Among the Equivalents. Chemical News. 20 August 1864, 10: 94–95 [25 November 2013]. (原始內容存檔於2011-01-01).
- ^ Newlands, John A. R. On the Law of Octaves. Chemical News. 18 August 1865, 12: 83 [25 November 2013]. (原始內容存檔於2011-01-01).
- ^ Mendelejew, Dimitri. Über die Beziehungen der Eigenschaften zu den Atomgewichten der Elemente. Zeitschrift für Chemie. 1869: 405–406 (德語).
- ^ Ralph, Jolyon; Chau, Ida. Petalite: Petalite mineral information and data. 2011-08-24 [2011-11-27]. (原始內容存檔於2017-12-23).
- ^ 129.0 129.1 Winter, Mark. WebElements Periodic Table of the Elements | Lithium |historical information. [2011-11-27]. (原始內容存檔於2009-10-16).
- ^ Weeks, Mary. Discovery of the Elements. Whitefish, Montana, United States: Kessinger Publishing. 2003: 124 [2009-08-10]. ISBN 0-7661-3872-0.
- ^ Johan Arfwedson. [2009-08-10]. (原始內容存檔於2008-06-05).
- ^ 132.0 132.1 van der Krogt, Peter. Lithium. Elementymology & Elements Multidict. [2010-10-05]. (原始內容存檔於2011-06-16).
- ^ Clark, Jim. Compounds of the Group 1 Elements. chemguide. 2005 [2009-08-10]. (原始內容存檔於2009-03-11).
- ^ Plinius Naturalis Historia XXXI
- ^ Newton, David E. Baker, Lawrence W. , 編. Chemical Elements. 1999. ISBN 978-0-7876-2847-5. OCLC 39778687.
- ^ 136.0 136.1 Davy, Humphry. On some new phenomena of chemical changes produced by electricity, in particular the decomposition of the fixed alkalies, and the exhibition of the new substances that constitute their bases; and on the general nature of alkaline bodies. Philosophical Transactions of the Royal Society of London. 1808, 98: 1–44. doi:10.1098/rstl.1808.0001.
- ^ Marggraf, Andreas Siegmund. Chymische Schriften. 1761: 167 [2013-10-11]. (原始內容存檔於2013-10-13).
- ^ du Monceau, H. L. D. Sur la Base de Sel Marine. Memoires de l'Academie royale des Sciences: 65–68. [2013-10-11]. (原始內容存檔於2019-08-21) (法語).
- ^ Weeks, Mary Elvira. The discovery of the elements. IX. Three alkali metals: Potassium, sodium, and lithium. Journal of Chemical Education. 1932, 9 (6): 1035. Bibcode:1932JChEd...9.1035W. doi:10.1021/ed009p1035.
- ^ Siegfried, R. The Discovery of Potassium and Sodium, and the Problem of the Chemical Elements. Isis. 1963, 54 (2): 247–258. JSTOR 228541. doi:10.1086/349704.
- ^ Enghag, P. 11. Sodium and Potassium. Encyclopedia of the elements. Wiley-VCH Weinheim. 2004. ISBN 3-527-30666-8.
- ^ 142.0 142.1 Weeks, Mary Elvira. The discovery of the elements. XIII. Some spectroscopic discoveries. Journal of Chemical Education. 1932, 9 (8): 1413–1434. Bibcode:1932JChEd...9.1413W. doi:10.1021/ed009p1413.
- ^ Kirchhoff, G.; Bunsen, R. Chemische Analyse durch Spectralbeobachtungen. Annalen der Physik und Chemie. 1861, 189 (7): 337–381. Bibcode:1861AnP...189..337K. doi:10.1002/andp.18611890702.
- ^ 144.0 144.1 Kaner, Richard. C&EN: It's Elemental: The Periodic Table – Cesium. American Chemical Society. 2003 [2010-02-25]. (原始內容存檔於2015-06-18).
- ^ GELLIUS ATTIC NIGHTS Book II. [2013-10-11].
- ^ Oxford English Dictionary, 2nd Edition
- ^ Alabamine & Virginium. TIME. 1932-02-15 [2007-04-01]. (原始內容存檔於2011-01-30).
- ^ MacPherson, H. G. An Investigation of the Magneto-Optic Method of Chemical Analysis. Physical Review (American Physical Society). 1934, 47 (4): 310–315. Bibcode:1935PhRv...47..310M. doi:10.1103/PhysRev.47.310.
- ^ Francium. McGraw-Hill Encyclopedia of Science & Technology 7. McGraw-Hill Professional. 2002: 493–494. ISBN 0-07-913665-6.
- ^ van der Krogt, Peter. Ununennium. Elementymology & Elements Multidict. [2011-02-14]. (原始內容存檔於2011-06-16).
- ^ R. W. Lougheed, J. H. Landrum, E. K. Hulet, J. F. Wild, R. J. Dougan, A. D. Dougan, H. Gäggeler, M. Schädel, K. J. Moody, K. E. Gregorich, and G. T. Seaborg. Search for superheavy elements using 48Ca + 254Esg reaction. Physical Reviews C. 1985, 32: 1760–1763. doi:10.1103/PhysRevC.32.1760.
- ^ Schadel, M.; Bruchle, W.; Brugger, M.; Gaggeler, H.; Moody, K.; Schardt, D.; Summerer, K.; Hulet, E.; Dougan, A.; N.N. Heavy isotope production by multinucleon transfer reactions with 254Es. Journal of the Less Common Metals. 1986, 122: 411. doi:10.1016/0022-5088(86)90435-2.
- ^ Modern alchemy: Turning a line. The Economist. 2012-05-12 [2012-10-05]. (原始內容存檔於2017-05-23).
- ^ Emsley, John. Nature's Building Blocks: An A-Z Guide to the Elements New. New York, NY: Oxford University Press. 2011: 593. ISBN 978-0-19-960563-7.
- ^ 155.0 155.1 Lodders, Katharina. Solar System Abundances and Condensation Temperatures of the Elements. The Astrophysical Journal. 2003, 591: 1220–1247. Bibcode:2003ApJ...591.1220L. doi:10.1086/375492.
- ^ Oddo, Giuseppe. Die Molekularstruktur der radioaktiven Atome. Zeitschrift für anorganische Chemie. 1914, 87: 253. doi:10.1002/zaac.19140870118.
- ^ Harkins, William D. THE EVOLUTION OF THE ELEMENTS AND THE STABILITY OF COMPLEX ATOMS. I. A NEW PERIODIC SYSTEM WHICH SHOWS A RELATION BETWEEN THE ABUNDANCE OF THE ELEMENTS AND THE STRUCTURE OF THE NUCLEI OF ATOMS. Journal of the American Chemical Society. 1917, 39 (5): 856. doi:10.1021/ja02250a002.
- ^ North, John. Cosmos an illustrated history of astronomy and cosmology Rev. and updated. Univ. of Chicago Press. 2008: 602. ISBN 978-0-226-59441-5.
- ^ Morgan, J. W.; Anders, E. Chemical composition of Earth, Venus, and Mercury. Proceedings of the National Academy of Sciences. 1980, 77 (12): 6973–6977. Bibcode:1980PNAS...77.6973M. PMC 350422
 . PMID 16592930. doi:10.1073/pnas.77.12.6973.
. PMID 16592930. doi:10.1073/pnas.77.12.6973.
- ^ Albarède, Francis. Geochemistry: an introduction. Cambridge University Press. 2003 [2013-10-14]. ISBN 978-0-521-89148-6. (原始內容存檔於2013-10-16).
- ^ List of Periodic Table Elements Sorted by Abundance in Earth's crust. Israel Science and Technology Directory. [2021-07-05]. (原始內容存檔於2017-02-02).
- ^ 162.0 162.1 162.2 Lide, D. R. (編), CRC Handbook of Chemistry and Physics 86th, Boca Raton (FL): CRC Press, 2005, ISBN 0-8493-0486-5
- ^ Lithium Occurrence. Institute of Ocean Energy, Saga University, Japan. [2009-03-13]. (原始內容存檔於2012-03-04).
- ^ Some Facts about Lithium. ENC Labs. [2010-10-15]. (原始內容存檔於2018-08-14).
- ^ Schwochau, Klaus. Extraction of metals from sea water. Topics in Current Chemistry. 1984,. 124/1984: 91–133. doi:10.1007/3-540-13534-0_3.
- ^ Wise, M. A. Trace element chemistry of lithium-rich micas from rare-element granitic pegmatites. Mineralogy and Petrology. 1995, 55 (13): 203–215. Bibcode:1995MinPe..55..203W. doi:10.1007/BF01162588.
- ^ CRC Handbook of Chemistry and Physics 4. CRC. 2006: 12. ISBN 0-8493-0474-1.
- ^ 168.0 168.1 168.2 Emsley, John. Nature's Building Blocks. Oxford: Oxford University Press. 2001: 151–153 [2013-10-14]. ISBN 0-19-850341-5. (原始內容存檔於2020-03-21).
- ^ 169.0 169.1 Gagnon, Steve. Francium. Jefferson Science Associates, LLC. [2007-04-01]. (原始內容存檔於2007-03-31).
- ^ 170.0 170.1 Winter, Mark. Geological information. Francium. The University of Sheffield. [2007-03-26]. (原始內容存檔於2008-04-02).
- ^ It's Elemental — The Periodic Table of Elements. Jefferson Lab. [2007-04-14]. (原始內容存檔於2007-04-29).
- ^ Ober, Joyce A. Lithium (PDF). United States Geological Survey: 77–78. [2007-08-19]. (原始內容存檔 (PDF)於2007-07-11).
- ^ Winter, Mark. WebElements Periodic Table of the Elements | Potassium | Essential information. Webelements. [2011-11-27]. (原始內容存檔於2011-11-21).
- ^ Eggeman, Tim. Sodium and Sodium Alloys. Kirk-Othmer Encyclopedia of Chemical Technology. John Wiley & Sons, Inc. Published online 2007. doi:10.1002/0471238961.1915040912051311.a01.pub2
- ^ Pauling, Linus. General Chemistry 1970. Dover Publications. 1988.
- ^ Los Alamos National Laboratory – Sodium. [2007-06-08]. (原始內容存檔於2019-05-03).
- ^ Merck Index, 9th ed., monograph 8325
- ^ Cesium and Rubidium Hit Market. Chemical & Engineering News. 1959, 37 (22): 50–56. doi:10.1021/cen-v037n022.p050.
- ^ 179.0 179.1 179.2 Butterman, William C.; Brooks, William E.; Reese, Jr., Robert G. Mineral Commodity Profile: Rubidium (PDF). United States Geological Survey. 2003 [2010-12-04]. (原始內容存檔 (PDF)於2011-09-25).
- ^ bulletin 585. United States. Bureau of Mines. 1995.
- ^ Burt, R. O. Caesium and cesium compounds. Kirk-Othmer encyclopedia of chemical technology 5 4th. New York: John Wiley & Sons, Inc. 1993: 749–764. ISBN 978-0-471-48494-3.
- ^ Stancari, G.; Veronesi, S.; Corradi, L.; Atutov, S. N.; Calabrese, R.; Dainelli, A.; Mariotti, E.; Moi, L.; Sanguinetti, S.; Tomassettia, L. Production of Radioactive Beams of Francium. Nuclear Instruments and Methods in Physics Research Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. 2006, 557 (2): 390–396. Bibcode:2006NIMPA.557..390S. doi:10.1016/j.nima.2005.11.193.
- ^ 183.0 183.1 183.2 Luis A. Orozco. Francium. Chemical and Engineering News. 2003 [2013-10-19]. (原始內容存檔於2019-05-12).
- ^ USGS. Lithium (PDF). 2011 [2011-12-04]. (原始內容存檔 (PDF)於2011-11-13).
- ^ Stampers, National Association of Drop Forgers and. Metal treatment and drop forging. 1957.
- ^ Harris, Jay C. Metal cleaning bibliographical abstracts. 1949: 76 [2013-10-19]. (原始內容存檔於2013-10-20).
- ^ 存档副本. [2020-07-08]. (原始內容存檔於2020-07-08).
- ^ Cordel, Oskar. Die Stassfurter Kalisalze in der Landwirthschalt: Eine Besprechung .... L. Schnock. 1868 [2011-05-29]. (原始內容存檔於2012-11-12) (德語).
- ^ Toedt, John; Koza, Darrell; Cleef-Toedt, Kathleen Van. Personal Cleansing Products: Bar Soap. Chemical composition of everyday products. Greenwood Publishing Group. 2005. ISBN 978-0-313-32579-3.
- ^ Schultz, H.; et al. Potassium compounds. Ullmann's Encyclopedia of Industrial Chemistry A22. 2006: 95. ISBN 3-527-30673-0. doi:10.1002/14356007.a22_031.pub2.
- ^ Heiserman, David L. Exploring Chemical Elements and their Compounds. McGraw-Hill. 1992: 201–203. ISBN 0-8306-3015-5.
- ^ Koch, E.-C. Special Materials in Pyrotechnics, Part II: Application of Caesium and Rubidium Compounds in Pyrotechnics. Journal Pyrotechnics. 2002, 15: 9–24 [2013-10-19]. (原始內容存檔於2011-07-13).
- ^ Winter, Mark. Uses. Francium. The University of Sheffield. [2007-03-25]. (原始內容存檔於2007-03-31).
- ^ Gomez, E; Orozco, L A; Sprouse, G D. Spectroscopy with trapped francium: advances and perspectives for weak interaction studies. Rep. Prog. Phys. 2005-11-07, 69 (1): 79–118. Bibcode:2006RPPh...69...79G. doi:10.1088/0034-4885/69/1/R02.
- ^ Peterson, I. Creating, cooling, trapping francium atoms (PDF). Science News. 1996-05-11, 149 (19): 294 [2009-09-11]. (原始內容 (PDF)存檔於2011-06-04).
- ^ Gray, Theodore. Facts, pictures, stories about the element Lithium in the Periodic Table. theodoregray.com. [2012-01-09]. (原始內容存檔於2011-12-27).
- ^ Howland, Robert H. Lithium: Underappreciated and Underused?. Psychiatric Annals. 2007年9月, 37 (9) [2012-11-06]. (原始內容存檔於2013-05-26).
- ^ Zarse, Kim; Terao, Takeshi; Tian, Jing; Iwata, Noboru; Ishii, Nobuyoshi; Ristow, Michael. Low-dose lithium uptake promotes longevity in humans and metazoans (PDF). European Journal of Nutrition (Springer). 2011年8月, 50 (5): 387–9 [2012-11-06]. PMC 3151375
 . PMID 21301855. doi:10.1007/s00394-011-0171-x. (原始內容存檔 (PDF)於2015-07-13).
. PMID 21301855. doi:10.1007/s00394-011-0171-x. (原始內容存檔 (PDF)於2015-07-13).
- ^ Sodium (PDF). Northewestern University. [2011-11-21]. (原始內容 (PDF)存檔於2012-03-26).
- ^ Sodium and Potassium Quick Health Facts. [2011-11-07]. (原始內容存檔於2018-06-30).
- ^ Dietary Reference Intakes: Water, Potassium, Sodium, Chloride, and Sulfate. Food and Nutrition Board,Institute of Medicine, United States National Academies. 2004-02-11 [2011-11-23]. (原始內容存檔於2011-10-06).
- ^ 近六成居民食盐量偏高. 2013年8月26日 [2013年10月20日]. (原始內容存檔於2013年10月20日).
- ^ Geleijnse, J. M.; Kok, F. J.; Grobbee, D. E. Impact of dietary and lifestyle factors on the prevalence of hypertension in Western populations. European Journal of Public Health. 2004, 14 (3): 235–239. PMID 15369026. doi:10.1093/eurpub/14.3.235.
- ^ Lawes, C. M.; Vander Hoorn, S.; Rodgers, A.; International Society of Hypertension. Global burden of blood-pressure-related disease, 2001 (PDF). Lancet. 2008, 371 (9623): 1513–1518 [2013-10-19]. PMID 18456100. doi:10.1016/S0140-6736(08)60655-8. (原始內容 (PDF)存檔於2012-01-28).
- ^ 205.0 205.1 Mikko Hellgren, Lars Sandberg, Olle Edholm. A comparison between two prokaryotic potassium channels (KirBac1.1 and KcsA) in a molecular dynamics (MD) simulation study. Biophys. Chem. 2006, 120 (1): 1–9. PMID 16253415. doi:10.1016/j.bpc.2005.10.002.
- ^ Relman, AS. The Physiological Behavior of Rubidium and Cesium in Relation to That of Potassium. The Yale journal of biology and medicine. 1956, 29 (3): 248–62. PMC 2603856
 . PMID 13409924.
. PMID 13409924.
- ^ 207.0 207.1 Meltzer, HL. A pharmacokinetic analysis of long-term administration of rubidium chloride. Journal of clinical pharmacology. 1991, 31 (2): 179–84 [2013-10-19]. PMID 2010564. (原始內容存檔於2012-07-09).
- ^ Pinsky, Carl; Bose, Ranjan; Taylor, J. R.; McKee, Jasper; Lapointe, Claude; Birchall, James. Cesium in mammals: Acute toxicity, organ changes and tissue accumulation. Journal of Environmental Science and Health, Part A. 1981, 16 (5): 549– 567. doi:10.1080/10934528109375003.
- ^ Johnson, Garland T.; Lewis, Trent R.; Wagner, D. Wagner. Acute toxicity of cesium and rubidium compounds. Toxicology and Applied Pharmacology. 1975, 32 (2): 239–245. PMID 1154391. doi:10.1016/0041-008X(75)90216-1.
- ^ Sartori H. E. Cesium therapy in cancer patients. Pharmacol Biochem Behav. 1984, 21 (Suppl 1): 11–13. PMID 6522427. doi:10.1016/0091-3057(84)90154-0.
- ^ Wood, Leonie. 'Cured' cancer patients died, court told. The Sydney Morning Herald. 2010-11-20 [2013-10-19]. (原始內容存檔於2011-06-29).
- ^ Winter, Mark. WebElements Periodic Table of the Elements | Francium | biological information. WebElements. [2011-02-15]. (原始內容存檔於2011-06-28).
| 左方一族: | 鹼金屬 第1族(ⅠA) |
右方一族: |
| 不存在 | 鹼土金屬 |
| |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||
|

















