锂:修订间差异
增加或调整内部链接 |
TingWeiLin7(留言 | 贡献) |
||
| 第107行: | 第107行: | ||
在生物系統內存有微量的鋰;,但其功能不明。已知鋰鹽可作治療人類[[躁鬱症]]的情緒穩定藥物。 |
在生物系統內存有微量的鋰;,但其功能不明。已知鋰鹽可作治療人類[[躁鬱症]]的情緒穩定藥物。 |
||
== |
==歷史== |
||
1800年巴西化學及政治家{{link-en|José Bonifácio de Andrada e Silva|José Bonifácio de Andrada}}在{{link-en|瑞典烏托島|Utö, Sweden}}的一個礦坑中發現{{link-en|透鋰長石|petalite}}(LiAlSi4O10)。<ref>{{cite journal | url = https://www.biodiversitylibrary.org/item/29658#page/256/mode/1up | page = 239 | title = Des caractères et des propriétés de plusieurs nouveaux minérauxde Suède et de Norwège, avec quelques observations chimiques faites sur ces substances | last = D'Andraba | authorlink = José Bonifácio de Andrada | journal = Journal de Physique, de Chimie, d'Histoire Naturelle, et des Arts | volume = 51 | date = 1800 | deadurl = no | archiveurl = https://web.archive.org/web/20150713145045/http://www.biodiversitylibrary.org/item/29658#page/256/mode/1up | archivedate = 13 July 2015 | df = dmy-all }}</ref><ref name=mindat>{{cite web|url=http://www.mindat.org/min-3171.html|title=Petalite Mineral Information|accessdate=10 August 2009|publisher=Mindat.org|deadurl=no|archiveurl=https://web.archive.org/web/20090216020902/http://www.mindat.org/min-3171.html|archivedate=16 February 2009|df=dmy-all}}</ref><ref name=webelementshistory>{{cite web|url=http://www.webelements.com/lithium/history.html|title=Lithium:Historical information|accessdate=10 August 2009|deadurl=no|archiveurl=https://web.archive.org/web/20091016023617/http://www.webelements.com/lithium/history.html|archivedate=16 October 2009|df=dmy-all}}</ref><ref name=discovery>{{Cite book|title=Discovery of the Elements |last=Weeks |first=Mary|date=2003|page=124 |publisher=Kessinger Publishing |location=Whitefish, Montana, United States |isbn=978-0-7661-3872-8|url=https://books.google.com/?id=SJIk9BPdNWcC|accessdate=10 August 2009}}</ref>不過一直到1817年[[約翰·奧古斯特·阿韋德松]](Johann Arfvedson)在化學家[[永斯·貝吉里斯]](Jöns Jacob Berzelius)的實驗室中分析透鋰長石礦物時才[[化學元素發現年表|發現]]這個新元素的存在。<ref>{{cite journal | author = Berzelius | date = 1817 | title = Ein neues mineralisches Alkali und ein neues Metall | trans-title = A new mineral alkali and a new metal | journal = Journal für Chemie und Physik | volume = 21 | pages = 44–48 | url = https://books.google.com/books?id=kAsAAAAAMAAJ&pg=PA44 | deadurl = no | archiveurl = https://web.archive.org/web/20161203044634/https://books.google.com/books?id=kAsAAAAAMAAJ&pg=PA44 | archivedate = 3 December 2016 | df = dmy-all }} From p. 45: ''"Herr ''August Arfwedson'', ein junger sehr verdienstvoller Chemiker, der seit einem Jahre in meinem Laboratorie arbeitet, fand bei einer Analyse des Petalits von Uto's Eisengrube, einen alkalischen Bestandtheil, … Wir haben es ''Lithion'' genannt, um dadurch auf seine erste Entdeckung im Mineralreich anzuspielen, da die beiden anderen erst in der organischen Natur entdeckt wurden. Sein Radical wird dann Lithium genannt werden."'' (Mr. ''August Arfwedson'', a young, very meritorious chemist, who has worked in my laboratory for a year, found during an analysis of petalite from Uto's iron mine, an alkaline component … We've named it ''lithion'', in order to allude thereby to its first discovery in the mineral realm, since the two others were first discovered in organic nature. Its radical will then be named "lithium".)</ref><ref name=berzelius>{{cite web|url=http://www.chemeddl.org/collections/ptl/ptl/chemists/bios/arfwedson.html|archiveurl=https://web.archive.org/web/20101007084500/http://www.chemeddl.org/collections/ptl/ptl/chemists/bios/arfwedson.html|archivedate=7 October 2010 |title=Johan August Arfwedson |accessdate=10 August 2009 |work= Periodic Table Live!}}</ref><ref name=uwis>{{cite web|url=http://genchem.chem.wisc.edu/lab/PTL/PTL/BIOS/arfwdson.htm|archiveurl=https://web.archive.org/web/20080605152857/http://genchem.chem.wisc.edu/lab/PTL/PTL/BIOS/arfwdson.htm|archivedate=5 June 2008 |title=Johan Arfwedson |accessdate=10 August 2009}}</ref><ref name=vanderkrogt>{{cite web|publisher = Elementymology & Elements Multidict|title = Lithium|first = Peter|last = van der Krogt|url = http://elements.vanderkrogt.net/element.php?sym=Li|accessdate = 5 October 2010|deadurl = no|archiveurl = https://web.archive.org/web/20110616005621/http://elements.vanderkrogt.net/element.php?sym=li|archivedate = 16 June 2011|df = dmy-all}}</ref>這個元素組成的化合物和[[鈉]] 和[[鉀]]的化合物相似,但其[[碳酸鋰|碳酸鹽]]和[[氫氧化鋰|氫氧化物]]在水中的 [[溶解性]]較小,[[鹽基|鹼性]]也較低。<ref name=compounds>{{cite web|url=http://www.chemguide.co.uk/inorganic/group1/compounds.html|title=Compounds of the Group 1 Elements|accessdate=10 August 2009|last=Clark|first=Jim|date=2005|deadurl=no|archiveurl=https://web.archive.org/web/20090311150044/http://www.chemguide.co.uk/inorganic/group1/compounds.html|archivedate=11 March 2009|df=dmy-all}}</ref> Berzelius 將這個鹼金屬命名為「lithion/lithina」來自希臘語單詞λιθoς(音譯為lithos,意為「石頭」),來反映它是在固體礦物中被發現,而不是在植物灰燼中發現的鉀,或是部分因在動物血液中有高豐度而知名的鈉。他將材料中的金屬命名為「鋰」。<ref name=krebs>{{Cite book|last = Krebs|first = Robert E.|date = 2006|title = The History and Use of Our Earth's Chemical Elements: A Reference Guide|publisher = Greenwood Press|location = Westport, Conn.|isbn = 978-0-313-33438-2}}</ref> <ref name=webelementshistory/><ref name=vanderkrogt/> |
|||
1790年-1800年科学家Jose de Andrada在[[瑞典]]乌托岛发现透锂长石和锂辉石两种矿石,1817年由[[瑞典]]科学家[[约翰·奥古斯特·阿韦德松]](Johann Arfvedson)在分析透锂长石矿时发现。不久,他又在锂辉石和锂云母中发现锂。[[永斯·贝采利乌斯]](Jöns Jacob Berzelius)在欧洲某些矿泉水里也发现了锂。19世纪,发现植物与动物体内也有锂。 |
|||
Arfwedson後來發現,這種相同的元素存在於[[鋰輝石]]和{{link-en|鋰雲母|lepidolite}}礦物中。<ref>See: |
|||
* Arwedson, Aug. (1818) [https://books.google.com/books?id=71QrAAAAcAAJ&pg=PA145#v=onepage&q&f=false "Undersökning af några vid Utö Jernmalmsbrott förekommende Fossilier, och af ett deri funnet eget Eldfast Alkali"] {{webarchive|url=https://web.archive.org/web/20171125213610/https://books.google.com/books?id=71QrAAAAcAAJ&pg=PA145 |date=25 November 2017 }}, ''Afhandlingar i Fysik, Kemi och Mineralogi'', '''6''' : 145–172. (in Swedish) |
|||
* Arwedson, Aug. (1818) [https://babel.hathitrust.org/cgi/pt?id=njp.32101076802493;view=1up;seq=105 "Untersuchung einiger bei der Eisen-Grube von Utö vorkommenden Fossilien und von einem darin gefundenen neuen feuerfesten Alkali"] (Investigation of some minerals occurring at the iron mines of Utö and of a new refractory alkali found therein), ''Journal für Chemie und Physik'', '''22''' (1) : 93–117. (in German)</ref><ref name=webelementshistory/> |
|||
1818年,{{link-en|Christian Gmelin|Christian Gmelin}}首次發現鋰鹽燃燒的焰色為鮮紅色。<ref name=webelementshistory/><ref>{{cite journal|author=Gmelin, C. G.|year=1818|url=https://books.google.com/books?id=E2OTAAAAIAAJ&pg=PA238#v=onepage&q&f=false|title=Von dem Lithon|trans-title=On lithium|journal=Annalen der Physik|volume=59|issue=7|pages=238–241|doi=10.1002/andp.18180590702|quote=p. 238 Es löste sich in diesem ein Salz auf, das an der Luft zerfloss, und nach Art der Strontiansalze den Alkohol mit einer purpurrothen Flamme brennen machte. (There dissolved in this [solvent; namely, absolute alcohol] a salt that deliquesced in air, and in the manner of strontium salts, caused the alcohol to burn with a purple-red flame.)|bibcode=1818AnP....59..229G|deadurl=no|archiveurl=https://web.archive.org/web/20151109122750/https://books.google.com/books?id=E2OTAAAAIAAJ&pg=PA238#v=onepage&q&f=false|archivedate=9 November 2015|df=dmy-all}}</ref>然而,Arfwedson和Gmelin都未能將純元素與其鹽分離。<ref name=webelementshistory/><ref name=vanderkrogt/><ref name="eote">{{Cite book|date = 2004|title = Encyclopedia of the Elements: Technical Data – History –Processing – Applications|publisher = Wiley|isbn = 978-3-527-30666-4|pages = 287–300|author = Enghag, Per}}</ref> 直到1821年{{link-en|William Thomas Brande|William Thomas Brande}}透過[[電解]][[氧化鋰]]才得到元素鋰,而這一個過程過去曾被化學家[[漢弗里·戴維]](Humphry Davy)用來分離鹼金屬鉀和鈉。<ref name=emsley>{{Cite book|last=Emsley |first=John |title=Nature's Building Blocks |publisher=Oxford University Press |location=Oxford|date=2001 |isbn=978-0-19-850341-5}}</ref><ref name="eote" /><ref>Brande, William Thomas (1821) ''A Manual of Chemistry'', 2nd ed. London, England: John Murray, vol. 2, [https://books.google.com/books?id=ERgAAAAAQAAJ&pg=PA57 pp. 57-58.] {{webarchive|url=https://web.archive.org/web/20151122161727/https://books.google.com/books?id=ERgAAAAAQAAJ&pg=PA57 |date=22 November 2015 }}</ref><ref>{{cite journal| publisher=Royal Institution of Great Britain|journal=The Quarterly Journal of Science and the Arts|volume=5| title=The Quarterly journal of science and the arts|date=1818|page=338|format=PDF|accessdate=5 October 2010|url=https://books.google.com/?id=D_4WAAAAYAAJ|author=Various authors}}</ref><ref>{{cite web|url = http://www.diracdelta.co.uk/science/source/t/i/timeline/source.html|title = Timeline science and engineering|publisher = DiracDelta Science & Engineering Encyclopedia|accessdate = 18 September 2008|deadurl = yes|archiveurl = https://web.archive.org/web/20081205043252/http://www.diracdelta.co.uk/science/source/t/i/timeline/source.html|archivedate = 5 December 2008|df = dmy-all}}</ref> Brande 還描述了一些純鋰鹽,如氯化物,估計[[氧化鋰]]含有約 55% 的金屬,並估計鋰的原子量大約為 9.8克/莫耳(現代值約 6.94克/莫耳)。<ref>{{cite book|url=https://books.google.com/?id=zkIAAAAAYAAJ|first1=William Thomas|last1=Brande|first2=William James|last2=MacNeven|title=A manual of chemistry|date=1821|page=191|accessdate=8 October 2010|publisher=Long}}</ref>1855年,{{link-en|Robert Bunsen|Robert Bunsen}}和{{link-en|Augustus Matthiessen|Augustus Matthiessen}}透過電解[[氯化鋰]]生產了更多的鋰。<ref name=webelementshistory/><ref>{{cite journal|author=Bunsen, R. |year=1855|url=http://babel.hathitrust.org/cgi/pt?id=uva.x002457943;view=1up;seq=517 |title=Darstellung des Lithiums|trans-title=Preparation of lithium|journal=Annalen der Chemie und Pharmacie|volume=94|pages= 107–111|doi=10.1002/jlac.18550940112}}</ref> 這個程序的發現促成德國公司 {{link-en|Metallgesellschaft AG|Metallgesellschaft}}於1923年透過將氯化鋰和[[氯化鉀]]的液體混合物進行電解,對鋰進行商業生產。<ref name=webelementshistory/><ref>{{cite web|url = http://www.echeat.com/free-essay/Analysis-of-the-Element-Lithium-29195.aspx|title = Analysis of the Element Lithium|first = Thomas|last = Green|date = 11 June 2006|publisher = echeat|deadurl = no|archiveurl = https://web.archive.org/web/20120421105704/http://www.echeat.com/free-essay/Analysis-of-the-Element-Lithium-29195.aspx|archivedate = 21 April 2012|df = dmy-all}}</ref><ref>{{cite book | url = https://books.google.com/books?id=Ua2SVcUBHZgC&pg=PA99 | page = 99 | title = Handbook of Lithium and Natural Calcium Chloride | isbn = 9780080472904 | author1 = Garrett | first1 = Donald E. | date = 5 April 2004 | deadurl = no | archiveurl = https://web.archive.org/web/20161203010924/https://books.google.com/books?id=Ua2SVcUBHZgC&pg=PA99 | archivedate = 3 December 2016 | df = dmy-all }}</ref> |
|||
鋰的生產和使用歷史上經歷了幾次劇烈的變化。 鋰的第一個主要應用是[[第二次世界大戰]]及之後不久用於飛機引擎的高溫{{link-en|鋰潤滑油脂|Lithium soap}}及類似應用。這個用途得到一些事實的支持:鋰基皂具有比其他鹼皂更高的熔點,並且比鈣基皂具有更低的腐蝕性。 對鋰皂和潤滑脂的需求得到了幾家小型採礦企業的支持,其中大部分企業是在美國。 |
|||
隨著[[核武器設計方案|核熔合武器]]的生產,[[冷戰]]時期對鋰的需求急劇增加。 當被中子照射時,6Li和 7Li 都會產生[[氚]],因此可用於自身產生氚,以及在[[氘化鋰|氫化鋰]]形式的氫彈內使用的一種固體聚變燃料。美國在1950年代末到1980年代中期之間成為鋰的主要生產國。 最後,鋰儲存量約為42,000噸氫氧化鋰。儲存的鋰在 6Li 中耗盡了75%,這足以影響許多標準化學品中鋰的原子量,甚至一些「天然來源」中鋰的[[原子量]]已被從同位素分離設施排入地下水的鋰鹽污染。<ref name = "Coplen2002">{{cite journal|doi=10.1351/pac200274101987|title=Isotope-abundance variations of selected elements (IUPAC Technical Report)|date=2002|last1=Coplen|first1=T. B.|last2=Bohlke|first2=J. K.|last3=De Bievre|first3=P.|last4=Ding|first4=T.|last5=Holden|first5=N. E.|last6=Hopple|first6=J. A.|last7=Krouse|first7=H. R.|last8=Lamberty|first8=A.|last9=Peiser|first9=H. S.|last10=N.N.|journal=Pure and Applied Chemistry|volume=74|issue=10|page=1987|display-authors=9}}</ref><ref name="USGSCR1994">{{cite web|url = http://minerals.usgs.gov/minerals/pubs/commodity/lithium/450494.pdf|title = Commodity Report 1994: Lithium|publisher = United States Geological Survey|accessdate = 3 November 2010|date = 1994|first = Joyce A.|last = Ober|deadurl = no|archiveurl = https://web.archive.org/web/20100609113707/http://minerals.usgs.gov/minerals/pubs/commodity/lithium/450494.pdf|archivedate = 9 June 2010|df = dmy-all}}</ref> |
|||
當使用[[霍爾-埃魯法]]工藝時,鋰被用於降低玻璃的熔化溫度並改善[[氧化鋁]]的熔化行為。<ref name="DeberitzBoche2003">{{cite journal|last1=Deberitz|first1=Jürgen|last2=Boche|first2=Gernot|title=Lithium und seine Verbindungen - Industrielle, medizinische und wissenschaftliche Bedeutung|journal=Chemie in Unserer Zeit|volume=37|issue=4|year=2003|pages=258–266|doi=10.1002/ciuz.200300264}}</ref><ref name="Bauer1985">{{cite journal|last1=Bauer|first1=Richard|title=Lithium - wie es nicht im Lehrbuch steht|journal=Chemie in Unserer Zeit|volume=19|issue=5|year=1985|pages=167–173|doi=10.1002/ciuz.19850190505}}</ref>這兩種用途在20世紀90年代中期佔據市場主導地位。[[核軍備競賽]]結束後,對鋰的需求下降,公開市場上能源庫存的出售進一步降低了價格。<ref name="USGSCR1994"/>在20世紀90年代中期,幾家公司開始從{{link-en|鹽水|brine}}中提取鋰,這被證明是比地下或露天採礦更便宜的選擇。大多數礦山關閉或轉移到其他材料,因為只有來自分區偉晶岩的礦石才能以有競爭力的價格開採。例如,北卡羅來納州{{link-en|Kings Mountain|Kings Mountain, North Carolina}}附近的美國礦山在21世紀初之前關閉。 |
|||
1818年,Brande和[[汉弗里·戴维]](Humphry Davy)通过电解氯化锂获取了少量的锂单质。1855年Bunsen和Mattiesen通过电解氯化锂取得足够的锂得以研究它的性质<ref name="第一卷" />。 |
|||
鋰離子電池的發展增加了對鋰的需求,並在2007年成為主要用途。<ref name="USGSYB1994">{{cite web|url = http://minerals.usgs.gov/minerals/pubs/commodity/lithium/myb1-2007-lithi.pdf|title = Minerals Yearbook 2007 : Lithium|publisher = United States Geological Survey|accessdate = 3 November 2010|date = 1994|first = Joyce A.|last = Ober|deadurl = no|archiveurl = https://web.archive.org/web/20100717174958/http://minerals.usgs.gov/minerals/pubs/commodity/lithium/myb1-2007-lithi.pdf|archivedate = 17 July 2010|df = dmy-all}}</ref>隨著2000年代鋰電池鋰需求的激增,新公司擴大了鹽水開採工。<ref name="IMR">{{Cite book| first = Jessica Elzea |last = Kogel|title = Industrial minerals & rocks: commodities, markets, and uses|isbn = 978-0-87335-233-8|page = 599|chapter-url = https://books.google.com/?id=zNicdkuulE4C&pg=PA600&lpg=PAPA599|chapter = Lithium|date = 2006|publisher = Society for Mining, Metallurgy, and Exploration|location = Littleton, Colo.}}</ref><ref>{{Cite book|url=https://books.google.com/books?id=8erDL_DnsgAC&pg=PA339|title=Encyclopedia of Chemical Processing and Design: Volume 28 – Lactic Acid to Magnesium Supply-Demand Relationships|publisher=M. Dekker|author=McKetta, John J.|date=18 July 2007|accessdate=29 September 2010|isbn=978-0-8247-2478-8|deadurl=no|archiveurl=https://web.archive.org/web/20130528093232/http://books.google.com/books?id=8erDL_DnsgAC&pg=PA339|archivedate=28 May 2013|df=dmy-all}}</ref> |
|||
有人認為,鋰在可再生能源和依賴電池的世界中將成為地緣政治競爭的主要對象之一,但這種觀點也被低估了經濟激勵對擴大生產的影響力。<ref>{{Cite journal|last=Overland|first=Indra|date=2019-03-01|title=The geopolitics of renewable energy: Debunking four emerging myths|journal=Energy Research & Social Science|volume=49|pages=36–40|doi=10.1016/j.erss.2018.10.018|issn=2214-6296}}</ref> |
|||
== 存在与分布 == |
== 存在与分布 == |
||
2019年7月14日 (日) 13:16的版本
鋰(希臘語:λίθος,拉丁: LITHOS,直譯"石頭")是一種化學元素。其中文名则来源于“Lithos”的第一个音节发音“里”,因为是金属,在左方加上部首“钅”。
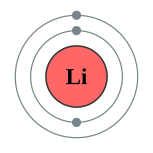
化學符號Li,原子序3,是一個軟、銀白色的鹼金屬。在標準條件下(STP),它是最輕的金屬和最輕的固體元素。三个电子中两个分布在K层,另一个在L层。锂是碱金属中最轻的一种。锂常呈+1或0氧化态,是否有-1氧化态則尚未得到证实[1]。但是锂和它的化合物并不像其他的碱金属那么典型,因为锂的电荷密度很大并且有稳定的氦型双电子层,使得锂容易极化其他的分子或离子,自己却不易受到极化。这一点影响到它和它的化合物的稳定[2]。
在標準條件下(STP),它是最輕的金屬和最輕的固體元素。同其他鹼金屬,鋰有高活性和易燃性,並儲存在礦物油中。切割時,它會表現出金屬光澤,但會快速被水氣潮解,變成暗銀灰色,接著變成黑色的氧化物。它不會以元素狀態存在於自然界,而只能於(通常是離子)化合物中發生,例如偉晶岩礦物,它們曾經是鋰的主要來源。由於其離子的溶解度,它存在於海水中並通常從鹽水中獲得。從氯化鋰和氯化鉀的混合物中電解分離鋰金屬。
在自然界中發現的兩種穩定的鋰同位素具有所有穩定核素中每個核子的結合能,因此鋰原子的核處於不穩定狀態。因核的性質相對不穩定,鋰在太陽系的含量排名第26。由於以上因素,鋰在核物理學中具重要用途。1932年鋰原子向氦的核分裂是第一次完全人為的核反應,而氘化鋰用作熱核武器的燃料。[3]
鋰及其化合物具多種工業應用,包括耐熱玻璃、陶瓷、鋰潤滑脂潤滑劑,用於鐵、鋼和鋁生產的助焊劑添加劑、鋰電池和鋰離子電池。這些用途消耗超過四分之三的鋰生產量。
在生物系統內存有微量的鋰;,但其功能不明。已知鋰鹽可作治療人類躁鬱症的情緒穩定藥物。
歷史
1800年巴西化學及政治家José Bonifácio de Andrada e Silva在瑞典烏托島的一個礦坑中發現透鋰長石(LiAlSi4O10)。[4][5][6][7]不過一直到1817年約翰·奧古斯特·阿韋德松(Johann Arfvedson)在化學家永斯·貝吉里斯(Jöns Jacob Berzelius)的實驗室中分析透鋰長石礦物時才發現這個新元素的存在。[8][9][10][11]這個元素組成的化合物和鈉 和鉀的化合物相似,但其碳酸鹽和氫氧化物在水中的 溶解性較小,鹼性也較低。[12] Berzelius 將這個鹼金屬命名為「lithion/lithina」來自希臘語單詞λιθoς(音譯為lithos,意為「石頭」),來反映它是在固體礦物中被發現,而不是在植物灰燼中發現的鉀,或是部分因在動物血液中有高豐度而知名的鈉。他將材料中的金屬命名為「鋰」。[13] [6][11] Arfwedson後來發現,這種相同的元素存在於鋰輝石和鋰雲母礦物中。[14][6] 1818年,Christian Gmelin首次發現鋰鹽燃燒的焰色為鮮紅色。[6][15]然而,Arfwedson和Gmelin都未能將純元素與其鹽分離。[6][11][16] 直到1821年William Thomas Brande透過電解氧化鋰才得到元素鋰,而這一個過程過去曾被化學家漢弗里·戴維(Humphry Davy)用來分離鹼金屬鉀和鈉。[17][16][18][19][20] Brande 還描述了一些純鋰鹽,如氯化物,估計氧化鋰含有約 55% 的金屬,並估計鋰的原子量大約為 9.8克/莫耳(現代值約 6.94克/莫耳)。[21]1855年,Robert Bunsen和Augustus Matthiessen透過電解氯化鋰生產了更多的鋰。[6][22] 這個程序的發現促成德國公司 Metallgesellschaft AG於1923年透過將氯化鋰和氯化鉀的液體混合物進行電解,對鋰進行商業生產。[6][23][24] 鋰的生產和使用歷史上經歷了幾次劇烈的變化。 鋰的第一個主要應用是第二次世界大戰及之後不久用於飛機引擎的高溫鋰潤滑油脂及類似應用。這個用途得到一些事實的支持:鋰基皂具有比其他鹼皂更高的熔點,並且比鈣基皂具有更低的腐蝕性。 對鋰皂和潤滑脂的需求得到了幾家小型採礦企業的支持,其中大部分企業是在美國。 隨著核熔合武器的生產,冷戰時期對鋰的需求急劇增加。 當被中子照射時,6Li和 7Li 都會產生氚,因此可用於自身產生氚,以及在氫化鋰形式的氫彈內使用的一種固體聚變燃料。美國在1950年代末到1980年代中期之間成為鋰的主要生產國。 最後,鋰儲存量約為42,000噸氫氧化鋰。儲存的鋰在 6Li 中耗盡了75%,這足以影響許多標準化學品中鋰的原子量,甚至一些「天然來源」中鋰的原子量已被從同位素分離設施排入地下水的鋰鹽污染。[25][26] 當使用霍爾-埃魯法工藝時,鋰被用於降低玻璃的熔化溫度並改善氧化鋁的熔化行為。[27][28]這兩種用途在20世紀90年代中期佔據市場主導地位。核軍備競賽結束後,對鋰的需求下降,公開市場上能源庫存的出售進一步降低了價格。[26]在20世紀90年代中期,幾家公司開始從鹽水中提取鋰,這被證明是比地下或露天採礦更便宜的選擇。大多數礦山關閉或轉移到其他材料,因為只有來自分區偉晶岩的礦石才能以有競爭力的價格開採。例如,北卡羅來納州Kings Mountain附近的美國礦山在21世紀初之前關閉。
鋰離子電池的發展增加了對鋰的需求,並在2007年成為主要用途。[29]隨著2000年代鋰電池鋰需求的激增,新公司擴大了鹽水開採工。[30][31]
有人認為,鋰在可再生能源和依賴電池的世界中將成為地緣政治競爭的主要對象之一,但這種觀點也被低估了經濟激勵對擴大生產的影響力。[32]
存在与分布
锂在自然界中丰度较大,居第27位,在地壳中约含0.0065%,但仅以化合物的形式存在。锂的矿物有30余种,主要存在于锂辉石()、锂云母以及透锂长石()和磷铝石中。在人和动物的有机体、土壤和矿泉水、可可粉、烟叶、海藻中都有锂存在。
2015年2月19日,日本國立天文台研究團隊從觀察2013年海豚座新星發現,新星爆炸製成了大量鋰元素,這意味著經典新星爆炸可能是宇宙製造鋰元素的主要機制[33]。
按美國地質調查局推算,2016年時鋰礦的世界蘊藏量1400萬噸,總生產量約3萬5000噸,其中智利的儲量達世界總儲量的52%,中國22%居次,阿根廷和澳大利亞分別佔14%和11%。生產方面澳大利亞通過礦石精製,南美洲則以費時的晾曬法提取鹽湖中鋰,所以前者生產效率比較高而生產量居世界之首,佔41%,智利居次34%,及阿根廷16%、中國6%。[34]
单质性质
概述
锂是一种极易反应的柔软的银白色碱金属。它在金属中比重最轻。锂在空气中易氧化,所以须贮存于固体石蜡、煤油或惰性气体中。它能与水和酸作用放出氢气,易与氧、氮、硫等化合。锂盐在水中的溶解度与镁盐类似,而不同于其他的碱金属盐。
物理性质
- 锂的密度非常小,仅有0.534g/cm3,为非气态单质中最小的一个。
- 因为锂原子半径小,故与其他的碱金属相比压缩性最小,硬度最大,熔点最高。
- 温度高于-117℃时,金属锂是典型的体心立方结构,但当温度降至-201℃时,开始转变为面心立方结构,温度越低,转变程度越大,但是转变不完全。在20℃时,锂的晶格常数为3.50Å[35],电导约为银的五分之一。
- 锂易与铁以外的任何一种金属熔合。[36]
化学性质
- 锂的化学性质十分活泼,在一定条件下,能与除稀有气体外的大部分非金属反应,但不像其他碱金属那样容易。
- 锂能同卤素发生反应生成卤化锂。
- 常温下,在除去二氧化碳的干燥空气中几乎不与氧气反应,但在100℃以上时发生燃烧,与氧生成氧化锂,火焰呈蓝色,但其蒸气火焰呈深红色,反应程度如同镁条燃烧一样,十分剧烈危险。尽管它不如其他碱金属那样容易燃烧,但是它燃烧的剧烈程度却是其他碱金属无法比拟的,就如同镁燃烧比钠更剧烈一样。若其露置在普通空气中会慢慢失去光泽,生成氧化锂、氮化锂和氢氧化锂,最后变为碳酸锂。[37]氧族其它元素也能在高温下与锂反应形成相应的化合物。
- 锂与碳在高温下生成碳化锂。
- 锂在其熔点附近很容易与氢反应,形成氢化锂。
- 锂块可以与水较快地反应,但并不特别剧烈,不燃烧,也不熔化,原因是其熔点、燃点较高,且因生成物LiOH溶解度较小(20℃:12.3~12.8g/100g),易附着在锂的表面阻碍反应继续进行[38];而粉末状锂与水发生爆炸性反应。
- 盐酸、稀硫酸、硝酸能与锂剧烈反应。浓硫酸和锂也能反应,有剧烈反应并熔化燃烧的可能性。
- 锂能同很多有机化合物发生反应,很多反应在有机合成上有重要的意义。
同位素与核性质
在自然界中锂以两种同位素——和组成,丰度分别为7.42%和92.58%。
通过人工制备,已得到锂的四種放射性同位素、、、。他们的衰变方式如下[39]:
锂的同位素可发生下列反应,放出热量:
也可用来制备氚:
制备
锂矿的提取法
硫酸盐法
锂辉石和硫酸钾一起烧结,钾将锂置换出来,形成可溶于水的硫酸锂。
- 2LiAl(SiO3)2 + K2SO4 = Li2SO4 + 2KAl(SiO3)2
硫酸盐分解法很长一段时间内是工业制备锂的唯一方法。此方法不仅适用于锂辉石,也可用来处理锂云母。
石灰法
将石灰或石灰石与锂矿石一起烧结,然后用水处理,浸取液经过多次蒸发,可从中结晶析出氢氧化锂。反应式如下(温度为1000℃):
- 2LiAl(SiO3)2 + 9CaO = Li2O + CaO·Al2O3 + 4[2CaO·SiO2]
此方法的优点是:
- 适用性强,能分解几乎所有的锂矿石。
- 反应不需要稀缺原料,石灰和石灰石均较便宜且容易获得。
缺点是:
- 要求精矿中锂含量很高,因为烧结时精矿会贫化。
- 因为浸取后得到的是稀溶液,因此蒸发会消耗大量热量,且耗时长。
硫酸法
首先提出此方法的是R.B.Ellestad和K.M.Leute[36],此方法适用于β-锂辉石和锂云母。原理如下(温度为250-300℃):
- 2LiAl(SO3)2 + H2SO4 = Li2SO4 + H2O·Al2O3·4SiO2
此反应的关键问题是硫酸只能与β-锂辉石反应,而对于α-锂辉石无法与之反应。用硫酸直接分解未经锻烧的锂辉石,提取出来的锂仅占总量的4%[36]。
天然卤水的提取
锂的来源也包括天然卤水和某些盐湖水。加工过程是将锂沉淀成Li2NaPO4,再将其转变为碳酸锂,即可作为原料来加工其他锂化合物了。加工天然卤水还可得到硼砂、碳酸钾、氯化钠、硫酸钠和氯化镁等。
金属锂的制备
电解法
锂可由电解熔融氯化锂而得。Guntz首先建议用电解熔融氯化锂和氯化钾的混合物来制备金属锂[40],这样可以把熔融温度从单质锂的610℃降至400℃。以石墨为阳极,以低碳钢为阴极,电解槽压为6.0-6.5V。这样可以得到纯度达到99%的锂。
- 2LiCl(l) → 2Li(s) + Cl2(g)
电解法制得的金属锂通常含有机械杂质(例如Na、K、Mg、Ca、Fe、Si和Al等),因此需要提纯;杂质可重新熔融,再借助比重不同滤除,不容易除去的钠和钾可以通过氢化法除去。
热还原法
3Li2O + 2Al = 6Li + Al2O3—33.6千卡
2Li2O + Si = 4Li + SiO2—76.3千卡
因为还原氧化锂是吸热反应,再加上金属锂的性质十分活泼,所以反应只能在高温和高真空中进行。
用途
合成原料
在许多反应中,锂可作为原料或中间物。在合成与锂相关的无机化合物时,常常是将金属锂与其他单质反应。若要求纯度较高,可用锂与气态单质或化合物反应。例如用锂和硫化氢合成硫化锂。反应方程式如下:
还原剂
金属锂溶于液氨和乙醇的混合溶剂中形成一个良好的还原剂,可用来还原含芳香环的有机化合物。比较贵重的甾族化合物通常用这种办法来还原。此法的优点是产率较高,缺点是比用钠还原昂贵,所以仅用于还原一些贵重的化合物。
催化剂
锂可用作丁二烯、异戊二烯等二烯烃聚合催化剂,也可用来制造共聚物。
电池工业
因为锂的原子量很小,只有6.9g·mol−1,因此用锂作阳极的电池具有很高的能量密度。锂也能够制造低温或高温下使用的电池[2]。
用于低温的电池,通常使用有机溶剂作为电解质,其中添加一些无机盐增加导电性,常用无机盐包括高氯酸锂、六氟磷酸锂、六氟砷酸锂和硫化锂等。二次锂电池中正极材料也为含锂化合物,如锂钴氧化物、锂镍氧化物、锂锰氧化物、锂铁氧化物等等,以及其多元化合物。二次锂电池中负极材料,也与锂的作用明显。
用于高温的电池,通常使用熔融的无机盐作为电解质,因此必须在该盐的熔点以上方可使用。例如:
合金
掺有锂的合金一般有强度大,密度小,耐高温等特性。也有人用锂合成了Li-Pb液态半导体合金[41]。
醫療
醫療用途的鋰目前主要分為兩種:一種為外用的局部治療,另一種則為已被廣泛使用的口服治療。.
根據臨床研究中顯示,當鋰被使用於外用的局部治療時,能有效治療脂漏性皮膚炎(seborrheic dermatitis)[42][43][44][45][46],目前鋰的作用机理還不十分清楚,這可能與鋰可抑制物質-P(substance-P)[47]及抑制Malassezia yeasts(引發痘痘元兇之一的細菌)生長所需的所有游離脂肪酸有關[48]。過去的一些研究顯示鋰可以抑制許多酶(enzyme):鈉鉀泵(Na/K ATPase)、腺苷環化酶(adenylcyclase)、enzymes of the prostaglandins E1 synthesis、和inositol-1-phosphatase等[49]。 鋰亦具有抗發炎(anti-inflammatory)及免疫調節(immunomodulatory)的作用[50][51]。除此之外,在法國的研究中顯示含鋰元素的活泉水( Evaux thermal spring water)能改善癌症患者因治療所引起的皮膚指甲等的副作用[52]。
口服的鋰主要被使用於精神科,用來治療躁鬱症。臨床使用的濃度為1毫克。口服用的鋰會造成許多皮膚的副作用,像是斑點丘疹(maculopapular eruption)、痤瘡(acne)、牛皮癬狀疹(psoriasiform eruption)。因此顯示口服的鋰有可能會促進或使已經存在的皮膚疾病更惡化,像是牛皮癬(psoriasis)和脂漏性皮膚炎(seborrheic dermatitis)[53][54]。
其他用途

锂还能用于:
保存方法
干燥环境下,锂金属不与氧气发生反应,只有在潮湿的环境下才与氧气发生反应,颜色由银白色变成黑色最后再变成白色。实验室中锂金属一般保存在干燥的惰性气体环境或是煤油中。
参考资料
- ^ J.L.Dye J.Chem.Educ., 54(6) 332(1977)
- ^ 2.0 2.1 刘翊纶任德厚《无机化学丛书》第一卷 北京:科学出版社289-354页1984年
- ^ Nuclear Weapon Design. Federation of American Scientists (1998-10-21). fas.org
- ^ D'Andraba. Des caractères et des propriétés de plusieurs nouveaux minérauxde Suède et de Norwège, avec quelques observations chimiques faites sur ces substances. Journal de Physique, de Chimie, d'Histoire Naturelle, et des Arts. 1800, 51: 239. (原始内容存档于13 July 2015). 已忽略未知参数
|df=(帮助) - ^ Petalite Mineral Information. Mindat.org. [10 August 2009]. (原始内容存档于16 February 2009). 已忽略未知参数
|df=(帮助) - ^ 6.0 6.1 6.2 6.3 6.4 6.5 6.6 Lithium:Historical information. [10 August 2009]. (原始内容存档于16 October 2009). 已忽略未知参数
|df=(帮助) - ^ Weeks, Mary. Discovery of the Elements. Whitefish, Montana, United States: Kessinger Publishing. 2003: 124 [10 August 2009]. ISBN 978-0-7661-3872-8.
- ^ Berzelius. Ein neues mineralisches Alkali und ein neues Metall [A new mineral alkali and a new metal]. Journal für Chemie und Physik. 1817, 21: 44–48. (原始内容存档于3 December 2016). 已忽略未知参数
|df=(帮助) From p. 45: "Herr August Arfwedson, ein junger sehr verdienstvoller Chemiker, der seit einem Jahre in meinem Laboratorie arbeitet, fand bei einer Analyse des Petalits von Uto's Eisengrube, einen alkalischen Bestandtheil, … Wir haben es Lithion genannt, um dadurch auf seine erste Entdeckung im Mineralreich anzuspielen, da die beiden anderen erst in der organischen Natur entdeckt wurden. Sein Radical wird dann Lithium genannt werden." (Mr. August Arfwedson, a young, very meritorious chemist, who has worked in my laboratory for a year, found during an analysis of petalite from Uto's iron mine, an alkaline component … We've named it lithion, in order to allude thereby to its first discovery in the mineral realm, since the two others were first discovered in organic nature. Its radical will then be named "lithium".) - ^ Johan August Arfwedson. Periodic Table Live!. [10 August 2009]. (原始内容存档于7 October 2010).
- ^ Johan Arfwedson. [10 August 2009]. (原始内容存档于5 June 2008).
- ^ 11.0 11.1 11.2 van der Krogt, Peter. Lithium. Elementymology & Elements Multidict. [5 October 2010]. (原始内容存档于16 June 2011). 已忽略未知参数
|df=(帮助) - ^ Clark, Jim. Compounds of the Group 1 Elements. 2005 [10 August 2009]. (原始内容存档于11 March 2009). 已忽略未知参数
|df=(帮助) - ^ Krebs, Robert E. The History and Use of Our Earth's Chemical Elements: A Reference Guide. Westport, Conn.: Greenwood Press. 2006. ISBN 978-0-313-33438-2.
- ^ See:
- Arwedson, Aug. (1818) "Undersökning af några vid Utö Jernmalmsbrott förekommende Fossilier, och af ett deri funnet eget Eldfast Alkali" 互联网档案馆的存檔,存档日期25 November 2017., Afhandlingar i Fysik, Kemi och Mineralogi, 6 : 145–172. (in Swedish)
- Arwedson, Aug. (1818) "Untersuchung einiger bei der Eisen-Grube von Utö vorkommenden Fossilien und von einem darin gefundenen neuen feuerfesten Alkali" (Investigation of some minerals occurring at the iron mines of Utö and of a new refractory alkali found therein), Journal für Chemie und Physik, 22 (1) : 93–117. (in German)
- ^ Gmelin, C. G. Von dem Lithon [On lithium]. Annalen der Physik. 1818, 59 (7): 238–241. Bibcode:1818AnP....59..229G. doi:10.1002/andp.18180590702. (原始内容存档于9 November 2015).
p. 238 Es löste sich in diesem ein Salz auf, das an der Luft zerfloss, und nach Art der Strontiansalze den Alkohol mit einer purpurrothen Flamme brennen machte. (There dissolved in this [solvent; namely, absolute alcohol] a salt that deliquesced in air, and in the manner of strontium salts, caused the alcohol to burn with a purple-red flame.)
已忽略未知参数|df=(帮助) - ^ 16.0 16.1 Enghag, Per. Encyclopedia of the Elements: Technical Data – History –Processing – Applications. Wiley. 2004: 287–300. ISBN 978-3-527-30666-4.
- ^ Emsley, John. Nature's Building Blocks. Oxford: Oxford University Press. 2001. ISBN 978-0-19-850341-5.
- ^ Brande, William Thomas (1821) A Manual of Chemistry, 2nd ed. London, England: John Murray, vol. 2, pp. 57-58. 互联网档案馆的存檔,存档日期22 November 2015.
- ^ Various authors. The Quarterly journal of science and the arts (PDF). The Quarterly Journal of Science and the Arts (Royal Institution of Great Britain). 1818, 5: 338 [5 October 2010].
- ^ Timeline science and engineering. DiracDelta Science & Engineering Encyclopedia. [18 September 2008]. (原始内容存档于5 December 2008). 已忽略未知参数
|df=(帮助) - ^ Brande, William Thomas; MacNeven, William James. A manual of chemistry. Long. 1821: 191 [8 October 2010].
- ^ Bunsen, R. Darstellung des Lithiums [Preparation of lithium]. Annalen der Chemie und Pharmacie. 1855, 94: 107–111. doi:10.1002/jlac.18550940112.
- ^ Green, Thomas. Analysis of the Element Lithium. echeat. 11 June 2006. (原始内容存档于21 April 2012). 已忽略未知参数
|df=(帮助) - ^ Garrett, Donald E. Handbook of Lithium and Natural Calcium Chloride. 5 April 2004: 99. ISBN 9780080472904. (原始内容存档于3 December 2016). 已忽略未知参数
|df=(帮助) - ^ Coplen, T. B.; Bohlke, J. K.; De Bievre, P.; Ding, T.; Holden, N. E.; Hopple, J. A.; Krouse, H. R.; Lamberty, A.; Peiser, H. S.; et al. Isotope-abundance variations of selected elements (IUPAC Technical Report). Pure and Applied Chemistry. 2002, 74 (10): 1987. doi:10.1351/pac200274101987.
- ^ 26.0 26.1 Ober, Joyce A. Commodity Report 1994: Lithium (PDF). United States Geological Survey. 1994 [3 November 2010]. (原始内容存档 (PDF)于9 June 2010). 已忽略未知参数
|df=(帮助) - ^ Deberitz, Jürgen; Boche, Gernot. Lithium und seine Verbindungen - Industrielle, medizinische und wissenschaftliche Bedeutung. Chemie in Unserer Zeit. 2003, 37 (4): 258–266. doi:10.1002/ciuz.200300264.
- ^ Bauer, Richard. Lithium - wie es nicht im Lehrbuch steht. Chemie in Unserer Zeit. 1985, 19 (5): 167–173. doi:10.1002/ciuz.19850190505.
- ^ Ober, Joyce A. Minerals Yearbook 2007 : Lithium (PDF). United States Geological Survey. 1994 [3 November 2010]. (原始内容存档 (PDF)于17 July 2010). 已忽略未知参数
|df=(帮助) - ^ Kogel, Jessica Elzea. Lithium. Industrial minerals & rocks: commodities, markets, and uses. Littleton, Colo.: Society for Mining, Metallurgy, and Exploration. 2006: 599. ISBN 978-0-87335-233-8.
- ^ McKetta, John J. Encyclopedia of Chemical Processing and Design: Volume 28 – Lactic Acid to Magnesium Supply-Demand Relationships. M. Dekker. 18 July 2007 [29 September 2010]. ISBN 978-0-8247-2478-8. (原始内容存档于28 May 2013). 已忽略未知参数
|df=(帮助) - ^ Overland, Indra. The geopolitics of renewable energy: Debunking four emerging myths. Energy Research & Social Science. 2019-03-01, 49: 36–40. ISSN 2214-6296. doi:10.1016/j.erss.2018.10.018.
- ^ http://www.nao.ac.jp/en/news/science/2015/20150218-subaru.html
- ^ 多部田俊輔、外山尚之. 中國企業參與全球鋰資源爭奪. 日經中文網. 2017年12月1日 [2018年3月3日] (中文(繁體)).
- ^ “Gmelins Handbueh der anorganische Chemie”, Lithium Ergazungs. band. System-Nummor 20. Verlag Chemie 1960
- ^ 36.0 36.1 36.2 奥斯特罗什科等 曾华珗译《锂的化学与工艺学》北京:中国工业出版社1965年
- ^ M.M.Markowitz, D.A.Boryta, J.Chem.Eng.Data., 1962(7) 586
- ^ 申泮文、王积涛主编《化合物词典》,上海辞书出版社,2002,周公度主编《化学辞典》,化学工业出版社,2003.6
- ^ 核素图编制组《核素图》北京:原子能出版社1976年
- ^ M.E.Weeks, J.Chem.Educ., 33, 487(1956)
- ^ J.E.Enderby. Can.J.Chem., 55(11), 1961(1977)
- ^ Arch Dermatol Res 2008; 300:215-223. Anti-inflammatory effects of lithium gluconate on keratinocytes: a possible explanation for effciency in seborrhoeic dermatitis
- ^ British Journal of Dermatology 2003; 148: 1230–1236. Lithium gluconate 8% vs. ketoconazole 2% in the treatment of seborrhoeic dermatitis: a multicentre, randomized study
- ^ Clin Exp Dermatol 1997; 22: 216-219. Topical lithium succinate ointment (Efalith) in the treatment of AIDS-related seborrhoeic dermatitis
- ^ Eur j Dermatol 2002; 12(6) : 549-52. Lithium gluconate in the treatment of seborrhoeic dermatitis: a multicenter, randomised, double-blind study versus placebo
- ^ J Am Acad Dermatol. 1992 Mar;26(3 Pt 2):452-7. A double-blind, placebo-controlled, multicenter trial of lithium succinate ointment in the treatment of seborrheic dermatitis. Efalith Multicenter Trial Group.
- ^ Nouv Dermatol, 2004;23:569-75. Evaluation of the inhibition of human sebocyte proliferation stimulated by substance P and corticotropin-releasing hormone by mineral constituents in Evaux thermal spring water
- ^ Lithium 1990; 1: 149-155. Lithium, fatty acids and seborrhoeic dermatitis: A new mechanism of lithium action and a new treatment for seborrhoeic dermatitis
- ^ Ann Dermatol Venereol 2004;131:255-61. Lithium
- ^ Ann Dermatol Venereol 2004;131:255-61. Lithium
- ^ Arch Dermatol Res 2008; 300:215-223. Anti-inflammatory effects of lithium gluconate on keratinocytes: a possible explanation for effciency in seborrhoeic dermatitis
- ^ Eur Oncology 2010; 6(1):3-5. The Neurogenic Component of Cutaneous Toxicities Induced by Chemotherapy – New Solutions
- ^ Am J Clin Dermatol 2004; 5:3–8. Cutaneous adverse eVects of lithium: epidemiology and management.
- ^ Ann Med Intern 1984; 13:637–638. Drug eruptions caused by lithium salts.
- 元素锂在洛斯阿拉莫斯国家实验室的介紹(英文)
- EnvironmentalChemistry.com —— 锂(英文)
- 元素锂在The Periodic Table of Videos(諾丁漢大學)的介紹(英文)
- 元素锂在Peter van der Krogt elements site的介紹(英文)
- WebElements.com – 锂(英文)
| 元素周期表(碱金属) | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| IA 1 |
IIA 2 |
IIIB 3 |
IVB 4 |
VB 5 |
VIB 6 |
VIIB 7 |
VIIIB 8 |
VIIIB 9 |
VIIIB 10 |
IB 11 |
IIB 12 |
IIIA 13 |
IVA 14 |
VA 15 |
VIA 16 |
VIIA 17 |
VIIIA 18 | ||||||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||||
| |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||
| ||||||||||||