三羧酸循環

三羧酸循環(tricarboxylic acid cycle) 可簡稱為TCA cycle,亦作檸檬酸循環(citric acid cycle),是有氧呼吸的第二階段。該循環以循環中一個重要中間體檸檬酸命名,又因爲檸檬酸是一種三元羧酸,該反應又稱爲三羧酸循環。該循環亦因由英國生物化學家克雷布斯(Krebs)發現而稱爲克雷布斯循環(Krebs cycle),克雷布斯亦因此項貢獻獲1953年諾貝爾生理學或醫學獎。丙酮酸在經過丙酮酸去氫酶系氧化,生成乙醯輔酶A(acetyl-CoA)後,與四碳二元羧酸草醯乙酸化合,生成檸檬酸,進入檸檬酸循環。隨後,經過一系列反應,兩個碳原子轉化爲二氧化碳(CO2)分子,檸檬酸中蘊藏的化學能轉化至還原的輔酶中。檸檬酸循環的終產物仍然是草醯乙酸,這使得該循環能源源不斷地氧化輸入循環的乙醯輔酶A。
一般情況下,檸檬酸循環產生的還原輔酶會連同糖解過程產生的還原輔酶一同,在氧化磷酸化過程中氧化,生成大量的ATP[1]:148。一分子的乙醯輔酶A在被檸檬酸循環代謝後,可產生兩分子的CO2分子、三分子NADH、一分子FADH2,以及一分子GTP[註 1][2]:340。
檸檬酸循環可以代謝醣類、脂質,以及大部分胺基酸,因爲這三類物質都能轉換爲乙醯輔酶A或檸檬酸循環的中間體,從而進入檸檬酸循環之中。另外,檸檬酸循環的許多中間體可供生物體利用。當中間產物不足時,可通過添補反應對中間產物進行補充。生物體最重要的填補反應是在丙酮酸羧化酶催化下,以一分子丙酮酸和一分子二氧化碳分子爲原料,合成一分子草醯乙酸的反應[2]:343。
檸檬酸循環發生於粒線體受質中,但也會部分地在粒線體內膜或皺褶膜上發生[1]:148-149。
發現
[編輯]
1930年代,檸檬酸循環中的一些化學反應就已由阿爾伯特·聖捷爾吉闡明。阿爾伯特·聖捷爾吉因他對檸檬酸循環中的一個重要中間體延胡索酸的研究,而獲得1937年諾貝爾生理學或醫學獎[3]。檸檬酸循環本身則是由德國生物化學家漢斯·阿道夫·克雷布斯在1937年於錫菲大學發現的。他因對檸檬酸循環的研究而獲得1953年諾貝爾生理醫學獎[4]。

進化
[編輯]構成檸檬酸循環的一些化學反應在厭氧細菌中就已出現了。檸檬酸循環本身則可能經過多次進化[5]。從理論上說,檸檬酸循環並不是沒有相關的替代方案。然而,檸檬酸循環的效率卻是最高的。即使存在進化上獨立的能替代檸檬酸循環的過程,它們也應該已通過趨同演化而與檸檬酸循環融合[6][7]。
在有氧呼吸中的位置
[編輯]醣類在細胞質受質中發生糖解後,生成的終產物是丙酮酸。丙酮酸通過粒線體外膜上的通道蛋白,再通過粒線體內膜上的丙酮酸轉位酶進入粒線體受質。之後,丙酮酸經丙酮酸去氫酶複合體氧化,轉化爲可進入檸檬酸循環的乙醯輔酶A,這一過程稱爲丙酮酸氧化[2]:332。檸檬酸循環發生於粒線體受質中,但也有一部分會於粒線體內膜或皺褶膜上發生。原核生物的檸檬酸循環則發生於細胞質受質中。檸檬酸循環產生的還原輔酶會在氧化磷酸化過程中與氧氣反應,產生的能量會部分轉移到ATP中[8]:368。
概述
[編輯]檸檬酸循環是一個關鍵的代謝途徑,它統一了碳水化合物、脂肪和蛋白質的代謝。
步驟
[編輯]檸檬酸循環可概括爲8大反應步驟[2]:335[8]:368:
第一步:檸檬酸合酶
[編輯]
檸檬酸合成酶催化乙醯輔酶A(Acetyl-CoA)與四碳的草醯乙酸(Oxaloacetate)發生縮合反應和硫酯水解,生成檸檬酸(Citrate),通常被視為循環的第一步。其四級結構由兩個亞基組成,兩個受質可以與每個亞基結合。[10]由於硫酯水解釋放能量,反應是不可逆的。酶的活性位點活化乙醯輔酶A,使其類似於草醯乙酸的碳中心:沿著兩個分子之間的鍵,硫酯基團(CoA)被水解,形成檸檬酸分子。[11]
該反應高度放能(ΔG°′ = -31.4 kJ/mol),也因此該步驟在標準條件下不可逆。此外,酶產生的檸檬酸能夠競爭性抑制酶活性,儘管該反應非常有利(因為是放能的),但檸檬酸合酶可以受到嚴格調節。[11]例如,檸檬酸鹽本身充當檸檬酸合成酶的抑制劑,而草醯乙酸與其結合會增加其對乙醯輔酶A的親和力。這方面具有相當大的生物學重要性,因為它可以完全調節整個克雷布斯循環,使酶成為整個循環的「起搏器」。[12][13]糖解中的磷酸果糖激酶1會被檸檬酸鹽抑制,同時它會活化乙醯輔酶 A 羧化酶以進行脂肪酸合成。這一點說明了我們代謝週期的相互關聯性。[14]

第二步:烏頭酸酶
[編輯]
檸檬酸在烏頭酸酶(Aconitase)的催化作用下異構化通過生成烏頭酸生成異檸檬酸(Isocitrate)。烏頭酸酶可以催化順烏頭酸的水合反應及水合產物檸檬酸、異檸檬酸的脫水反應。雖然該反應是可逆的,但在pH=7.0,25攝氏度條件下,平衡混合物中檸檬酸和異檸檬酸的比例為9:1,因爲異檸檬酸不斷消耗,在克雷布斯循環中,由於質量作用定律,反應平衡不斷右移。一旦產生了順烏頭酸,就添加水分子以將雙鍵氧化成羥基,並通過添加水產生異檸檬酸。[16][17]
酶的活性位點有一個鐵硫簇,可與一些極性胺基酸殘基共同結合受質。絲胺酸、精胺酸、組胺酸和天門冬胺酸殘基確保與受質的結合,與(1R,2S)-檸檬酸鹽單獨特異性結合,排斥與其它形式的結合。[18][19][20]

第三步:異檸檬酸去氫酶
[編輯]
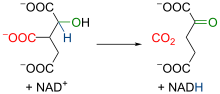
異檸檬酸在異檸檬酸去氫酶(Isocitrate dehydrogenase)作用下,經中間體草醯琥珀酸(Oxalosuccinate)氧化脫羧生成α-酮戊二酸(α-Ketoglutarate)。粒線體異檸檬酸去氫酶是一種依賴於NAD+和Mn2+、Mg2+存在的酶,在異檸檬酸轉化爲草醯琥珀酸的過程中,有一分子NAD+還原爲NADH。[22][23]草醯琥珀酸具有β-酮酸的結構,與α位羧基的氧絡合的二價離子的存在增加了該區域的電負度,導致分子電子重排,發生脫羧反應(即釋放CO2分子),從而形成α-酮戊二酸,末端有兩個羧基,和一個酮位於兩個羧基之一的α位。該反應中,酶的活性要在Mg2+或Mn2+離子的輔助下才可實現。由於具有足夠的放能(ΔG°' = -8.4 kJ/mol),能夠將先前的反應從烏頭酸酶向前推進。總的來說,該過程生成了一分子NADH以及一分子CO2。[24][25]
第四步:α-酮戊二酸去氫酶
[編輯]
異檸檬酸轉化為α-酮戊二酸後,α-酮戊二酸在α-酮戊二酸去氫酶複合體(α-Ketoglutarate dehydrogenase complex)的催化作用下,進行第二次氧化脫羧反應,與輔酶A化合,生成琥珀醯輔酶A(Succinyl-CoA),該過程還會生成一分子CO2,以及一分子NADH。該反應的機理與丙酮酸氧化機理相似,在生理條件下同樣是一個單向反應。[27]兩個反應都包括α-酮酸的脫羧以及隨後與輔酶A生成高能硫酯鍵,催化這些反應的錯合物彼此相似。[28]
α-酮戊二酸去氫酶複合體由三種酶組成:α-酮戊二酸去氫酶(E1)、二氫硫辛醯轉琥珀酸酶(E2)、二氫硫辛醯去氫酶(E3),α-酮戊二酸去氫酶複合體要在一些輔助因子的輔助下才能發揮功能。該反應的自由能差為ΔG°′ = -30.1 kJ/mol,因此高度放能。[28]

第五步:琥珀醯輔酶A合成酶
[編輯]
琥珀醯輔酶A是一種高能硫酯,其水解ΔG°′ = -33.5 kJ/mol,與ATP的-30.5 kJ/mol相似。檸檬酸合酶利用具有這種高能鍵的中間體來完成二碳分子(乙醯輔酶A)和四碳分子(草乙酸)之間的融合,而在琥珀醯輔酶A合成酶(Succinyl-CoA synthetase)利用這種能量來磷酸化。
來自硫酯的能量簡單地轉化為與磷酸鍵相連的能量:反應的第一步生成高能中間體磷酸琥珀醯,隨後,催化位點中存在的組胺酸將磷酸鹽從磷酸酯中去除。碳水化合物分子,生成產物琥珀酸和磷酸組胺酸分子,磷酸組胺酸分子迅速將磷酸鹽轉化為核苷二磷酸鹽,將其「充電」為三磷酸鹽。
琥珀酸輔酶A轉化爲琥珀酸(Succinate)和輔酶A,生成一分子GTP(該酶有兩個版本,分別生成ATP和GTP;不同生物,或同一生物的不同組織會依對ATP和GTP需求的差異在該步使用相應版本的酶)。這是循環中在受質水平上發生磷酸化、生成高能磷酸鍵的唯一步驟。
接下來,琥珀酸經過三步反應,重新轉化爲草醯乙酸。

第六步:琥珀酸去氫酶
[編輯]
循環的最後部分是四碳分子的重新排列,直到草醯乙酸。為實現這一點,琥珀酸上存在的亞甲基橋必須轉化為羰基,這種轉化通過三個步驟發生:第一次氧化、水合和二次氧化。這三個步驟,除了再生草醯乙酸之外,還可以通過形成FADH2和NADH來提取更多能量。
第一個氧化反應是琥珀酸在琥珀酸去氫酶(Succinate dehydrogenase)的催化作用下,轉化爲延胡索酸(Fumarate)。該過程中有一分子FAD還原爲FADH2。琥珀酸去氫酶錯合物是循環中唯一以FAD而不是NAD+作為氫受體的酶,FAD通過組胺酸殘基與酶共價連接。該酶使用FAD,因為與反應相關的能量不足以還原 NAD+。

第七步:延胡索酸
[編輯]
延胡索酸經延胡索酸酶(Fumarase)催化,催化水分子中的H+和OH-基團加成到反式分子上,由於該酶只能在一側結合 OH-,轉化爲L-蘋果酸(L-Malate)。
延胡索酶有兩類:I類和II類,取決於其相關亞基的排列、對金屬的需求及其熱穩定性。I類延胡索酸酶在受熱或輻射時能夠改變狀態或變得失活,對超氧陰離子敏感,依賴Fe2+,是二聚體,約120 kD。II類延胡索酸酶存在於原核生物和真核生物中,是 20 kD的四聚酶,包含三個不同的顯著同源的胺基酸片段,並且不依賴鐵且熱穩定。已知原核生物具有三種不同形式的延胡索酸酶:延胡索酸酶A、延胡索酸酶B和延胡索酸酶C,後者屬於II類延胡索酶,而延胡索酸酶A和延胡索酸酶B被歸類為I類。[32][33]

第八步:蘋果酸去氫酶
[編輯]
L-蘋果酸在蘋果酸去氫酶(Malate dehydrogenase)的催化作用下,轉化爲草醯乙酸。該過程生成一分子NADH。
與最後一個反應相關的吉布斯自由能顯然是正的(與循環中的其他反應不同)。該酶的活性是由檸檬酸合酶消耗草醯乙酸和電子傳遞鏈消耗NADH 驅動。該反應平衡傾向於蘋果酸一側,但因草醯乙酸不斷消耗,反應得以持續進行。基於上述理由,該反應也是檸檬酸循環的一個重要調控位點[1]:149。
至此,檸檬酸循環完成。生成的草醯乙酸可再次進入檸檬酸循環[2]:335。

添補反應
[編輯]三羧酸循環的中間產物可能會因參與其他代謝過程而消耗,添補反應(Anaplerotic reactions)能夠補充檸檬酸循環的各中間產物.使得其物質量保持相對平衡[35]。添補反應中最重要的一個是在丙酮酸羧化酶催化下,以一分子丙酮酸和一分子二氧化碳分子爲原料,合成一分子草醯乙酸的反應。而在植物體內,乙醛酸循環能起到同樣的作用[2]:343。另外,乳酸可以先氧化爲丙酮酸,然後再通過羧化反應轉化爲草醯乙酸進入檸檬酸循環[1]:152。
總反應式
[編輯]高等動物的檸檬酸循環可用下式表示:[2]:340
乙醯輔酶A+3 NAD+ + FAD + GDP + Pi + 2 H2O →
輔酶A-SH + 3 NADH + 3 H+ + FADH2 + GTP + 2 CO2
- 每一輪檸檬酸循環中,生成三分子NADH、一分子FADH2、一分子GTP、兩個碳原子以CO2的形式離開循環。完整的三羧酸循環進行一輪,草醯乙酸的分子數目不會發生變化,因此,從淨反應的意義上講,可以認爲草醯乙酸起了催化劑的作用[1]:148。
- 兩個碳原子以CO2的形式離開循環。二氧化碳分子數與乙醯輔酶A帶入的碳原子數相同,使整個循環的碳原子數守恆。但值得注意的是,這兩個碳原子不一定就是構成乙醯輔酶A的乙醯基的那兩個碳原子[1]:149。
- 檸檬酸循環生成的NADH、FADH2中蘊藏的化學能會在接下來的氧化磷酸化中轉化至ATP分子中[1]:148。
調控及抑制
[編輯]調控
[編輯]多種途徑均可調控檸檬酸循環的進行。總的來說,當細胞供能充足時(ATP、NADH、乙醯輔酶A等物質濃度升高),檸檬酸循環速度較慢,而當細胞供能處於不足狀態時(ADP濃度高,ATP、NADH濃度低),檸檬酸循環的速度會加快,保證能爲生物體提供適量的ATP以及還原輔酶[8]:370。
首先,因爲檸檬酸循環是呼吸作用的一個環節,對下游的電子傳遞鏈、氧化磷酸化進行調控即可對檸檬酸循環起到調控作用。對檸檬酸循環上游的丙酮酸氧化進行調控也可以起調控檸檬酸活性的作用。另外,也可以通過調控檸檬酸循環中的酶的活性起調控檸檬酸循環的作用。從化學原理上講,對能進行得較徹底的反應進行調控效果較好,因此,丙酮酸去氫酶、檸檬酸合成酶、異檸檬酸去氫酶、α-酮戊二酸去氫酶是較好的調控位點。對檸檬酸循環的調控通常來說與細胞的狀態有密切關係。比如,去氫酶需要鈣離子的活化,而肌肉收縮時,胞內的鈣離子濃度會升高,這也正是需能較高的時候。此外,一些酶也能直接和ATP/ADP,或NADH/NAD+反應,並發生活性變化,比如異檸檬酸去氫酶能經由ADP活化,也可透過ATP/NADH來抑制。蘋果酸去氫酶的活性受NAD+/NADH比值的影響。此外,檸檬酸循環的中間體的濃度也可以對檸檬酸循環的活性起到調控作用。比如,草醯乙酸可以抑制琥珀醯去氫酶的活性。不過,這類調控在體內到底發揮多大的作用,目前還未得到充分研究。[1]:153[2]:342
抑制
[編輯]部分物質可以通過化學作用抑制檸檬酸循環的進行,其中,以下三種物質研究得較透徹:氟乙酸、亞砷酸、丙二酸[1]:151。
其中,氟乙酸通過生成氟乙醯輔酶A,再生成氟代乙醯輔酶A進而生成氟檸檬酸。氟檸檬酸能抑制烏頭酸酶的活性,使得檸檬酸循環無法繼續進行。利用這一原理,可以用氟乙酸製造殺蟲劑或滅鼠藥。[2]:337亞砷酸能抑制α-酮戊二酸去氫酶複合體的酶活性[1]:149。丙二酸與琥珀酸去氫酶的受質琥珀酸結構相似,能通過與該酶發生不可逆結合使其失活[2]:339。
此外,該途徑關鍵的限速酶檸檬酸合酶受ATP、NADH、琥珀醯CoA的抑制。異檸檬酸去氫酶受ATP的抑制。α-酮戊二酸去氫酶系受ATP和琥珀醯CoA的抑制。
與其他代謝過程的關係
[編輯]檸檬酸循環與包括脂肪酸合成、糖異生、轉胺基作用、嘌呤和嘧啶的合成等在內的多種生物體內的代謝過程密切相關[8]:371。
糖異生及轉胺基作用
[編輯]在人的肝、腎中,檸檬酸循環中的草醯乙酸可通過糖質新生作用轉化爲葡萄糖。在糖質新生作用中,最關鍵的酶是磷酸丙酮酸羧基激酶,它可以使草醯乙酸脫羧,生成磷酸丙酮酸,GTP分子爲該反應提供能量。值得注意的是,琥珀醯輔酶A轉化爲琥珀酸過程中生成的GTP分子可用於上述過程,是一個糖異生與檸檬酸循環聯繫的紐帶[1]:150。
檸檬酸循環的一些中間體可通過轉胺基作用,經過一系列反應轉化爲胺基酸。比如,α-酮戊二酸可以轉化爲麩胺酸,草醯乙酸可以轉化爲天門冬胺酸。上述過程是可逆的,即胺基酸也可以通過去胺基作用轉化爲檸檬酸循環的中間體而進入檸檬酸循環分解代謝。不過,胺基酸通過上述途徑分解代謝產生的能量很少,一般情況下,只佔生物體總產能的1%不到[2]:438。
脂肪酸合成
[編輯]在非反芻動物體內,細胞質受質中發生的長鏈脂肪酸合成以乙醯輔酶A爲主要原料。但丙酮酸氧化生成的乙醯輔酶A卻位於粒線體受質內,且乙醯輔酶A是無法穿過粒線體膜的。不過,在烏頭酸酶與受質的結合處於飽和狀態的條件下,粒線體受質中的檸檬酸可轉運到細胞質受質中。細胞質受質中的ATP-檸檬酸解離酶可將檸檬酸裂解爲乙醯輔酶A以及草醯乙酸。後者即可用於脂肪酸合成過程。這樣的機制也能保證只有當檸檬酸循環的強度達到一定強度的條件下,檸檬酸才可以用於脂肪酸合成[1]:153。另外,輸入粒線體的脂肪酸(脂肪的消化產物)也能通過轉化爲乙醯輔酶A進入循環[36]:448。
紫質合成
[編輯]另外,琥珀醯輔酶A亦是紫質環合成的重要中間體,紫質中大部分的碳原子都來自琥珀醯輔酶A。紫質是血紅素蛋白(包括血紅素、肌紅素和細胞色素等)的重要組成成分[8]:371[37]。
參見
[編輯]注釋
[編輯]參考文獻
[編輯]- ^ 1.00 1.01 1.02 1.03 1.04 1.05 1.06 1.07 1.08 1.09 1.10 1.11 Robert K. Murray et al. Haper's Illustrated Biochemistry(哈珀生物化學) (導讀本). 科學出版社. 2010. ISBN 978-7-03-028539-3.
- ^ 2.00 2.01 2.02 2.03 2.04 2.05 2.06 2.07 2.08 2.09 2.10 王鏡岩、朱聖庚、徐長法. 生物化學教程. 高等教育出版社. 2008. ISBN 978-7-04-018363-4.
- ^ The Nobel Prize in Physiology or Medicine 1937. The Nobel Foundation. [2011-10-26]. (原始內容存檔於2007-02-19).
- ^ The Nobel Prize in Physiology or Medicine 1953. The Nobel Foundation. [2011-10-26]. (原始內容存檔於2007-02-22).
- ^ Gest H. Evolutionary roots of the citric acid cycle in prokaryotes. Biochem. Soc. Symp. 1987, 54: 3–16. PMID 3332996.
- ^ Meléndez-Hevia E, Waddell TG, Cascante M. The puzzle of the Krebs citric acid cycle: assembling the pieces of chemically feasible reactions, and opportunism in the design of metabolic pathways during evolution. J. Mol. Evol. September 1996, 43 (3): 293–303. PMID 8703096. doi:10.1007/BF02338838.
- ^ Ebenhöh O, Heinrich R. Evolutionary optimization of metabolic pathways. Theoretical reconstruction of the stoichiometry of ATP and NADH producing systems. Bull. Math. Biol. January 2001, 63 (1): 21–55. PMID 11146883. doi:10.1006/bulm.2000.0197.
- ^ 8.0 8.1 8.2 8.3 8.4 David Hames, Nigel Hooper. Instant Notes in Biochemistry (3rd edition) 精要速覽系列:生物化學. 科學出版社. 2005. ISBN 978-7-03-025218-0 (英語).
- ^ Template:Cita pubblicazione
- ^ Wiegand, Georg; Remington, Stephen J. CITRATE SYNTHASE: Structure, Control, and Mechanism. Annual Review of Biophysics and Biophysical Chemistry. 1986-06, 15 (1) [2024-01-21]. ISSN 0883-9182. doi:10.1146/annurev.bb.15.060186.000525. (原始內容存檔於2022-11-08) (英語).
- ^ 11.0 11.1 Condon, R. Erasmus: Paradigm of Renaissance Humanism Stanley R. Friesen, Padova, Piccin Nuova Libraria, 2001, 164 pages.. Journal of Gastrointestinal Surgery. 2002-08, 6 (4). ISSN 1091-255X. doi:10.1016/s1091-255x(02)00020-3.
- ^ Wiegand, Georg; Remington, Stephen J. CITRATE SYNTHASE: Structure, Control, and Mechanism. Annual Review of Biophysics and Biophysical Chemistry. 1986-06, 15 (1) [2024-01-21]. ISSN 0883-9182. doi:10.1146/annurev.bb.15.060186.000525. (原始內容存檔於2022-11-08) (英語).
- ^ MacDonald, Michael J; Al-Masri, Hussam; Jumelle-Laclau, Muriel; Cruz, Meredith O. Oscillations in Activities of Enzymes in Pancreatic Islet Subcellular Fractions Induced by Physiological Concentrations of Effectors. Diabetes. 1997-12-01, 46 (12). ISSN 0012-1797. doi:10.2337/diab.46.12.1996.
- ^ Bordoni, Bruno; Simonelli, Marta; Morabito, Bruno. The Fascial Breath. Cureus. 2019-07-23. ISSN 2168-8184. doi:10.7759/cureus.5208.
- ^ Lauble, Hanspeter; Stout, Charles David. Steric and conformational features of the aconitase mechanism. Proteins: Structure, Function, and Bioinformatics. 1995-05, 22 (1). ISSN 0887-3585. doi:10.1002/prot.340220102 (英語).
- ^ Olsen, Luke; Hassan, Huzaifa; Xia, Fanning; Keaton, Sarah; Rohner, Nicolas. Cavefish mount a rapid and sustained regenerative response following skeletal muscle injury. Zoological Research. 2023, 44 (4). ISSN 2095-8137. doi:10.24272/j.issn.2095-8137.2022.486.
- ^ M. DE PANFILIS; L. MARCELLI. Il periodo sismico della Sicilia occidentale iniziato il 14 Gennaio 1968. Annals of Geophysics. 2011-05-09, 21 (4). ISSN 2037-416X. doi:10.4401/ag-5072.
- ^ Condon, R. Erasmus: Paradigm of Renaissance Humanism Stanley R. Friesen, Padova, Piccin Nuova Libraria, 2001, 164 pages.. Journal of Gastrointestinal Surgery. 2002-08, 6 (4). ISSN 1091-255X. doi:10.1016/s1091-255x(02)00020-3.
- ^ Robbins, A. H.; Stout, C. D. The structure of aconitase. Proteins: Structure, Function, and Bioinformatics. 1989-01, 5 (4) [2024-01-21]. ISSN 0887-3585. doi:10.1002/prot.340050406. (原始內容存檔於2023-02-11) (英語).
- ^ Beinert, Helmut; Kennedy, Mary Claire. Aconitase, a two‐faced protein: enzyme and iron regulatory factor. The FASEB Journal. 1993-12, 7 (15). ISSN 0892-6638. doi:10.1096/fasebj.7.15.8262329.
- ^ Stoddard, B.L.; Mesecar, A.; Koshland Junior, D.E. ORBITAL STEERING IN THE CATALYTIC POWER OF ENZYMES: SMALL STRUCTURAL CHANGES WITH LARGE CATALYTIC CONSEQUENCES. dx.doi.org. 1997-11-12 [2024-01-21].
- ^ Schowen, Richard L. Principles of biochemistry 2nd ed. (Lehninger, Albert L.; Nelson, David L.; Cox, Michael M.). Journal of Chemical Education. 1993-08, 70 (8) [2024-01-21]. ISSN 0021-9584. doi:10.1021/ed070pa223.1. (原始內容存檔於2023-04-19).
- ^ Yasutake, Yoshiaki; Watanabe, Seiya; Yao, Min; Takada, Yasuhiro; Fukunaga, Noriyuki; Tanaka, Isao. Crystal Structure of the Monomeric Isocitrate Dehydrogenase in the Presence of NADP+. Journal of Biological Chemistry. 2003-09, 278 (38) [2024-01-21]. doi:10.1074/jbc.M304091200. (原始內容存檔於2024-06-04) (英語).
- ^ Carlo di Giuliano di Filippo. Benezit Dictionary of Artists. Oxford University Press http://dx.doi.org/10.1093/benz/9780199773787.article.b00032269. 2011-10-31. 缺少或
|title=為空 (幫助) - ^ Condon, R. Erasmus: Paradigm of Renaissance Humanism Stanley R. Friesen, Padova, Piccin Nuova Libraria, 2001, 164 pages.. Journal of Gastrointestinal Surgery. 2002-08, 6 (4). ISSN 1091-255X. doi:10.1016/s1091-255x(02)00020-3.
- ^ Knapp, James E.; Carroll, Donald; Lawson, Janet E.; Ernst, Stephen R.; Reed, Lester J.; Hackert, Marvin L. Expression, purification, and structural analysis of the trimeric form of the catalytic domain of the Escherichia coli dihydrolipoamide succinyltransferase. Protein Science. 2000-01, 9 (1). ISSN 0961-8368. PMC 2144448
 . PMID 10739245. doi:10.1110/ps.9.1.37 (英語).
. PMID 10739245. doi:10.1110/ps.9.1.37 (英語).
- ^ Condon, R. Erasmus: Paradigm of Renaissance Humanism Stanley R. Friesen, Padova, Piccin Nuova Libraria, 2001, 164 pages.. Journal of Gastrointestinal Surgery. 2002-08, 6 (4). ISSN 1091-255X. doi:10.1016/s1091-255x(02)00020-3.
- ^ 28.0 28.1 Voet, Judith G.; Voet, Donald. Editorial. Biochemical Education. 2000-05, 28 (3). ISSN 0307-4412. doi:10.1111/j.1539-3429.2000.tb00041.x.
- ^ Fraser, Marie E.; James, Michael N.G.; Bridger, William A.; Wolodko, William T. Phosphorylated and dephosphorylated structures of pig heart, GTP-specific succinyl-CoA synthetase. Journal of Molecular Biology. 2000-06, 299 (5). doi:10.1006/jmbi.2000.3807 (英語).
- ^ Oyedotun, Kayode S.; Lemire, Bernard D. The Quaternary Structure of the Saccharomyces cerevisiae Succinate Dehydrogenase. Journal of Biological Chemistry. 2004-03, 279 (10). doi:10.1074/jbc.M311876200 (英語).
- ^ Estévez, Marcel; Skarda, Jeremy; Spencer, Josh; Banaszak, Leonard; Weaver, Todd M. X‐ray crystallographic and kinetic correlation of a clinically observed human fumarase mutation. Protein Science. 2002-06, 11 (6). ISSN 0961-8368. PMC 2373640
 . PMID 12021453. doi:10.1110/ps.0201502 (英語).
. PMID 12021453. doi:10.1110/ps.0201502 (英語).
- ^ Lynch, AM; Morton, CC. FH (fumarate hydratase). Atlas of Genetics and Cytogenetics in Oncology and Haematology. 2011-02, (4). ISSN 1768-3262. doi:10.4267/2042/38351.
- ^ Estévez, Marcel; Skarda, Jeremy; Spencer, Josh; Banaszak, Leonard; Weaver, Todd M. X‐ray crystallographic and kinetic correlation of a clinically observed human fumarase mutation. Protein Science. 2002-06, 11 (6) [2024-01-21]. ISSN 0961-8368. PMC 2373640
 . PMID 12021453. doi:10.1110/ps.0201502. (原始內容存檔於2023-12-16) (英語).
. PMID 12021453. doi:10.1110/ps.0201502. (原始內容存檔於2023-12-16) (英語).
- ^ Nishiyama, M.; Birktoft, J.J.; Beppu, T. Alteration of coenzyme specificity of malate dehydrogenase from Thermus flavus by site-directed mutagenesis.. Journal of Biological Chemistry. 1993-03, 268 (7). ISSN 0021-9258. doi:10.1016/s0021-9258(18)53446-3.
- ^ Owen O, Kalhan S, Hanson R. The key role of anaplerosis and cataplerosis for citric acid cycle function. J. Biol. Chem. 2002, 277 (34): 30409–12 [2016-08-05]. PMID 12087111. doi:10.1074/jbc.R200006200. (原始內容存檔於2008-11-06).
- ^ B. Alberts等著 丁小燕、陳躍磊等譯. 細胞生物學精要(Essential Cell Biology)第三版(中譯本). 科學出版社. 2012. ISBN 978-7-03-033015-4.
- ^ Stryer, Lubert. Citric acid cycle.. In: Biochemistry. Fourth. New York: W.H. Freeman and Company. 1995: 509–527, 569–579, 614–616, 638–641, 732–735, 739–748, 770–7731995. ISBN 0 7167 2009 4.


