立方烷
| 立方烷 | |||
|---|---|---|---|
| |||
| |||
| IUPAC名 Pentacyclo[4.2.0.02,5.03,8.04,7]octane 五環[4.2.0.02,5.03,8.04,7]辛烷 | |||
| 別名 | 五環辛烷 | ||
| 識別 | |||
| CAS號 | 277-10-1 | ||
| ChemSpider | 119867 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | TXWRERCHRDBNLG-UHFFFAOYAL | ||
| ChEBI | 33014 | ||
| 性質 | |||
| 化學式 | C8H8 | ||
| 莫耳質量 | 104.15 g·mol⁻¹ | ||
| 密度 | 1.29 g/cm3 | ||
| 熔點 | 133.5 °C(407 K)([1]) | ||
| 沸點 | 161.6 °C(435 K)([1]) | ||
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |||
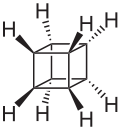
立方烷[2](英語:Cubane)是一種人工合成的烷烴,又稱五環辛烷,化學式為C8H8,外觀為有光澤的晶體。八個碳原子對稱地排列在立方體的八個角上。此烷烴屬於柏拉圖烴的一種。立方烷於1964年由芝加哥大學的Dr. Philip Eaton與Thomas W. Cole首先合成。[3]在他們合成出立方烷之前,人們曾一度認為其不可合成,因為碳碳鍵的鍵角均為90度,張力過大而不穩定。不過當此物質被合成出以後,人們發現它在動力學上很穩定。立方烷生成熱、密度等均很大,因而備受矚目[4]。
立方烷的衍生物用途也較為廣泛。如立方烷的八個頂點全被硝化後得到的八硝基立方烷是一種高能量密度的炸藥[5]。多異氰基立方烷亦是高能量密度材料[4]。
結構[編輯]
立方烷分子結構為立方體型,8個頂角處各有一個碳原子,另各有一個氫原子與之相連。碳原子採用變形的sp3雜化,C-C鍵鍵長155.1pm,大於一般的碳碳單鍵。[6]:99
合成路線[編輯]
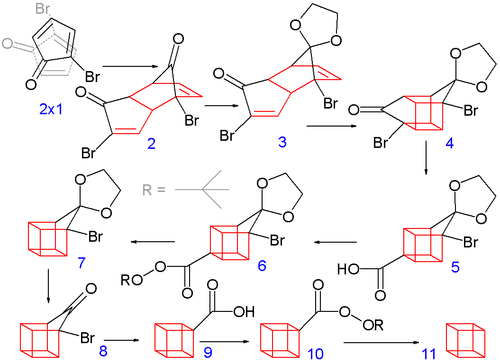
1964年的立方烷有機合成[3][7]比較經典,其起始原料是2-環戊烯酮(即第一部分中的化合物1.1):
| 第一部分:合成立方烷的前體2-溴代環戊二烯酮 |
|---|
在溶劑四氯化碳中,N-溴代丁二醯亞胺上的溴原子取代了2-環戊烯酮烯丙位上的氫,生成化合物1.2,然後在正戊烷 - 二氯甲烷混合溶劑中將其進一步溴化得到三溴代物1.3,後者再在乙醚中被二甲胺消除兩分子溴化氫便可得到2-溴代環戊二烯酮1.4。[3][7]
| 第二部分:合成立方烷 |
|---|
在第二部分中,2.1首先自發地二聚為2.2,這是一個迪爾斯-阿爾德反應,與環戊二烯二聚為雙環戊二烯較為相似。因為每個溴原子都需要與另一溴原子以及羰基保持最小的位阻,另外生成內型產物的過渡態中有次級軌道作用[8]:347[注 1],所以這步反應只生成內型產物,這是後續步驟成功的前提。接著在溶劑苯中,用對甲苯磺酸催化,以乙二醇保護兩個羰基,使其成為縮酮。其中一個被保護的羰基在鹽酸水溶液的作用下會被選擇性去保護,而得到2.3。
在下一步中,內型產物2.3(兩個碳碳雙鍵較為接近)通過光化學[2+2]環加成反應形成了籠狀化合物2.4。在氫氧化鉀的作用下,α-溴代酮通過法沃斯基重排而縮環,轉變為羧酸2.5。隨後,在氯化亞碸的作用下將羧基轉為醯氯,後者與過氧化叔丁醇反應,在吡啶中生成了叔丁基過氧酯2.6。將2.6加熱後可進行脫羧反應變為2.7。同樣地,將另一個羰基去保護,得到2.8,然後以相同的手法通過法沃斯基重排得到2.9,再脫羧得到2.10與2.11,最後在甲醇溶液中析出結晶而得到產品。[3][7]
反應[編輯]
立方烷可以通過金屬離子催化的σ遷移反應轉變為楔形烷[9][10]。
在銠催化劑下,立方烷會轉變成三環辛二烯,後者在50–60 °C下分解成環辛四烯。[11]
參見[編輯]
- 其他柏拉圖烴:
- 名稱獨特的化學物質列表
注釋[編輯]
參考資料[編輯]
- ^ 1.0 1.1 Biegasiewicz, Kyle; Griffiths, Justin; Savage, G. Paul; Tsanakstidis, John; Priefer, Ronny. Cubane: 50 years later. Chemical Reviews. 2015, 115 (14): 6719–6745. PMID 26102302. doi:10.1021/cr500523x.
- ^ 國家教育研究院樂詞網--立方烷. terms.naer.edu.tw. [2023-05-27]. (原始內容存檔於2023-05-27).
- ^ 3.0 3.1 3.2 3.3 Cubaneand Thomas W. Cole. Philip E. Eaton and Thomas W. Cole J. Am. Chem. Soc.; 1964; 86(15) pp 3157 - 3158; doi:10.1021/ja01069a041
- ^ 4.0 4.1 张骥 肖鹤鸣. 多异氰基立方烷生成热的理论研究——高能量密度材料(HEDM)的寻求. 《中国科学:B辑》. 2001 (6). 493-498.. [2014-08-19]. (原始內容存檔於2020-04-10).
- ^ 郑剑. 硝基立方烷及其氮杂衍生物的能量特性计算研究. 《固体火箭技术》. 1995 (1). 45-53.. [2014-08-19]. (原始內容存檔於2020-04-10).
- ^ 周公度. 《化学中的多面体》. 北京大學出版社. 2009年6月. ISBN 9787301092149.
- ^ 7.0 7.1 7.2 The Cubane System Philip E. Eaton and Thomas W. Cole J. Am. Chem. Soc.; 1964; 86(5) pp 962 - 964; doi:10.1021/ja01059a072
- ^ 8.0 8.1 邢其毅等. 《基础有机化学》(第三版)上册. 高等教育出版社. 2005年6月. ISBN 9787040166378.
- ^ Smith, Michael B.; March, Jerry. March's Advanced Organic Chemistry
 5th. John Wiley & Sons. 2001: 1459. ISBN 0-471-58589-0.
5th. John Wiley & Sons. 2001: 1459. ISBN 0-471-58589-0.
- ^ Kindler, K.; Lührs, K. Studien über den Mechanismus chemischer Reaktionen, XXIII. Hydrierungen von Nitrilen unter Verwendung von Terpenen als Wasserstoffdonatoren. Chem. Ber. 1966, 99: 227–232. doi:10.1002/cber.19660990135.
- ^ Cassar, Luigi; Eaton, Philip E.; Halpern, Jack. Catalysis of symmetry-restricted reactions by transition metal compounds. Valence isomerization of cubane. Journal of the American Chemical Society. 1970, 92 (11): 3515–3518 [2023-02-04]. ISSN 0002-7863. doi:10.1021/ja00714a075. (原始內容存檔於2023-02-04) (英語).
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||