鈣
鈣(英語:Calcium),是一種化學元素,化學符號為Ca,原子序數為20,原子量為40.078 u。鈣是一種銀白色鹼土金屬,化學活性頗高,暴露於空氣下就會形成深色的氧化物和氮化物。它的物理和化學性質與其較重的同族元素鍶(Sr)和鋇(Ba)相似。它是地殼中第五豐富的元素,占地殼總質量3%[4],也是地殼中第三豐富的金屬,僅次於鐵和鋁。地球上最常見的鈣化合物是存在於石灰岩和早期海洋生物的化石殘骸的碳酸鈣。石膏、硬石膏,螢石和磷灰石也是鈣的來源。鈣的名稱源自拉丁語 calx,意為石灰。
雖然在很久以前就已經發現許多鈣的化合物,但是在十七世紀後才開始對這些化合物的性質有更深一層的了解。單質鈣直到1808年才由命名這個元素的漢弗里·戴維藉由電解其氧化物分離出來。鈣化合物有廣泛的工業應用:鈣補充劑、在造紙工業中作為漂白劑的使用、水泥和絕緣體的原料以及用於製作肥皂。另一方面,純鈣因為反應性高而用處不多。少量的純鈣用於製造合金,鈣鉛合金也可以做汽車電池。
鈣是人體內第五豐富的元素,也是最豐富的金屬元素。[5]作為電解質,鈣離子在生物體及細胞內的化學反應中扮演重要的角色。鈣離子是第二信使系統的一份子,也是神經元釋放的神經遞質之一。它參與肌肉收縮的過程,也是各種酵素的輔因子。[5]細胞外的鈣離子則負責維持細胞膜內外的電位差,合成蛋白質,並在成骨作用中扮演關鍵角色。[5][6]
性質
[編輯]歸類
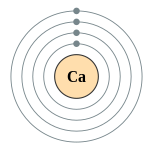
[編輯]鈣是有延展性的銀色金屬(有時描述為淺黃色),性質和較重的鹼土金屬鎂、鍶、鋇和鐳非常相似。一個鈣原子有二十個電子,電子組態為 [Ar]4s2。和其它鹼土金屬一樣,鈣在最外層的s軌域里有兩個價電子,極易在化學反應中失去它們,產生有穩定的惰性氣體電子層結構的二價陽離子。[7]
由於CaX2的標準莫耳生成焓遠高於CaX,CaX2的晶格能也遠大於CaX,因此鈣化合物也多以二價離子化合物存在。 [7]
鹼土金屬中,鈹與同族的鎂、鈣、鍶、鋇相比差別較大,性質更像鋁和鋅,且有貧金屬的性質,這使得某些地區對「鹼土金屬」的傳統定義會把它排除在外。[8]
物理性質
[編輯]鈣的熔點是842 °C,沸點是1494 °C,這些值比相鄰週期的鎂和鍶都高。它的晶體結構和鍶一樣是面心立方晶系,超過450 °C時會轉變成和鎂一樣的六方最密堆積結構。鈣的密度為1.55 g/cm3,是所有鹼土金屬中最小的。[7]
鈣比鉛硬,但仍然可以用刀切割。雖然按體積計算的話,鈣的導電性比銅和鋁差,但由於其密度非常低,按質量計算的話鈣的導電性就會比銅和鋁好。[9]儘管鈣因為會和空氣中的氧氣反應,在大多數作為導體的應用中不可用,但有人已考慮將其用於太空。[9]
化學性質
[編輯]鈣的化學性質與鹼土金屬中的鍶、鋇相似。舉個例子,鈣和水反應生成氫氧化鈣和氫氣的速度比鎂快,但比鍶慢。它也會和空氣中的氧氣和氮氣反應,形成氧化鈣和氮化鈣的混合物。[10]細碎的鈣會在空氣中自發燃燒,形成氮化物。大塊的鈣的反應性較低,會和空氣中的水蒸氣反應,但在濕度低於30%下可以無限期保存。[11]
- 、
- 鈣在空氣中的緩慢氧化[12]
除了簡單氧化物CaO以外,鈣的過氧化物 CaO2可以由金屬鈣被高壓氧氣直接氧化而成,而且有證據表明黃色的超氧化物 Ca(O2)2存在。[13][14]
鈣單質與其氧化物會直接與水發生反應,得到氫氧化鈣 Ca(OH)2,其是一種強鹼,鹼性弱於鍶、鋇和鹼金屬的氫氧化物。[15]
- 鈣、鍶、鋇單質及其氧化物會與水劇烈反應,而鈹和鎂與水的反應十分緩慢[16]
鈣的四種二鹵化物都是已知的,[17]無水氯化鈣可用作乾燥劑,氟化鈣是製取HF和F2的原料[18]。 大多數鹼土金屬的鹽類都難溶於水,碳酸鈣(CaCO3)和硫酸鈣(CaSO4)都是常見的礦物組成。[19]
- 鈣的碳酸鹽在受熱時(1173 K)分解[20]
像鍶和鋇,以及鹼金屬和二價的鑭系元素銪和鐿一樣,金屬鈣可溶於液氨,形成深藍色溶液。[7]
由於Ca2+離子較大,所以它的配位數也較高,在像是CaZn13的金屬間化合物中甚至能達到24。[21]鈣會和含氧的螯合劑如EDTA和多聚磷酸鹽形成螯合物,這個性質可用於分析化學和在硬水中除去鈣離子。在沒有空間位阻影響的情況下,越小的鹼土金屬陽離子形成的錯合物越穩定,但當與多齒配位基螯合形成大環化合物時,該趨勢則相反。[19][22]
雖然同族的鎂可以形成很多常用的有機鎂化合物,有機鈣化合物卻因為更難製造且反應性更強而較少被使用。不過,最近有人已將它們作為可能的催化劑研究。[23][24][25][26][27]由於Yb2+(102 pm)和Ca2+(100 pm)的離子半徑相似,有機鈣化合物的性質更像有機鐿化合物。[28]
大部分有機鈣化合物都只能在低溫下合成,而在這些化合物中使用大位阻基團可以增加穩定性。舉個例子,二茂鈣 Ca(C5H5)2只能由鈣和二茂汞或是環戊二烯反應而成,而將C5H5基團替換成更大的C5(CH3)5增加了化合物的溶解度、揮發性和動力學穩定性。[28]

同位素
[編輯]天然鈣有五種穩定同位素(40Ca、42Ca、43Ca、44Ca和46Ca)和半衰期長到可以看作穩定的48Ca(半衰期4.3 × 1019年)的混合物。鈣是第一種有六個天然同位素的元素。[10]
在這六種同位素中,40Ca最常見,占了天然鈣的96.941%。它是矽燃燒過程中產生的,也是質子數和中子數相等的穩定同位素中最重的。此外,原生同位素40K的衰變也使40Ca的數量不斷增加。40Ca捕獲一個α粒子會產生不穩定的44Ti,後者迅速發生兩次電子捕獲,生成穩定的44Ca。它是第二常見的鈣同位素,占了2.806%。[29][30]
剩下的四種同位素42Ca、43Ca、46Ca和48Ca較為稀有,它們在天然鈣的含量都不足1%。鈣較輕的四種同位素是氧燃燒過程和矽燃燒過程的主要產物,而剩下的兩種重同位素則需要通過中子捕獲產生。46Ca主要在「熱」s-過程中,短壽的45Ca捕獲一個中子而成的,而48Ca則是Ia超新星的r-過程產生的。[29][30]
在分別多出六個和八個中子的核種中,46Ca和48Ca是其中最輕的「穩定」核種。雖然48Ca的中子很多,但它的質子數20和中子數28都是幻數,所以非常穩定。它β衰變成48Sc的過程因為自旋的嚴重失配而受到很大阻礙:48Ca的自旋為0,而48Sc的自旋為6+,所以衰變被角動量的轉化所禁止。因此,48Ca的衰變方式是雙β衰變成48Ti,它也是已知會雙β衰變的同位素里最輕的。[31][32]
46Ca理論上也可以雙β衰變成46Ti,但這個過程仍未被觀察到。最輕也最常見的40Ca的質子數和中子數也都是幻數,理論上可以雙電子捕獲成40Ar,但這也一樣仍未被觀察到。40Ca和46Ca的半衰期下限分別為5.9 × 1021年和2.8 × 1015年。[31]
除開幾乎穩定的48Ca以外,鈣最穩定的放射性同位素是41Ca。它通過電子捕獲衰變成41K,半衰期約為十萬年。自然界中存在痕量的41Ca,它們是由40Ca中子活化而成的。[30]
其它從35Ca到60Ca的放射性鈣同位素也是已知的,它們都比41Ca更短壽。在這之中最穩定的是45Ca(半衰期163天)和47Ca(半衰期4.54天)。比42Ca輕的鈣同位素會正β衰變成鉀的同位素,而比44Ca的鈣同位素會負β衰變成鈧的同位素。不過當這些同位素逼近原子核滴線時,質子發射和中子發射會變成它們的主要衰變方式。[31]
歷史
[編輯]
雖然在很久以前就已經發現許多鈣的化合物,但是在十七世紀後才開始對這些化合物的性質有更深一層的了解。[33]早在公元前7000年,石灰就被用作建材[34]和雕像的熟石膏。[35]第一個石灰窯可以追溯到公元前2500年,於美索不達米亞的哈法耶被發現。[36][37]
石膏(CaSO4·2H2O)是胡夫金字塔的建材,也是圖坦卡蒙陵墓中熟石膏的材料。古羅馬人則通過使用加熱石灰岩(CaCO3)產生的石灰砂漿作為建材。鈣的名稱「calcium」源自拉丁文「calx」,意為石灰。[33]
維特魯威注意到煅燒石灰岩產生的石灰會比原本的石灰岩輕,並把這個現象歸咎於水的沸騰。1755年,約瑟夫·布拉克證明這是因為煅燒過程會釋放二氧化碳氣體,而它並沒有被古羅馬人發現到。[38]
鈣和同族的鎂、鍶和鋇都是由漢弗里·戴維在1808年分離的。繼約恩斯·貝爾塞柳斯和馬格努斯·馬丁·阿夫·龐廷電解的工作後,戴維通過將金屬氧化物與氧化汞的混合物放在鉑板上作為陽極,陰極則是部分浸入汞中的鉑絲。之後,他通過電解產生鈣汞齊和鎂汞齊,然後蒸餾掉汞得到金屬鈣和鎂。[33][39]不過,純鈣不能通過這種方法大量製備,直到一個多世紀後才發現了一種在商業上可行的生產方法。[38]
存在和生產
[編輯]
鈣是地球地殼中第五豐富的元素,也是第三豐富的金屬,僅次於鋁和鐵。[33]它也是月陸中第四豐富的元素。[11]碳酸鈣沉積岩作為以前的海洋生物的化石殘骸,以兩種形式遍布地球表面,分別為三方晶系的方解石(更常見)和正交晶系的霞石(在溫帶海域中形成)。珊瑚、貝殼和珍珠的主要成分都是碳酸鈣。除了方解石和霞石,其它重要的鈣礦包括石膏(CaSO4·2H2O)、硬石膏(CaSO4)、螢石(CaF2)和磷灰石([Ca5(PO4)3F])。[33]
鈣的主要生產者是中國(每年約10000至12000噸)、俄羅斯(每年約6000至8000噸)和美國(每年約2000至4000噸),加拿大和法國也是次要生產國。2005年,全球鈣產量約為24000噸,其中大約一半被美國使用。[9]
俄羅斯和中國仍然使用戴維的電解方法來生產鈣,但用了熔融氯化鈣代替氧化鈣。[9]因為鈣的反應性低於鍶或鋇,所以和空氣反應產生的氧化物-氮化物層是穩定的,可以車床加工。[40]在美國和加拿大,鈣則是由鋁在高溫下還原石灰而成的。[9]
地球化學循環
[編輯]鈣循環提供了地質構造運動、氣候和碳循環之間的聯繫。山脈的隆起會使花崗岩等含鈣岩石經受化學風化作用,並將Ca2+離子釋放到地表水中。這些離子之後會被運輸到海洋,和海水溶解的CO2反應生成石灰石(CaCO
3),沉降到海底並合併到新的岩石中。海水溶解的CO2、碳酸根和碳酸氫根都屬於「溶解無機碳」(DIC)。[41]
實際反應要更複雜,涉及CO2和水在海水pH下反應而成的碳酸氫根離子(HCO−
3):
在海水的pH下,大部分溶解的CO2都會立刻變成HCO−
3。該反應導致一分子CO2從海洋或大氣淨傳輸到岩石圈。[42]反應的結果是化學風化釋放的每個Ca2+離子最終會從地表(大氣、海洋、土壤和生物體)中去除一個CO2分子,並將其儲存到碳酸鹽礦物中停留數億年。因此,岩石中鈣的風化作用會清除海洋和大氣中的CO2,對氣候產生強烈的長期影響。[41][43]
用途
[編輯]由於其對氧和硫的化學親和性很強,金屬鈣最大的用處是煉鋼[44]。它的氧化物和硫化物一旦形成,就會以夾雜物的形式從鋼中浮出,處理後這些夾雜物就會分散在整個鋼中並變成小球狀,從而提高了可鑄性、清潔度和機械性能。鈣也可以生產無需維護的汽車蓄電池,在這些蓄電池中使用了0.1 % 鈣鉛合金來代替常用的銻鉛合金[45],減少了失水量和自放電量。[46]由於存在膨脹和開裂的風險,有時還會將鋁加入這些合金中。鈣鉛合金也用於鑄造。[46]鈣還用於強化用於軸承的鋁合金,控制鑄鐵中的石墨碳以及去除鉛中的鉍雜質。[40]金屬鈣還存在於一些溝渠清潔劑中,它遇水產生的熱和氫氧化鈣可以皂化脂肪和液化阻塞下水道的蛋白質(例如頭髮中的角蛋白)。[47]
除了煉鋼,鈣的反應性還可以用於從高純氬氣中去除氮氣,也是氮氣和氧氣的吸氣劑。它也用於在鉻、鋯、釷和鈾的生產中充當還原劑。鈣也可以用來儲存氫氣,因為它與氫氣反應形成氫化鈣固體,氫氣可以很容易地從其中重新放出。[40]
據報道,鈣同位素在形成礦物時觀察到類似「分餾」的現象。1997年,Skulan和DePaolo觀察到[48]鈣礦中的鈣同位素略比礦物溶液中的鈣同位素輕,這一研究成為了醫學和古海洋學中類似應用的基礎。因此在骨骼被鈣化的動物中,軟組織的鈣同位素豐度可以反映骨骼礦物質形成和溶解的相對速率。[49]
在人體中,尿液中鈣同位素豐度的變化已被證明與骨礦物質平衡的變化有關。當骨頭形成的速率比固體被吸收的速率快時,軟組織的44Ca/40Ca比例會增加,反之亦然。因為這種關係,測量尿液或血液的鈣同位素可能有助於早期檢測骨質疏鬆等代謝性骨病。[49]
類似的系統也存在於海水中。當礦物沉澱去除Ca2+的速率超過新的鈣流向海洋的速率時,海水的44Ca/40Ca的比例趨於上升。1997年,Skulan和DePaolo提出了海水44Ca/40Ca隨地質時間變化的第一個證據,以及對這些變化的理論解釋。最近的論文證實了這一觀察結果,表明海水中的Ca2+濃度不是恆定的,並且海洋在鈣輸入和輸出方面從未處於「穩定狀態」。這個發現具有重要的氣候學意義,因為海洋的鈣循環與碳循環密切相關。[50][51]
很多鈣化合物用於食品、藥品和醫藥等用處。人們會通過添加乳酸鈣、焦磷酸鈣和磷酸鈣來補充食物中的鈣和磷,而磷酸鈣也用作牙膏的拋光劑和抗酸藥。乳糖酸鈣是用作藥物的懸浮劑的白色粉末,磷酸二氫鈣在烘培中可用作膨鬆劑,亞硫酸鈣在造紙中用作漂白劑和消毒劑,矽酸鈣是橡膠的強化劑,而乙酸鈣用於製造肥皂和合成樹脂。[46]
鈣列於世界衛生組織基本藥物標準清單當中。[52]
食物來源
[編輯]富含鈣的食物包括如優格和起司的乳製品、沙丁魚、鮭魚、大豆製品、羽衣甘藍和補充了鈣的穀物片。[6]
由於擔心大量攝入鈣導致的長期副作用(如動脈鈣化和腎結石),美國國家醫學院(IOM)和歐洲食品安全局(EFSA)都對鈣設了可耐受最高攝入量(ULs)。美國國家醫學院定的值是9–18歲不超過3克/日,19–50歲不超過2.5克/日,51歲以上不超過2克/日。[53]歐洲食品安全局定的值對所有成年人都是2.5克/日,但因為兒童和青少年的信息不足而沒有確定他們的可耐受最高攝入量。[54]
對人體的影響
[編輯]| 年齡 | 每天的鈣攝入量(毫克) |
|---|---|
| 1–3歲 | 700 |
| 4–8歲 | 1000 |
| 9–18歲 | 1300 |
| 19–50歲 | 1000 |
| >51歲 | 1000 |
| 孕期 | 1000 |
| 哺乳期 | 1000 |

功能
[編輯]鈣是人體大量需要的生命元素。[5][6]Ca2+離子起到電解質的作用,對肌肉、循環和消化系統的健康至關重要。此外,鈣對於骨骼的構建是必不可少的,而且還參與了血細胞的合成。鈣也調節肌肉收縮、神經傳導和血液的凝固。Ca2+離子可以和很多有機化合物(尤其是蛋白質)形成穩定的錯合物,因此它才能發揮這種作用。鈣化合物的溶解度的範圍很大,使骨骼得以形成。[5][57]
結合
[編輯]鈣離子和蛋白質的結合方式有三種:第一種方式是和麩胺酸或天冬胺酸的羰基結合,第二種方式是和磷酸化的絲胺酸、酪胺酸或蘇胺酸結合,第三種方式則是和γ-羧基化的胺基酸螯合。胰蛋白酶是一種消化酶,它使用第一種結合方式;而骨鈣蛋白是一種骨基質蛋白,它使用第三種結合方式。[58]
一些像是骨橋蛋白和骨涎蛋白等骨基質蛋白同時使用第一種和第二種結合方式。和鈣結合是酶常見的激活方式,其它一些酶的激活方式則是與結合了鈣的酶結合。鈣還與細胞膜的磷脂層結合,錨定與細胞表面相關的蛋白質。[58]
營養
[編輯]鈣是複合維生素的常見成分,[5]但在裡面的是哪種鈣化合物可能會影響其生物利用度。檸檬酸鈣、蘋果酸鈣和乳酸鈣的生物利用度都很高,而草酸鈣的生物利用度較低。其它可用的鈣化合物包括碳酸鈣、檸檬酸蘋果酸鈣和葡萄糖酸鈣。[5]攝入的鈣有約三分之一會以游離離子的形式被腸道吸收,然後由腎臟調節血漿鈣水平。[5]
骨骼的形成和血清的激素調節
[編輯]甲狀旁腺激素和維生素D都可以通過允許和增強鈣離子沉積來促進骨骼的形成,從而在不影響骨量或礦物質含量的情況下實現快速骨轉換。[5]當血漿鈣水平下降時,細胞表面受體會被激活並分泌甲狀旁腺激素,然後通過從腎、腸和骨細胞中提取鈣來刺激鈣進入血漿。甲狀旁腺激素的骨形成作用會被降鈣素拮抗,其分泌隨著血漿鈣水平的增加而增加。[58]
血清鈣水平異常
[編輯]過量攝入鈣會導致高血鈣症,不過因為腸道對鈣的吸收效率相當低,高血鈣症更可能是因為甲狀旁腺激素(PTH)分泌過多或維生素D攝入過多引起的,它們都有利於鈣的吸收。所有這些情況都會導致過量的鈣沉積在心臟、血管或腎臟中。高血鈣症的症狀包括厭食、噁心、嘔吐、記憶力減退、精神錯亂、肌肉無力、排尿增多、脫水和代謝性骨病。[58]
長期高血鈣症通常會導致軟組織的鈣化,並造成嚴重的後果。鈣化會導致血管壁喪失彈性和血流中斷,進而產生易損斑塊和血栓。相反的,鈣或維生素D攝入不足會導致低血鈣症,常由甲狀旁腺激素分泌不足或細胞內的PTH受體有缺陷引起。低血鈣症的症狀包括神經肌肉興奮,這可能會導致手足強直和心臟組織傳導性的破壞。[58]
骨病
[編輯]由於骨骼的發育需要鈣,所以很多骨病都可以追溯到骨骼組織中的有機基質或羥基磷灰石的結構。骨質疏鬆是每單位體積骨骼中礦物質含量的減少,可以通過補充鈣、維生素D和雙膦酸鹽來治療。[5][6]鈣、維生素D和磷酸鹽攝入不足會導致骨質軟化。[58]
危險性
[編輯]| 鈣 | |
|---|---|

| |
| 危險性 | |
GHS危險性符號
| |
| GHS提示詞 | Danger |
| H-術語 | H261 |
| P-術語 | P231+232 |
| NFPA 704 | |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
金屬鈣會與水和酸劇烈反應,所以接觸人體中的水份後會造成嚴重的腐蝕。[59]吞下金屬鈣會嚴重腐蝕口腔、食道和胃,甚至可能致命。[47]長期接觸鈣會不會產生明顯的不利影響仍不明確。[59]
參考文獻
[編輯]- ^ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip J. H.; Gröning, Manfred; Holden, Norman E.; Meijer, Harro A. J. Standard atomic weights of the elements 2021 (IUPAC Technical Report). Pure and Applied Chemistry. 2022-05-04. ISSN 1365-3075. doi:10.1515/pac-2019-0603 (英語).
- ^ Krieck, Sven; Görls, Helmar; Westerhausen, Matthias. Mechanistic Elucidation of the Formation of the Inverse Ca(I) Sandwich Complex [(thf)3Ca(μ-C6H3-1,3,5-Ph3)Ca(thf)3] and Stability of Aryl-Substituted Phenylcalcium Complexes. Journal of the American Chemical Society. 2010, 132 (35): 100818110534020. PMID 20718434. doi:10.1021/ja105534w.
- ^ Weast, Robert. CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. 1984: E110. ISBN 0-8493-0464-4.
- ^ 柯清水 編著. 【新世紀化工化學辭典】 The new century dictionary of chemical engineering and chemistry. 第一版. 正文書局. 2000: 355. ISBN 957-40-0253-5.
- ^ 5.00 5.01 5.02 5.03 5.04 5.05 5.06 5.07 5.08 5.09 Calcium. Linus Pauling Institute, Oregon State University, Corvallis, Oregon. 2017-09-01 [2019-08-31]. (原始內容存檔於2020-06-16).
- ^ 6.0 6.1 6.2 6.3 Calcium: Fact Sheet for Health Professionals. Office of Dietary Supplements, US National Institutes of Health. 2019-07-09 [2019-08-31]. (原始內容存檔於2018-03-17).
- ^ 7.0 7.1 7.2 7.3 Greenwood & Earnshaw 2016,第112-13頁.
- ^ Parish, R. V. The Metallic Elements. London: Longman. 1977: 34. ISBN 978-0-582-44278-8.
- ^ 9.0 9.1 9.2 9.3 9.4 Hluchan & Pomerantz 2006,第484頁.
- ^ 10.0 10.1 C. R. Hammond The elements (pp. 4–35) in Lide, D. R. (編), CRC Handbook of Chemistry and Physics 86th, Boca Raton (FL): CRC Press, 2005, ISBN 0-8493-0486-5
- ^ 11.0 11.1 Hluchan & Pomerantz 2006,第483頁.
- ^ 北京師範大學無機化學教研室_等 2003,第651頁.
- ^ Greenwood & Earnshaw 2016,第119頁.
- ^ Nils-Gösta Vannerberg. F. Albert Cotton , 編. Peroxides, Superoxides, and Ozonides of the Metals of Groups Ia, IIa, and IIb. Progress in Inorganic Chemistry 4. International Journal of Quantum Chemistry. 1962-01-01. doi:10.1002/9780470166055.ch3.
- ^ Greenwood & Earnshaw 2016,第121頁.
- ^ 武漢大學_等校 2011,第796頁.
- ^ Greenwood & Earnshaw 2016,第117頁.
- ^ 北京師範大學無機化學教研室_等 2003,第662頁.
- ^ 19.0 19.1 Greenwood & Earnshaw 2016,第122-15頁.
- ^ 北京師範大學無機化學教研室_等 2003,第661頁.
- ^ Greenwood & Earnshaw 2016,第115頁.
- ^ Cynthia K. Schauer; Oren P. Anderson. Highly polydentate ligands. 5. Structures of alkaline-earth complexes of the calcium-selective ligand EGTA4- (H4EGTA = 3,12-Bis(carboxymethyl)-6,9-dioxa-3,12-diazatetradecanedioic acid). Inorganic Chemistry. 1988, 27 (18): 3118–3130. doi:10.1021/ic00291a015.
- ^ Harder, S.; Feil, F.; Knoll, K. Novel Calcium Half-Sandwich Complexes for the Living and Stereoselective Polymerization of Styrene. Angew. Chem. Int. Ed. 2001, 40 (22): 4261–64. PMID 29712082. doi:10.1002/1521-3773(20011119)40:22<4261::AID-ANIE4261>3.0.CO;2-J.
- ^ Crimmin, Mark R.; Casely, Ian J.; Hill, Michael S. Calcium-Mediated Intramolecular Hydroamination Catalysis. Journal of the American Chemical Society. 2005, 127 (7): 2042–43. PMID 15713071. doi:10.1021/ja043576n.
- ^ Jenter, Jelena; Köppe, Ralf; Roesky, Peter W. 2,5-Bis{N-(2,6-diisopropylphenyl)iminomethyl}pyrrolyl Complexes of the Heavy Alkaline Earth Metals: Synthesis, Structures, and Hydroamination Catalysis. Organometallics. 2011, 30 (6): 1404–13. doi:10.1021/om100937c.
- ^ Arrowsmith, Merle; Crimmin, Mark R.; Barrett, Anthony G. M.; Hill, Michael S.; Kociok-Köhn, Gabriele; Procopiou, Panayiotis A. Cation Charge Density and Precatalyst Selection in Group 2-Catalyzed Aminoalkene Hydroamination. Organometallics. 2011, 30 (6): 1493–1506. doi:10.1021/om101063m.
- ^ Penafiel, J.; Maron, L.; Harder, S. Early Main Group Metal Catalysis: How Important is the Metal?. Angew. Chem. Int. Ed. 2014, 54 (1): 201–06. PMID 25376952. doi:10.1002/anie.201408814.
- ^ 28.0 28.1 Greenwood & Earnshaw 2016,第136-37頁.
- ^ 29.0 29.1 Cameron, A. G. W. Abundance of the Elements in the Solar System (PDF). Space Science Reviews. 1973, 15 (1): 121–46 [2022-07-10]. Bibcode:1973SSRv...15..121C. S2CID 120201972. doi:10.1007/BF00172440. (原始內容 (PDF)存檔於2016-12-28).
- ^ 30.0 30.1 30.2 Clayton, Donald. Handbook of Isotopes in the Cosmos: Hydrogen to Gallium. Cambridge University Press. 2003: 184–98. ISBN 9780521530835.
- ^ 31.0 31.1 31.2 Audi, G.; Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S. The NUBASE2016 evaluation of nuclear properties (PDF). Chinese Physics C. 2017, 41 (3): 030001. Bibcode:2017ChPhC..41c0001A. doi:10.1088/1674-1137/41/3/030001.
- ^ Arnold, R.; et al. Measurement of the double-beta decay half-life and search for the neutrinoless double-beta decay of 48Ca with the NEMO-3 detector. Physical Review D. 2016, 93 (11): 112008. Bibcode:2016PhRvD..93k2008A. S2CID 55485404. arXiv:1604.01710
 . doi:10.1103/PhysRevD.93.112008.
. doi:10.1103/PhysRevD.93.112008.
- ^ 33.0 33.1 33.2 33.3 33.4 Greenwood & Earnshaw 2016,第108頁.
- ^ Miller, M. Michael. Commodity report:Lime (PDF). United States Geological Survey. [2012-03-06]. (原始內容 (PDF)存檔於2011-11-12).
- ^ Garfinkel, Yosef. Burnt Lime Products and Social Implications in the Pre-Pottery Neolithic B Villages of the Near East. Paléorient. 1987, 13 (1): 69–76. JSTOR 41492234. doi:10.3406/paleo.1987.4417.
- ^ Williams, Richard. Lime Kilns and Lime Burning. 2004: 4. ISBN 978-0-7478-0596-0.[失效連結]
- ^ Oates, J. A. H. Lime and Limestone: Chemistry and Technology, Production and Uses. 2008 [2022-07-11]. ISBN 978-3-527-61201-7. (原始內容存檔於2022-07-18).
- ^ 38.0 38.1 Weeks, Mary Elvira; Leichester, Henry M. Discovery of the Elements. Easton, PA: Journal of Chemical Education. 1968: 505–10. ISBN 978-0-7661-3872-8. LCCN 68-15217.
- ^ Davy, H. Electro-chemical researches on the decomposition of the earths; with observations on the metals obtained from the alkaline earths, and on the amalgam procured from ammonia. Philosophical Transactions of the Royal Society of London. 1808, 98: 333–70 [2022-07-11]. Bibcode:1808RSPT...98..333D. doi:10.1098/rstl.1808.0023
 . (原始內容存檔於2021-03-22).
. (原始內容存檔於2021-03-22).
- ^ 40.0 40.1 40.2 Greenwood & Earnshaw 2016,第110頁.
- ^ 41.0 41.1 Berner, Robert. The long-term carbon cycle, fossil fuels and atmospheric composition. Nature. 2003, 426 (6964): 323–26. Bibcode:2003Natur.426..323B. PMID 14628061. S2CID 4420185. doi:10.1038/nature02131.
- ^ Zeebe. Marine carbonate chemistry. National Council for Science and the Environment. 2006 [2010-03-13]. (原始內容存檔於2011-09-03).
- ^ Walker, James C. G.; Hays, P. B.; Kasting, J. F. A negative feedback mechanism for the long-term stabilization of Earth's surface temperature. Journal of Geophysical Research: Oceans. 1981-10-20, 86 (C10): 9776–82. Bibcode:1981JGR....86.9776W. ISSN 2156-2202. doi:10.1029/JC086iC10p09776 (英語).
- ^ 黃淑媛; 羅鋼; 楊健; 徐剛軍; 周軍軍; 鄭慶. 氧含量对超低碳钢炼钢连铸过程夹杂物演变的影响. 煉鋼. 2021, 37 (4): 38–48.
- ^ Lakshmi, C. S.; Manders, J. E.; Rice, D. M. Structure and properties of lead–calcium–tin alloys for battery grids. J. Power Sources. 1998, 73 (1): 23–29. ISSN 0378-7753. doi:10.1016/S0378-7753(98)00018-4.
- ^ 46.0 46.1 46.2 Hluchan & Pomerantz 2006,第485-87頁.
- ^ 47.0 47.1 Rumack BH. POISINDEX. Information System Micromedex, Inc., Englewood, CO, 2010; CCIS Volume 143. Hall AH and Rumack BH (Eds)
- ^ Skulan, J.; Depaolo, D. J.; Owens, T. L. Biological control of calcium isotopic abundances in the global calcium cycle. Geochimica et Cosmochimica Acta. June 1997, 61 (12): 2505–10. Bibcode:1997GeCoA..61.2505S. doi:10.1016/S0016-7037(97)00047-1.
- ^ 49.0 49.1 Skulan, J.; Bullen, T.; Anbar, A. D.; Puzas, J. E.; Shackelford, L.; Leblanc, A.; Smith, S. M. Natural calcium isotopic composition of urine as a marker of bone mineral balance. Clinical Chemistry. 2007, 53 (6): 1155–58. PMID 17463176. doi:10.1373/clinchem.2006.080143
 .
.
- ^ Fantle, M.; Depaolo, D. Ca isotopes in carbonate sediment and pore fluid from ODP Site 807A: The Ca2+(aq)–calcite equilibrium fractionation factor and calcite recrystallization rates in Pleistocene sediments. Geochim Cosmochim Acta. 2007, 71 (10): 2524–46. Bibcode:2007GeCoA..71.2524F. doi:10.1016/j.gca.2007.03.006.
- ^ Griffith, Elizabeth M.; Paytan, Adina; Caldeira, Ken; Bullen, Thomas; Thomas, Ellen. A Dynamic marine calcium cycle during the past 28 million years. Science. 2008, 322 (12): 1671–74. Bibcode:2008Sci...322.1671G. PMID 19074345. S2CID 206515318. doi:10.1126/science.1163614.
- ^ World Health Organization. World Health Organization model list of essential medicines: 21st list 2019. Geneva: World Health Organization. 2019. hdl:10665/325771
 . WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
. WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
- ^ Institute of Medicine (US) Committee to Review Dietary Reference Intakes for Vitamin D Calcium; Ross, A. C.; Taylor, C. L.; Yaktine, A. L.; Del Valle, H. B. ch 6. Tolerable Upper Intake Levels. Dietary Reference Intakes for Calcium and Vitamin D. Washington, D.C: National Academies Press. 2011: 403–56 [2022-07-12]. ISBN 978-0-309-16394-1. PMID 21796828. doi:10.17226/13050. (原始內容存檔於2019-08-31).
- ^ Tolerable Upper Intake Levels For Vitamins And Minerals (PDF), European Food Safety Authority, 2006 [2022-07-12], (原始內容 (PDF)存檔於2016-03-16)
- ^ Institute of Medicine (US) Committee to Review Dietary Reference Intakes for Vitamin D Calcium; Ross, A. C.; Taylor, C. L.; Yaktine, A. L.; Del Valle, H. B. ch. 5. Dietary Reference Intakes. Dietary Reference Intakes for Calcium and Vitamin D. Washington, D.C: National Academies Press. 2011: 345–402 [2022-07-13]. ISBN 978-0-309-16394-1. PMID 21796828. doi:10.17226/13050. (原始內容存檔於2019-12-07).
- ^ Balk EM, Adam GP, Langberg VN, Earley A, Clark P, Ebeling PR, Mithal A, Rizzoli R, Zerbini CA, Pierroz DD, Dawson-Hughes B. Global dietary calcium intake among adults: a systematic review. Osteoporosis International. December 2017, 28 (12): 3315–24. PMC 5684325
 . PMID 29026938. doi:10.1007/s00198-017-4230-x.
. PMID 29026938. doi:10.1007/s00198-017-4230-x.
- ^ Sosa Torres, Martha; Kroneck, Peter M.H; "Introduction: From Rocks to Living Cells" pp. 1–32 in "Metals, Microbes and Minerals: The Biogeochemical Side of Life" (2021) pp. xiv + 341. Walter de Gruyter, Berlin. Editors Kroneck, Peter M.H. and Sosa Torres, Martha. doi:10.1515/9783110589771-001
- ^ 58.0 58.1 58.2 58.3 58.4 58.5 Hluchan & Pomerantz 2006,第489-94頁.
- ^ 59.0 59.1 Hluchan & Pomerantz 2006,第487-89頁.
擴展閱讀
[編輯]- Greenwood, Norman Neill; Earnshaw, Alan. Chemistry of the elements. 2016. ISBN 978-0-7506-3365-9. OCLC 1040112384 (英語).
- Hluchan, Stephen E.; Pomerantz, Kenneth, Calcium and Calcium Alloys, Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA, 2006-04-15, doi:10.1002/14356007.a04_515.pub2
- 北京師範大學無機化學教研室 等 (編). 《无机化学》 下册. 北京: 高等教育出版社. 2003. ISBN 978-7-04-011583-3.
- 武漢大學 等校 (編). 《无机化学》 下册. 北京: 高等教育出版社. 2011. ISBN 978-7-04-004880-3.
外部連結
[編輯]- 元素鈣在洛斯阿拉莫斯國家實驗室的介紹(英文)
- EnvironmentalChemistry.com —— 鈣(英文)
- 元素鈣在The Periodic Table of Videos(諾丁漢大學)的介紹(英文)
- 元素鈣在Peter van der Krogt elements site的介紹(英文)
- WebElements.com – 鈣(英文)