铱:修订间差异
K1234567890y(留言 | 贡献) 小无编辑摘要 |
Yinweichen(留言 | 贡献) 无编辑摘要 |
||
| 第5行: | 第5行: | ||
|enname=Iridium |
|enname=Iridium |
||
|left=[[鋨]] |
|left=[[鋨]] |
||
|right=[[鉑]] |
|right=[[鉑]] |
||
|above=[[銠]] |
|above=[[銠]] |
||
|below=[[䥑]] |
|below=[[䥑]] |
||
|series=過渡金屬 |
|series=過渡金屬 |
||
|group=9 |
|group=9 |
||
| 第91行: | 第91行: | ||
|first isolation date=1803 |
|first isolation date=1803 |
||
}} |
}} |
||
'''銥'''是一种化学[[元素]],[[化学符号]]是'''Ir''',[[原子序数]]77。 |
|||
'''銥'''是一種[[化學元素]],符號為'''Ir''',[[原子序]]為77。銥屬於[[鉑系元素|鉑系]][[過渡金屬]],質地堅硬易碎,呈銀白色。銥是繼[[鋨]]之後第二[[硬度|堅硬]]的元素,其耐[[腐蝕]]性也是所有元素中最高的,甚至在2000 °C高溫下仍然能抵抗腐蝕。雖然固態銥只能被少數熔融鹽和[[鹵素]]侵蝕,但是銥粉末的反應性則高得多,可以輕易燃燒。 |
|||
銥於1803年在[[鉑]]的不溶雜質中被發現。主要發現者[[史密森·特南特]](Smithson Tennant),將其命名為Iridium,其名源自虹神[[伊里斯]],因其有許多不同顏色的鹽類。銥是一種稀有元素,在地球的[[地殼]]上年產量和消費量為三[[噸]]。銥191和銥193是僅有的兩個天然[[同位素]],也是唯一的[[穩定同位素]],銥193較銥191豐富。 |
|||
1803年,[[史密森·特南特]]在自然[[鉑]]礦石的不可溶雜質中發現了銥元素。由於該元素的鹽有眾多鮮豔的顏色,所以他根據[[希臘神話]]中的彩虹女神[[伊里斯]](Iris)把這一新元素命名為「Iridium」。銥是地球地殼中[[地球的地殼元素豐度列表|最稀有的元素]]之一。其全球年產量及年消耗量只有三噸。自然產生的銥由穩定[[同位素]]<sup>191</sup>Ir和<sup>193</sup>Ir組成,後者的比例較高。 |
|||
自然界中銥通常存在於自然合金中或以單質(指未與其他元素形成化合物而存在的狀況)存在,尤常見於自然的鋨銥合金礦(iridium–osmium alloys)中。在鎳或銅的礦床中,鉑族元素亦可能以硫化物(如(Pt,Pd)S)、碲化物(如PtBiTe)、銻化物(如PdSb)或砷化物(如{{chem|PtAs|2}})等形式存在,在所有的這些化合物中的鉑原子可能為少量的銥與鋨原子所取代;此外,就如同所有的鉑族元素一般,銥可能會以合金的形式出現於自然銅(Native Copper,一種在其中銅以單質存在的礦物)或鎳的礦物中。<ref>{{cite journal| doi = 10.1016/j.mineng.2004.04.001| journal = Minerals Engineering| volume = 17| year = 2004| pages = 961–979| title =Characterizing and recovering the platinum group minerals—a review| first = Z.| last = Xiao| coauthors= Laplante, A. R.| issue = 9–10}}</ref> |
|||
最有實用價值的銥化合物包括它的鹽以及它與[[氯]]所產生的酸。銥還可以形成多種[[有機金屬化學|有機金屬化合物]],用於工業[[催化]]反應和科學研究當中。銥金屬可用作高耐蝕性高溫工具的材料,用於製造[[火花塞]]、高溫[[半導體]]再結晶過程所用的[[坩堝]]以及[[氯鹼法]]所用的電極等等。一些[[放射性同位素熱電機]]也有用到銥的[[放射性同位素]]。 |
|||
== 物理性质 == |
|||
一些落到地球的[[隕石]]的含銥量比其周邊環境高出許多。[[K-T界線]](白堊紀﹣第三紀)黏土層上的銥含量異常高,因此科學家提出假說,稱某大型天體在6600萬年前撞擊地球,導致包括[[恐龍]]在內的許多物種滅絕,即[[白堊紀-第三紀滅絕事件]]。根據估算,地球中銥的總含量應比地殼中的銥含量要高很多。但與其他鉑系金屬一樣,銥具有高密度,且容易與[[鐵]]結合,因此地球剛形成時的大部份銥都已沉到地底深處。 |
|||
铱是一種硬度高且脆,銀白色的[[鉑族]][[過渡金屬]],高温时可压成薄片或拉丝。銥是[[密度]]第二高個的元素(次於[[鋨]]),即使在測試溫度2000℃的高溫,銥也仍是最耐腐蝕,耐磨的材料。 |
|||
== |
==性質== |
||
===物理性質=== |
|||
[[File:iridium2.jpg|left|thumb|1[[金衡盎司]](約31.1克)電弧熔煉的銥金屬]] |
|||
銥屬於[[鉑系元素|鉑系]]金屬,和[[鉑]]一樣呈白色,另帶少許黃色。銥堅硬易碎,[[熔點]]也非常高,所以很難鑄造和塑性。製造工序因此一般使用[[粉末冶金]]。<ref name="greenwood" />銥是唯一一種在1600 °C以上的空氣中仍保持優良力學性質的金屬。<ref name="hunt" />其[[沸點]]極高,在所有元素中排第10位。銥在0.14 [[開爾文|K]]以下會呈現[[超導體]]性質。<ref>{{cite book|last=Kittel |first=C.|title=Introduction to Solid state Physics, 7th Edition |publisher=Wiley-India |year=2004 |isbn=81-265-1045-5}}</ref> |
|||
銥的[[彈性模量]]在[[鋨]]以下,為所有金屬中第二高。<ref name="hunt" />其[[剪切模量]]很高,[[泊松比]]很低,因此具有很高的[[剛度]],使得銥的加工生產過程非常困難。儘管生產不易,價格昂貴,但銥還是有多項應用,包括在極端條件下加強機械的強度。<ref name="hunt" /> |
|||
某些鹽類和[[鹵素]]對固體銥有腐蝕性。當銥被磨成粉末將更具化學活性且易燃。铱亦像锇一样,在[[合金]]中更能抵抗高温及腐蚀,例如用在高温装置或电子开关等地方。 |
|||
銥的[[密度]]在所有元素中排第二位,僅比[[鋨]]稍低(低約0.12%)。<ref>{{cite journal|title=Osmium, the Densest Metal Known|author=Arblaster, J. W.|journal=Platinum Metals Review|volume=39|issue=4|year=1995|pages=164|url=http://www.platinummetalsreview.com/dynamic/article/view/pmr-v39-i4-164-164}}</ref><ref>{{cite book|last = Cotton|first = Simon|title = Chemistry of Precious Metals| page = 78|publisher = Springer-Verlag New York, LLC|year = 1997|isbn = 978-0-7514-0413-5}}</ref>由於密度值十分相近,測量也並不容易,所以這兩個元素到底哪一個密度更高曾經並沒有定論。<ref name="crc">{{cite book| author=Lide, D. R.| title=CRC Handbook of Chemistry and Physics (70th Edn.)| publisher=Boca Raton (FL):CRC Press| year=1990}}</ref>不過,[[X射線晶體學]]技術大大提高了測量密度的準確度,最終得出銥和鋨的密度值分別為22.56 g/cm<sup>3</sup>和22.59 g/cm<sup>3</sup>。<ref>{{cite journal|url=http://www.platinummetalsreview.com/pdf/pmr-v33-i1-014-016.pdf|format=PDF|title=Densities of osmium and iridium: recalculations based upon a review of the latest crystallographic data|author=Arblaster, J. W.|journal=Platinum Metals Review|volume=33|issue=1|year=1989|pages=14–16}}</ref> |
|||
== 用途 == |
|||
===化學性質=== |
|||
最重要的銥化合物為其鹽類和[[氯]]化的酸類 ,銥也可以形成有機金屬化合物,作為工業用催化劑和研究用途,例如用于化学工业上合成醋酸的Cativa<sup>TM</sup> 催化法需要使用铱的羰基配合物[Ir(CO)<sub>2</sub>I<sub>2</sub>]<sup>−</sup>。 |
|||
銥是抗腐蝕性最強的金屬之一:<ref name="Emsley" />它能夠在高溫下抵禦幾乎所有[[酸]]、[[王水]]、熔融金屬,甚至是矽酸鹽。但是某些熔融[[鹽]],如[[氰化鈉]]和[[氰化鉀]],<ref name="Emsley" />以及[[氧]]和[[鹵素]](特別是[[氟]])在高溫下還是可以侵蝕銥的。<ref name="perry">{{cite book|title = Handbook of Inorganic Compounds|author=Perry, D. L.|pages = 203–204| year = 1995| isbn = 1439814619| publisher = CRC Press}}</ref><ref name="lagowski">{{cite book|title = Chemistry Foundations and Applications| volume = 2|editor = Lagowski, J. J.| pages=250–251| year = 2004| isbn = 0028657233| publisher = Thomson Gale}}</ref> |
|||
===化合物=== |
|||
銥目前使用於需要在高耐蝕性,高溫工作環境的設備,如[[火星塞]],[[坩堝]](高溫下的半導體再結晶)和生產氯氣的[[氯鹼法]]之電極。因其抗腐蝕性,銥也用於[[放射性同位素熱電機]]的保護層 。 |
|||
{|class="wikitable" style="float:right;margin:1em" |
|||
|- |
|||
! colspan=2| 氧化態<ref group="注">最常見的氧化態以粗體表示。右欄為擁有該氧化態的其中一種化合物。</ref> |
|||
|- |
|||
| −3||{{chem|[Ir(CO)|3|]|3-}} |
|||
|- |
|||
| −1||{{chem|[Ir(CO)|3|(PPh|3|)]|-}} |
|||
|- |
|||
| '''0'''||{{chem|Ir|4|(CO)|12}} |
|||
|- |
|||
| +1||{{chem|[Ir(CO)Cl(PPh|3|)|2|]}} |
|||
|- |
|||
| +2||{{chem|IrCl|2}} |
|||
|- |
|||
| '''+3'''||{{chem|IrCl|3}} |
|||
|- |
|||
| '''+4'''||{{chem|IrO|2}} |
|||
|- |
|||
| +5||{{chem|Ir|4|F|20}} |
|||
|- |
|||
| +6||{{chem|IrF|6}} |
|||
|} |
|||
{{Category see also|铱化合物}} |
|||
銥化合物的氧化態介乎−3和+6,最常見的有+3和+4。<ref name="greenwood" />高氧化態的化合物比較罕見,包括[[六氟化銥|{{chem|IrF|6}}]]和兩種混合氧化物{{chem|Sr|2|MgIrO|6}}及{{chem|Sr|2|CaIrO|6}}。<ref name="greenwood">{{cite book| last=Greenwood|first = N. N.|coauthors = Earnshaw, A.| title=Chemistry of the Elements|edition = 2nd|publisher=Oxford: Butterworth–Heinemann| year=1997| isbn=0-7506-3365-4|pages=1113–1143, 1294| oclc=213025882 37499934 41901113}}</ref><ref>{{cite journal| last = Jung| first = D.| title = High Oxygen Pressure and the Preparation of New Iridium (VI) Oxides with Perovskite Structure: {{chem|Sr|2|MIrO|6}} (M = Ca, Mg)| journal = Journal of Solid State Chemistry| volume = 115| issue = 2| year = 1995|pages = 447–455| doi= 10.1006/jssc.1995.1158|bibcode = 1995JSSCh.115..447J| last2 = Demazeau| first2 = Gérard }}</ref>2009年,科學家利用[[基質隔離]]方法(在6 K的[[氬]]氣中)對過氧化銥配合物進行[[紫外線]]照射,製成了[[四氧化銥]]({{chem|IrO|4}})。然而這一化合物預計在更高的溫度下無法穩定保持固體狀態。<ref>{{cite journal|title=Formation and Characterization of the Iridium Tetroxide Molecule with Iridium in the Oxidation State +VIII|journal=Angewandte Chemie International Edition|volume=48|year=2009|pages=7879–7883|author=Gong, Y.; Zhou, M.; Kaupp, M.; Riedel, S.|doi=10.1002/anie.200902733|issue=42}}</ref> |
|||
[[二氧化銥]]({{chem|IrO|2}})為棕色粉末,是銥唯一一種性質已經過充分研究的氧化物。<ref name="greenwood" />三氧化二銥是一種黑藍色粉末,在硝酸中會氧化成{{chem|IrO|2}}。<ref name="perry" />其他已知的化合物包括二硫化銥、二硒化銥、三硫化二銥和三硒化二銥等,另外也有研究指出{{chem|IrS|3}}的存在。<ref name="greenwood" />銥還可以形成氧化態為+4和+5的銥酸,如{{chem|K|2|IrO|3}}和{{chem|KIrO|3}}。在高溫下使銥與[[氧化鉀]]或[[超氧化鉀]]反應,就可取得這些銥酸。<ref>{{cite journal|title=The chemistry of ruthenium, osmium, rhodium, iridium, palladium and platinum in the higher oxidation states|journal=Coordination Chemistry Reviews|volume=46|year=1982|pages=1–127|author=Gulliver, D. J; Levason, W.|doi=10.1016/0010-8545(82)85001-7}}</ref> |
|||
汽車工業界,銥可用於製作高檔次[[火花塞]]的放電極,其性能優於銅質火花塞。 |
|||
目前尚未發現化學式為{{chem|Ir|''x''|H|''y''}}的[[氫]]銥[[二元化合物]],但有些已知配合物包含{{chem|IrH|5|4-}}和{{chem|IrH|6|3-}}離子,其中銥的氧化態分別為+1和+3。<ref>{{cite book| last = Holleman| first = A. F.| coauthors = Wiberg, E.; Wiberg, N.| title=Inorganic Chemistry, 1st Edition| publisher=Academic Press| year=2001| isbn=0-12-352651-5| oclc =47901436}}</ref>科學家認為,{{chem|Mg|6|Ir|2|H|11}}當中同時存在{{chem|IrH|5|4-}}以及含18個電子的{{chem|IrH|4|5-}}離子。<ref>{{cite journal| last = Černý| first = R.|coauthors = Joubert, J.-M.; Kohlmann, H.; Yvon, K.| title = {{chem|Mg|6|Ir|2|H|11}}, a new metal hydride containing saddle-like {{chem|IrH|4|5-}} and square-pyramidal {{chem|IrH|5|4-}} hydrido complexes| journal = Journal of Alloys and Compounds| volume = 340| issue = 1–2| year = 2002|pages = 180–188| doi=10.1016/S0925-8388(02)00050-6}}</ref> |
|||
由於銥耐磨的特性,過去也大量用於[[鋼筆]]之[[鋼筆#筆尖|筆尖]]。於筆尖上附上一塊耐磨之鉑銥合金,稱為銥點。現今仍保留銥點之稱呼,但已很少含有銥<ref>{{cite web|url=http://www.nibs.com/article4.html|title=Where's the Iridium?|work=The Nibster}}</ref>。 |
|||
銥並不形成一鹵化物和二鹵化物,而是會與每一種鹵素形成對應的三鹵化物{{chem|IrX|3}}。<ref name="greenwood" />氧化態為+4或以上的鹵化物只有[[四氟化銥]]、[[五氟化銥]]和[[六氟化銥]]。<ref name="greenwood" />六氟化銥({{chem|IrF|6}})是一種反應性很高的揮發性黃色固體,其分子結構呈[[八面體]]形。它在水中會分解,而且銥黑(即金屬銥粉末)可將其還原成晶體狀的四氟化銥({{chem|Ir||F|4}})。<ref name="greenwood" />五氟化銥的特性相似,但它其實是一種[[四聚體]]{{chem|Ir|4|F|20}},由四個角對角連接的八面體所形成。<ref name="greenwood" /> |
|||
铱可在[[铂]]矿中发现。熔点、硬度都比铂高。铱铂合金曾被用于制作国际公尺原器,用10%铱和90%铂的合金制成[[国际米尺]],作为长度单位米的标准。 |
|||
[[File:Vaska's-complex-2D.png|thumb|left|[[羰基二(三苯基膦)氯化銥|沃什卡配合物]]的結構]] |
|||
== 其他相关信息 == |
|||
工業上最重要的銥化合物是六氯銥酸({{chem|H|2|IrCl|6}})及其銨鹽。<ref name="ullmann-pt" />銥的純化過程、大多數銥化合物的生產初始步驟以及[[陽極]]塗層的製備過程都要用到這些化合物。{{chem|IrCl|6|2-}}離子呈棕黑色,能夠輕易還原成淺色的{{chem|IrCl|6|3-}},且該反應可以逆轉。<ref name="ullmann-pt" />[[三氯化銥]]({{chem|IrCl|3}})常被用作其他Ir(III)化合物的製備原料。<ref name="greenwood" />氯和銥粉末在650 °C經氧化反應會形成無水三氯化銥,<ref name="ullmann-pt" />而{{chem|Ir|2|O|3}}溶於[[氫氯酸]]中則可製成水合三氯化銥。另一種類似的製備原料是六氯銥酸銨({{chem|(NH|4|)|3|IrCl|6}})。三價銥配合物具[[抗磁性]],分子結構一般為八面體型。<ref name="greenwood" /> |
|||
銥的有機化合物含有銥﹣[[碳]]鍵,其中銥的氧化態通常較低。比如,[[十二羰基四銥]]({{chem|Ir|4|(CO)|12}})是最常見兼最穩定的[[金屬羰基配合物]],當中的銥就處於0氧化態。<ref name="greenwood" />十二羰基四銥中的每一個銥原子都與另外三個鍵合,形成四面體[[原子簇]]。一些重要的Ir(I)有機化合物都是以發現者命名的。這包括[[羰基二(三苯基膦)氯化銥|沃什卡配合物]]({{chem|IrCl(CO)[P(C|6|H|5|)|3|]|2}}),它會與{{chem|O|2}}氧分子鍵合,這種特性十分特殊。<ref>{{cite journal| first =L.| last= Vaska| coauthors = DiLuzio, J.W.| title = Carbonyl and Hydrido-Carbonyl Complexes of Iridium by Reaction with Alcohols. Hydrido Complexes by Reaction with Acid|journal=[[Journal of the American Chemical Society]]|year = 1961|volume = 83|pages = 2784–2785| doi = 10.1021/ja01473a054| issue =12}}</ref>[[克拉布特利催化劑]](Crabtree's catalyst)是一種用於[[氫化]]反應的均相催化劑。<ref>{{cite journal|first = R. H.| last = Crabtree| title = Iridium compounds in catalysis| journal = Accounts of Chemical Research| year = 1979| volume = 12| pages = 331–337| doi = 10.1021/ar50141a005|issue = 9}}</ref>這些化合物都屬於平面正方形d<sup>8</sup>配合物,共有16個[[價電子]],因此反應性很高。<ref>{{cite book| title=The Organometallic Chemistry of the Transition Metals| url=http://chimicibicocca.altervista.org/data/chimica_lucidi.pdf| author=Crabtree, R. H.| year=2005| publisher=Wiley| isbn=0471662569| oclc=224478241}}</ref> |
|||
[[铱卫星]]是一组拥有66枚卫星的洲际通讯系统。它本来设计有77枚卫星,所以用有77个电子的铱元素命名。 |
|||
===同位素=== |
|||
在[[K-T界線]]粘土層有不尋常高豐度的銥,引起了[[阿爾瓦茲假說]],該假說解釋在6500萬年前一個巨大的[[隕石]]撞擊地殼,所造成[[恐龍]]以及許多其他物種的滅絕,因為銥在隕石中的豐度遠高於地球的地殼平均豐度。一般認為銥在地球上的總量應高於在地殼岩石的觀察,當地球剛誕生,還是熔融狀態時,因銥與其他鉑類金屬的高密度和讓他們有和鐵鍵結的趨勢,造成大量的銥下沉到地殼以下和鐵結合。 |
|||
{{Main|銥的同位素}} |
|||
銥有兩種自然穩定[[同位素]]:<sup>191</sup>Ir和<sup>193</sup>Ir,[[豐度]]分別為37.3%和62.7%。<ref name="nubase" />已人工合成的[[放射性同位素]]共有34種,[[質量數]]從164至199不等。<sup>192</sup>Ir夾在兩個穩定同位素之間,也是最穩定的放射性同位素,[[半衰期]]為73.827天。這一同位素在[[近距離治療]]<ref name="mager" />和工業[[射線照相]]技術中具有用途,特別是在天然氣工業中用於無損檢測鋼鐵的焊接處。銥-192曾造成多宗輻射意外。另外有三個同位素的半衰期在一天以上:<sup>188</sup>Ir、<sup>189</sup>Ir和<sup>190</sup>Ir。<ref name="nubase" />質量數低於191的同位素會同時進行[[β衰變|β<sup>+</sup>衰變]]、[[α衰變]]以及[[質子發射]],但有兩者除外:<sup>189</sup>Ir進行[[電子捕獲]],而<sup>190</sup>Ir進行[[正電子發射]]。質量數高於191的同位素則進行[[β衰變|β<sup>−</sup>衰變]],其中<sup>192</sup>Ir會少量進行電子捕獲。<ref name="nubase">{{cite journal| last = Audi| first = G.| title = The NUBASE Evaluation of Nuclear and Decay Properties| journal = Nuclear Physics A| volume = 729| pages = 3–128| publisher = Atomic Mass Data Center| year = 2003| doi=10.1016/j.nuclphysa.2003.11.001|bibcode = 2003NuPhA.729....3A| last2 = Bersillon| first2 = O.| last3 = Blachot| first3 = J.| last4 = Wapstra| first4 = A.H. }}</ref>所有銥同位素都是在1934至2001年間發現的,其中最新發現的是<sup>171</sup>Ir。<ref>{{cite journal|title=The discoverers of the iridium isotopes: the thirty-six known iridium isotopes found between 1934 and 2001|author=Arblaster, J. W.|journal=Platinum Metals Review|volume=47|issue=4|year=2003|pages=167–174|url=http://www.platinummetalsreview.com/dynamic/article/view/47-4-167-174}}</ref> |
|||
銥共有32種已知[[同核異構體]],質量數介乎164到197。最穩定的同核異構體是<sup>192m2</sup>Ir,它會經同核異能躍遷,半衰期為241年,<ref name="nubase" />因此比所有處於基態的放射性同位素都要穩定。最不穩定的異構體是<sup>190m3</sup>Ir,其半衰期只有2微秒。<ref name="nubase" /><sup>191</sup>Ir是所有元素中首個被證實呈現[[穆斯堡爾效應]]的同位素。該同位素應用在[[穆斯堡爾譜學|穆斯堡爾光譜分析]]中,在物理學、化學、生物化學、冶金學和礦物學等領域都有用到。<ref name="ir-191" /> |
|||
{{过渡金属|Ir}} |
|||
{{Elements.links|Ir|77}} |
|||
{{過渡金屬3}} |
|||
{{珠寶材料}} |
|||
==歷史== |
|||
[[File:Winged goddess Cdm Paris 392.jpg|thumb|希臘神話中的[[伊里斯]]。銥就是以她命名的。]] |
|||
銥的發現與鉑以及其他[[鉑系]]元素息息相關。古[[埃塞俄比亞]]人<ref name="Egypt">{{cite journal| title = The So-Called 'Platinum' Inclusions in Egyptian Goldwork| first = J. M.| last = Ogden| journal = The Journal of Egyptian Archaeology| volume = 62| year = 1976| pages = 138–144| jstor = 3856354| doi = 10.2307/3856354}}</ref>和南美洲各文化的人<ref name="preCol">{{cite journal| journal = Platinum Metals Rev.| year = 1980| volume = 24| issue = 21| pages = 70–79| title =The Powder Metallurgy of Platinum| first = J. C.| last =Chaston}}</ref>自古便有使用自然產生的鉑金屬,當中必定含有少量其他鉑系元素,這也包括銥。17世紀[[西班牙征服者]]在今天的[[哥倫比亞]][[喬科省]]發現了鉑,並將其帶到歐洲。<ref>{{cite journal|title=The Platinum of New Granada: Mining and Metallurgy in the Spanish Colonial Empire|author=McDonald, M.|journal=Platinum Metals Review|volume=3|issue=4|year=959|pages=140–145|url=http://www.platinummetalsreview.com/dynamic/article/view/pmr-v3-i4-140-145}}</ref>然而直到1748年,科學家才發現它並不是任何已知金屬的合金,而是一種全新的元素。<ref>{{cite book|author=Juan, J.; de Ulloa, A.|year=1748|title=Relación histórica del viage a la América Meridional|volume=1|page=606|language=Spanish}}</ref> |
|||
當時研究鉑的化學家將它置於[[王水]] ([[氫氯酸]]和[[硝酸]]的混合物)當中,從而產生可溶鹽。製成的溶液每次都留下少量深色的不可溶殘留物。<ref name="hunt" />[[約瑟夫·普魯斯特]]曾以為這一殘留物是[[石墨]]。<ref name="hunt" />法國化學家維多·科萊-德科提爾(Victor Collet-Descotils)、福爾克拉伯爵安東萬·弗朗索瓦(Antoine François, comte de Fourcroy)和路易·尼古拉·沃克朗(Louis Nicolas Vauquelin)在1803年也同樣觀察到了這一黑色殘留物,但因量太少而沒有進行進一步實驗。<ref name="hunt" /> |
|||
1803年,英國化學家[[史密森·特南特]]分析了殘留物,並推斷其中必含新的金屬元素。沃克朗把該粉末來回在酸鹼中浸洗,<ref name="Emsley" />取得了一種揮發性氧化物。他認為這是新元素的氧化物,並把新元素命名為「ptene」,源於希臘文的「{{lang|el|πτηνος}}」(ptènos),即「有翼的」。<ref>{{cite book|title=A System of Chemistry of Inorganic Bodies|author=Thomson, T.|publisher=Baldwin & Cradock, London; and William Blackwood, Edinburgh|year=1831|page=693}}</ref><ref name="griffith">{{cite journal |doi=10.1595/147106704X4844 |title=Bicentenary of Four Platinum Group Metals. Part II: Osmium and iridium – events surrounding their discoveries |author=Griffith, W. P. |journal=Platinum Metals Review |volume=48 |issue=4 |year=2004 |pages=182–189}}</ref>特南特則擁有更大量的殘留物,並在不久後辨認出兩種新元素,也就是鋨和銥。<ref name="hunt" /><ref name="Emsley" />在一連串用到[[氫氧化鈉]]和[[氫氯酸]]的反應之後,他製成了一種深紅色晶體(很可能是{{chem|Na|2|[IrCl|6}}]·''n''{{chem|H|2|O}})。<ref name="griffith" />銥的許多鹽都有鮮豔的顏色,所以特南特取[[希臘神話]]中的彩虹女神[[伊里斯]]({{lang|el|Ἶρις}},Iris)之名,把銥命名為「Iridium」。<ref name="weeks">{{cite book| title = Discovery of the Elements| pages = 414–418| author = Weeks, M. E.| year= 1968| edition = 7| publisher = Journal of Chemical Education| isbn = 0-8486-8579-2| oclc = 23991202}}</ref>元素的發現被記錄在1804年6月21日致[[皇家學院]]的一封信中。<ref name="hunt">{{cite journal| title= A History of Iridium| first =L. B.| last =Hunt| journal = Platinum Metals Review| volume =31| issue = 1| year = 1987| url = http://www.platinummetalsreview.com/pdf/pmr-v31-i1-032-041.pdf| pages= 32–41}}</ref><ref>{{cite journal| title= On Two Metals, Found in the Black Powder Remaining after the Solution of Platina| first = S.| last = Tennant| journal = Philosophical Transactions of the Royal Society of London| volume = 94| year =1804| pages= 411–418| jstor = 107152| doi= 10.1098/rstl.1804.0018}}</ref> |
|||
1813年,英國化學家約翰·喬治·求爾德倫(John George Children)首次熔化銥金屬。<ref name="hunt" />1842年,羅伯特·海爾(Robert Hare)首次取得高純度銥金屬。他量得的銥密度為21.8 g/cm<sup>3</sup>,並發現這一金屬幾乎不可延展,且硬度極高。1860年,[[亨利·愛丁·聖克萊爾·德維爾]]和朱爾·亨利·德布雷(Jules Henri Debray)第一次大量熔化銥。每公斤銥的熔化過程需要超過300升的純{{chem|O|2}}和{{chem|H|2}}。<ref name="hunt" /> |
|||
銥如此難熔化塑性,這大大限制了它的實際應用。約翰·艾薩克·霍金斯(John Isaac Hawkins)在1834年發明了裝有銥造筆尖的金質鋼筆。1880年,約翰·霍蘭德(John Holland)和威廉·洛弗蘭德·達德利(William Lofland Dudley)利用[[磷]]大大簡化了銥的熔化過程,並在美國申請了專利。英國[[莊信萬豐]]公司之後表示,他們早在1837年就開始使用類似的方法熔解銥,而且已在多個[[世界博覽會]]展出經熔融製成的銥。<ref name="hunt" />奧托·佛斯納(Otto Feussner)在1993年第一次在[[熱電偶]]中使用銥﹣釕合金材料,使這種新型器材能夠測量高達2000 °C的溫度。<ref name="hunt" /> |
|||
1957年,[[魯道夫·穆斯堡爾]]在只含<sup>191</sup>Ir的固體金屬樣本中,發現原子能夠進行無反衝的[[γ射線]]共振發射及吸收。<ref>{{cite journal| first=R. L.| last = Mössbauer| authorlink = 魯道夫·穆斯堡爾| title = Gammastrahlung in Ir<sup>191</sup>| journal = Zeitschrift für Physik A | volume = 151| pages = 124–143| year = 1958| language = German| doi = 10.1007/BF01344210|bibcode = 1958ZPhy..151..124M| issue=2 }}</ref>他所進行的實驗是20世紀標誌性的物理實驗之一。<ref>{{cite book|pages=179–190|title=Landmark Experiments in Twentieth Century Physics|author=Trigg, G. L.|publisher=Courier Dover Publications|isbn=0-486-28526-X|year=1995|oclc=31409781}}</ref>此現象稱為[[穆斯堡爾效應]](其他呈現該效應的原子核也陸續被發現,如<sup>57</sup>Fe),是[[穆斯堡爾譜學]]的中心原理,在物理學、化學、生物化學、冶金學和礦物學中都有重要的應用。<ref name="ir-191">{{cite book |title=Handbook of Ceramics and Composites |author=Chereminisoff, N. P. |publisher=CRC Press |year=1990 |isbn=0-8247-8006-X |page=424}}</ref>論文發佈的僅僅3年之後,即1961年,穆斯堡爾就因這一發現獲得了[[諾貝爾物理學獎]],時年32歲。<ref>{{cite book|title=Nobel Lectures, Physics 1942–1962|publisher=Elsevier|year=1964|chapter=The Nobel Prize in Physics 1961: presentation speech| first =I.| last =Waller| url =http://nobelprize.org/nobel_prizes/physics/laureates/1961/press.html}}</ref> |
|||
==存量== |
|||
[[File:元素豐度.svg|thumb|350px|銥是地球地殼中最為稀有的元素之一。圖為地殼各元素的相對豐度。]] |
|||
[[File:Willamette Meteorite AMNH.jpg|thumb|[[威拉姆特隕石]]是已知第六大隕石,內含百萬分之4.7的銥元素。<ref>{{cite journal|title=The chemical classification of iron meteorites—VII. A reinvestigation of irons with Ge concentrations between 25 and 80 ppm|author=Scott, E. R. D.; Wasson, J. T.; Buchwald, V. F.|journal=Geochimica et Cosmochimica Acta|year=1973|volume=37|pages=1957–1983|doi=10.1016/0016-7037(73)90151-8|bibcode = 1973GeCoA..37.1957S|issue=8 }}</ref>]] |
|||
銥是地球地殼中[[地球的地殼元素豐度列表|最稀有的元素]]之一,平均質量比例只有百萬分之0.001。[[金]]的豐度是它的40倍,[[鉑]]是它的10倍,而[[銀]]和[[汞]]都是它的80倍。<ref name="greenwood" />[[碲]]的豐度與銥相近,另外只有三種穩定元素比銥更加稀有:[[錸]]、[[釕]]和[[銠]],其中後兩者的豐度是銥的十分之一。<ref name="greenwood" />相比之下,銥在[[隕石]]裡的含量則高很多,一般在百萬分之0.5以上。<ref name="argonne" />科學家相信,銥在整個地球的含量比在地殼中的含量高很多,但由於它密度高,而且具親鐵性,所以在地球仍處於熔融狀態時,就已沉到[[地球結構|地球的內核]]了。<ref name="ullmann-pt">{{cite book|author=Renner, H.; Schlamp, G.; Kleinwächter, I.; Drost, E.; Lüschow, H. M.; Tews, P.; Panster, P.; Diehl, M.; Lang, J.; Kreuzer, T.; Knödler, A.; Starz, K. A.; Dermann, K.; Rothaut, J.; Drieselman, R.|chapter=Platinum group metals and compounds|title=Ullmann's Encyclopedia of Industrial Chemistry|publisher=Wiley|year=2002|doi=10.1002/14356007.a21_075}}</ref> |
|||
銥在自然中以純金屬或合金的形態出現,尤其是各種比例的銥﹣鋨合金。<ref name="Emsley">{{cite book| title = Nature's Building Blocks: An A–Z Guide to the Elements| last = Emsley| first=J.| publisher = [[Oxford University Press]]| year = 2003| location = Oxford, England, UK| isbn = 0-19-850340-7| chapter = Iridium| pages=201–204}}</ref>[[鎳]]和[[銅]]礦藏中含有鉑系金屬的[[硫化物]](如(Pt,Pd)S)、[[碲化物]](如PtBiTe)、[[銻化物]](PdSb)和[[砷化物]](如{{chem|PtAs|2}})。這些化合物中的鉑會被少量的銥和鋨元素取代。與其他鉑系元素一樣,銥可以形成自然鎳合金及銅合金。<ref>{{cite journal| doi = 10.1016/j.mineng.2004.04.001| journal = Minerals Engineering| volume = 17| year = 2004| pages = 961–979| title =Characterizing and recovering the platinum group minerals—a review| first = Z.| last = Xiao| coauthors= Laplante, A. R.| issue = 9–10}}</ref> |
|||
地殼中有三種地質結構的銥含量最高:[[火成岩]]、[[撞擊坑]]以及前二者演化而成的地質結構。最大的已知礦藏有[[南非]]的[[布殊維爾德火成雜岩體]]、<ref name="kirk-pt" />[[俄羅斯]]的[[諾里爾斯克]]及[[加拿大]]的[[索德柏立盆地]]等。美國有較小的鋨礦藏。<ref name="kirk-pt" />銥也出現在次生礦藏中,與[[沖積層]]礦藏中的鉑以及其他鉑系元素結合。[[前哥倫布時期]][[哥倫比亞]][[喬科省]]居民所用的沖積層礦藏至今仍是鉑系元素的一大來源。截至2003年,並沒有數據記錄全球銥儲藏量。<ref name="Emsley" /> |
|||
===白堊紀﹣第三紀界線=== |
|||
[[File:K-T boundary.jpg|thumb|left|[[K-T界線]],由紅色箭頭所示。]] |
|||
{{Main|白堊紀-第三紀滅絕事件}} |
|||
6600萬年前形成的[[K-T界線]]記錄了從[[白堊紀]]到[[古近紀]]的轉捩點,此[[地層]]的黏土的[[銥異常|銥含量異常高]]。<ref name="Alvarez" />[[路易斯·阿爾瓦雷茨]]為首的研究團隊在1980年提出假說,指這一地層中的銥是[[小行星]]或[[彗星]]撞擊地球時帶來的。<ref name="Alvarez">{{cite journal|title=Extraterrestrial cause for the Cretaceous–Tertiary extinction|author=[[Luis Walter Alvarez|Alvarez, L. W.]]; Alvarez, W.; Asaro, F.; Michel, H. V.|year=1980|journal=Science|volume=208|issue=4448|pages=1095–1108|doi=10.1126/science.208.4448.1095|pmid=17783054|bibcode = 1980Sci...208.1095A }}</ref>這一理論稱為[[阿爾瓦雷茨假說]],目前被公認為[[恐龍]]滅絕的最佳解釋。後來人們在中美洲[[尤卡坦半島]]地底發現了約6600萬年前形成的大型撞擊坑,即[[希克蘇魯伯隕石坑]],這很可能就是阿爾瓦雷茨假說中那顆隕石的撞擊地點。<ref>{{cite journal|last =Hildebrand| first = A. R.| coauthors = Penfield, Glen T.; Kring, David A.; Pilkington, Mark; Zanoguera, Antonio Camargo; Jacobsen, Stein B.; Boynton, William V.|title=Chicxulub Crater; a possible Cretaceous/Tertiary boundary impact crater on the Yucatan Peninsula, Mexico|year = 1991|volume = 19| issue = 9| journal = Geology| pages = 867–871| doi = 10.1130/0091-7613(1991)019<0867:CCAPCT>2.3.CO;2|bibcode = 1991Geo....19..867H }}</ref><ref>{{cite book|author=Frankel, C.|title=The End of the Dinosaurs: Chicxulub Crater and Mass Extinctions|year=1999|publisher=Cambridge University Press|isbn=0-521-47447-7|oclc=40298401}}</ref>杜威·麥克林(Dewey M. McLean)等人則認為是[[火山]]活動把銥帶到地球表面的,因為地球深處存在更多的銥元素,而且許多火山至今仍在放出銥,如[[留尼旺]]島上的[[富爾奈斯火山]]。<ref>{{cite book|title=The Cretaceous-Tertiary Event and Other Catastrophes in Earth History|author=Ryder, G.; Fastovsky, D. E.; Gartner, S.|publisher=Geological Society of America|year=1996|isbn=0-8137-2307-8|page=47}}</ref><ref>{{cite journal|author=Toutain, J.-P.; Meyer, G.|year=1989|title=Iridium-Bearing Sublimates at a Hot-Spot Volcano (Piton De La Fournaise, Indian Ocean)|journal=Geophysical Research Letters|volume=16|issue=12|pages=1391–1394|doi=10.1029/GL016i012p01391|bibcode=1989GeoRL..16.1391T}}</ref> |
|||
{{clear}} |
|||
==生產== |
|||
{|class="wikitable" style="text-align:center; float:right; margin-left:0.5em" |
|||
!年份!!消耗量(噸)!!價格(美元/金衡盎司)<ref name=usgs>[http://minerals.usgs.gov/minerals/pubs/commodity/platinum/ Platinum-Group Metals]. U.S. Geological Survey Mineral Commodity Summaries</ref> |
|||
|- |
|||
|2001|| 2.6||415.25 |
|||
|- |
|||
|2002||2.5 ||294.62 |
|||
|- |
|||
|2003|| 3.3||93.02 |
|||
|- |
|||
|2004||3.60 ||185.33 |
|||
|- |
|||
|2005||3.86 ||169.51 |
|||
|- |
|||
|2006||4.08 ||349.45 |
|||
|- |
|||
|2007||3.70 ||444.43 |
|||
|- |
|||
|2008||3.10 ||448.34 |
|||
|- |
|||
|2009||2.52||420.4 |
|||
|- |
|||
|2010||10.40||642.15 |
|||
|}<!--請更新,或製成圖表,可參見http://www.platinum.matthey.com/prices/price-charts --> |
|||
鋨是[[鎳]]和[[銅]]開採和提煉過程的副產品。在鎳和銅的電解精煉過程中,金、銀等貴金屬、鉑系元素以及[[硒]]和[[碲]]等非金屬元素都會積聚在正電極上。<ref name=usgs/>這一泥狀物質要進入溶液才可把其中的金屬分離出來。具體方法取決於混合物的成份,但主要有兩種:加入[[過氧化鈉]]後溶於[[王水]],或直接溶於[[氯]]和[[氫氯酸]]的混合溶液。<ref name="ullmann-pt" /><ref name="kirk-pt" /> |
|||
要在溶解狀態下從其他鉑系金屬中分離出銥,需使{{chem|(NH|4|)|2|IrCl|6}}沉澱,或用有機胺把{{chem|IrCl|6|2-}}萃取出來。<ref>{{cite journal| title = The Platinum Metals| first = Raleigh| last = Gilchrist| journal = Chemical Reviews| year = 1943| volume = 32| issue = 3| pages = 277–372| doi = 10.1021/cr60103a002}}</ref>第一種分離方法類似於特南特所用的方法。第二種方法可以作為持續的[[溶劑提取]]過程,所以更適合工業規模的生產。兩種方法的產物都可用氫進行還原反應,產生粉末或海綿狀的銥金屬,再用[[粉末冶金]]技術來加工。<ref>{{cite journal| title =Processing of Iridium and Iridium Alloys| first = E. K.| last = Ohriner| journal = Platinum Metals Review| volume = 52| issue = 3| year = 2008| pages = 186–197| doi =10.1595/147106708X333827}}</ref><ref>{{cite journal| first = L. B.| last = Hunt| coauthors = Lever, F. M.| journal = Platinum Metals Review| volume = 13| issue = 4| year = 1969| pages = 126–138| title = Platinum Metals: A Survey of Productive Resources to industrial Uses| url = http://www.platinummetalsreview.com/pdf/pmr-v13-i4-126-138.pdf|format=PDF}}</ref> |
|||
過去數十年間的銥價格波動頗大。相對其他工業用金屬(如[[鋁]]和[[銅]])來說,銥的全球市場量很小,所以價格很容易受產量、需求量、[[投機]]、囤積和產國政治等多方面變化的影響。由於屬性特殊,所以銥的價格會隨當今科技的變化而波動:用來製造大型單個晶體的銥製坩堝滯銷,導致銥價格在2001至2003年間下降。<ref name=usgs/><ref>{{cite journal |author=Hagelüken, C. |journal=Metall |volume=60 |issue=1–2 |year=2006 |pages=31–42 |title=Markets for the catalysts metals platinum, palladium, and rhodium |url=http://web.archive.org/web/20090304195307/http://www.preciousmetals.umicore.com/publications/articles_by_umicore/general/show_Metal_PGMmarkets_200602.pdf|format=PDF}}</ref>2010至2014年,多個生產單個[[藍寶石]]晶體的工廠建立,促使銥價升至超過每盎司1000美元。這些藍寶石被用於電視[[LED]]背光燈中。<ref> |
|||
{{cite web |
|||
| url = http://www.platinum.matthey.com/media/1631250/other_pgm.pdf |
|||
| title = Platinum 2013 Interim Review |
|||
| last = |
|||
| first = |
|||
| date = |
|||
| website = [http://www.platinum.matthey.com/publications/pgm-market-reviews Platinum Today] |
|||
| publisher = [[Johnson Matthey]] Plc |
|||
| accessdate = 2014-01-10 |
|||
}} |
|||
</ref> |
|||
==應用== |
|||
銥的需求量從2009年的2.5噸升至2010年的10.4噸。這主要是因為電子相關應用的需求量從0.2噸升至6噸:銥製坩堝被廣泛用於大型高質量單個晶體的生產,而這些晶體的需求在這段時間大大提高。銥的消耗量預期將因為積累的坩堝庫存而飽和,這在2000年代也曾經發生過。其他重要應用還包括[[火花塞]](2007年消耗0.78噸)、[[氯鹼法]]所用的電極(同年消耗1.1噸)以及化學催化劑(同年消耗0.75噸)。<ref name=usgs/><ref name="platinum2008">{{cite book| first = D.| last = Jollie| title=Platinum 2008|publisher=Johnson Matthey|year=2008| issn = 0268-7305|url=http://www.platinum.matthey.com/uploaded_files/Pt2008/08_complete_publication.pdf| format = PDF|accessdate=2008-10-13}}</ref> |
|||
===工業及醫學=== |
|||
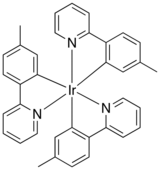
[[File:Ir(mppy)3.png|thumb|160px|right|{{chem|Ir(mppy)|3}}的分子結構]] |
|||
銥的應用大部份運用其高熔點、高硬度和抗腐蝕性質。銥金屬以及銥﹣鉑合金和鋨﹣銥合金的耗損很低,可用來製造多孔[[噴絲板]]。噴絲板用於把塑料聚合物擠壓成纖維,例如[[人造絲]]。<ref>{{cite journal|title= Spinnerets for viscose rayon cord yarn| journal = Fibre Chemistry| volume =10| issue = 4| year = 1979| doi = 10.1007/BF00543390| pages = 377–378| first = R. V.| last = Egorova| coauthors = Korotkov, B. V.; Yaroshchuk, E. G.; Mirkus, K. A.; Dorofeev N. A.; Serkov, A. T.}}</ref>鋨﹣銥合金也可以用於[[指南針]]軸承和[[計重秤]]。<ref name="Emsley">{{cite web| url = http://www.rsc.org/chemsoc/visualelements//PAGES/pdf/iridium.PDF| title = Iridium|publisher = Royal Society of Chemistry| work = Visual Elements Periodic Table| format = PDF| author = Emsley, J.| date = 2005-01-18| accessdate = 2008-09-17}}</ref> |
|||
銥的耐腐蝕、耐高溫性質很強,所以非常適合作為合金添加物。飛機引擎中的一些長期使用部件是由銥合金組成的,銥﹣[[鈦]]合金也被用作水底管道材料。<ref name="Emsley"/>加入銥可提升鉑合金的硬度。純鉑的[[維氏硬度]]為56 HV,而含50%銥的鉑合金硬度可超過500 HV。<ref>{{cite journal| url = http://www.platinummetalsreview.com/pdf/pmr-v4-i1-018-026.pdf|format=PDF|accessdate=2008-10-13| journal = Platinum Metals Review| title = Iridium Platinum Alloys| first = A. S.|last = Darling| year = 1960| volume =4| issue =l| pages = 18–26}}</ref><ref>{{cite journal|doi = 10.1595/147106705X24409| title = The Hardening of Platinum Alloys for Potential Jewellery Application| first = T.|last = Biggs| coauthors= Taylor, S. S.; van der Lingen, E.| journal = Platinum Metals Review| year = 2005| volume = 49| issue = 1| pages = 2–15}}</ref> |
|||
銥也常被用於須承受高溫的儀器當中。比如,[[柴可拉斯基法]]使用銥製高溫[[坩堝]],產生單個氧化物晶體,如藍寶石、[[釓鎵石榴石]]和[[釔鋁石榴石]]等。這些晶體被用於[[電腦記憶體]]和[[固態激光器]]零件當中。<ref>{{cite journal|title= On the Use of Iridium Crucibles in Chemical Operations| first = W.| last = Crookes|authorlink=威廉·克魯克斯| journal = Proceedings of the Royal Society of London. Series A, Containing Papers of a Mathematical and Physical Character| volume = 80| issue = 541| year = 1908| pages = 535–536| jstor = 93031|doi= 10.1098/rspa.1908.0046|bibcode = 1908RSPSA..80..535C }}</ref><ref name="Handley">{{cite journal|title= Increasing Applications for Iridium| first = J. R.| last = Handley| journal = Platinum Metals Review| volume = 30| issue = 1| year = 1986| pages = 12–13| url = http://www.platinummetalsreview.com/pdf/pmr-v30-i1-012-013.pdf}}</ref><ref name="hunt" />銥合金能夠抵禦電弧侵蝕,所以是[[火花塞]]電觸頭的理想材料。<ref name="Handley" /><ref>{{cite book| url = http://books.google.com/?id=I03qepnj2IwC| title = Euromat 99| author = Stallforth, H.; Revell, P. A.| publisher= Wiley-VCH| year = 2000| isbn = 978-3-527-30124-9}}</ref> |
|||
[[Cativa催化法]]是把[[甲醇]]轉變為[[乙酸]]的過程,可使用銥化合物作為[[催化劑]]。<ref name="ullmann-acetic">{{cite book|first=H.|last= Cheung|coauthors = Tanke, R. S.; Torrence, G. P.|chapter=Acetic acid|title=Ullmann's Encyclopedia of Industrial Chemistry|publisher=Wiley|year=2000|doi=10.1002/14356007.a01_045}}</ref> |
|||
放射性同位素銥-192在γ[[射線照相]]中是一種重要的能源,有助對金屬進行[[無損檢測]]。<ref>{{cite journal|title= The use and scope of Iridium 192 for the radiography of steel| first = R.| last = Halmshaw| year = 1954| journal = British Journal of Applied Physics| volume = 5| pages = 238–243| doi = 10.1088/0508-3443/5/7/302|bibcode = 1954BJAP....5..238H|issue= 7 }}</ref><ref name=Hellier>{{cite book|last = Hellier|first = Chuck|title = Handbook of Nondestructive Evlaluation|publisher = The McGraw-Hill Companies|year = 2001|isbn = 978-0-07-028121-9}}</ref>另外,[[近距離治療]]利用<sup>192</sup>Ir所釋放的[[γ射線]]來治療癌症。這種治療方法把輻射源置於癌組織附近或裡面,可用於治療[[前列腺癌]]、[[膽管癌]]及[[子宮頸癌]]等。<ref name="Emsley" /> |
|||
===科學=== |
|||
[[File:Platinum-Iridium meter bar.jpg|right|thumb|[[國際米原器]]]] |
|||
1889年製成的[[國際米原器]]和[[國際公斤原器]]是由含90%鉑和10%銥的合金組成的,原器由位於[[巴黎]]附近的[[國際度量衡局]]保存。<ref name="Emsley" />[[米 (單位)|米]]的定義在1960年改為[[氪]]的[[發射光譜]]中的一條[[譜線]],<ref group="注">米的定義在1983年再次改變。今天的米定義為光在真空中{{frac|299,792,458}}秒內行進的距離。</ref><ref name="meter">{{cite web| url=http://www.mel.nist.gov/div821/museum/timeline.htm| publisher = National Institute for Standards and Technology|first =W. B.| last = Penzes|title=Time Line for the Definition of the Meter|year=2001|accessdate=2008-09-16}}</ref>但[[公斤]]的定義仍然是公斤原器。<ref>General section citations: ''Recalibration of the U.S. National Prototype Kilogram'', R.{{nbsp}}S.{{nbsp}}Davis, Journal of Research of the National Bureau of Standards, '''90''', No. 4, {{nowrap|July–August}} 1985 ([http://nvl.nist.gov/pub/nistpubs/jres/090/4/V90-4.pdf 5.5{{nbsp}}MB PDF, here]); and ''The Kilogram and Measurements of Mass and Force'', Z.{{nbsp}}J.{{nbsp}}Jabbour ''et al.'', J. Res. Natl. Inst. Stand. Technol. '''106''', 2001, {{nowrap|25–46}} ([http://nvl.nist.gov/pub/nistpubs/jres/106/1/j61jab.pdf 3.5{{nbsp}}MB PDF, here])<sub>{{nbsp}}</sub></ref> |
|||
[[航海家計劃|航海家號]]、[[維京號]]、[[先鋒計劃|先鋒號]]和[[卡西尼-惠更斯號]]、[[伽利略號]]和[[新視野號]]等無人宇宙飛船都有使用含有銥的[[放射性同位素熱電機]]。由於熱電機要承受高達2000 °C的高溫,所以包裹著[[鈈]]-238同位素的容器是以既堅硬又耐高溫的銥所製。<ref name="hunt" /> |
|||
銥還被用於[[X射線望遠鏡]]中。<ref name="Ziegler">{{cite journal| doi = 10.1016/S0168-9002(01)00533-2| title = High-efficiency tunable X-ray focusing optics using mirrors and laterally-graded multilayers| first = E.| last = Ziegler,| coauthors = Hignette, O.; Morawe, Ch.; Tucoulou, R.| journal = Nuclear Instruments and Methods in Physics Research Section A: Accelerators, Spectrometers, Detectors and Associated Equipment| volume = 467–468| year = 2001|pages = 954–957|bibcode = 2001NIMPA.467..954Z }}</ref>[[錢德拉X射線天文台]]的反射鏡上有一層60[[納米]]厚的銥塗層。在測試過多種金屬之後,銥的[[X射線]]反射能力證明比鎳、金和鉑都要優勝。這層銥的平滑程度要有幾個原子以內的準確度,須在氣態下在高[[真空]]環境中塗在[[鉻]]底層上。<ref>{{cite web|title=Face-to-Face with Jerry Johnston, CXC Program Manager & Bob Hahn, Chief Engineer at Optical Coating Laboratories, Inc., Santa Rosa, CA|publisher=Harvard-Smithsonian Center for Astrophysics; Chandra X-ray Center|url=http://chandra.harvard.edu/press/bios/johnston.html|accessdate=2008-09-24|year=1995}}</ref> |
|||
[[粒子物理學]]在[[反質子]]的產生過程中也用到銥。過程中,高強度[[質子]]束射向密度必須很高的「轉換目標體」。雖然可以使用[[鎢]],但銥的優勝之處在於,它可以更穩定地承受入射粒子束使溫度升高時所造成的[[衝擊波]]。<ref>{{cite journal|title = Production of low-energy antiprotons| journal =Zeitschrift Hyperfine Interactions| volume =109| year = 1997|doi = 10.1023/A:1012680728257| pages = 33–41| first = D.| last =Möhl|bibcode = 1997HyInt.109...33M }}</ref> |
|||
[[File:C-HactnBergGrah.png|450px|left|thumb|有機銥化學中烴的氧化加成反應<ref name=RGB>{{cite journal|title=Carbon-hydrogen activation in completely saturated hydrocarbons: direct observation of M + R-H -> M(R)(H)|author=Janowicz, A. H.; Bergman, R. G.|journal=Journal of the American Chemical Society|year=1982|volume=104|issue=1|pages=352–354|doi=10.1021/ja00365a091}}</ref><ref name=WAGG>{{cite journal|title=Oxidative addition of the carbon-hydrogen bonds of neopentane and cyclohexane to a photochemically generated iridium(I) complex|author=Hoyano, J. K.; Graham, W. A. G.|journal=Journal of the American Chemical Society|year=1982|volume=104|issue=13|pages=3723–3725|doi=10.1021/ja00377a032}}</ref>]] |
|||
[[碳-氫鍵活化反應]](C–H活化)是斷開[[碳-氫鍵]]的反應。這種鍵在以前曾被認為具有低反應性。科學家在1982年宣佈首次成功活化[[飽和烴]]中的C–H鍵,反應使用銥的有機配合物,使烴進行[[氧化加成]]。<ref name=RGB/><ref name=WAGG/> |
|||
銥配合物可以用來催化[[不對稱氫化反應]]。這類催化劑已被用於合成[[天然產物]],並能夠把本來難以氫化的基底(例如非官能團化[[烯烴]]等)氫化成其中一種[[對映異構體]] 。<ref>{{cite journal|doi=10.1002/chem.200500755|year=2006|author=Källström, K; Munslow, I; Andersson, P. G.|title=Ir-catalysed asymmetric hydrogenation: Ligands, substrates and mechanism|volume=12|issue=12|pages=3194–3200|pmid=16304642|journal=Chemistry – A European Journal}}</ref><ref>{{cite journal|doi=10.1021/ar700113g|year=2007|author=Roseblade, S. J.; Pfaltz, A.|title=Iridium-catalyzed asymmetric hydrogenation of olefins|volume=40|issue=12|pages=1402–1411|pmid=17672517|journal=[[Accounts of Chemical Research]]}}</ref> |
|||
銥可以形成多種[[配合物]],在[[有機發光二極體]](OLED)當中起到作用。<ref>{{cite journal|title = Electrophosphorescence from substituted poly(thiophene) doped with iridium or platinum complex| doi = 10.1016/j.tsf.2004.05.095| year = 2004| journal = Thin Solid Films| volume = 468| issue = 1–2| pages = 226–233| first = X.| last = Wang| coauthors = Andersson, M. R.; Thompson, M. E.; Inganäsa, O.|bibcode = 2004TSF...468..226W }}</ref><ref>{{cite journal|url=http://sa.rochester.edu/jur/issues/fall2002/tonzetich.pdf|title=Organic Light Emitting Diodes—Developing Chemicals to Light the Future|publisher=Rochester University|first=Zachary J.|last=Tonzetich|journal=Journal of Undergraduate Research|volume=1|issue=1|year=2002|format=PDF|accessdate=2008-10-10}}</ref><ref>{{cite journal| title=New Trends in the Use of Transition Metal-Ligand Complexes for Applications in Electroluminescent Devices| author = Holder, E.|coauthors = Langefeld, B. M. W.; Schubert, U. S.| journal = Advanced Materials| volume = 17| issue = 9| pages = 1109–1121| date = 2005-04-25|doi=10.1002/adma.200400284}}</ref> |
|||
===被淘汰的用途=== |
|||
[[File:Fountain-pen-nib.jpg|right|150px|thumb|標有「Iridium Point」(銥金筆)的[[鋼筆]]筆頭]] |
|||
銥﹣鋨合金曾被加入到[[鋼筆]]筆頭中。1834年開始,一些鋼筆生產商開始把銥安裝在金筆頭上,這是銥的首個主要應用。<ref name="hunt" />自1944年起,著名的[[派克]]51鋼筆就有含釕﹣銥合金的筆尖,合金中的銥含量為3.8%。今天的鋼筆筆頭幾乎不再含有銥,而是含其他的金屬,例如鎢。<ref>{{cite journal|url=http://www.nibs.com/ArticleIndex.html|journal=The PENnant|volume=XIII|issue=2|year=1999|title=Notes from the Nib Works—Where's the Iridium?|author=Mottishaw, J.}}</ref> |
|||
銥﹣鉑合金曾經用於[[加農炮]]的[[點火孔]]和排氣孔。根據1867年巴黎[[世界博覽會]]的一份報告,[[莊信萬豐]]所展出的一份展品「曾在一把魏渥斯步槍中經歷超過3000發,仍無損無耗。所有知道火炮排氣孔損耗所導致的麻煩和花費的人,都會非常欣賞這一重要的應用」。<ref>原文:"… has been used in a Withworth gun for more than 3000 rounds, and scarcely shows signs of wear yet. Those who know the constant trouble and expense which are occasioned by the wearing of the vent-pieces of cannon when in active service, will appreciate this important adaptation." {{cite journal|editor=Crookes, W.|volume=XV|year=1867|journal=The Chemical News and Journal of Physical Science|title=The Paris Exhibition|pages=182 }}</ref> |
|||
「銥黑」是一種染料,它含有非常細緻的銥粉末。銥黑可以把[[瓷器]]染成很深的黑色。有19世紀的文獻稱「所有其他的黑色瓷器染料與它一比較,都變成了灰色」。<ref>{{cite book|title=The Playbook of Metals: Including Personal Narratives of Visits to Coal, Lead, Copper, and Tin Mines, with a Large Number of Interesting Experiments Relating to Alchemy and the Chemistry of the Fifty Metallic Elements|author=Pepper, J. H.|publisher=Routledge, Warne, and Routledge|year=1861|page=455}}</ref> |
|||
==安全== |
|||
成塊的銥金屬沒有生物用途亦無害,因為它不與生物組織反應。人體組織內的銥比例只有一兆(萬億)分之二十左右。<ref name="Emsley" />和大部份金屬一樣,銥的金屬細粉具有危險性。這樣的粉末會刺激組織,且容易在空氣中燃燒。<ref name="kirk-pt">{{cite book|title=Kirk Othmer Encyclopedia of Chemical Technology|first =R. J.| last = Seymour| coauthors = O'Farrelly, J. I.|chapter=Platinum-group metals|doi=10.1002/0471238961.1612012019052513.a01.pub2|year=2001|publisher=Wiley}}</ref>由於銥化合物的處理量一般都很低,所以人們對其毒性所知甚少。不過銥的可溶鹽,如各種鹵化銥,則含有毒性。<ref name="mager" />大部份銥化合物都不可溶,所以很難被人體吸收。<ref name="Emsley" /> |
|||
{{chem|192|Ir}}同位素和其他放射性同位素一樣是危險的。唯一的相關意外是在[[近距離治療]]時受該同位素輻射的意外照射。<ref name="mager">{{cite book|title=Encyclopaedia of Occupational Health and Safety|first =J.| last = Mager Stellman| chapter=Iridium|isbn=978-92-2-109816-4|year=1998|publisher=International Labour Organization| pages =63.19| url = http://books.google.com/?id=nDhpLa1rl44C&pg=PT125|oclc=35279504 45066560}}</ref>{{chem|192|Ir}}所放出的高能[[伽馬射線]]會提高患癌症的可能性。外照射可導致燒傷、[[輻射中毒]]甚至死亡。攝入<sup>192</sup>Ir可導致腸胃內膜燒傷。<ref>{{cite web| title = Radioisotope Brief: Iridium-192 (Ir-192)| work = Radiation Emergencies| publisher = Centers for Disease Control and Prevention| date = 2004-08-18| url = http://emergency.cdc.gov/radiation/isotopes/pdf/iridium.pdf| format = PDF| accessdate = 2008-09-20}}</ref><sup>192</sup>進入體內的Ir、<sup>192m</sup>Ir和<sup>194m</sup>Ir主要會積累在[[肝臟]]中,所放出的伽馬射線和[[β粒子|β輻射]]會對身體造成損害。<ref name="argonne">{{cite web| title = Iridium| work = Human Health Fact Sheet| publisher = Argonne National Laboratory|year = 2005| url = http://www.ead.anl.gov/pub/doc/Iridium.pdf| format = PDF| accessdate = 2008-09-20}}</ref> |
|||
==備註== |
|||
<references group="注" /> |
|||
==參考資料== |
|||
{{Reflist|2}} |
|||
==外部鏈接== |
|||
{{Commons|Iridium}} |
|||
{{Wiktionary|iridium}} |
|||
* [http://www.periodicvideos.com/videos/077.htm Iridium] at ''The Periodic Table of Videos''(諾丁漢大學) |
|||
* [http://www.britannica.com/EBchecked/topic/293985/iridium-Ir Iridium in Encyclopædia Britannica] |
|||
{{元素週期表}} |
|||
{{銥化合物}} |
|||
<!--{{隕石}},目前尚未完成--> |
|||
{{珠寶材料}} |
|||
[[Category:过渡金属]] |
[[Category:过渡金属]] |
||
2014年2月1日 (六) 06:24的版本
銥是一種化學元素,符號為Ir,原子序為77。銥屬於鉑系過渡金屬,質地堅硬易碎,呈銀白色。銥是繼鋨之後第二堅硬的元素,其耐腐蝕性也是所有元素中最高的,甚至在2000 °C高溫下仍然能抵抗腐蝕。雖然固態銥只能被少數熔融鹽和鹵素侵蝕,但是銥粉末的反應性則高得多,可以輕易燃燒。
1803年,史密森·特南特在自然鉑礦石的不可溶雜質中發現了銥元素。由於該元素的鹽有眾多鮮豔的顏色,所以他根據希臘神話中的彩虹女神伊里斯(Iris)把這一新元素命名為「Iridium」。銥是地球地殼中最稀有的元素之一。其全球年產量及年消耗量只有三噸。自然產生的銥由穩定同位素191Ir和193Ir組成,後者的比例較高。
最有實用價值的銥化合物包括它的鹽以及它與氯所產生的酸。銥還可以形成多種有機金屬化合物,用於工業催化反應和科學研究當中。銥金屬可用作高耐蝕性高溫工具的材料,用於製造火花塞、高溫半導體再結晶過程所用的坩堝以及氯鹼法所用的電極等等。一些放射性同位素熱電機也有用到銥的放射性同位素。
一些落到地球的隕石的含銥量比其周邊環境高出許多。K-T界線(白堊紀﹣第三紀)黏土層上的銥含量異常高,因此科學家提出假說,稱某大型天體在6600萬年前撞擊地球,導致包括恐龍在內的許多物種滅絕,即白堊紀-第三紀滅絕事件。根據估算,地球中銥的總含量應比地殼中的銥含量要高很多。但與其他鉑系金屬一樣,銥具有高密度,且容易與鐵結合,因此地球剛形成時的大部份銥都已沉到地底深處。
性質
物理性質

銥屬於鉑系金屬,和鉑一樣呈白色,另帶少許黃色。銥堅硬易碎,熔點也非常高,所以很難鑄造和塑性。製造工序因此一般使用粉末冶金。[2]銥是唯一一種在1600 °C以上的空氣中仍保持優良力學性質的金屬。[3]其沸點極高,在所有元素中排第10位。銥在0.14 K以下會呈現超導體性質。[4]
銥的彈性模量在鋨以下,為所有金屬中第二高。[3]其剪切模量很高,泊松比很低,因此具有很高的剛度,使得銥的加工生產過程非常困難。儘管生產不易,價格昂貴,但銥還是有多項應用,包括在極端條件下加強機械的強度。[3]
銥的密度在所有元素中排第二位,僅比鋨稍低(低約0.12%)。[5][6]由於密度值十分相近,測量也並不容易,所以這兩個元素到底哪一個密度更高曾經並沒有定論。[7]不過,X射線晶體學技術大大提高了測量密度的準確度,最終得出銥和鋨的密度值分別為22.56 g/cm3和22.59 g/cm3。[8]
化學性質
銥是抗腐蝕性最強的金屬之一:[9]它能夠在高溫下抵禦幾乎所有酸、王水、熔融金屬,甚至是矽酸鹽。但是某些熔融鹽,如氰化鈉和氰化鉀,[9]以及氧和鹵素(特別是氟)在高溫下還是可以侵蝕銥的。[10][11]
化合物
| 氧化態[注 1] | |
|---|---|
| −3 | [Ir(CO) 3]3− |
| −1 | [Ir(CO) 3(PPh)] 3 |
| 0 | Ir 4(CO) 12 |
| +1 | [Ir(CO)Cl(PPh 3) 2] |
| +2 | IrCl 2 |
| +3 | IrCl 3 |
| +4 | IrO 2 |
| +5 | Ir 4F 20 |
| +6 | IrF 6 |
銥化合物的氧化態介乎−3和+6,最常見的有+3和+4。[2]高氧化態的化合物比較罕見,包括IrF
6和兩種混合氧化物Sr
2MgIrO
6及Sr
2CaIrO
6。[2][12]2009年,科學家利用基質隔離方法(在6 K的氬氣中)對過氧化銥配合物進行紫外線照射,製成了四氧化銥(IrO
4)。然而這一化合物預計在更高的溫度下無法穩定保持固體狀態。[13]
二氧化銥(IrO
2)為棕色粉末,是銥唯一一種性質已經過充分研究的氧化物。[2]三氧化二銥是一種黑藍色粉末,在硝酸中會氧化成IrO
2。[10]其他已知的化合物包括二硫化銥、二硒化銥、三硫化二銥和三硒化二銥等,另外也有研究指出IrS
3的存在。[2]銥還可以形成氧化態為+4和+5的銥酸,如K
2IrO
3和KIrO
3。在高溫下使銥與氧化鉀或超氧化鉀反應,就可取得這些銥酸。[14]
目前尚未發現化學式為Ir
xH
y的氫銥二元化合物,但有些已知配合物包含IrH4−
5和IrH3−
6離子,其中銥的氧化態分別為+1和+3。[15]科學家認為,Mg
6Ir
2H
11當中同時存在IrH4−
5以及含18個電子的IrH5−
4離子。[16]
銥並不形成一鹵化物和二鹵化物,而是會與每一種鹵素形成對應的三鹵化物IrX
3。[2]氧化態為+4或以上的鹵化物只有四氟化銥、五氟化銥和六氟化銥。[2]六氟化銥(IrF
6)是一種反應性很高的揮發性黃色固體,其分子結構呈八面體形。它在水中會分解,而且銥黑(即金屬銥粉末)可將其還原成晶體狀的四氟化銥(IrF
4)。[2]五氟化銥的特性相似,但它其實是一種四聚體Ir
4F
20,由四個角對角連接的八面體所形成。[2]

工業上最重要的銥化合物是六氯銥酸(H
2IrCl
6)及其銨鹽。[17]銥的純化過程、大多數銥化合物的生產初始步驟以及陽極塗層的製備過程都要用到這些化合物。IrCl2−
6離子呈棕黑色,能夠輕易還原成淺色的IrCl3−
6,且該反應可以逆轉。[17]三氯化銥(IrCl
3)常被用作其他Ir(III)化合物的製備原料。[2]氯和銥粉末在650 °C經氧化反應會形成無水三氯化銥,[17]而Ir
2O
3溶於氫氯酸中則可製成水合三氯化銥。另一種類似的製備原料是六氯銥酸銨((NH
4)
3IrCl
6)。三價銥配合物具抗磁性,分子結構一般為八面體型。[2]
銥的有機化合物含有銥﹣碳鍵,其中銥的氧化態通常較低。比如,十二羰基四銥(Ir
4(CO)
12)是最常見兼最穩定的金屬羰基配合物,當中的銥就處於0氧化態。[2]十二羰基四銥中的每一個銥原子都與另外三個鍵合,形成四面體原子簇。一些重要的Ir(I)有機化合物都是以發現者命名的。這包括沃什卡配合物(IrCl(CO)[P(C
6H
5)
3]
2),它會與O
2氧分子鍵合,這種特性十分特殊。[18]克拉布特利催化劑(Crabtree's catalyst)是一種用於氫化反應的均相催化劑。[19]這些化合物都屬於平面正方形d8配合物,共有16個價電子,因此反應性很高。[20]
同位素
銥有兩種自然穩定同位素:191Ir和193Ir,豐度分別為37.3%和62.7%。[21]已人工合成的放射性同位素共有34種,質量數從164至199不等。192Ir夾在兩個穩定同位素之間,也是最穩定的放射性同位素,半衰期為73.827天。這一同位素在近距離治療[22]和工業射線照相技術中具有用途,特別是在天然氣工業中用於無損檢測鋼鐵的焊接處。銥-192曾造成多宗輻射意外。另外有三個同位素的半衰期在一天以上:188Ir、189Ir和190Ir。[21]質量數低於191的同位素會同時進行β+衰變、α衰變以及質子發射,但有兩者除外:189Ir進行電子捕獲,而190Ir進行正電子發射。質量數高於191的同位素則進行β−衰變,其中192Ir會少量進行電子捕獲。[21]所有銥同位素都是在1934至2001年間發現的,其中最新發現的是171Ir。[23]
銥共有32種已知同核異構體,質量數介乎164到197。最穩定的同核異構體是192m2Ir,它會經同核異能躍遷,半衰期為241年,[21]因此比所有處於基態的放射性同位素都要穩定。最不穩定的異構體是190m3Ir,其半衰期只有2微秒。[21]191Ir是所有元素中首個被證實呈現穆斯堡爾效應的同位素。該同位素應用在穆斯堡爾光譜分析中,在物理學、化學、生物化學、冶金學和礦物學等領域都有用到。[24]
歷史

銥的發現與鉑以及其他鉑系元素息息相關。古埃塞俄比亞人[25]和南美洲各文化的人[26]自古便有使用自然產生的鉑金屬,當中必定含有少量其他鉑系元素,這也包括銥。17世紀西班牙征服者在今天的哥倫比亞喬科省發現了鉑,並將其帶到歐洲。[27]然而直到1748年,科學家才發現它並不是任何已知金屬的合金,而是一種全新的元素。[28]
當時研究鉑的化學家將它置於王水 (氫氯酸和硝酸的混合物)當中,從而產生可溶鹽。製成的溶液每次都留下少量深色的不可溶殘留物。[3]約瑟夫·普魯斯特曾以為這一殘留物是石墨。[3]法國化學家維多·科萊-德科提爾(Victor Collet-Descotils)、福爾克拉伯爵安東萬·弗朗索瓦(Antoine François, comte de Fourcroy)和路易·尼古拉·沃克朗(Louis Nicolas Vauquelin)在1803年也同樣觀察到了這一黑色殘留物,但因量太少而沒有進行進一步實驗。[3]
1803年,英國化學家史密森·特南特分析了殘留物,並推斷其中必含新的金屬元素。沃克朗把該粉末來回在酸鹼中浸洗,[9]取得了一種揮發性氧化物。他認為這是新元素的氧化物,並把新元素命名為「ptene」,源於希臘文的「πτηνος」(ptènos),即「有翼的」。[29][30]特南特則擁有更大量的殘留物,並在不久後辨認出兩種新元素,也就是鋨和銥。[3][9]在一連串用到氫氧化鈉和氫氯酸的反應之後,他製成了一種深紅色晶體(很可能是Na
2[IrCl
6]·nH
2O)。[30]銥的許多鹽都有鮮豔的顏色,所以特南特取希臘神話中的彩虹女神伊里斯(Ἶρις,Iris)之名,把銥命名為「Iridium」。[31]元素的發現被記錄在1804年6月21日致皇家學院的一封信中。[3][32]
1813年,英國化學家約翰·喬治·求爾德倫(John George Children)首次熔化銥金屬。[3]1842年,羅伯特·海爾(Robert Hare)首次取得高純度銥金屬。他量得的銥密度為21.8 g/cm3,並發現這一金屬幾乎不可延展,且硬度極高。1860年,亨利·愛丁·聖克萊爾·德維爾和朱爾·亨利·德布雷(Jules Henri Debray)第一次大量熔化銥。每公斤銥的熔化過程需要超過300升的純O
2和H
2。[3]
銥如此難熔化塑性,這大大限制了它的實際應用。約翰·艾薩克·霍金斯(John Isaac Hawkins)在1834年發明了裝有銥造筆尖的金質鋼筆。1880年,約翰·霍蘭德(John Holland)和威廉·洛弗蘭德·達德利(William Lofland Dudley)利用磷大大簡化了銥的熔化過程,並在美國申請了專利。英國莊信萬豐公司之後表示,他們早在1837年就開始使用類似的方法熔解銥,而且已在多個世界博覽會展出經熔融製成的銥。[3]奧托·佛斯納(Otto Feussner)在1993年第一次在熱電偶中使用銥﹣釕合金材料,使這種新型器材能夠測量高達2000 °C的溫度。[3]
1957年,魯道夫·穆斯堡爾在只含191Ir的固體金屬樣本中,發現原子能夠進行無反衝的γ射線共振發射及吸收。[33]他所進行的實驗是20世紀標誌性的物理實驗之一。[34]此現象稱為穆斯堡爾效應(其他呈現該效應的原子核也陸續被發現,如57Fe),是穆斯堡爾譜學的中心原理,在物理學、化學、生物化學、冶金學和礦物學中都有重要的應用。[24]論文發佈的僅僅3年之後,即1961年,穆斯堡爾就因這一發現獲得了諾貝爾物理學獎,時年32歲。[35]
存量


銥是地球地殼中最稀有的元素之一,平均質量比例只有百萬分之0.001。金的豐度是它的40倍,鉑是它的10倍,而銀和汞都是它的80倍。[2]碲的豐度與銥相近,另外只有三種穩定元素比銥更加稀有:錸、釕和銠,其中後兩者的豐度是銥的十分之一。[2]相比之下,銥在隕石裡的含量則高很多,一般在百萬分之0.5以上。[37]科學家相信,銥在整個地球的含量比在地殼中的含量高很多,但由於它密度高,而且具親鐵性,所以在地球仍處於熔融狀態時,就已沉到地球的內核了。[17]
銥在自然中以純金屬或合金的形態出現,尤其是各種比例的銥﹣鋨合金。[9]鎳和銅礦藏中含有鉑系金屬的硫化物(如(Pt,Pd)S)、碲化物(如PtBiTe)、銻化物(PdSb)和砷化物(如PtAs
2)。這些化合物中的鉑會被少量的銥和鋨元素取代。與其他鉑系元素一樣,銥可以形成自然鎳合金及銅合金。[38]
地殼中有三種地質結構的銥含量最高:火成岩、撞擊坑以及前二者演化而成的地質結構。最大的已知礦藏有南非的布殊維爾德火成雜岩體、[39]俄羅斯的諾里爾斯克及加拿大的索德柏立盆地等。美國有較小的鋨礦藏。[39]銥也出現在次生礦藏中,與沖積層礦藏中的鉑以及其他鉑系元素結合。前哥倫布時期哥倫比亞喬科省居民所用的沖積層礦藏至今仍是鉑系元素的一大來源。截至2003年,並沒有數據記錄全球銥儲藏量。[9]
白堊紀﹣第三紀界線

6600萬年前形成的K-T界線記錄了從白堊紀到古近紀的轉捩點,此地層的黏土的銥含量異常高。[40]路易斯·阿爾瓦雷茨為首的研究團隊在1980年提出假說,指這一地層中的銥是小行星或彗星撞擊地球時帶來的。[40]這一理論稱為阿爾瓦雷茨假說,目前被公認為恐龍滅絕的最佳解釋。後來人們在中美洲尤卡坦半島地底發現了約6600萬年前形成的大型撞擊坑,即希克蘇魯伯隕石坑,這很可能就是阿爾瓦雷茨假說中那顆隕石的撞擊地點。[41][42]杜威·麥克林(Dewey M. McLean)等人則認為是火山活動把銥帶到地球表面的,因為地球深處存在更多的銥元素,而且許多火山至今仍在放出銥,如留尼旺島上的富爾奈斯火山。[43][44]
生產
| 年份 | 消耗量(噸) | 價格(美元/金衡盎司)[45] |
|---|---|---|
| 2001 | 2.6 | 415.25 |
| 2002 | 2.5 | 294.62 |
| 2003 | 3.3 | 93.02 |
| 2004 | 3.60 | 185.33 |
| 2005 | 3.86 | 169.51 |
| 2006 | 4.08 | 349.45 |
| 2007 | 3.70 | 444.43 |
| 2008 | 3.10 | 448.34 |
| 2009 | 2.52 | 420.4 |
| 2010 | 10.40 | 642.15 |
鋨是鎳和銅開採和提煉過程的副產品。在鎳和銅的電解精煉過程中,金、銀等貴金屬、鉑系元素以及硒和碲等非金屬元素都會積聚在正電極上。[45]這一泥狀物質要進入溶液才可把其中的金屬分離出來。具體方法取決於混合物的成份,但主要有兩種:加入過氧化鈉後溶於王水,或直接溶於氯和氫氯酸的混合溶液。[17][39]
要在溶解狀態下從其他鉑系金屬中分離出銥,需使(NH
4)
2IrCl
6沉澱,或用有機胺把IrCl2−
6萃取出來。[46]第一種分離方法類似於特南特所用的方法。第二種方法可以作為持續的溶劑提取過程,所以更適合工業規模的生產。兩種方法的產物都可用氫進行還原反應,產生粉末或海綿狀的銥金屬,再用粉末冶金技術來加工。[47][48]
過去數十年間的銥價格波動頗大。相對其他工業用金屬(如鋁和銅)來說,銥的全球市場量很小,所以價格很容易受產量、需求量、投機、囤積和產國政治等多方面變化的影響。由於屬性特殊,所以銥的價格會隨當今科技的變化而波動:用來製造大型單個晶體的銥製坩堝滯銷,導致銥價格在2001至2003年間下降。[45][49]2010至2014年,多個生產單個藍寶石晶體的工廠建立,促使銥價升至超過每盎司1000美元。這些藍寶石被用於電視LED背光燈中。[50]
應用
銥的需求量從2009年的2.5噸升至2010年的10.4噸。這主要是因為電子相關應用的需求量從0.2噸升至6噸:銥製坩堝被廣泛用於大型高質量單個晶體的生產,而這些晶體的需求在這段時間大大提高。銥的消耗量預期將因為積累的坩堝庫存而飽和,這在2000年代也曾經發生過。其他重要應用還包括火花塞(2007年消耗0.78噸)、氯鹼法所用的電極(同年消耗1.1噸)以及化學催化劑(同年消耗0.75噸)。[45][51]
工業及醫學
3的分子結構
銥的應用大部份運用其高熔點、高硬度和抗腐蝕性質。銥金屬以及銥﹣鉑合金和鋨﹣銥合金的耗損很低,可用來製造多孔噴絲板。噴絲板用於把塑料聚合物擠壓成纖維,例如人造絲。[52]鋨﹣銥合金也可以用於指南針軸承和計重秤。[9]
銥的耐腐蝕、耐高溫性質很強,所以非常適合作為合金添加物。飛機引擎中的一些長期使用部件是由銥合金組成的,銥﹣鈦合金也被用作水底管道材料。[9]加入銥可提升鉑合金的硬度。純鉑的維氏硬度為56 HV,而含50%銥的鉑合金硬度可超過500 HV。[53][54]
銥也常被用於須承受高溫的儀器當中。比如,柴可拉斯基法使用銥製高溫坩堝,產生單個氧化物晶體,如藍寶石、釓鎵石榴石和釔鋁石榴石等。這些晶體被用於電腦記憶體和固態激光器零件當中。[55][56][3]銥合金能夠抵禦電弧侵蝕,所以是火花塞電觸頭的理想材料。[56][57]
Cativa催化法是把甲醇轉變為乙酸的過程,可使用銥化合物作為催化劑。[58]
放射性同位素銥-192在γ射線照相中是一種重要的能源,有助對金屬進行無損檢測。[59][60]另外,近距離治療利用192Ir所釋放的γ射線來治療癌症。這種治療方法把輻射源置於癌組織附近或裡面,可用於治療前列腺癌、膽管癌及子宮頸癌等。[9]
科學

1889年製成的國際米原器和國際公斤原器是由含90%鉑和10%銥的合金組成的,原器由位於巴黎附近的國際度量衡局保存。[9]米的定義在1960年改為氪的發射光譜中的一條譜線,[注 2][61]但公斤的定義仍然是公斤原器。[62]
航海家號、維京號、先鋒號和卡西尼-惠更斯號、伽利略號和新視野號等無人宇宙飛船都有使用含有銥的放射性同位素熱電機。由於熱電機要承受高達2000 °C的高溫,所以包裹著鈈-238同位素的容器是以既堅硬又耐高溫的銥所製。[3]
銥還被用於X射線望遠鏡中。[63]錢德拉X射線天文台的反射鏡上有一層60納米厚的銥塗層。在測試過多種金屬之後,銥的X射線反射能力證明比鎳、金和鉑都要優勝。這層銥的平滑程度要有幾個原子以內的準確度,須在氣態下在高真空環境中塗在鉻底層上。[64]
粒子物理學在反質子的產生過程中也用到銥。過程中,高強度質子束射向密度必須很高的「轉換目標體」。雖然可以使用鎢,但銥的優勝之處在於,它可以更穩定地承受入射粒子束使溫度升高時所造成的衝擊波。[65]

碳-氫鍵活化反應(C–H活化)是斷開碳-氫鍵的反應。這種鍵在以前曾被認為具有低反應性。科學家在1982年宣佈首次成功活化飽和烴中的C–H鍵,反應使用銥的有機配合物,使烴進行氧化加成。[66][67]
銥配合物可以用來催化不對稱氫化反應。這類催化劑已被用於合成天然產物,並能夠把本來難以氫化的基底(例如非官能團化烯烴等)氫化成其中一種對映異構體 。[68][69]
銥可以形成多種配合物,在有機發光二極體(OLED)當中起到作用。[70][71][72]
被淘汰的用途

銥﹣鋨合金曾被加入到鋼筆筆頭中。1834年開始,一些鋼筆生產商開始把銥安裝在金筆頭上,這是銥的首個主要應用。[3]自1944年起,著名的派克51鋼筆就有含釕﹣銥合金的筆尖,合金中的銥含量為3.8%。今天的鋼筆筆頭幾乎不再含有銥,而是含其他的金屬,例如鎢。[73]
銥﹣鉑合金曾經用於加農炮的點火孔和排氣孔。根據1867年巴黎世界博覽會的一份報告,莊信萬豐所展出的一份展品「曾在一把魏渥斯步槍中經歷超過3000發,仍無損無耗。所有知道火炮排氣孔損耗所導致的麻煩和花費的人,都會非常欣賞這一重要的應用」。[74]
「銥黑」是一種染料,它含有非常細緻的銥粉末。銥黑可以把瓷器染成很深的黑色。有19世紀的文獻稱「所有其他的黑色瓷器染料與它一比較,都變成了灰色」。[75]
安全
成塊的銥金屬沒有生物用途亦無害,因為它不與生物組織反應。人體組織內的銥比例只有一兆(萬億)分之二十左右。[9]和大部份金屬一樣,銥的金屬細粉具有危險性。這樣的粉末會刺激組織,且容易在空氣中燃燒。[39]由於銥化合物的處理量一般都很低,所以人們對其毒性所知甚少。不過銥的可溶鹽,如各種鹵化銥,則含有毒性。[22]大部份銥化合物都不可溶,所以很難被人體吸收。[9]
192
Ir同位素和其他放射性同位素一樣是危險的。唯一的相關意外是在近距離治療時受該同位素輻射的意外照射。[22]192
Ir所放出的高能伽馬射線會提高患癌症的可能性。外照射可導致燒傷、輻射中毒甚至死亡。攝入192Ir可導致腸胃內膜燒傷。[76]192進入體內的Ir、192mIr和194mIr主要會積累在肝臟中,所放出的伽馬射線和β輻射會對身體造成損害。[37]
備註
參考資料
- ^ Magnetic susceptibility of the elements and inorganic compounds, in Lide, D. R. (编), CRC Handbook of Chemistry and Physics 86th, Boca Raton (FL): CRC Press, 2005, ISBN 0-8493-0486-5
- ^ 2.00 2.01 2.02 2.03 2.04 2.05 2.06 2.07 2.08 2.09 2.10 2.11 2.12 2.13 Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Oxford: Butterworth–Heinemann. 1997: 1113–1143, 1294. ISBN 0-7506-3365-4. OCLC 213025882 37499934 41901113 请检查
|oclc=值 (帮助). - ^ 3.00 3.01 3.02 3.03 3.04 3.05 3.06 3.07 3.08 3.09 3.10 3.11 3.12 3.13 3.14 Hunt, L. B. A History of Iridium (PDF). Platinum Metals Review. 1987, 31 (1): 32–41.
- ^ Kittel, C. Introduction to Solid state Physics, 7th Edition. Wiley-India. 2004. ISBN 81-265-1045-5.
- ^ Arblaster, J. W. Osmium, the Densest Metal Known. Platinum Metals Review. 1995, 39 (4): 164.
- ^ Cotton, Simon. Chemistry of Precious Metals. Springer-Verlag New York, LLC. 1997: 78. ISBN 978-0-7514-0413-5.
- ^ Lide, D. R. CRC Handbook of Chemistry and Physics (70th Edn.). Boca Raton (FL):CRC Press. 1990.
- ^ Arblaster, J. W. Densities of osmium and iridium: recalculations based upon a review of the latest crystallographic data (PDF). Platinum Metals Review. 1989, 33 (1): 14–16.
- ^ 9.00 9.01 9.02 9.03 9.04 9.05 9.06 9.07 9.08 9.09 9.10 9.11 Emsley, J. Iridium. Nature's Building Blocks: An A–Z Guide to the Elements. Oxford, England, UK: Oxford University Press. 2003: 201–204. ISBN 0-19-850340-7. 引证错误:带有name属性“Emsley”的
<ref>标签用不同内容定义了多次 - ^ 10.0 10.1 Perry, D. L. Handbook of Inorganic Compounds. CRC Press. 1995: 203–204. ISBN 1439814619.
- ^ Lagowski, J. J. (编). Chemistry Foundations and Applications 2. Thomson Gale. 2004: 250–251. ISBN 0028657233.
- ^ Jung, D.; Demazeau, Gérard. High Oxygen Pressure and the Preparation of New Iridium (VI) Oxides with Perovskite Structure: Sr
2MIrO
6 (M = Ca, Mg). Journal of Solid State Chemistry. 1995, 115 (2): 447–455. Bibcode:1995JSSCh.115..447J. doi:10.1006/jssc.1995.1158. - ^ Gong, Y.; Zhou, M.; Kaupp, M.; Riedel, S. Formation and Characterization of the Iridium Tetroxide Molecule with Iridium in the Oxidation State +VIII. Angewandte Chemie International Edition. 2009, 48 (42): 7879–7883. doi:10.1002/anie.200902733.
- ^ Gulliver, D. J; Levason, W. The chemistry of ruthenium, osmium, rhodium, iridium, palladium and platinum in the higher oxidation states. Coordination Chemistry Reviews. 1982, 46: 1–127. doi:10.1016/0010-8545(82)85001-7.
- ^ Holleman, A. F.; Wiberg, E.; Wiberg, N. Inorganic Chemistry, 1st Edition. Academic Press. 2001. ISBN 0-12-352651-5. OCLC 47901436.
- ^ Černý, R.; Joubert, J.-M.; Kohlmann, H.; Yvon, K. Mg
6Ir
2H
11, a new metal hydride containing saddle-like IrH5−
4 and square-pyramidal IrH4−
5 hydrido complexes. Journal of Alloys and Compounds. 2002, 340 (1–2): 180–188. doi:10.1016/S0925-8388(02)00050-6. - ^ 17.0 17.1 17.2 17.3 17.4 Renner, H.; Schlamp, G.; Kleinwächter, I.; Drost, E.; Lüschow, H. M.; Tews, P.; Panster, P.; Diehl, M.; Lang, J.; Kreuzer, T.; Knödler, A.; Starz, K. A.; Dermann, K.; Rothaut, J.; Drieselman, R. Platinum group metals and compounds. Ullmann's Encyclopedia of Industrial Chemistry. Wiley. 2002. doi:10.1002/14356007.a21_075.
- ^ Vaska, L.; DiLuzio, J.W. Carbonyl and Hydrido-Carbonyl Complexes of Iridium by Reaction with Alcohols. Hydrido Complexes by Reaction with Acid. Journal of the American Chemical Society. 1961, 83 (12): 2784–2785. doi:10.1021/ja01473a054.
- ^ Crabtree, R. H. Iridium compounds in catalysis. Accounts of Chemical Research. 1979, 12 (9): 331–337. doi:10.1021/ar50141a005.
- ^ Crabtree, R. H. The Organometallic Chemistry of the Transition Metals (PDF). Wiley. 2005. ISBN 0471662569. OCLC 224478241.
- ^ 21.0 21.1 21.2 21.3 21.4 Audi, G.; Bersillon, O.; Blachot, J.; Wapstra, A.H. The NUBASE Evaluation of Nuclear and Decay Properties. Nuclear Physics A (Atomic Mass Data Center). 2003, 729: 3–128. Bibcode:2003NuPhA.729....3A. doi:10.1016/j.nuclphysa.2003.11.001.
- ^ 22.0 22.1 22.2 Mager Stellman, J. Iridium. Encyclopaedia of Occupational Health and Safety. International Labour Organization. 1998: 63.19. ISBN 978-92-2-109816-4. OCLC 35279504 45066560 请检查
|oclc=值 (帮助). - ^ Arblaster, J. W. The discoverers of the iridium isotopes: the thirty-six known iridium isotopes found between 1934 and 2001. Platinum Metals Review. 2003, 47 (4): 167–174.
- ^ 24.0 24.1 Chereminisoff, N. P. Handbook of Ceramics and Composites. CRC Press. 1990: 424. ISBN 0-8247-8006-X.
- ^ Ogden, J. M. The So-Called 'Platinum' Inclusions in Egyptian Goldwork. The Journal of Egyptian Archaeology. 1976, 62: 138–144. JSTOR 3856354. doi:10.2307/3856354.
- ^ Chaston, J. C. The Powder Metallurgy of Platinum. Platinum Metals Rev. 1980, 24 (21): 70–79.
- ^ McDonald, M. The Platinum of New Granada: Mining and Metallurgy in the Spanish Colonial Empire. Platinum Metals Review. 959, 3 (4): 140–145.
- ^ Juan, J.; de Ulloa, A. Relación histórica del viage a la América Meridional 1. 1748: 606 (Spanish).
- ^ Thomson, T. A System of Chemistry of Inorganic Bodies. Baldwin & Cradock, London; and William Blackwood, Edinburgh. 1831: 693.
- ^ 30.0 30.1 Griffith, W. P. Bicentenary of Four Platinum Group Metals. Part II: Osmium and iridium – events surrounding their discoveries. Platinum Metals Review. 2004, 48 (4): 182–189. doi:10.1595/147106704X4844.
- ^ Weeks, M. E. Discovery of the Elements 7. Journal of Chemical Education. 1968: 414–418. ISBN 0-8486-8579-2. OCLC 23991202.
- ^ Tennant, S. On Two Metals, Found in the Black Powder Remaining after the Solution of Platina. Philosophical Transactions of the Royal Society of London. 1804, 94: 411–418. JSTOR 107152. doi:10.1098/rstl.1804.0018.
- ^ Mössbauer, R. L. Gammastrahlung in Ir191. Zeitschrift für Physik A. 1958, 151 (2): 124–143. Bibcode:1958ZPhy..151..124M. doi:10.1007/BF01344210 (German).
- ^ Trigg, G. L. Landmark Experiments in Twentieth Century Physics. Courier Dover Publications. 1995: 179–190. ISBN 0-486-28526-X. OCLC 31409781.
- ^ Waller, I. The Nobel Prize in Physics 1961: presentation speech. Nobel Lectures, Physics 1942–1962. Elsevier. 1964.
- ^ Scott, E. R. D.; Wasson, J. T.; Buchwald, V. F. The chemical classification of iron meteorites—VII. A reinvestigation of irons with Ge concentrations between 25 and 80 ppm. Geochimica et Cosmochimica Acta. 1973, 37 (8): 1957–1983. Bibcode:1973GeCoA..37.1957S. doi:10.1016/0016-7037(73)90151-8.
- ^ 37.0 37.1 Iridium (PDF). Human Health Fact Sheet. Argonne National Laboratory. 2005 [2008-09-20].
- ^ Xiao, Z.; Laplante, A. R. Characterizing and recovering the platinum group minerals—a review. Minerals Engineering. 2004, 17 (9–10): 961–979. doi:10.1016/j.mineng.2004.04.001.
- ^ 39.0 39.1 39.2 39.3 Seymour, R. J.; O'Farrelly, J. I. Platinum-group metals. Kirk Othmer Encyclopedia of Chemical Technology. Wiley. 2001. doi:10.1002/0471238961.1612012019052513.a01.pub2.
- ^ 40.0 40.1 Alvarez, L. W.; Alvarez, W.; Asaro, F.; Michel, H. V. Extraterrestrial cause for the Cretaceous–Tertiary extinction. Science. 1980, 208 (4448): 1095–1108. Bibcode:1980Sci...208.1095A. PMID 17783054. doi:10.1126/science.208.4448.1095.
- ^ Hildebrand, A. R.; Penfield, Glen T.; Kring, David A.; Pilkington, Mark; Zanoguera, Antonio Camargo; Jacobsen, Stein B.; Boynton, William V. Chicxulub Crater; a possible Cretaceous/Tertiary boundary impact crater on the Yucatan Peninsula, Mexico. Geology. 1991, 19 (9): 867–871. Bibcode:1991Geo....19..867H. doi:10.1130/0091-7613(1991)019<0867:CCAPCT>2.3.CO;2.
- ^ Frankel, C. The End of the Dinosaurs: Chicxulub Crater and Mass Extinctions. Cambridge University Press. 1999. ISBN 0-521-47447-7. OCLC 40298401.
- ^ Ryder, G.; Fastovsky, D. E.; Gartner, S. The Cretaceous-Tertiary Event and Other Catastrophes in Earth History. Geological Society of America. 1996: 47. ISBN 0-8137-2307-8.
- ^ Toutain, J.-P.; Meyer, G. Iridium-Bearing Sublimates at a Hot-Spot Volcano (Piton De La Fournaise, Indian Ocean). Geophysical Research Letters. 1989, 16 (12): 1391–1394. Bibcode:1989GeoRL..16.1391T. doi:10.1029/GL016i012p01391.
- ^ 45.0 45.1 45.2 45.3 Platinum-Group Metals. U.S. Geological Survey Mineral Commodity Summaries
- ^ Gilchrist, Raleigh. The Platinum Metals. Chemical Reviews. 1943, 32 (3): 277–372. doi:10.1021/cr60103a002.
- ^ Ohriner, E. K. Processing of Iridium and Iridium Alloys. Platinum Metals Review. 2008, 52 (3): 186–197. doi:10.1595/147106708X333827.
- ^ Hunt, L. B.; Lever, F. M. Platinum Metals: A Survey of Productive Resources to industrial Uses (PDF). Platinum Metals Review. 1969, 13 (4): 126–138.
- ^ Hagelüken, C. Markets for the catalysts metals platinum, palladium, and rhodium (PDF). Metall. 2006, 60 (1–2): 31–42.
- ^
Platinum 2013 Interim Review (PDF). Platinum Today. Johnson Matthey Plc. [2014-01-10]. 外部链接存在于
|website=(帮助) - ^ Jollie, D. Platinum 2008 (PDF). Johnson Matthey. 2008 [2008-10-13]. ISSN 0268-7305.
- ^ Egorova, R. V.; Korotkov, B. V.; Yaroshchuk, E. G.; Mirkus, K. A.; Dorofeev N. A.; Serkov, A. T. Spinnerets for viscose rayon cord yarn. Fibre Chemistry. 1979, 10 (4): 377–378. doi:10.1007/BF00543390.
- ^ Darling, A. S. Iridium Platinum Alloys (PDF). Platinum Metals Review. 1960, 4 (l): 18–26 [2008-10-13].
- ^ Biggs, T.; Taylor, S. S.; van der Lingen, E. The Hardening of Platinum Alloys for Potential Jewellery Application. Platinum Metals Review. 2005, 49 (1): 2–15. doi:10.1595/147106705X24409.
- ^ Crookes, W. On the Use of Iridium Crucibles in Chemical Operations. Proceedings of the Royal Society of London. Series A, Containing Papers of a Mathematical and Physical Character. 1908, 80 (541): 535–536. Bibcode:1908RSPSA..80..535C. JSTOR 93031. doi:10.1098/rspa.1908.0046.
- ^ 56.0 56.1 Handley, J. R. Increasing Applications for Iridium (PDF). Platinum Metals Review. 1986, 30 (1): 12–13.
- ^ Stallforth, H.; Revell, P. A. Euromat 99. Wiley-VCH. 2000. ISBN 978-3-527-30124-9.
- ^ Cheung, H.; Tanke, R. S.; Torrence, G. P. Acetic acid. Ullmann's Encyclopedia of Industrial Chemistry. Wiley. 2000. doi:10.1002/14356007.a01_045.
- ^ Halmshaw, R. The use and scope of Iridium 192 for the radiography of steel. British Journal of Applied Physics. 1954, 5 (7): 238–243. Bibcode:1954BJAP....5..238H. doi:10.1088/0508-3443/5/7/302.
- ^ Hellier, Chuck. Handbook of Nondestructive Evlaluation. The McGraw-Hill Companies. 2001. ISBN 978-0-07-028121-9.
- ^ Penzes, W. B. Time Line for the Definition of the Meter. National Institute for Standards and Technology. 2001 [2008-09-16].
- ^ General section citations: Recalibration of the U.S. National Prototype Kilogram, R. S. Davis, Journal of Research of the National Bureau of Standards, 90, No. 4, July–August 1985 (5.5 MB PDF, here); and The Kilogram and Measurements of Mass and Force, Z. J. Jabbour et al., J. Res. Natl. Inst. Stand. Technol. 106, 2001, 25–46 (3.5 MB PDF, here)
- ^ Ziegler,, E.; Hignette, O.; Morawe, Ch.; Tucoulou, R. High-efficiency tunable X-ray focusing optics using mirrors and laterally-graded multilayers. Nuclear Instruments and Methods in Physics Research Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. 2001,. 467–468: 954–957. Bibcode:2001NIMPA.467..954Z. doi:10.1016/S0168-9002(01)00533-2.
- ^ Face-to-Face with Jerry Johnston, CXC Program Manager & Bob Hahn, Chief Engineer at Optical Coating Laboratories, Inc., Santa Rosa, CA. Harvard-Smithsonian Center for Astrophysics; Chandra X-ray Center. 1995 [2008-09-24].
- ^ Möhl, D. Production of low-energy antiprotons. Zeitschrift Hyperfine Interactions. 1997, 109: 33–41. Bibcode:1997HyInt.109...33M. doi:10.1023/A:1012680728257.
- ^ 66.0 66.1 Janowicz, A. H.; Bergman, R. G. Carbon-hydrogen activation in completely saturated hydrocarbons: direct observation of M + R-H -> M(R)(H). Journal of the American Chemical Society. 1982, 104 (1): 352–354. doi:10.1021/ja00365a091.
- ^ 67.0 67.1 Hoyano, J. K.; Graham, W. A. G. Oxidative addition of the carbon-hydrogen bonds of neopentane and cyclohexane to a photochemically generated iridium(I) complex. Journal of the American Chemical Society. 1982, 104 (13): 3723–3725. doi:10.1021/ja00377a032.
- ^ Källström, K; Munslow, I; Andersson, P. G. Ir-catalysed asymmetric hydrogenation: Ligands, substrates and mechanism. Chemistry – A European Journal. 2006, 12 (12): 3194–3200. PMID 16304642. doi:10.1002/chem.200500755.
- ^ Roseblade, S. J.; Pfaltz, A. Iridium-catalyzed asymmetric hydrogenation of olefins. Accounts of Chemical Research. 2007, 40 (12): 1402–1411. PMID 17672517. doi:10.1021/ar700113g.
- ^ Wang, X.; Andersson, M. R.; Thompson, M. E.; Inganäsa, O. Electrophosphorescence from substituted poly(thiophene) doped with iridium or platinum complex. Thin Solid Films. 2004, 468 (1–2): 226–233. Bibcode:2004TSF...468..226W. doi:10.1016/j.tsf.2004.05.095.
- ^ Tonzetich, Zachary J. Organic Light Emitting Diodes—Developing Chemicals to Light the Future (PDF). Journal of Undergraduate Research (Rochester University). 2002, 1 (1) [2008-10-10].
- ^ Holder, E.; Langefeld, B. M. W.; Schubert, U. S. New Trends in the Use of Transition Metal-Ligand Complexes for Applications in Electroluminescent Devices. Advanced Materials. 2005-04-25, 17 (9): 1109–1121. doi:10.1002/adma.200400284.
- ^ Mottishaw, J. Notes from the Nib Works—Where's the Iridium?. The PENnant. 1999, XIII (2).
- ^ 原文:"… has been used in a Withworth gun for more than 3000 rounds, and scarcely shows signs of wear yet. Those who know the constant trouble and expense which are occasioned by the wearing of the vent-pieces of cannon when in active service, will appreciate this important adaptation." Crookes, W. (编). The Paris Exhibition. The Chemical News and Journal of Physical Science. 1867, XV: 182.
- ^ Pepper, J. H. The Playbook of Metals: Including Personal Narratives of Visits to Coal, Lead, Copper, and Tin Mines, with a Large Number of Interesting Experiments Relating to Alchemy and the Chemistry of the Fifty Metallic Elements. Routledge, Warne, and Routledge. 1861: 455.
- ^ Radioisotope Brief: Iridium-192 (Ir-192) (PDF). Radiation Emergencies. Centers for Disease Control and Prevention. 2004-08-18 [2008-09-20].
外部鏈接
| 维基共享资源中相关的多媒体资源:铱 |
| 查看维基词典中的词条「iridium」。 |
- Iridium at The Periodic Table of Videos(諾丁漢大學)
- Iridium in Encyclopædia Britannica
| 元素周期表 | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| IA 1 |
IIA 2 |
IIIB 3 |
IVB 4 |
VB 5 |
VIB 6 |
VIIB 7 |
VIIIB 8 |
VIIIB 9 |
VIIIB 10 |
IB 11 |
IIB 12 |
IIIA 13 |
IVA 14 |
VA 15 |
VIA 16 |
VIIA 17 |
VIIIA 18 | ||||||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||||
| |||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||



